Sr. Director:
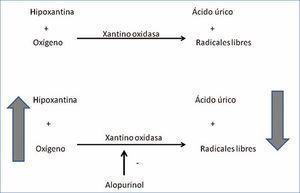
El alopurinol es un inhibidor de la xantino oxidasa. La xantino oxidasa es una enzima que tiene como sustratos la hipoxantina y el oxígeno, y como productos el ácido úrico y radicales libres. Los efectos beneficiosos del alopurinol no son debidos solo a la disminución del ácido úrico, sino también a la disminución del estrés oxidativo y al aumento de la hipoxantina y el oxígeno tisular (figura 1). Así, actualmente hay datos que permiten afirmar que el alopurinol mejora la disfunción endotelial, disminuye el estrés oxidativo vascular, mejora la isquemia miocárdica y disminuye la hipertrofia ventricular izquierda1. Además, en varios estudios se ha demostrado que el alopurinol disminuye la mortalidad total2,3 y en estudios con menor número de pacientes se ha sugerido que disminuye el número de eventos cardiovasculares4,5.
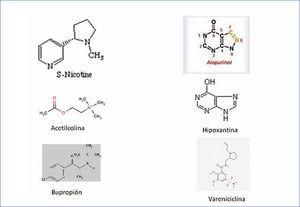
En un estudio previo de 112 pacientes con insuficiencia renal crónica estadio 3, todos ellos sin historia de eventos cardiovasculares previos, observamos que ninguno de los 30 pacientes que tomaban alopurinol fumaban (0 % fumadores con alopurinol frente a 20,73 % fumadores entre los que no lo tomaban; p = 0,029). Como el número de pacientes era muy escaso, se decidió ampliar el número de pacientes estudiados para confirmar los resultados y aumentar su potencia estadística. Se interrogó consecutivamente a 483 pacientes con diabetes mellitus y enfermedad renal que acudieron a consultas externas de nefropatía diabética durante aproximadamente unos tres meses consecutivos. Solo se recogieron los datos de si tomaban alopurinol, si eran fumadores activos y si eran exfumadores. Los estudios estadísticos se realizaron con el SPSS 15.0. En los 483 pacientes estudiados, 143 tomaban alopurinol y 340 no lo tomaban. En los pacientes que lo tomaban había un menor porcentaje de fumadores activos (8,3 % frente a 15,59 %, p = 0,034) y un mayor porcentaje de exfumadores (33,56 % frente a 13, 82 %, p = 0,000) (tabla 1). A la vista de estos resultados se podría afirmar que los pacientes diabéticos con patología nefrológica seguidos en consultas externas de nefropatía diabética que toman alopurinol son menos fumadores activos y es más probable que sean exfumadores. Dado que estos resultados son meramente descriptivos y no demuestran causalidad, nos planteamos qué le faltaría al trabajo para poder obtener resultados más concluyentes. El primer planteamiento sería preguntarnos si los que dejaron de fumar lo hicieron porque tenían mayor comorbilidad vascular que les hizo abandonar el tabaco; para ello se podría usar un índice de comorbilidad, pero recordemos que en el estudio inicial con 112 pacientes ninguno de ellos había tenido un evento cardiovascular previo. La siguiente pregunta que se plantea es si ha habido algún tipo de intervención psicológica o farmacológica para abandonar el tabaco. Aunque a todos los pacientes diabéticos con patología nefrológica se les hace intervención psicológica para abandonar el tabaco, los datos de intervención farmacológica no han sido recogidos. El siguiente planteamiento es si existía una relación temporal entre el abandono del tabaco y la toma de alopurinol, o sea, saber si el cese del tabaquismo era posterior al inicio del alopurinol. En nuestro trabajo recogíamos el tiempo que llevaban tomando el alopurinol, pero es difícil que el paciente refiera la fecha exacta en la que abandonó el tabaco. Por último, habría que encontrar un mecanismo que apoye farmacológicamente la asociación hallada. En la figura 2 se observan las moléculas relacionadas con los receptores nicotínicos cerebrales. Si bien no somos expertos en farmacología, sí observamos que la molécula de nicotina, la acetilcolina y el bupropión comparten terminaciones CH3 y que las moléculas tanto del alopurinol como de la hipoxantina son más parecidas a la molécula de vareniciclina con terminaciones NH. Dado que en el cerebro no existe la enzima xantino oxidasa, nos podríamos plantear si el alopurinol actuaría sobre otros enzimas cerebrales o sobre receptores cerebrales. Sin embargo, dado que sí se ha demostrado que en el cerebro hay hipoxantina, se podría sugerir que el efecto observado es debido a un aumento de la hipoxantina cerebral secundario al uso de alopurinol, hecho este que nos parece más probable.
En conclusión, los pacientes que toman alopurinol fuman menos y es más probable que sean exfumadores. Dado que estos hallazgos son meramente descriptivos, serían necesarios estudios futuros bien diseñados que apoyen esta observación. Mientras se ponen en marcha estos estudios, nos pareció interesante comunicarlo a la comunidad científica, pues este hallazgo podría ser uno más de los efectos beneficiosos del alopurinol.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Figura 1. Mecanismo de accion del alopurinol.
Tabla 1. Porcentaje de fumadores y exfumadores en pacientes diabéticos con enfermedad renal según su tratamiento con alopurinol
Figura 2. Moléculas de alopurinol e hipoxantina frente a moléculas conocidas que actúan sobre receptores nicotínicos cerebrales.