La prevalencia de la sarcopenia varía entre el 1,5% y el 68% de los pacientes con enfermedad renal crónica (ERC). El amplio intervalo se debe a las distintas herramientas diagnósticas y puntos de corte utilizados. Es preciso establecer un diagnóstico e intervención precoces de sarcopenia, por su asociación a peor calidad de vida (QoL), mayor tasa de hospitalización y episodios adversos. La revisión del consenso European Working Group on Sarcopenia in Older People (EWGSOP2) propone la ecografía como herramienta emergente para cuantificar la masa muscular. Nuestro objetivo es describir la prevalencia de pacientes en riesgo de sarcopenia en diálisis peritoneal (DP) y la utilidad de la ecografía en nuestro medio.
Material y métodosRealizamos un estudio observacional en pacientes prevalentes de DP en el Hospital Universitario Puerta de Hierro de enero a octubre del 2023. Se recogieron parámetros clínicos, de eficacia, analíticos y nutricionales junto al desempeño funcional medido por SPPB, fragilidad (escala FRAIL), riesgo de desnutrición (escala MIS), bioimpedancia y la estima de la masa apendicular esquelética mediante fórmula de Lin. Se añadió la medición ecográfica de la grasa supramuscular, los ejes (X e Y) y el área del recto anterior del cuádriceps (RAC), ajustada por estatura y superficie corporal. Clasificamos a los pacientes con riesgo de sarcopenia según la fuerza palmar por los criterios EWGSOP2 ajustados por sexo. Este estudio fue aprobado por el Comité de Ética de Investigación con Medicamentos del Hospital Universitario Puerta de Hierro (N.° 16/2023).
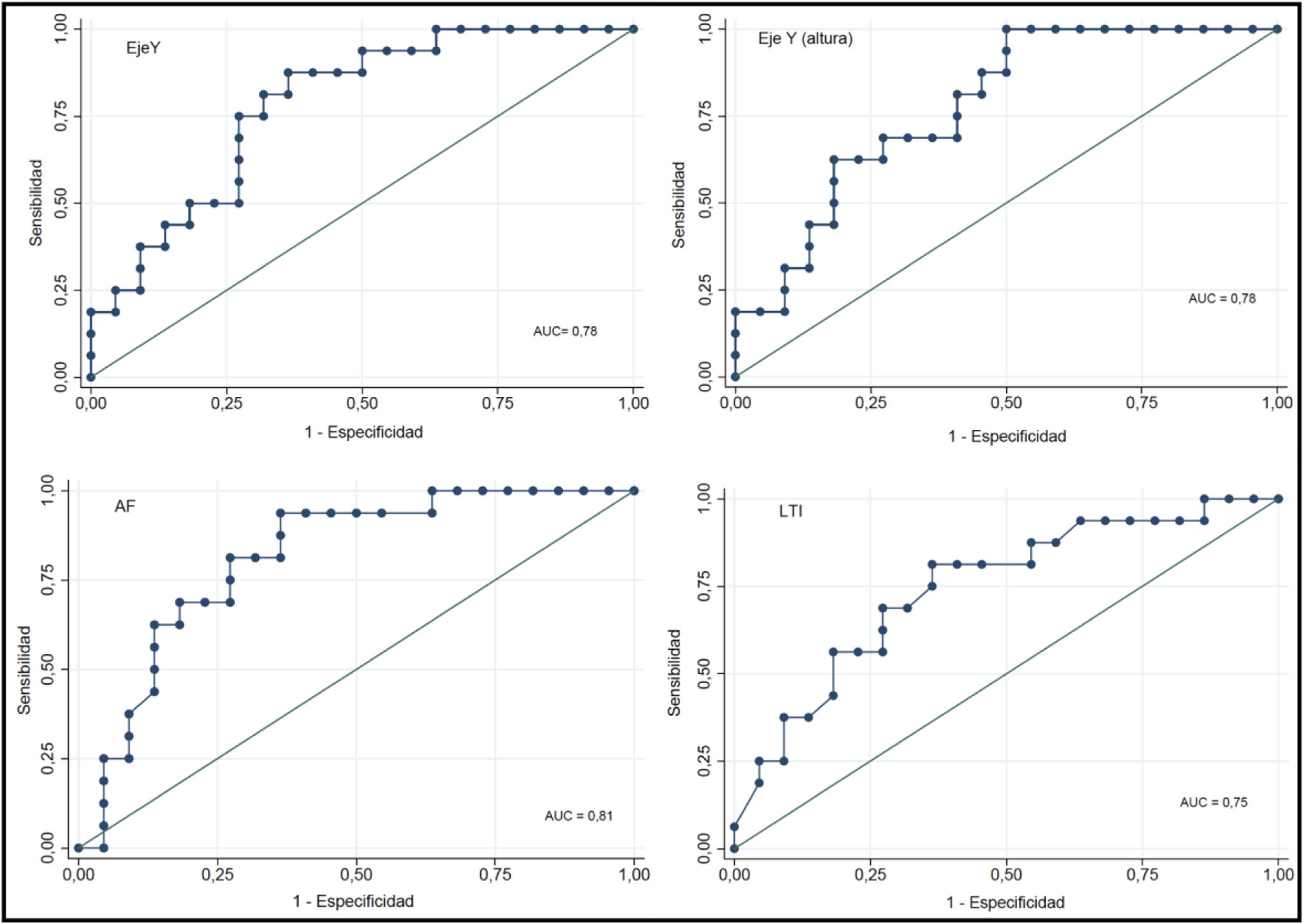
ResultadosEvaluamos a 38 pacientes, con una edad media de 65,4 años (DE 14,9); el 65,8% eran varones. El 52,6% tenía un índice de masa magra (LTI) disminuido y el 23,7% un índice de masa grasa (FTI) disminuido, con un ángulo de fase medio de 4,5 (DE 1,1). Clasificamos al 42,1% de los pacientes como riesgo de sarcopenia según la fuerza palmar; eran mayores, comórbidos, con peor nutrición por la escala MIS y peores puntuaciones de fragilidad y capacidad funcional. De igual modo, tenían un menor LTI, menor masa muscular esquelética apendicular y menor grosor del cuádriceps (eje Y 8,5mm [DE 2,4] vs. 11,8mm [DE 3,3]; p=0,002). Los pacientes con riesgo de sarcopenia tenían niveles más bajos de fósforo y mayores de proteína C reactiva. La capacidad predictiva de la ecografía para clasificar a los pacientes con riesgo de sarcopenia fue de AUC 0,78 (0,64-0,93) para el eje Y, similar a las obtenidas con el LTI y el ángulo de fase de la bioimpedancia.
ConclusionesEl riesgo de sarcopenia es altamente prevalente en DP y se relaciona con la edad, comorbilidad de desnutrición e inflamación de los pacientes. La ecografía es una herramienta accesible, segura, de bajo coste y fácil de utilizar a pie de cama. Este método nos sirve para cuantificar la masa muscular y valorar su calidad. Proponemos el espesor del músculo RAC (eje Y) como el mejor parámetro complementario, dada su buena correlación con la bioimpedancia y su valor diagnóstico de riesgo sarcopénico. Nuestra experiencia servirá de base a futuros estudios para definir puntos de corte específicos en DP y diseñar protocolos de seguimiento e intervención.
The prevalence of sarcopenia varies between 1.5% and 68% among patients with chronic kidney disease (CKD). This wide range is due to the different diagnostic tools and the cut-off points used. Early diagnosis and intervention of sarcopenia are essential because of its association with poorer quality of life (QoL), higher hospitalization rates, and adverse events. The European Working Group on Sarcopenia in Older People (EWGSOP2) consensus review suggests ultrasound as an emerging tool to quantify muscle mass. Our objective is to describe the prevalence of sarcopenia risk in peritoneal dialysis (PD) and the utility of ultrasound in our setting.
Material and methodsWe conducted an observational study in prevalent PD patients at the Puerta de Hierro University Hospital between January and October 2023. Clinical, efficacy, analytical and nutritional parameters were collected, along with functional performance measured by SPPB, frailty (FRAIL scale), risk of malnutrition (MIS scale), bioimpedance and estimation of appendicular skeletal muscle mass using Lin's formula. Ultrasound measurement of supramuscular fat, axes (X and Y) and the area of the rectus femoris muscle of the quadriceps were also included, adjusted for height and body surface area. We classified patients at risk of sarcopenia based on handgrip strength according to EWGSOP2 criteria, adjusted for sex. This study was approved by the Ethics Committee of Puerta de Hierro University Hospital (No. 16/2023).
ResultsWe evaluated 38 patients, with a mean age of 65.4 years (SD 14.9), 65.8% were male. 52.6% had a reduced lean tissue index (LTI) and 23.7% had a reduced fat tissue index (FTI), with a mean phase angle (AF) of 4.5 (SD 1.1). We classified 42.1% as patients at risk of sarcopenia based on handgrip strength. They were older, had more comorbidities, poorer nutrition according to the MIS scale, and showed worse scores on frailty and functional capacity. Similary, they had a lower LTI, lower appendicular skeletal muscle mass, and lower quadriceps muscle thickness (Y axis 8.5mm [SD 2.4] vs. 11.8mm [SD 3.3], P=0.002). Patients at risk of sarcopenic had lower phosphorus levels and higher C-reactive protein levels. The predictive capacity of ultrasound for classifying patients at risk of sarcopenia was AUC 0.78 (0.64-0.93) for Y axis, similar to those obtained with the LTI and AF of bioimpedance.
ConclusionsSarcopenia risk is highly prevalent in PD and is related to age, comorbidity, malnutrition and inflammation in patients. Ultrasound is an accessible, safe, low-cost and easy-to-use tool at the bedside. This method helps us to quantify muscle mass and assess its quality. We propose the thickness of the rectus femoris muscle (Y axis) as the best complementary parameter given its good correlation with bioimpedance and its diagnostic value for sarcopenic risk. Our experience will serve as a basis for future studies that allow us to define specific cut-off points in PD and design monitoring and intervention protocols.
El término sarcopenia define un síndrome caracterizado por la pérdida de masa muscular y disminución de la fuerza que se asocia con el envejecimiento, descrito en 19891. La senescencia va a contribuir al desarrollo de este síndrome. Se ha demostrado que a partir de la cuarta década de vida el músculo esquelético comienza a declinar y es una de las causas más importantes del deterioro funcional y de la pérdida de independencia. En este proceso influyen factores extrínsecos, como una nutrición deficiente y una vida sedentaria, y también intrínsecos, como los cambios hormonales, la inflamación, la pérdida de proteínas en el músculo, el estrés oxidativo y la alteración de factores que regulan la miogénesis2.
Este síndrome también puede verse en personas menos ancianas, en situaciones de enfermedades crónicas e inflamación que condicionen malnutrición, ya sea por malabsorción, disminución de ingesta o actividad física baja3. En ciertos perfiles de pacientes es muy difícil distinguir si la causa de la sarcopenia es el envejecimiento per se o la enfermedad asociada, como sucede en los pacientes con enfermedad renal crónica (ERC). En este caso, se trata de una población longeva con comorbilidad asociada y, en muchas ocasiones, con un estado de inflamación mantenido.
En contraste con la sarcopenia asociada al envejecimiento, que progresa de manera lenta y se debe a cambios hormonales y metabólicos relacionados con la edad, la sarcopenia en la ERC es acelerada y multifactorial4. En la ERC confluyen múltiples procesos, como la acidosis metabólica, resistencia a la insulina, déficit de vitamina D y aumento de estrés oxidativo, así como un estado de inflamación crónico con disminución de la ingesta calórico-proteica, que provoca un aumento del catabolismo proteico5. A ello se añaden diversos factores, tales como: la técnica de diálisis, la edad, el desequilibrio hormonal y las dietas muy restrictivas, que disminuyen la síntesis proteica y contribuyen a un balance negativo de proteínas6.
Es relevante establecer un diagnóstico precoz de sarcopenia debido a su impacto negativo en la calidad de vida (QoL), hospitalizaciones y episodios adversos5,7,8. Su prevalencia oscila entre el 1,5% y el 68% de los pacientes en diálisis. Este rango tan amplio se debe a la falta de consenso para la definición de sarcopenia en pacientes con ERC7,9 y a la variabilidad de las herramientas diagnósticas disponibles y de los protocolos utilizados por cada centro10. Los parámetros antropométricos habitualmente utilizados, como el peso, la talla o el índice de masa corporal (IMC), no llegan a reflejar la verdadera sarcopenia, ya que la masa muscular esquelética perdida es reemplazada por grasa y se mantiene el peso total, en un proceso conocido como mioestatosis11, que se ve en la obesidad sarcopénica. Esta situación tiene la capacidad de alterar la funcionalidad del músculo y constituye un poderoso predictor de discapacidad y mortalidad12.
La revisión del consenso European Working Group on Sarcopenia in Older People (EWGSOP2), publicada en el 2019, recomienda una aproximación práctica al diagnóstico de sarcopenia. Se propone realizar un cribado de sarcopenia mediante la evaluación de la fuerza de prensión manual (handgrip), para detectar «dinapenia» (disminución de la fuerza muscular)6, clasificando a estas personas como en «riesgo de sarcopenia». Ese dato por sí mismo nos debería llevar a proponer una intervención diagnóstica/correctora, seguida de una valoración de la masa muscular total para confirmar el diagnóstico de sarcopenia.
El método de referencia recomendado para la valoración de la masa muscular por este grupo es la DEXA (por sus siglas en inglés: dual energy X-ray absorptiometry), aunque en la realidad no está disponible en la mayoría de las unidades de nutrición y su uso se limita a protocolos de investigación, por lo que se opta por la bioimpedancia multifrecuencia como procedimiento alternativo.
La bioimpedancia es una herramienta muy extendida en nuestro medio de atención al paciente con ERC y diálisis, que ha llegado a posicionarse como el patrón de referencia para la sobrehidratación y la nutrición. Con esta técnica no es posible una medición directa de la masa muscular, ya que lo que estima es el índice de masa magra, que contiene músculo, piel, huesos y vísceras. Además, presenta limitaciones relacionadas con la estructura corporal del paciente (como en casos extremos de obesidad o desnutrición), la temperatura o incluso el estado de sobrehidratación, que pueden alterar las mediciones13-15. A su vez, presenta algunas contraindicaciones que limitan su empleo: el uso de algunos tipos de dispositivos cardiacos implantables, determinadas prótesis metálicas y el embarazo. Por ello, en unidades de endocrinología y geriatría se han empezado a buscar nuevas herramientas para la medición directa de la masa muscular como la ecografía, cuya ventaja principal es su inocuidad, disponibilidad en nefrología, bajo coste de material fungible y portabilidad, que permite una valoración a pie de cama (POCUS por sus siglas en inglés), lo que hace que cada día su uso esté más extendido.
En este escenario de relevancia de la sarcopenia como factor pronóstico, ausencia de evidencia específica en diálisis peritoneal (DP) y falta de recomendaciones propias en guías clínicas, decidimos poner en marcha un protocolo de evaluación sistemática de la sarcopenia para todos los pacientes de nuestro programa de DP.
Material y métodosSe realizó un estudio observacional en pacientes incidentes (a la semana de iniciar DP) y prevalentes de la Unidad de Diálisis Peritoneal del Hospital Universitario Puerta de Hierro Majadahonda entre enero del 2023 y octubre del 2023. Los pacientes incluidos debían estar en una situación de estabilidad clínica (sin ingresos en los últimos 3 meses, sin procesos infecciosos ni neoplásicos activos). Los datos clínicos de paciente, etiología, técnica, eficacia y laboratorio fueron recogidos por nefrólogos y enfermeros en una historia clínica electrónica estructurada. Además, se recogieron datos del desempeño funcional y la fragilidad, junto con la masa muscular y el riesgo de desnutrición. Este estudio fue aprobado por el Comité de Ética de Investigación con Medicamentos del Hospital Universitario Puerta de Hierro (N.° 16/2023).
La fuerza muscular se evalúa por dinamometría (kg), con dinamómetro CAMRY modelo: EH101, calculando la mayor de 3 mediciones de la fuerza de agarre de mano en la extremidad dominante. Dado que no tenemos guías específicas para ERC y que sabemos que son pacientes con un estado de inflamación crónica y senescencia acelerada, asumimos las recomendaciones del EWGSOP216, considerando el límite de fuerza muscular disminuida en prensión palmar <27kg en varones y <16kg en mujeres. Clasificamos a los pacientes por debajo del punto de corte como con riesgo de sarcopenia.
La fragilidad se valoró mediante la escala FRAIL, que consta de 5 preguntas relativas a 5 dominios: fatigabilidad, resistencia, deambulación, comorbilidad y pérdida de peso no intencionada17. Se consideran frágiles con una puntuación igual o mayor de 3 puntos.
La medición del desempeño funcional se realizó con el Short physical performance battery (SPPB)18, que consiste en la evaluación de 3 ejercicios sencillos que se realizan en un orden determinado, para evitar la fatiga de la persona y asegurar su reproducibilidad:
- 1.
Prueba de equilibrio en 3posiciones: pies juntos, semi-tándem y tándem.
- 2.
Prueba de velocidad de la marcha en 4 metros.
- 3.
Prueba de levantarse de la silla 5 veces sin apoyar los brazos.
La puntuación total del SPPB resulta de la suma de las 3pruebas y oscila entre 0 y 12. Así se clasifica a los pacientes según su puntuación: desde 0 (discapacidad grave) hasta 12 (paciente robusto).
Utilizamos la escala de malnutrición inflamación (MIS) para valorar el riesgo de desnutrición de nuestros pacientes: el rango normal es ≤3; leve 3-5; moderado 6-8 y grave ≥8.
La medición de la composición corporal se realizó con un equipo de bioimpedancia multifrecuencia (BCM ® Fresenius Medical Care, Bad Homburg, Alemania), siguiendo el protocolo habitual de la unidad y las recomendaciones del fabricante. Se recopilaron los datos de peso, talla, IMC, estado de sobrehidratación (OH), índice de masa grasa (FTI), índice de masa magra (LTI), agua corporal total y ángulo de fase (AF) a 50kHz. A partir de la bioimpedancia estimamos la masa muscular esquelética apendicular (MMEA) mediante la fórmula de Lin, donde MMEA (kg)=−1,838+0,395×agua total corporal (L)+0,105×peso (kg)+1,231×sexo masculino - 0,026×edad (años)19. Este resultado lo dividimos por la estatura (m2) para calcular el índice de MMEA (IMMEA). Se considera masa muscular disminuida cuando está por debajo de 5,5kg/m2 en mujeres y de 7kg/m2 en hombres, según lo publicado por EWGSOP2.
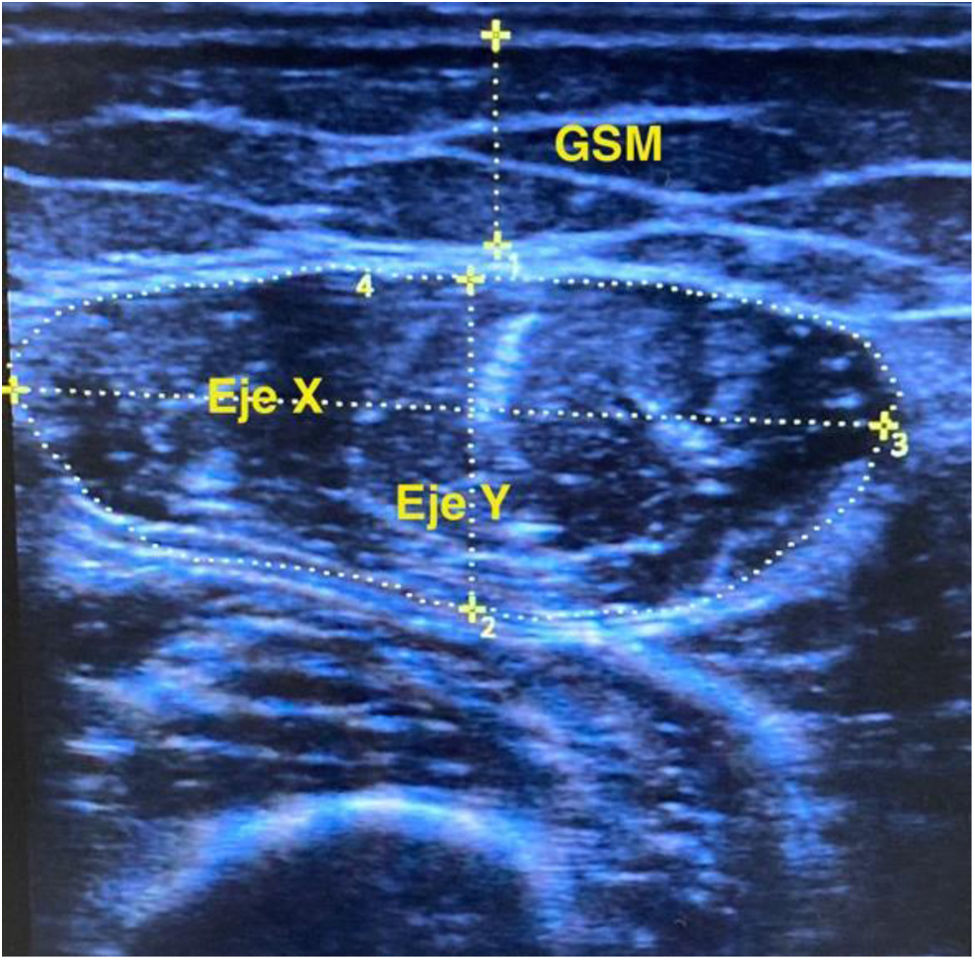
La masa muscular se midió mediante ecografía utilizando el equipo Digital Color Doppler Ultrasound (SonoScape, China), siguiendo los protocolos previamente publicados20,21. La medición se realizó en modo B y con sonda lineal (6-12MHz), en el tercio inferior de la línea imaginaria entre la espina ilíaca anterosuperior y la rótula de la pierna dominante, en decúbito supino, con el músculo relajado y con el transductor perpendicular al eje longitudinal. Se procedía a medir el grosor del recto anterior del cuádriceps (RAC) eje X/eje Y, su área y la grasa supramuscular, como detalla la figura 1. Para evitar errores en las mediciones, utilizamos la media de 3mediciones consecutivas del mismo observador. Estas mediciones se ajustaron por altura (eje Y /[Alt]2) y por superficie corporal del paciente (eje Y/Sc). Para el cálculo de la superficie corporal utilizamos la fórmula de Du Bois y Du Bois22.
Análisis estadísticoLos datos se registraron en una base de datos diseñada para este fin. Las variables continuas se muestran como media y desviación estándar (DE) o mediana y rango intercuartílico (RIC), según su distribución. Las variables categóricas se muestran como frecuencias o porcentajes. Las comparaciones entre grupos se realizaron con t de Student o Mann-Whitney o χ2, según la naturaleza de las variables. El análisis de correlación para variables cuantitativas se realizó con la prueba de Pearson. Para estimar la capacidad de la ecografía en discriminar a los pacientes con riesgo de sarcopenia calculamos curvas ROC (receiver operating characteristic), utilizando como indicador el área bajo la curva (AUC) y su intervalo de confianza al 95%. Consideramos significativo un valor de p<0,05. Los análisis se hicieron con el paquete estadístico Stata v. 16.0 (Stata Statistical Software: Release 16, 2019. College Station, TX: StataCorp LLC).
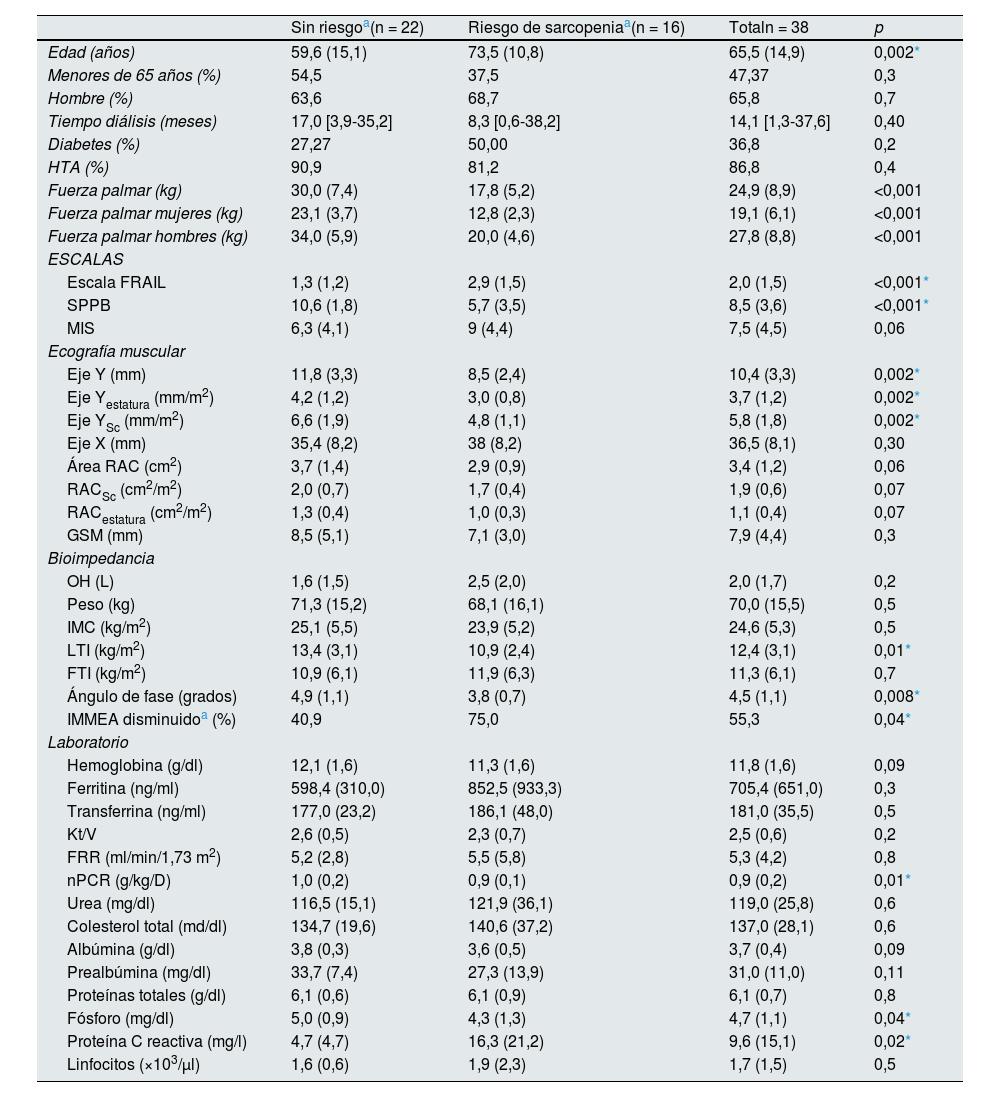
ResultadosCaracterísticas basales de los pacientesSe evaluó a 38 pacientes, con una media de edad de 65,4 años (DE 14,9), el 65,8% eran varones que llevaban en DP una mediana de 14,1 meses RIC [1,3-37,6]. El 44,7% procedía de hemodiálisis, un 5,3% tenían un trasplante de órgano sólido no renal y el 5,3% provenía de un trasplante renal no funcionante. El 47,37% se clasificó como prefrágil y un 34,2% como frágil. La prevalencia de comorbilidades fue: 86,8% hipertensos, 36,8% diabéticos, 36,8% con antecedentes de fibrilación auricular y 31,6% con cardiopatía isquémica. Estas características son similares a las previamente descritas por el GCDP23. El resto de las características basales, así como los datos analíticos y valores obtenidos mediante bioimpedancia y ecografía de toda la muestra, se resumen en la tabla 1. En la población estudiada el 52,6% tenía un LTI disminuido y el 23,7% el FTI disminuido, según los valores propuestos por el fabricante ajustados por edad y sexo, con el ángulo de fase medio de 4,5 (DE 1,1). La masa muscular esquelética apendicular se estimó a partir de los datos obtenidos por la bioimpedancia con la fórmula de Lin y, de acuerdo con lo indicado en EWGSOP2, el 55,3% presentaba un índice de masa muscular apendicular disminuida ajustada a sexo, con una media de 5,7kg/m2 (DE 1,4) en mujeres y de 6,7kg/m2 (DE 1,0) en hombres. Además, encontramos una tendencia a un mayor riesgo de sarcopenia en los pacientes diabéticos.
Características basales de los pacientes clasificados por riesgo de sarcopenia
| Sin riesgoa(n = 22) | Riesgo de sarcopeniaa(n = 16) | Totaln = 38 | p | |
| Edad (años) | 59,6 (15,1) | 73,5 (10,8) | 65,5 (14,9) | 0,002* |
| Menores de 65 años (%) | 54,5 | 37,5 | 47,37 | 0,3 |
| Hombre (%) | 63,6 | 68,7 | 65,8 | 0,7 |
| Tiempo diálisis (meses) | 17,0 [3,9-35,2] | 8,3 [0,6-38,2] | 14,1 [1,3-37,6] | 0,40 |
| Diabetes (%) | 27,27 | 50,00 | 36,8 | 0,2 |
| HTA (%) | 90,9 | 81,2 | 86,8 | 0,4 |
| Fuerza palmar (kg) | 30,0 (7,4) | 17,8 (5,2) | 24,9 (8,9) | <0,001 |
| Fuerza palmar mujeres (kg) | 23,1 (3,7) | 12,8 (2,3) | 19,1 (6,1) | <0,001 |
| Fuerza palmar hombres (kg) | 34,0 (5,9) | 20,0 (4,6) | 27,8 (8,8) | <0,001 |
| ESCALAS | ||||
| Escala FRAIL | 1,3 (1,2) | 2,9 (1,5) | 2,0 (1,5) | <0,001* |
| SPPB | 10,6 (1,8) | 5,7 (3,5) | 8,5 (3,6) | <0,001* |
| MIS | 6,3 (4,1) | 9 (4,4) | 7,5 (4,5) | 0,06 |
| Ecografía muscular | ||||
| Eje Y (mm) | 11,8 (3,3) | 8,5 (2,4) | 10,4 (3,3) | 0,002* |
| Eje Yestatura (mm/m2) | 4,2 (1,2) | 3,0 (0,8) | 3,7 (1,2) | 0,002* |
| Eje YSc (mm/m2) | 6,6 (1,9) | 4,8 (1,1) | 5,8 (1,8) | 0,002* |
| Eje X (mm) | 35,4 (8,2) | 38 (8,2) | 36,5 (8,1) | 0,30 |
| Área RAC (cm2) | 3,7 (1,4) | 2,9 (0,9) | 3,4 (1,2) | 0,06 |
| RACSc (cm2/m2) | 2,0 (0,7) | 1,7 (0,4) | 1,9 (0,6) | 0,07 |
| RACestatura (cm2/m2) | 1,3 (0,4) | 1,0 (0,3) | 1,1 (0,4) | 0,07 |
| GSM (mm) | 8,5 (5,1) | 7,1 (3,0) | 7,9 (4,4) | 0,3 |
| Bioimpedancia | ||||
| OH (L) | 1,6 (1,5) | 2,5 (2,0) | 2,0 (1,7) | 0,2 |
| Peso (kg) | 71,3 (15,2) | 68,1 (16,1) | 70,0 (15,5) | 0,5 |
| IMC (kg/m2) | 25,1 (5,5) | 23,9 (5,2) | 24,6 (5,3) | 0,5 |
| LTI (kg/m2) | 13,4 (3,1) | 10,9 (2,4) | 12,4 (3,1) | 0,01* |
| FTI (kg/m2) | 10,9 (6,1) | 11,9 (6,3) | 11,3 (6,1) | 0,7 |
| Ángulo de fase (grados) | 4,9 (1,1) | 3,8 (0,7) | 4,5 (1,1) | 0,008* |
| IMMEA disminuidoa (%) | 40,9 | 75,0 | 55,3 | 0,04* |
| Laboratorio | ||||
| Hemoglobina (g/dl) | 12,1 (1,6) | 11,3 (1,6) | 11,8 (1,6) | 0,09 |
| Ferritina (ng/ml) | 598,4 (310,0) | 852,5 (933,3) | 705,4 (651,0) | 0,3 |
| Transferrina (ng/ml) | 177,0 (23,2) | 186,1 (48,0) | 181,0 (35,5) | 0,5 |
| Kt/V | 2,6 (0,5) | 2,3 (0,7) | 2,5 (0,6) | 0,2 |
| FRR (ml/min/1,73 m2) | 5,2 (2,8) | 5,5 (5,8) | 5,3 (4,2) | 0,8 |
| nPCR (g/kg/D) | 1,0 (0,2) | 0,9 (0,1) | 0,9 (0,2) | 0,01* |
| Urea (mg/dl) | 116,5 (15,1) | 121,9 (36,1) | 119,0 (25,8) | 0,6 |
| Colesterol total (md/dl) | 134,7 (19,6) | 140,6 (37,2) | 137,0 (28,1) | 0,6 |
| Albúmina (g/dl) | 3,8 (0,3) | 3,6 (0,5) | 3,7 (0,4) | 0,09 |
| Prealbúmina (mg/dl) | 33,7 (7,4) | 27,3 (13,9) | 31,0 (11,0) | 0,11 |
| Proteínas totales (g/dl) | 6,1 (0,6) | 6,1 (0,9) | 6,1 (0,7) | 0,8 |
| Fósforo (mg/dl) | 5,0 (0,9) | 4,3 (1,3) | 4,7 (1,1) | 0,04* |
| Proteína C reactiva (mg/l) | 4,7 (4,7) | 16,3 (21,2) | 9,6 (15,1) | 0,02* |
| Linfocitos (×103/μl) | 1,6 (0,6) | 1,9 (2,3) | 1,7 (1,5) | 0,5 |
Los datos se muestran como media (desviación estándar), mediana [rango intercuartílico], o número y porcentaje.
FRR: función renal residual; FTI: índice de masa grasa; GSM: grasa supramuscular del muslo; IC: insuficiencia cardiaca; IMC: índice de masa muscular; IMMEA: índice de masa muscular esquelética apendicular; LTI: índice de masa magra; MIS: Malnutrition Index Score; nPCR: tasa de catabolismo proteico normalizado; OH: sobrehidratación relativa; RAC: recto anterior del cuádriceps; SPPB: Short physical performance battery.
Respecto a la fuerza palmar, todos los pacientes fueron capaces de realizar la medición. En conjunto, el 42,1% de los pacientes presentó una fuerza palmar disminuida ajustada por sexo y fueron clasificados como pacientes en riesgo de sarcopenia. El valor medio fue de 19,1kg (DE 6,1) en mujeres y de 27,8 kg (DE 8,8) en hombres, con un 44% de los hombres y un 38,5% de las mujeres con una fuerza palmar disminuida. Observamos que los pacientes con handgrip disminuido eran mayores, aunque el 37,5% tenían menos de 65 años. De la misma forma, asociaban mayor comorbilidad, peor nutrición por la escala MIS y peores puntuaciones de fragilidad y capacidad funcional por escala FRAIL y SPPB. De igual modo, tenían una tendencia a menor masa muscular medida por ecografía y menor masa magra estimada por bioimpedancia. En el grupo de riesgo, un 75% de los pacientes tenía un IMMEA disminuido, con diferencias estadísticas significativas respecto al grupo sin riesgo. Estos pacientes son los clasificados como sarcopénicos (handgrip disminuido+IMMEA disminuido), que en nuestra cohorte suponen el 31,6%. En parámetros de hidratación se objetivó una tendencia a la sobrehidratación en el grupo de riesgo.
Respecto a los parámetros analíticos, los pacientes con riesgo de sarcopenia presentaban niveles más bajos de fósforo, con una tendencia a menores niveles de albúmina y prealbúmina, como valores subrogados de desnutrición (tabla 1). Pero hay una correlación negativa de la albúmina plasmática con la sobrehidratación en este grupo de pacientes (r2-0,26; p=0,046), que podría justificar su descenso. De igual manera, cabe observar que los pacientes con riesgo de sarcopenia presentan niveles más elevados de proteína C reactiva, sin correlación aparente con la sobrehidratación.
Las mediciones ecográficas del músculo recto anterior del cuádriceps (RAC) se resumen en la tabla 1 y destaca una reducción significativa del grosor (Y) sin cambios en el eje horizontal (X), con una tendencia a mayor grasa supramuscular. Los parámetros corregidos por estatura y superficie corporal de paciente se comportan de igual manera.
Los parámetros con mejor poder discriminativo de la medición ecográfica fue el eje Yestatura (AUC 0,78; IC 95%: 0,63-0,93) y eje Y (AUC 0,78; IC 95%: 0,64-0,93) (fig. 2).
El poder discriminativo de las estimaciones obtenidas por bioimpedancia (AF y LTI) para riesgo de sarcopenia por handgrip presentan curvas ROC similares, con valores de 0,81 y 0,75, respectivamente.
Valoración del estado nutricional según la escala MISLa media de la puntuación MIS era de 7,4 (DE 4,4), el 31,6% de los pacientes presentaban un riesgo grave de desnutrición (MIS >8) y un 34,2% riesgo moderado (MIS 6-8). No había diferencias significativas al estratificar por sexos (riesgo grave en mujeres 30,8% y de hombres 32,0%; p=0,6).
El ángulo de fase va disminuyendo con tendencia lineal significativa al progresar el riesgo de desnutrición por MIS (5 [DE 1,1] vs. 4,6 [DE 1.2] vs. 3,7 [DE 0,7]; p=0,03). La medición de la grasa supramuscular disminuyó a medida que aumentó el riesgo medido por MIS (10,5 [DE 5,7] vs. 6,9 [DE 3,3] vs. 6,3 [DE 2,5]; p=0,03). No se encontraron diferencias significativas en el resto de los parámetros medidos por ecografía.
Correlación de parámetros nutricionales, funcionales y datos ecográficosNo se objetivó relación entre la albúmina, proteínas totales, vitamina D y el IMC con parámetros ecográficos; solo la prealbúmina se correlacionó positivamente con la medición ecográfica del grosor del cuádriceps eje Y con una r2 de 0,11 (p=0,04).
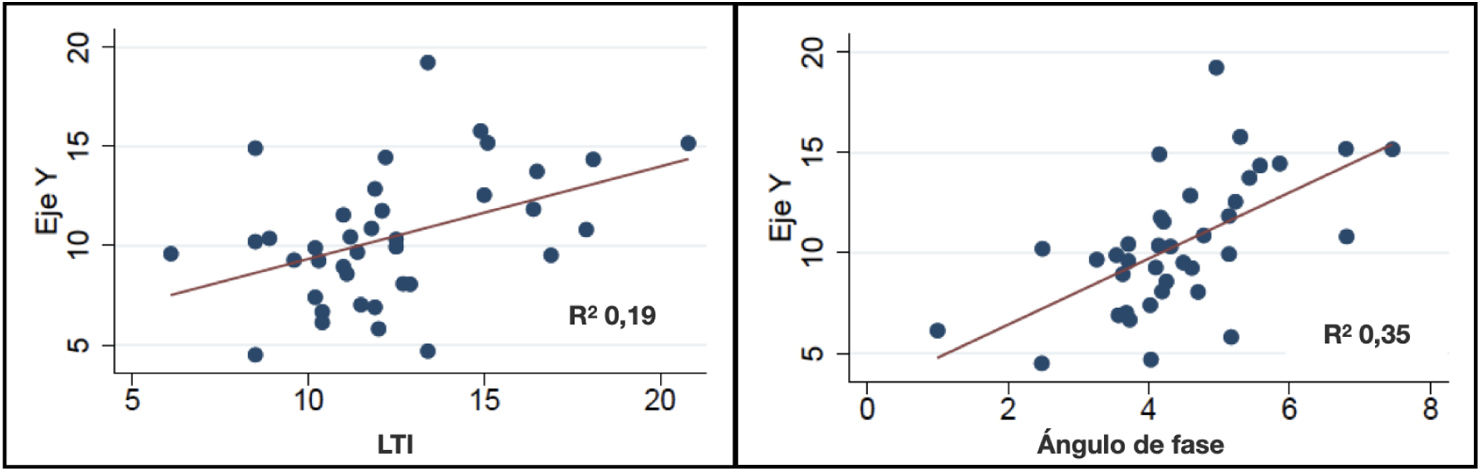
El análisis de correlación de los valores obtenidos por ecografía como eje Y del RAC tiene una adecuada correlación con el ángulo fase, algo similar pasa con el eje Y corregido por superficie corporal y estatura (fig. 3). Es importante recalcar que la valoración ecográfica de la grasa supramuscular mostró una adecuada correlación con el FTI (r2-0,51; p≤0,001) y fue negativa con el LTI (r2-0,13; p=0,02).
Al separar en pacientes frágiles y no frágiles según la escala FRAIL, los pacientes frágiles tienen un menor grosor del cuádriceps (eje Y: 8,8mm [DE 3,3] vs. 11,3mm [DE 3,1]); p=0,03). Si hacemos el análisis según su estado funcional medido por SPPB, los pacientes con una limitación grave (SPPB≤6) presentan un eje Y menor de 7,82mm (DE 2,6) frente al resto (11,5mm; DE 3,0; p=0,04.
DiscusiónHemos observado que casi la mitad de nuestros pacientes en DP presentan una fuerza palmar compatible con riesgo de sarcopenia, que se asocia con la edad, la comorbilidad cardiovascular, la fragilidad evaluada por escalas y la desnutrición/inflamación. Sin embargo, existe un considerable porcentaje de pacientes menores de 65 años que presentan una fuerza muscular disminuida, lo que apoya la teoría de una senescencia acelerada con sarcopenia precoz. Sabemos que existe una relación no lineal entre la edad cronológica y la fuerza palmar desde la infancia hasta la senescencia24, pero carecemos de puntos de corte específicos en población con enfermedad renal.
Estudios previos en el ámbito de la ERC describen una elevada prevalencia de sarcopenia que se asocia a peores resultados clínicos, con aumento de la discapacidad, fragilidad y mortalidad. En nuestro estudio, el 31,6% se clasifica como sarcopénicos (handgrip disminuido+IMMEA disminuido), valores algo más elevados que los publicados en esta población específica, pero sabemos que los estudios sobre la prevalencia de sarcopenia en pacientes en diálisis arrojan resultados muy variables, dependiendo de las poblaciones, los métodos utilizados para medir la masa muscular y los criterios de diagnósticos10.
En un metaanálisis que analiza la prevalencia de sarcopenia en la ERC, se observó que el 46,5% de los pacientes en DP presentaban riesgo de sarcopenia, datos similares a los de nuestra población. De igual manera, observaron que, de los pacientes en hemodiálisis, un 51,5% presentaba riesgo, porcentaje que disminuye en los pacientes ERC sin diálisis, con una prevalencia del 19,6%25. Por ello, prevenir y diagnosticar de manera precoz este síndrome es primordial1,26. En este sentido, parece razonable que una técnica económica, inocua accesible y fácilmente reproducible, como la ecografía, sea utilizada rutinariamente por especialistas entrenados.
En la actualidad sabemos que el peso, la talla y el IMC, parámetros utilizados tradicionalmente en una valoración nutricional, no son bastante sensibles para detectar cambios tempranos en la composición corporal27. El método más expandido de diagnóstico de sarcopenia en la nefrología es la bioimpedancia, que estima el índice de masa magra, masa grasa y el estado de hidratación, a partir del cual, mediante fórmulas, es posible estimar la masa muscular esquelética apendicular. Para definir un descenso de la masa muscular, es necesario el cálculo de la MMEA, información obtenida mediante DEXA, pero, dado su elevado costo y la falta de disponibilidad, desde el punto de vista clínico, las guías nos recomiendan el uso de fórmulas a partir de la bioimpedancia. Nosotros nos hemos decantado por la fórmula de Lin, validada para su uso en pacientes en hemodiálisis, que presenta un elevado poder predictivo para el diagnóstico de sarcopenia19.
Es necesario recordar que la bioimpedancia puede verse artefactada por situaciones extremas de hidratación o cambios en la geometría corporal. En el caso de los pacientes en DP, por ejemplo, el abdomen lleno hace que se sobrestime el LTI28. Aunque el ángulo de fase ha demostrado ser el mejor marcador de desnutrición, que además refleja propiedades de las membranas celulares y el equilibrio entre agua intracelular y extracelular, este puede variar de forma fisiológica en función de la edad, el sexo, el IMC, la raza y en caso de valores extremos de composición corporal29,30. En otros estudios realizados en pacientes en DP con el objetivo de valorar la posibilidad de utilizar el bioimpedancia como sustituto de la valoración subjetiva global en el desgaste proteico energético, se ha objetivado que la sensibilidad y especificidad del bioimpedancia para distinguir a los pacientes malnutridos fue baja31. Por otro lado, aunque una medición de bioimpedancia precisa un tiempo similar al de la ecografía, tiene ciertas limitaciones, como la exclusión de determinados pacientes (prótesis o marcapasos) y un gasto de fungibles en cada medición.
En esta línea, el Grupo de Trabajo Europeo Sobre Sarcopenia (EWGSOP2) nombra la ecografía como una herramienta potencial para valorar la masa muscular con la ventaja de realizar al mismo tiempo una valoración cuantitativa y cualitativa16. Existen ya trabajos que validan su capacidad para estimar la masa muscular comparándola con la DEXA, la resonancia magnética y la tomografía computarizada32,33.
La ecografía se ha postulado como una herramienta asequible e inocua para valorar parámetros de composición corporal, por lo que su uso se está extendiendo rápidamente en especialidades como la nefrología. La asociación de la ecografía a pie de cama con otras herramientas ya contrastadas, como la bioimpedancia, permiten una mejor valoración de nuestros pacientes. Sin embargo, es necesario definir los puntos de corte específicos para nuestra población, el plan de seguimiento más eficiente y el valor predictivo de estos parámetros sobre los episodios clínicos.
La ecografía muscular del RAC es una técnica inocua y asequible que correlaciona bien con los estimadores clásicos por impedanciometría (LTI y ángulo de fase) y tienen el mismo valor predictivo de riesgo de sarcopenia. Existen pocos estudios previos publicados sobre la ecografía de masa muscular en pacientes en diálisis o enfermos renales. El grupo de Souza comparó la ecografía con la tomografía y encontró una diferencia de 3,97mm, con una fuerte correlación entre ambos métodos en pacientes prediálisis32. En población en hemodiálisis se ha demostrado que la ecografía del recto anterior del cuádriceps discrimina a pacientes con síndrome de desgaste proteico según el grosor del músculo y su área34. A pesar de ser una técnica emergente y atractiva por su facilidad de uso, en la actualidad carecemos de puntos de corte y protocolos definidos, lo que dificulta aplicarla en la práctica clínica diaria.
Proponemos el valor del grosor del RAC (eje Y) como el parámetro más relevante para el seguimiento de la estimación de masa muscular. La pérdida de masa del RAC estimada por área es significativa, pero el eje Y resulta más discriminativo, ya que el músculo sarcopénico es más flácido y, aunque mantiene el eje X, pierde grosor y aumenta la grasa supramuscular. Los análisis del eje Y se confirman en los índices corregidos por estatura o superficie corporal del paciente, necesarios para su estandarización.
Nuestro trabajo describe por primera vez la utilidad de la ecografía para valorar la masa muscular en pacientes en DP. El grupo de trabajo SARCUS propone protocolizar los diferentes parámetros para establecer medidas más homogéneas que permitan analizar los datos de una forma más universal35.
En nuestro análisis observamos que la evaluación por ecografía muscular del cuádriceps demostró ser un buen indicador de la masa muscular total del paciente, con una buena correlación con la masa magra medida por bioimpedancia y con la fuerza muscular evaluada por handgrip. Es precisamente esta fuerza, medida por dinamometría, la que el grupo EWGSOP2 recomienda como herramienta práctica para definir intervenciones, ya que este parámetro se asocia de manera independiente a resultados adversos en población general, como los ingresos hospitalarios prolongados, el mal desempeño funcional, la disminución en la calidad de vida y el aumento en la mortalidad36. La dinapenia (reducción de fuerza medida por handgrip) y la sarcopenia (pérdida de fuerza y masa muscular) no son conceptos idénticos, aunque el criterio práctico del EWGSOP2 señala la dinapenia como el parámetro más accesible que identifica el riesgo y, por sí mismo, nos debe impulsar a intervenir y proteger al paciente.
Igualmente observamos como los pacientes catalogados como frágiles presentaron una masa muscular del cuádriceps significativamente disminuida medida por ecografía respecto a los no frágiles. Esto también se mantiene al analizar el grosor del cuádriceps (eje Y) según su capacidad funcional medido por SPPB.
Cabe destacar que la medición de la grasa supramuscular del muslo se correlacionó adecuadamente con parámetros de grasa medidos por bioimpedancia, por lo que, además de medir la masa muscular, podemos tener una referencia de la grasa corporal global.
Cabe afirmar que existe una adecuada relación de los valores obtenidos por ecografía respecto a las múltiples herramientas utilizadas en la actualidad para valorar al paciente tanto desde el punto de vista nutricional como desde un abordaje integral. De igual forma hemos demostrado que la ecografía presenta una capacidad predictiva elevada para discriminar a pacientes con riesgo de sarcopenia. Hay que tener en cuenta que la ecografía por sí sola mide un punto del paciente, por lo que es necesario usarla junto con otras herramientas de cara a una adecuada valoración de la composición corporal.
Nuestro estudio está limitado por su naturaleza unicéntrica y por el tamaño muestral, algo común en España, donde las unidades tienen 20 pacientes de media y una permanencia en DP de solo 2 años. Además, se trata de una medición puntual que no tiene en cuenta la evolución de la técnica, si bien la definición de un protocolo de medición realizado por un único observador refuerza su validez interna. Es posible que nuestra realidad local, con perfiles de pacientes que provienen de hemodiálisis previa, expliquen parte de nuestros hallazgos, pero no podemos abordar subanálisis estratificados por grupos. Es necesario promover estudios multicéntricos para mejorar la potencia estadística y reducir la variabilidad, con el fin de definir puntos de corte de las pruebas diagnósticas de sarcopenia aquí propuestas para la población renal.
ConclusionesEl riesgo de sarcopenia es altamente prevalente en pacientes en DP y se relaciona con la edad, la comorbilidad, la desnutrición y la inflamación. La ecografía se postula como una herramienta accesible, segura, de bajo coste y fácil de utilizar a pie de cama en todos los ámbitos de la medicina clínica, ampliando la evaluación del estado de hidratación y volemia (POCUS) con la medición de parámetros musculares. Proponemos utilizar el grosor del músculo RAC (eje Y) como el mejor parámetro complementario, dada su buena correlación con el ángulo de fase y su valor diagnóstico de riesgo sarcopénico, comparable al de estimadores clásicos de impedanciometría.
Creemos que desde un abordaje multidisciplinar que englobe diferentes técnicas diagnósticas de sarcopenia lograremos una valoración más completa de nuestros pacientes en las unidades de DP. Nuestra experiencia puede servir de base a futuros estudios para definir puntos de corte específicos en DP y diseñar protocolos de seguimiento e intervención sobre la sarcopenia y la fragilidad de la población con enfermedad renal.
AutoríaTodos los firmantes cumplen los criterios de autoría propuestos por el International Committee of Medical Journal Editors (ICMJE), son responsables del trabajo y han dado su aprobación a esta versión.
FinanciaciónEste estudio ha sido financiado por «Unrestricted Grants» de FRIAT, Nipro y ViforSCL a través de la Fundación Madrileña de Nefrología, así como del Instituto de Investigación Puerta de Hierro Segovia de Arana (IDIPHISA). Ha sido financiado parcialmente a través de RICORS RD21/0005 y RD24/0004.
Conflicto de interesesJP ha recibido apoyo para congresos e investigación de Vifor CSL y Astellas, pero no supone conflicto con el contenido del presente artículo. El resto de los autores no tienen ningún conflicto de interés en el área de conocimiento del presente trabajo.
Cumplimiento de guías éticasEl presente estudio ha sido aprobado por el CEIm del Hospital Puerta de Hierro (N° 16/2023) y se ha realizado de acuerdo con la Declaración de Helsinki, el International Council for Harmonization guidelines for Good Clinical Practice y las regulaciones locales aplicables.
Los autores agradecen el apoyo de la Fundación Madrileña de Nefrología y del grupo colaborativo GCDP en la elaboración del presente artículo.