Objetivo: Comparar la dinámica de la secreción de calcio-PTH in vivo e in vitro de glándulas paratiroideas hiperplásicas. Materiales y métodos: Se estudiaron 7 pacientes con hiperparatiroidismo secundario y las 23 glándulas hiperplásicas obtenidas tras paratiroidectomía de estos mismos pacientes. Estudios in vivo de la curva de secreción de PTH se obtuvieron con inducción de hipocalcemia e hipercalcemia con infusiones intravenosas continuas de EDTA sódico y gluconato de calcio, respectivamente. Para los estudios in vitro se emplearon pequeñas piezas de paratiroides de 1 mm que se transfirieron secuencialmente a concentraciones de calcio variables: 0,4, 0,6, 0,8, 1, 1,25 y 1,50 mM, determinándose la concentración de PTHi en el medio. Resultados: Las curvas de secreción de PTH in vivo e in vitro fueron sigmoidales y similares, aunque el set point in vivo era más alto que el in vitro (1,57 ± 0,05 frente a 1,27 ± 0,07 mM; p <0,001). El grado de inhibición máxima de PTH fue similar en ambas circunstancias (30,5 ± 8,1 frente a 33,6 ± 5,4%; p = NS), con una correlación directa significativa (r = 0,901; p <0,01). El set point in vivo no se correlacionaba con las concentraciones de PTH basales, aunque se correlacionó significativamente con las concentraciones basales de calcio sérico (r = 0,62; p <0,02). Conclusiones: El set point in vivo del calcio está más relacionado con la concentración sérica de calcio que con la concentración basal de PTHi. Aunque hay diferencias entre el set point de calcio in vivo e in vitro, el grado máximo de inhibición de PTH y la curva sigmoidal fueron similares en las dos circunstancias.
Aim: To compare the dynamics in vivo and in vitro calcium-PTH release of uremic patients with secondary hyperparathyroidism and their hyperplasic parathyroid glands after parathyroidectomy. Materials and methods: Seven patients with secondary HPT and their 23 hyperplasic glands obtained after surgical parathyroidectomy were evaluated. In vivo studies of the PTH secretion curve were obtained by induction of hypocalcemia and hypercalcemia with a continuous endovenous infusion of sodium EDTA and Ca gluconate, respectively. For the in vitro studies, small parathyroid pieces of 1 mm were sequentially transferred to wells with varying Ca concentrations: 0.4, 0.6, 0.8, 1, 1.25 and 1.5 mM. iPTH concentrations were determined in the medium. Results: The in vivo set point did not correlate with the basal, maximal or minimal PTH concentrations, although it correlated significantly with the basal serum Ca concentration (r = 0.62, p <0.02). Both in vivo and in vitro PTH secretion curves were sigmoidal, although the in vivo set point was higher than the in vitro (1.57 ± 0.05 vs. 1.27 ± 0.07 mM, p <0.001). The degree of maximal PTH inhibition were similar in both circumstances (30.5 ± 8.1 vs. 33.6 ± 5.4 %; p = NS) with a significant direct correlation (r = 0.901; p <0.01). Conclusions: The in vivo set point of calcium is more closely related to serum calcium concentration than to basal iPTH concentration. Although there are differences between the in vivo and in vitro calcium set point the maximal degree of PTH inhibition was similar in both circumstances.
INTRODUCCIÓN
La secreción de hormona paratiroidea (PTH) está modulada, entre otros, por el calcio iónico extracelular que interactúa a través del receptor-sensor de calcio de la célula paratiroidea1,2. Se sabe que la dinámica de la secreción de PTH en respuesta a los cambios de la concentración de calcio sérico es anormal en las glándula paratiroideas hiperplásicas3 y que éstas muestran una reducción en el número de receptores de calcio4-7. Fisiológicamente, la relación entre la secreción de PTH y la concentración de calcio extracelular está definida por una curva sigmoidea. Así, la disminución de la concentración de calcio produce un aumento en la secreción de PTH hasta que alcanza un máximo; por el contrario, el aumento de la concentración de calcio reduce la secreción de PTH hasta un mínimo. El set point de la secreción de PTH suele definirse como la concentración de calcio extracelular requerida para disminuir la secreción de PTH máxima a un 50%3,8, aunque también se ha definido como la concentración sérica de calcio requerida para disminuir la secreción de PTH a la mitad de la diferencia entre el máximo y el mínimo9,10. En cualquier caso, el set point de la secreción de PTH define la sensibilidad de la glándula paratiroides a la concentración de calcio extracelular11.
La comparación in vivo frente a in vitro de la respuesta de PTH regulada por calcio en pacientes urémicos con hiperparatiroidismo secundario ha sido muy poco evaluada.
El objetivo de este trabajo es comparar la dinámica de la secreción de PTH regulada por calcio de un grupo de pacientes urémicos con hiperparatiroidismo secundario y sus glándulas paratiroides hiperplásicas obtenidas tras paratiroidectomía.
MATERIAL Y MÉTODOS
Se incluyeron 7 pacientes urémicos con hiperparatiroidismo secundario, 5 hombres y 2 mujeres, con una edad media de 45 ± 15 años. Los valores séricos basales medios fueron: PTHi 1.151 ± 375 pg/ml, Ca sérico 10,8 ± 0,7 mg/dl, P 5,34 ± 1,38 mg/dl. En el momento del estudio ningún paciente estaba recibiendo vitamina D ni análogos de vitamina D.
Tras la paratiroidectomía se obtuvieron 23 glándulas paratiroideas hiperplásicas.
Inmediatamente tras la resección, las glándulas paratiroideas se separaron en varias alícuotas e incubaron a 4 °C en RPMI con concentraciones de calcio de 1,5 mM durante 16-18 horas hasta que se realizaba el estudio in vitro. De las varias alícuotas incubadas de cada glándula, una de ellas se utilizó para la evaluación de la secreción de PTH in vitro.
Evaluación de la secreción de PTH regulada por calcio in vitro
Medio de incubación
La alícuota de tejido paratiroideo se cortó en piezas de aproximadamente 1 mm3 que se separaron en pocillos individuales de nylon, cada uno de ellos con un medio de incubación de 2 ml a 37 °C (AOS-0, SBS Instruments S.A., Badalona, España). El medio de incubación era una solución tamponada (pH = 7,4) que contenía (en mM): NaCl 125, KCl 5,9, MgCl2 0,5, NaH2PO4 Na2HPO4 (1:2) 1, Napiruvato 441, glutamina 4, glucosa 12, Hepes 25 con insulina rápida 0,1 U/ml, albúmina sérica bovina 0,1%, penicilina G 100 U/ml, estreptomicina 100 Tg/ml y CaCl2 en rangos desde 0,4 hasta 1,5.
Secreción de PTH regulada por calcio
Tras 5 horas de incubación, el tejido paratiroideo se transfirió secuencialmente a intervalos de 1 hora a otros pozos que contenían soluciones con concentraciones variables de calcio: 0,4, 0,6, 0,8, 1,0, 1,25, y 1,35 o 1,5 mM. La concentración de calcio se confirmó en cada experimento con la medición del calcio ionizado usando un electrodo selectivo (modelo 634, Ciba Corning, Essex, Reino Unido). El calcio ionizado en el medio se mantuvo constante durante la hora de incubación. La concentración de PTHi en el medio de incubación se midió usando el equipo humano PTHi IRMA (Nichols, Institute, San Juan Capistrano, CA, EE.UU.), con un coeficiente de variación intraensayo e interensayo del 4,3 y del 4,7%, respectivamente.
Evaluación de la secreción de PTH regulada por calcio in vivo
La curva de secreción de PTH regulada por calcio in vivo se obtuvo en 7 pacientes renales con hiperparatiroidismo secundario. Para determinar la máxima secreción de PTH inducida por hipocalcemia, se hizo una infusión intravenosa continua de EDTA sódico diluido en dextrosa en agua destilada al 5% a una tasa inicial de 20 mg/kg/h con incremento de 5 mg/kg/h cada 10 minutos durante un período de 60 minutos. Una semana después, la secreción mínima de PTH inducida por hipercalcemia se determinó con una infusión intravenosa de gluconato de calcio en dextrosa en agua destilada al 5% a una tasa inicial de 6 mg/kg/h con incrementos de 3 mg/kg/h cada 10 minutos durante 60 minutos. Durante los experimentos se tomaron muestras de sangre para concentraciones de calcio ionizado y PTHi a los 0, 5, 10, 15, 20, 25, 30, 40, 50 y 60 minutos. Se registraron los valores individuales de PTHi y calcio ionizado durante la hipocalcemia o la hipercalcemia, y se realizó la curva de secreción paratiroidea.
Terminología
Se utilizaron los siguientes términos: 1) PTH basal, el nivel de PTH antes de la inducción de hipocalcemia o hipercalcemia; 2) PTH máxima, el nivel más alto de PTH observado en respuesta a la hipocalcemia y que una reducción de la concentración de calcio sérico no lograba aumentar más el valor de PTH; 3) PTH mínima, el nivel de PTH mínimo durante la supresión por la hipercalcemia y que los aumentos posteriores de calcio sérico no lograban disminuir más su valor; 4) el set point de la secreción de PTH se calculó de dos maneras: una como la concentración de calcio sérico a la cual la secreción de PTH máxima se reducía a un 50% y otra como la concentración de calcio que reducía la secreción de PTH a la mitad entre la secreción máxima y la mínima3.
La PTHi se determinó mediante IRMA (Allegro, Nichols Institute, San Juan Capistrano, CA, EE.UU.). El calcio iónico sérico fue medido con un electrodo selectivo de calcio (Ciba Corning c-634). El calcio sérico total y el fósforo se midieron con técnicas de laboratorio estándar.
Reactivos
El RPMI se adquirió a Biowhittaker, Vervier, Bélgica, el PBS a Oxoid, Hampshire, Reino Unido y los demás reactivos provienen de Sigma, St. Louis, MO, EE.UU.
Análisis estadístico
Los valores se expresan en media ± DE. Se emplearon ANOVA y test de Duncan para comparar promedios múltiples. El test de la t no pareado se usó para evaluar las diferencias entre promedios de grupos. La correlación entre dos variables se evaluó por análisis de regresión lineal.
RESULTADOS
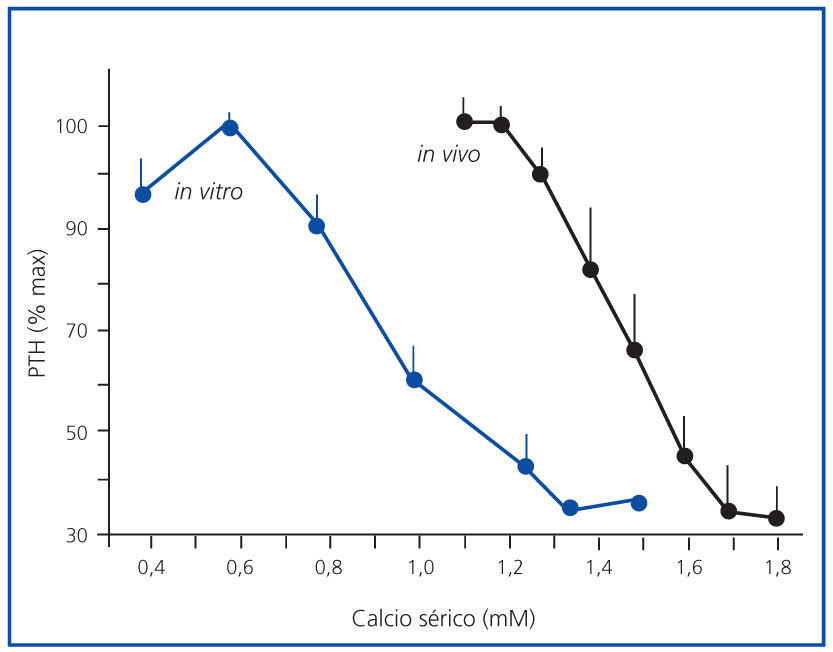
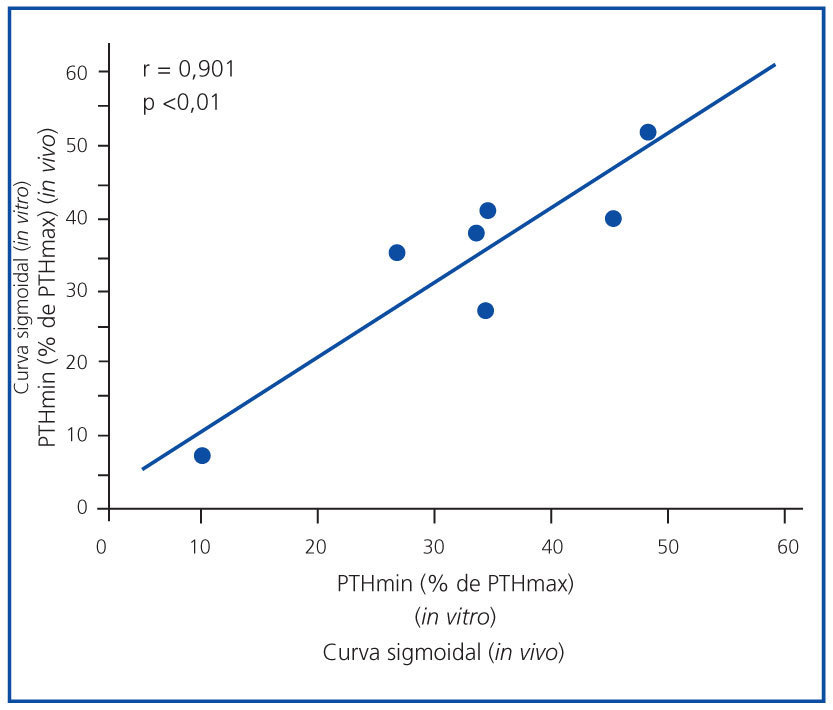
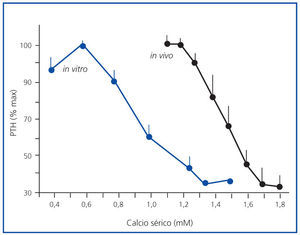
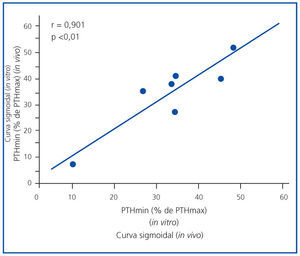
En la figura 1 se expone la media de las curvas de la dinámica de la secreción de PTH regulada por calcio in vivo de los 7 pacientes urémicos con hiperparatiroidismo secundario y la media de las curvas in vitro de las glándulas obtenidas. Para facilitar la comparación entre los estudios in vivo e in vitro, la secreción de PTH se representa como un porcentaje de la estimulación máxima. Las curvas in vivo e in vitro fueron sigmoidales y muy similares. Por otro lado, el grado de inhibición máxima de PTH (PTH mínima) fue similar en ambos experimentos, 30,5 ± 8,1 frente a 33,6 ± 5,4% in vivo e in vitro, respectivamente (p = NS), con una correlación directa muy significativa (r = 0,91; p <0,01) (figura 2).
En los tejidos paratiroideos de glándulas hiperplásicas, el aumento del calcio extracelular in vitro produce una disminución en la secreción de PTH que aparece con niveles de calcio tan bajos como 0,8 mM y una inhibición máxima de secreción de PTH con calcio sérico de 1,25 mM.
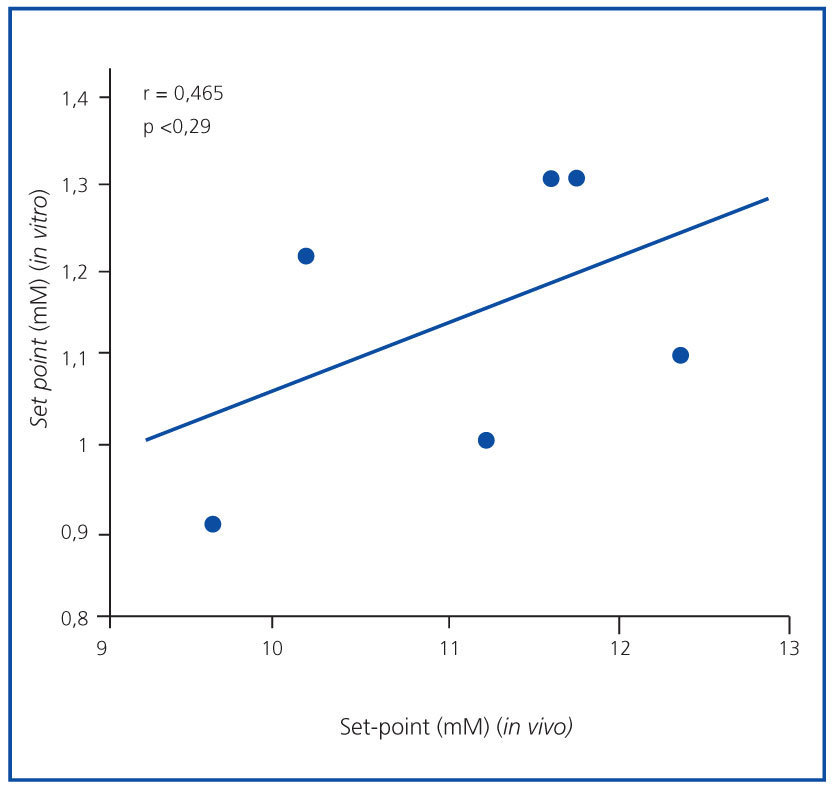
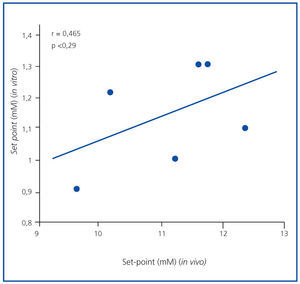
El set point de secreción de PTH fue mayor en el estudio in vivo que en el in vitro. El promedio del set point de secreción de PTH in vivo fue 1,57 ± 0,05 mM, superior al valor in vitro, que fue de 1,27 ± 0,07 mM (p <0,001), sin correlación significativa (r = 0,465; p = NS) (figura 3). Resultados similares se obtuvieron cuando el set point se calculó como la concentración de calcio que reducía la secreción de PTH a la mitad de la secreción máxima y la mínima (1,46 ± 0,05 in vivo frente a 0,92 ± 0,05 mM in vitro; p <0,001)
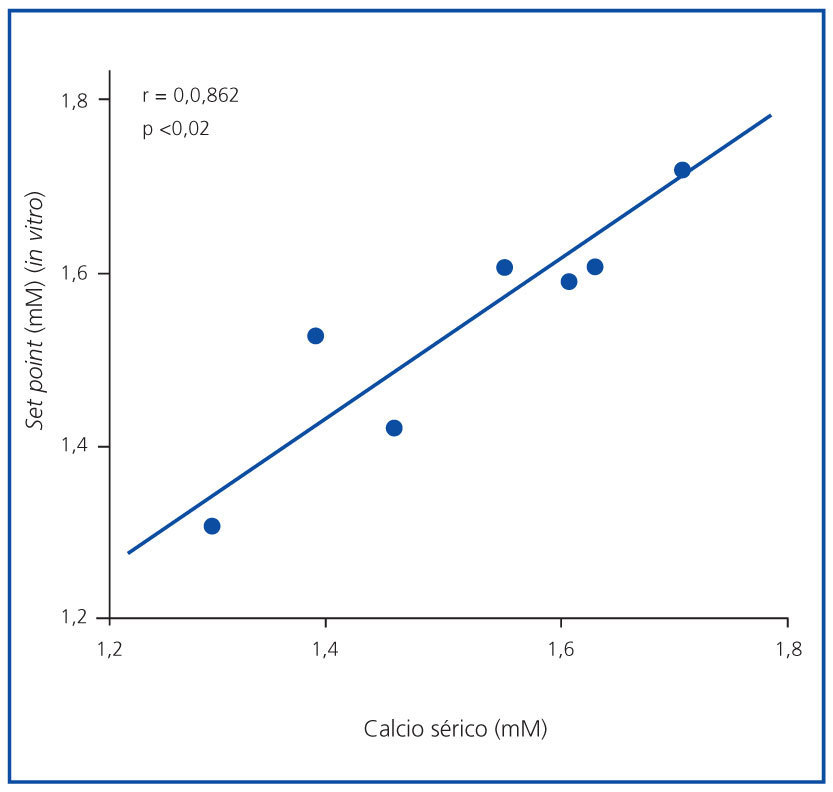
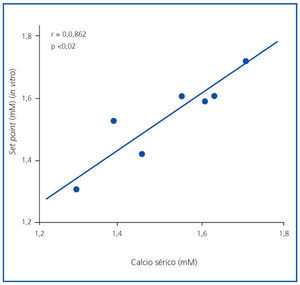
El set point in vivo no se correlacionó con las concentraciones de PTH basales, máximas o mínimas (el valor de R fue 0,403, 0,229 y 0,624, respectivamente), aunque se correlacionó significativamente con la concentración de calcio sérico basal (r = 0,862; p <0,02) (figura 4).
DISCUSIÓN
Las células paratiroideas responden, tanto in vivo como in vitro, a concentraciones crecientes de calcio iónico extracelular, con una rápida disminución de la secreción de PTH, y a concentraciones decrecientes de calcio iónico extracelular a un rápido aumento de la secreción de PTH. Este efecto se encuentra mediado por una interacción directa de los iones de calcio con el receptor-sensor de calcio.
Esta relación entre la secreción de PTH y la concentración de calcio extracelular se puede expresar con una curva sigmoidea. Asimismo, la sensibilidad de la glándula paratiroides a la concentración de calcio extracelular puede definirse por el set point de calcio que se suele expresar como la concentración de calcio requerida para disminuir la secreción máxima de PTH a la mitad3,5, si bien también se puede expresar como la concentración sérica de calcio requerida para disminuir la secreción de PTH a la mitad de la diferencia entre el máximo y el mínimo6,7,11.
Existen diferentes estudios en los que se demuestra, tanto in vivo como in vitro, que la respuesta de la PTH a la concentración de calcio es anormal en pacientes con hiperparatiroidismo primario13,14 y en pacientes urémicos con hiperparatiroidismo secundario15-17.
Otro estudio in vitro mostró una rápida regulación a la baja entre la expresión de los receptores sensibles al calcio extracelular y la concentración de calcio extracelular18.
Estudios in vitro usando células paratiroideas aisladas de adenomas de glándulas hiperplásicas demostraron que el set point de la secreción de PTH era mayor que en el tejido paratiroideo normal, lo que sugiere una anormal regulación de la secreción de PTH regulada por calcio13-17. Sin embargo, un estudio in vivo en el que se comparaban voluntarios sanos y pacientes afectados de enfermedad renal crónica con hiperparatiroidismo secundario no encontró diferencias en el set point de calcio de ambos grupos19.
Otros trabajos recientes han referido que los calcimiméticos, en estudios en ratas urémicas con hiperplasia de paratiroides, son capaces de incrementar el ARNm del receptor-sensor de calcio20. Asimismo, otro trabajo reciente ha comunicado que los calcimiméticos (Cinacalcet), en pacientes urémicos con hiperparatiroidismo secundario, son capaces de aumentar la sensibilidad de la glándula al efecto inhibitorio del calcio reduciendo el set point del calcio21.
La gran mayoría de trabajos que valoran la curva sigmoidal de secreción de PTH y el set point del calcio se han realizado in vitro o in vivo, pero la información que relaciona los resultados in vivo con los obtenidos in vitro es muy escasa.
En el presente estudio se compara la dinámica de la secreción de PTH in vivo (curva PTH-calcio) de pacientes urémicos con hiperparatiroidismo secundario con la dinámica obtenida in vitro usando glándulas paratiroideas hiperplásicas de estos mismos pacientes tras la resección quirúrgica.
Aunque las formas de las curvas sigmoidales PTH-calcio fueron muy similares, el set point in vivo y la curva completa se desplazó a la derecha comparada con la curva obtenida in vitro. Sin embargo, en los estudios hubo una estrecha correlación entre la inhibición máxima de PTH obtenida in vitro e in vivo.
Se acepta que los valores de PTH máxima in vivo son un reflejo de la masa de la glándula paratiroidea3; además hay que tener en cuenta que in vivo el resultado probablemente muestra una respuesta combinada de todas las glándulas. En cambio, in vitro los resultados sólo reflejan la respuesta de una glándula determinada, lo que explicaría el hecho de que en nuestro estudio obtengamos curvas similares in vivo e in vitro, pero con un mayor set point y la curva más desplazada a la derecha en los estudios in vivo.
Nuestro estudio muestra también que el set point de la secreción de PTH regulada por calcio en pacientes con hiperparatiroidismo secundario se correlacionó de forma significativa con el calcio sérico basal, lo que confirma observaciones previas de pacientes en hemodiálisis22. Estos resultados sugieren que el set point in vivo de la secreción de PTH regulada por calcio está relacionado de una manera más cercana con la concentración de calcio sérico que con la severidad del hiperparatiroidismo secundario evaluada por el nivel de PTH en sangre. De ello se deduce que probablemente la glándula paratiroidea hiperplásica sería capaz de adaptarse a la concentración de calcio sérico, ya que las modificaciones del calcio sérico se asociaron con un cambio paralelo en el set point de la secreción de PTH23. Así pues, con los datos de nuestro estudio y otros publicados24 podemos considerar que el grado de hipercalcemia y el aumento del set point en la secreción de PTH probablemente reflejan mejor la severidad del hiperparatiroidismo secundario.
En conclusión, el set point in vivo del calcio está más relacionado con la concentración sérica de calcio que con la concentración basal de PTH. Aunque hay diferencias entre el set point de calcio in vivo e in vitro, el grado máximo de inhibición de PTH y la dinámica de la secreción de PTH regulada por el calcio fueron similares en las dos circunstancias.
Figura 1. Curva sigmoidal (in vivo e in vitro).
Figura 2. Correlación curva sigmoidal (in vivo frente a in vitro).
Figura 3. Correlación set point (in vivo frente a in vitro).
Figura 4. Correlación calcemia-set point (in vivo).