Introducción: Los pacientes trasplantados eligen diálisis peritoneal (DP) en menor proporción que los incidentes. Objetivo: Describir la supervivencia en técnica de los postrasplantados (post-TX) y estudiar los factores predictores de transferencia a hemodiálisis (HD). Método: Estudio observacional, multicéntrico de incidentes (2003-2010). Variable principal: Paso a HD. Comparación post-TX frente a DP-de novo. Pacientes: 906 pacientes (54,8 años, 64,9% hombres) de 19 centros, con seguimiento hasta siete años, un 8,4% receptores de trasplante. Etiologías: glomerulonefritis 25,4%, nefropatía diabética 16,7%, vascular 10,7%, intersticial 13,6%, poliquistosis renal 11,2%. Comorbilidad: índice de Charlson 5,1 (desviación estándar, DE = 2,4), el 21,6% con diabetes mellitus (DM), el 24,0% con evento cardiovascular previo. El 71,6% inician en diálisis peritoneal continua ambulatoria (DPCA) y el resto en automática. Al mes de inicio, la función renal (FR) es 7,3 (DE = 3,8) ml/min, Kt/V 2,6 (DE = 0,7), y el ClCr 96,3 (DE = 35,3) l/semana x 1,72 m2. Resultados: El mantenimiento en técnica estimado por KM es de 1,85 años, con un intervalo de confianza (IC) al 95% de [1,68-2,02] para la salida por cualquier causa y de 5,46 años [4,42-6,50] para transferencia a HD. Durante el seguimiento fueron sometidos a trasplante 306 pacientes (0,49 trasplantes por año en lista) y pasaron a HD 154. El mejor modelo de regresión de Cox para paso a HD incluye: DM con Hazard ratio (HR) 1,69 [1,19-2,40], trasplante previo: 1,63 [1,01-2,63] y edad 1,01 [1,00-1,02]. Los post-TX son más jóvenes (43,8 frente a 55,3 años) y con menos comorbilidad (DM 18,4 frente al 21,9%; CV 15,8 frente al 24,7%). Sin embargo, presentan menos FR al inicio, 5,10 frente a 7,46 ml/min, y mayor pérdida de FR. Los pacientes post-TX pasan a HD en mayor proporción (28,9 frente al 15,8%; p <0,006). Limitaciones: Estudio observacional, ausencia de protocolo común para paso a HD. Conclusión: La DP parece ser una buena técnica inicial por su baja mortalidad y alta tasa de trasplantes. Aunque el riesgo de paso a HD es mayor en los post-TX, el tiempo que pasan en DP es suficiente para considerarla como una buena opción de diálisis.
Background: Peritoneal dialysis (PD) seems to be a good option to initiate renal replacement therapy (RRT), but patients with graft failure choose PD less frequently than incident patients (de novo). Objective: To describe patient movements between PD and kidney transplantation (TX) and risk factors for failure of the PD technique. Method: Multicentre observational study of patients starting PD between 2003 and 2009 with follow-up until January 2010. Survival analysis based on switching from PD to HD as an event using Kaplan-Meier (KM) and forward, stepwise Cox proportional hazards models. Hazard ratio and 95% confidence intervals (HR [CI]) are shown. Main variable: Switch from PD to HD. Two-group comparison: PD post transplant (post-TX) patients (76) compared to pure incident PD (de novo-PD) patients (830). Patients: 906 PD patients from 19 public hospitals with a mean age of 54.8 years (64.9% male); main ESRD aetiology: glomerulonephritis (25.4%), diabetes (16.7%), vascular-ischaemic (10.7%), interstitial (13.6%) and polycystic (11.2%). Comorbidity conditions: Charlson Index 5.1 (SD 2.4); 21.6% diabetes mellitus (DM), 24.0% cardiovascular (CV) events. Results: Mean follow-up period on PD: 1.85 years (95% CI [1.68-2.02 years]). KM estimation for switching to HD due to PD failure was 5.46 years [4.42-6.50 years]. At the end of follow-up, 88 patients had died, 154 had been transferred to HD and 306 had received a graft (annual rate for patients on waiting list: 0.49 TX per year on PD). The best Cox multivariate model for switching from PD to HD includes: post-TX (HR: 1.63 [1.01-2.63]), DM (HR: 1.69 [1.19-2.40]) and age (1.01 [1.00-1.02]) per year. Post-TX patients were younger (43.8 years vs 55.3 years) and with less comorbidity conditions than de novo-PD patients (DM 18.4% vs 21.9%; CV 15.8% vs 24.7%). However post-TX patients had worse clinical evolution with a rapid decline of renal function (¿-3.88 vs –1.8ml/min per year); a higher admission rate (0.9 vs 0.62 per year) but similar peritonitis rate (0.45 vs 0.53 episodes per year). They also needed to be transferred to HD more frequently (28.9% vs 15.8%; P<.006) and needed more time to TX (4.8 years vs 1.7 years, Kaplan-Meier). Consequently, time spent on PD was higher in the post-TX group (2.8 vs 1.8 year). Limitations: Observational study with absence of a standard protocol to switch PD-HD. Conclusion: PD seems to be a good first choice technique due to low mortality and high TX ratio in our area. A previous graft failure is associated with a higher rate of PD-failure but time spent on PD is enough to consider this technique as a good option.
INTRODUCCIÓN
A pesar de los avances en la terapia inmunosupresora en las últimas décadas, cada año un 4% de pacientes trasplantados presentan fallo del injerto y precisan reiniciar diálisis1,2. Debido al incremento de pacientes trasplantados, esta situación es cada vez más frecuente.
La vuelta a diálisis tras fracaso del injerto es una situación difícil de aceptar por el paciente y por el propio nefrólogo, lo que contribuye a posponer esta decisión. Por ello estos pacientes suelen presentar una peor situación clínica que justifica una mayor mortalidad precoz que los que inician diálisis de novo3. Ésta se debe fundamentalmente a complicaciones cardiovasculares (CV) y a infecciones4. Los factores que aumentan el riesgo de muerte en estos pacientes son: la edad más avanzada, el género femenino, la diabetes, la insuficiencia cardíaca, la hipoalbuminemia y un mayor grado de anemia4-7. Por otro lado, hay una serie de factores de riesgo específicos, como son el tiempo pasado en diálisis previamente, el tratamiento inmunosupresor prolongado y la pérdida más rápida de la función renal residual8,9.
No está claro cuál es la modalidad óptima de tratamiento renal sustitutivo (TRS) para los pacientes que retornan a diálisis por fracaso del trasplante10. Los estudios publicados al respecto tienen múltiples limitaciones: se incluyen pocos pacientes, no son multicéntricos, no se realiza un buen ajuste entre grupos y, con frecuencia, no se registran con detalle datos clínicos relevantes. Por otro lado, no disponemos de estudios específicos en nuestra área, y la realidad de cada país puede ser muy diferente. En el momento actual, no existe evidencia de que la modalidad de diálisis influya en la supervivencia del paciente que retorna a diálisis tras el fallo del injerto11. Para estos pacientes, la diálisis peritoneal (DP) puede ser tan válida como la hemodiálisis (HD) y debería ser considerada como una opción que permita mantener su autonomía. Sin embargo, la realidad es que la mayoría de los pacientes que vienen del trasplante reinician su tratamiento renal sustitutivo TRS en HD11.
El presente estudio analiza la evolución de los pacientes que inician DP tras el fallo de un injerto renal en 19 hospitales de la zona centro y pretende aportar datos propios y actuales sobre este controvertido tema.
PACIENTES Y MÉTODOS
Se trata de un estudio observacional, multicéntrico, con muestreo sistemático consecutivo de enfermos pertenecientes a las distintas áreas sanitarias que componen los hospitales que conforman el Grupo Centro de Diálisis Peritoneal (GCDP) y con un seguimiento máximo de siete años. Este grupo está integrado por 19 hospitales públicos de la región centro de España, que atienden un área de salud global de 8,8 millones de habitantes.
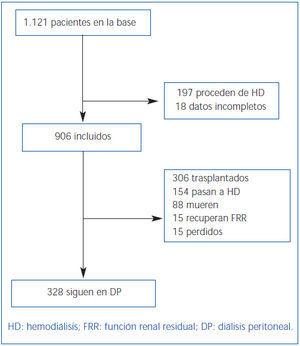
Durante siete años (desde enero de 2003 hasta enero de 2010) se recogen todos los pacientes que inician DP procedentes de trasplante (grupo post-TX) o de novo (grupo DP-de novo); los pacientes que provienen de HD no han sido incluidos. Los pacientes son seguidos hasta salida de técnica, fallecimiento o fin de estudio y sólo se recoge un 1,7% de pérdidas de seguimiento (figura 1). Al inicio se recogen parámetros demográficos, causa de la nefropatía, comorbilidad, procedencia y motivo de elección de técnica (libre o por indicación médica obligada debido a contraindicación para HD). Para estimar la comorbilidad se utiliza el índice de Charlson, que ha sido previamente validado para DP12. Al inicio y semestralmente se recogen datos clínicos de objetivos, eficacia, función residual, transporte peritoneal, control de anemia y control de presión arterial (PA). Las peritonitis y los ingresos se recogen cuando suceden. Las salidas del programa se clasifican en: recuperación de función renal, muerte, paso a HD, trasplante y pérdida de seguimiento y/o traslado.
Cada centro dispone de bases de datos idénticas diseñadas específicamente para esta recogida de datos multipropósito y anualmente se integran en una oficina central. Un experto en estadística audita y depura los datos por rangos y rutinas lógicas. Los pacientes dan su consentimiento informado a la inclusión en la técnica. La gestión y el análisis estadístico de los datos se realizan con el gestor estadístico SPSS v 11.0. Los datos de variables numéricas se muestran como media y desviación estándar (DE) y los de las variables categóricas como frecuencias. Todas las tasas obtenidas (de mortalidad, ingresos y peritonitis) se refieren al tiempo real en técnica de cada paciente.
Los pacientes fueron clasificados en dos grupos, post-TX y DP-de novo. Las comparaciones entre variables categóricas se realizan mediante la chi cuadrado y las variables cuantitativas con test de la t de Student o de la U de Mann-Whitney, cuando la variable no sigue una distribución normal. Se aplican tests para análisis de supervivencia por Kaplan-Meier (KM), calculando el rango logarítmico (log-rank) correspondiente. Los datos de supervivencia se muestran como la mediana de supervivencia e intervalo de confianza (IC) al 95%; en los casos en los que no se alcanzan el percentil 50 de la distribución, se muestra la media. Para cada análisis de supervivencia se consideran distintos eventos; así, los tres tipos de análisis realizados tienen en cuenta: la muerte como evento para la supervivencia del paciente; el paso a HD como evento para el análisis de mantenimiento en técnica, y el agregado de muerte, paso a HD, trasplante y recuperación de función renal (FR) nos permite estimar el tiempo real pasado en técnica. Para el análisis de tiempo hasta el trasplante se consideran sólo los pacientes incluidos en lista de trasplante en algún momento de su seguimiento.
Para el análisis multivariante de supervivencia se utiliza la regresión de Cox por pasos hacia atrás (backward), incluyendo todas las variables del univariante que tienen una p <0,30. Se comprueba que las variables incluidas no vulneran el principio de proporcionalidad.
RESULTADOS
Descripción global
Entre enero de 2003 y enero de 2010 se incluyeron 90IC6 pacientes que comienzan tratamiento con DP, con una edad media de 54,8 años (DE = 15,9) y un 64,9% de hombres. El 3,9% están en DP por imposibilidad de recibir HD a criterio médico y el resto por libre elección. La comorbilidad se establece por un índice de Charlson con edad de 5,1 (DE = 2,4); el 21,6% presenta diabetes mellitus (DM) y el 24% ha sufrido algún evento cardiovascular previo (un 8,4% infarto agudo de miocardio [IAM], un 6,6%, insuficiencia cardíaca [IC]; un 4,7% accidentente cerebrovascular agudo [ACVA] y un 12,7%, arteriopatía periférica).
Las etiologías de la enfermedad renal crónica (ERC), por orden de frecuencia decreciente, son: glomerular (25,4%), Nefropatía diabética (16,7%), no filiada (14,4%), intersticial (13,6%), poliquistosis renal (11,2%), vascular (10,7%), sistémicas (4,2%), hereditarias (2,0%) y otras (1,7%). El 8,4% de los pacientes (n = 76) proceden de un trasplante fallido (grupo post-TX) y el resto son incidentes en DP como primera técnica en TRS (grupo DP-de novo). El 71,6% inician DP en técnicas manuales (diálisis peritoneal continua ambulatoria [DPCA]) y el resto en alguna modalidad con cicladora automática (DPA). El 47,8% están en lista de espera de trasplante en algún momento del seguimiento.
La tabla 1 recoge las características de los dos grupos y es destacable que los pacientes post-TX son más jóvenes, con menor comorbilidad y menor porcentaje de hombres. La eficacia y el cumplimiento de los objetivos descritos previamente no presentan diferencias, salvo por la menor FR al inicio y la mayor tasa de pérdida de FR a los seis meses.
Evolución clínica de los pacientes
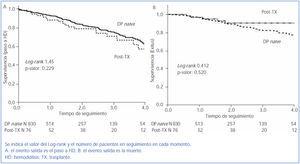
El seguimiento medio global es de 1,7 años por paciente (tiempo total en riesgo 1.563 años-paciente). Al final del tiempo total de seguimiento son sometidos a trasplante un 33,8% (n = 306), fallecen un 9,7% (n = 88), pasan a HD un 17,0% (n = 154) y el resto continúan en DP. Sólo se pierde el seguimiento del 1,7% de los pacientes por traslado. El 66% del total de pacientes incluidos en lista de trasplante reciben un injerto a lo largo del seguimiento. La tasa de trasplante anual es de 0,49 por paciente y año en lista de espera. El mantenimiento en técnica estimado por Kaplan-Meier (mediana) es de 1,85 años, con un IC al 95% [1,68-2,02] para salida por cualquier causa, de 5,46 años [4,42-6,50] para transferencia a HD y de 6,05 años [5,3-6,8] para mortalidad (figura 2).
Los pacientes post-TX tienen una mayor tasa de ingresos (0,90 frente a 0,62 ingresos/año en riesgo; p = 0,006), pero similar incidencia de peritonitis (0,45 frente a 0,53 episodios/año en riesgo; p = 0,10). Sin embargo, presentan una mayor prevalencia de infecciones por Gram negativos (30,8 frente al 20,1%), a costa de una menor tasa de cultivos negativos (10,3 frente al 18,8%).
La tasa de mortalidad es similar en ambos grupos (post-TX: 0,05 frente a DP-de novo: 0,06 por año en riesgo; diferencia no significativa) con una distribución similar de las causas de muerte (42,0% cardiovascular, 6,8% cáncer, 19,3% sepsis, 2,3% peritonitis, 4,5% rechazo de tratamiento). Los pacientes post-TX tienen una media de supervivencia estimada por KM en 6,05 años equivalente a la de DP-de novo que es de 6,35 años, con un rango logarítmico de 0,143 (p = 0,52).
El modelo multivariante más eficiente para evaluar la mortalidad incluye las variables: edad, FR, haber tenido algún ECV previo y ser diabético (los coeficientes se exponen en la tabla 2).
Cambio entre técnicas de terapia renal sustitutiva
Un 35,2% de los pacientes DP-de novo reciben su primer trasplante durante el seguimiento, frente a un 18,4% de retrasplante en el otro grupo (p = 0,006). Si consideramos sólo los pacientes incluidos en lista de trasplante, un 64,1% de los pacientes con DP-de novo y un 32,6% del grupo post-TX son sometidos a trasplante (p <0,001). La estimación por KM del tiempo hasta el trasplante en estos pacientes fue de 4,77 años en pacientes con trasplante previo, con un IC al 95% [2,48-7,09] y de 1,74 años en DP-de novo (1,55-1,92).
Sin embargo, la tasa de fallo de técnica por paso a HD no muestra diferencias significativas (13,3 frente a 9,4 por 100 pacientes-año en riesgo; p = 0,13). Las causas de paso a HD son similares, salvo por un mayor porcentaje de incapacidad para mantener un adecuado balance hídrico (22,7 frente a 6,8 %; p = 0,016).
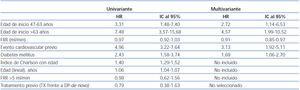
La mediana de tiempo hasta HD fue de 5,46 años, con un IC al 95% de [4,40-6,52] frente a 4,21 años (3,42-5,00), con una HR de 1,32 y un IC al 95% [0,84-2,08] por regresión de Cox (figura 1). Este efecto negativo del trasplante previo alcanza significación estadística tras realizar una corrección por edad y comorbilidad, con una HR de 1,63 [1,02-2,60] para trasplante previo y 1,12 [1,05-1,19] por punto de Charlson. El análisis univariante de los factores asociados con la salida a HD se detalla en la tabla 3.
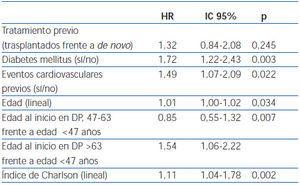
El modelo multivariante más eficiente para evaluar los factores al inicio de la DP que se asocian a la salida a HD incluye el trasplante previo, la DM y la edad. Los coeficientes se detallan en la tabla 4. Si trabajamos con otros valores analíticos (FR, eficacia, permeabilidad peritoneal y anemia), obtenemos un modelo en el que la FR basal sustituye a la edad y al tratamiento previo (tabla 4).
Por tanto, el tiempo total que permanece el paciente en DP (considerando salida por cualquier causa) es mayor para el grupo post-TX (mediana 2,83 años [2,43-3,22] frente a 1,81 años [1,64-1,97]; Log-rank 5,44; p = 0,02); esta diferencia es a expensas de una menor tasa de trasplante y del mayor tiempo necesario para encontrar ese segundo trasplante.
DISCUSIÓN
A pesar de la mejora de los cuidados nefrológicos y de los avances en el tratamiento inmunosupresor, se calcula que hasta un 20% de los pacientes que reciben un trasplante retornan a diálisis por fallo del injerto a los tres años y esta cifra se incrementa a razón del 2-4% por año. Entre un 4 y un 10% de los pacientes que inician diálisis anualmente provienen de un fallo de injerto renal13. Este colectivo emergente dentro del TRS integral de la ERC supone un reto para la comunidad nefrológica.
En nuestro medio, el trasplante es la primera causa de salida de DP en pacientes incidentes y el tiempo medio necesario para recibir el injerto ronda los 1,7 años. Por ello, se considera que la DP es una buena elección para iniciar un modelo de TRS integrado. Sin embargo, la elección de DP entre los pacientes con fallo de injerto es menor. Los pacientes que provienen de un trasplante tienen una peor evolución que los pacientes con DP-de novo, con una pérdida acelerada de FR residual (FRR), mayor tiempo hasta el segundo trasplante, mayor tasa de infecciones y de ingresos, peor cumplimiento de objetivos terapéuticos14 y mayor riesgo de fallo de técnica de DP.
Varios estudios han puesto de manifiesto la elevada mortalidad en el grupo de pacientes que reinician diálisis tras fallo del trasplante, tanto en HD como en DP. Un análisis del registro USRDS, sobre más de 170.000 pacientes, presenta una mortalidad un 80% mayor en pacientes que perdían su trasplante que en los pacientes que permanecían en diálisis esperando su primer trasplante. Este mayor riesgo se concentra en los tres primeros meses de reinicio de la diálisis, pero continúa siendo elevado incluso después de cinco años de seguimiento15. Estudios más recientes confirman la mayor mortalidad de los pacientes en DP post-TX3,15,16.
¿Qué factores pueden explicar la peor evolución de los pacientes con fallo del trasplante?
Los pacientes post-TX de nuestra serie son casi 12 años más jóvenes y presentan menos comorbilidad que los pacientes DP-de novo (menor prevalencia de DM y de eventos cardiovasculares previos a la DP). Pese a ello, su supervivencia no es mejor y su evolución es peor si se considera globalmente. Aunque la mortalidad es similar entre ambos grupos, existen importantes diferencias en otras variables intermedias de evolución, como mantenimiento en técnica DP, tasas de ingreso, infecciones y cumplimiento de objetivos. Esto parece deberse a una mayor carga de tiempo pasado en ERC, algo que los índices de comorbilidad habituales no son capaces de valorar. Un reciente trabajo publicado en nuestra Revista compara la situación al inicio de diálisis de pacientes post-TX con los de novo y los autores sólo encuentran un peor control de la anemia, que desaparece al año de seguimiento. En esa serie iniciar con HD o DP no condicionaba cambios en el pronóstico17.
La FRR es una pieza básica en el mantenimiento en la técnica del paciente en DP. Los pacientes procedentes de un trasplante previo tienen menor FRR al inicio y una pérdida acelerada de la misma que explica la mayor transferencia a HD por imposibilidad de mantener un adecuado balance hídrico. Estos datos son concordantes con los publicados en el estudio de ANZ-DATA18. Aunque la transferencia a HD es mayor en el grupo post-TX de nuestra serie, el tiempo pasado en DP es superior a la media global de mantenimiento en DP y podría ser suficiente hasta recibir un segundo trasplante. No disponemos de datos sobre el manejo de la inmunosupresión (IS) en nuestros pacientes, por lo que no podemos analizar su papel en la evolución de la FRR.
Algunos autores refieren que la IS, aun a dosis bajas, puede favorecer una infección peritoneal. Sin embargo, en nuestra serie la tasa global de peritonitis es similar. Los estudios publicados que analizan la presencia de peritonitis en los pacientes procedentes del trasplante son escasos y con resultados diversos19-21. En la serie de Gregoor, et al.21 se encontró una tasa similar de peritonitis, pero mayor mortalidad por infecciones graves en el grupo que recibía prednisona (dosis media 9 mg/día) que en el que no la recibía. Otros autores tampoco encuentran diferencias en la tasa de peritonitis entre los que portaban un injerto fallido y los que no19,20. Actualmente, no hay datos que avalen el mantenimiento de IS en pacientes en DP más allá de seis meses22.
¿Cuál es la mejor técnica para los que retornan a diálisis tras fallo del trasplante renal?
Pocos estudios comparan la supervivencia de los pacientes con fallo de injerto que inician DP o HD. Davies23 no encuentra diferencias en la supervivencia del paciente o la técnica cuando estudia a 45 pacientes con fallo del injerto que inician diálisis (28 en DP y 17 en HD); tampoco De Jonge, en su serie de 60 pacientes (21 pacientes que vuelven a DP y 39 en HD)19. Ambos trabajos presentan serias limitaciones metodológicas para extraer conclusiones robustas. Sin una evidencia firme a favor o en contra, podemos seguir considerando la DP como una buena opción que permite una independencia del centro de tratamiento, similar a la que llevaban con el trasplante funcionante. No obstante, la realidad es que este colectivo retorna mayoritariamente a HD. Según el registro Madrileño REMER, en 2008 por cada paciente incidente de novo en DP, cinco inician HD. Sin embargo, por cada paciente con fallo del injerto que reinicia en DP, 12 lo hacen en HD. Según nuestra serie, son los más jóvenes y con menor comorbilidad los que eligen la DP. Esta selección positiva de los mejores pacientes podría explicar su buena evolución en comparación con series previamente publicadas3,15,16. Por otro lado, los resultados de la DP en general han mejorado en los últimos 10 años, como recogen algunas publicaciones españolas recientes25.
Las razones para este predominio de la HD sobre DP pueden ser las mismas que en los pacientes incidentes de novo. Entre ellas destacan aspectos organizativos como la escasa implantación de los programas de DP, la urgencia de inicio de diálisis o la ausencia de protocolos de información reglados en consultas de ERC avanzada. Asimismo, también pueden resaltarse otras más específicas de esta situación, como el cansancio del paciente y la falta de ánimo para implicarse en su autocuidado. La elección de la modalidad de diálisis tras la pérdida del injerto debe de seguir criterios similares a los que se aplican en los pacientes que inician diálisis de novo10. En ausencia de contraindicación absoluta, el paciente debe recibir de nuevo información actualizada para poder elegir la técnica de diálisis que considere más idónea26.
Retrasplante como opción terapéutica real en los pacientes que retornan a diálisis por fallo del trasplante
Frecuentemente, el retorno a la diálisis se acompaña de un proceso de duelo incompleto, e incluso puede requerir ayuda psicológica. Sabemos que la supervivencia del injerto es menor en los pacientes sometidos a retrasplantes que en los que reciben su primer riñón22. Sin embargo, la supervivencia del paciente sometido a un retrasplante es mejor que la esperada para el paciente que permanece en diálisis22,27. Por desgracia, según los datos del USRSD28, menos del 15-20% de los pacientes que retornan a diálisis tras fallo del injerto pueden acceder a un retrasplante.
En la serie del GCDP, la primera causa de salida de DP para los pacientes DP-de novo es el trasplante, de manera que dos de cada tres pacientes en lista de espera han sido trasplantados a los 18 meses de iniciar DP. En este período de tiempo se incluye la valoración del paciente, la realización de estudios necesarios para la inclusión en la lista de espera y el tiempo hasta encontrar un órgano compatible. Para los pacientes en DP post-TX, la situación es más complicada, ya que se tarda más en encontrar un órgano compatible, lo cual alarga el tiempo hasta el retrasplante. Aunque el riesgo de transferencia a HD fue mayor para los pacientes con fallo del injerto previo, su salida por retrasplante es menor. Por ello, el tiempo global que pasan en DP los pacientes post-TX es mayor que el de los incidentes de novo, y supera los dos años. Este período de dos años parece suficiente para considerar que merece la pena el paso por DP.
Nuestro estudio presenta algunas limitaciones: se trata de un estudio observacional; existe una asimetría en el tamaño de ambos grupos, y no se ha aplicado un protocolo especifico común para considerar el inicio de la DP, ni la transferencia del paciente a HD. Sin embargo, son datos muy recientes y provienen de un muestreo sistemático con inclusión de todos los pacientes que reciben DP en un área extensa, lo que asegura la aplicabilidad de los resultados presentados.
En resumen, la relación entre la DP y el trasplante renal puede y debe ser bidireccional. La DP se considera una buena técnica de inicio del TRS, siendo el trasplante la primera causa de salida y el tiempo de espera razonable en nuestra serie. Tras el fallo del injerto debemos considerar la DP como una alternativa muy razonable que ofertar a nuestros pacientes. Los pacientes que retornan de un trasplante fracasado necesitan una atención especial por su mayor tasa de complicaciones, aunque posiblemente esta recomendación valga tanto para DP como para HD.
Agradecimientos:
Proyecto co-financiado por Baxter (2003-2011) Amgen (2005-2011) Fresenius (2007-2011) y Gambro (2009-2011) a través de la Fundación Madrileña de Nefrología-SOMANE. Los autores no tienen relación contractual ni pertenecen a comites asesores de las empresas de DP en España.
Tabla 4. Riesgo de paso a hemodiálisis según el modelo multivariante de Cox
Figura 1. Diagrama de flujo de pacientes.
Figura 2. Curvas de supervivencia de Kaplan-Meier.
Tabla 3. Riesgo relativo de paso a hemodiálisis según el modelo univariante de Cox
Tabla 2. Riesgo de mortalidad según el modelo univariante y multivariante de Cox
Tabla 1. Descripción basal y a los seis meses de la muestra