El nefrólogo que controla pacientes con ERC, en diálisis especialmente, se enfrenta frecuentemente a la toma de decisiones en cuanto a la prescripción de quelantes del fósforo. Y es una decisión compleja. Todas las medicaciones que se usan actualmente como quelantes del fósforo (hidróxido de aluminio, acetato y carbonato cálcico, sales de magnesio, sevelamer y carbonato de lantano) son efectivas en el descenso del fósforo sérico pero no hay datos suficientes comparativos de eficacia para recomendar el uso de un captor específico a todos los pacientes. Además el número de comprimidos a añadir al tratamiento del paciente es numeroso y los costos muy diferentes. Si bien es cierto que los datos epidemiológicos demuestran una positiva asociación aunque no una relación causal entre los niveles elevados de fósforo sérico y la morbi-mortalidad, sin embargo, hasta el momento los beneficios derivados de descender el fósforo sérico en la evolución clínica de los pacientes (hospitalización, fracturas, eventos cardiovasculares o mortalidad) no han sido estudiados.
El presente trabajo tiene como objetivo trasladar la información que disponemos sobre el tema y sensibilizar al nefrólogo que con solamente una prescripción a un paciente de un quelante del fósforo puede incrementar el gasto sanitario hasta 2.500 euros más anuales por paciente.
ALGUNAS CONSIDERACIONES SOBRE LOS CAPTORES DEL FÓSFORO ACTUALES
Hidróxido de aluminio
Al inicio de los años 70 el uso de captores del fósforo compuestos por aluminio era el método de elección ya que se formaban productos no absorbibles en la luz intestinal. El hidróxido de aluminio fue un quelante del fósforo muy eficaz1 pero desgraciadamente el uso prolongado se asoció con acúmulo de aluminio y una toxicidad que se manifestaba como encefalopatía, osteomalacia, anemia microcítica y miopatía2-4. La consecuencia es que la utilización de hidróxido de aluminio ha sido limitada para tratamiento de emergencia o tratamientos a corto plazo o finalmente abandonada de forma definitiva.
No obstante, todas las complicaciones relacionadas con el depósito de aluminio en el paciente con ERC vinieron motivadas por un contenido de aluminio en el agua muy elevado, previo a la instalación sistemática de procesos de ósmosis inversa con la generación de agua de calidad para la hemodiálisis. Existen unas publicaciones, especialmente en niños, respecto a la utilización del hidróxido de aluminio por vía oral y su repercusión tóxica en el organismo. Su escasa absorción intestinal (0,01%), se contrarresta con que su eliminación a nivel renal es del 90%. Tiene la ventaja de la experiencia acumulada de que es potente y altamente efectivo. No existen estudios randomizados prospectivos que demuestren la toxicidad del aluminio a dosis adecuadas, ingerido con los alimentos y no con estómafo vacio, en pacientes tratados con agua tratada con concentraciones de aluminio inferiores a 5 ug/l. La eventual toxicidad sería a muy largo plazo y los costos son muy pequeños (lo que puede ser una causa de su abandono al no tener patrocinador comercial).
En este momento podríamos por tanto resumir que el hidróxido de aluminio es un excelente quelante que podría estar contraindicado para largos periodos de tiempo y en casos de enfermedad ósea adinámica. Por el contrario, no estaría absolutamente contraindicado en cortos periodos de tiempo, en pacientes de edad avanzada (con corta esperanza de vida) y en pacientes con alta probabilidad de trasplantes. Debe administrarse con estómago lleno pues su absorción en medio ácido es más elevada.
COMPUESTOS CÁLCICOS
Carbonato cálcico
Las sales de calcio han sido una alternativa importante como captores del fósforo en sustitución del aluminio. El carbonato cálcico se disuelve mejor en un medio ácido y su ligazón al fósforo es mejor a pH elevados disminuyendo significativamente cuando el pH desciende por debajo de 5 por lo que es menos efectivo que el aluminio. El carbonato cálcico controla adecuadamente el fósforo pero su efectividad viene limitada por la posibilidad de hipercalcemia. El carbonato cálcico contiene una alta proporción de calcio elemental (40%) y la hipercalcemia aparece cuando se da a altas dosis, cuando se administra concomitantemente con vitamina D (que aumenta la absorción intestinal de calcio) o con el uso de calcio en el baño de diálisis de alta concentración (> 2,5 meq/l). Como hemos comentado previamente la proporción de calcio que se absorbe aumenta dramáticamente cuando no se sincroniza con las comidas y se absorbe mucha más cantidad de calcio elemental cuando el carbonato cálcico se da en un estómago vacío o dos horas después de haber comido en comparación con la administración inmediatamente después de las comidas5.
Acetato cálcico
Es una alternativa al carbonato cálcico como quelante del fósforo y contiene además menos calcio elemental (25%) que el carbonato cálcico. Ello se traduce en que la cantidad de fósforo ligado por cantidad de calcio absorbido es dos veces más alta con el acetato cálcico que con el carbonato cálcico. En un estudio realizado por Mai y cols., demostraron que la absorción de fósforo disminuía al 40% de lo ingerido con el acetato cálcico comparado con el 21,7% con una equivalente cantidad de carbonato cálcico, es decir, entre pacientes con enfermedad renal crónica avanzada el acetato cálcico liga aproximadamente dos veces más que el carbonato la cantidad de fósforo por cantidad de calcio absorbido6-8. Eso se explica porque el acetato cálcico tiene una solubilidad mejor tanto en soluciones ácidas como alcalinas. Sin embargo este efecto de que sólo la mitad del calcio es requerido con el acetato cálcico para el mismo efecto quelante no puede descuidar la posibilidad de hipercalcemia con dosis elevadas de acetato cálcico.
Dosis de compuestos cálcicos
La dosis de quelantes del fósforo compuestos por calcio generalmente se aumenta hasta que el fósforo sérico se encuentre entre 4,5 y 5,5 mg/dl o aparezca hipercalcemia pues los niveles de calcio plasmáticos deben mantenerse en el límite bajo de lo normal (8,4 a 9,5 mg/dl) y el producto fosfocálcico debe mantenerse en < 55 mg/mm2. Ante la eventual complicación de que el tratamiento con compuestos cálcicos produzcan el desarrollo de calcificaciones coronarias arteriales9 el grupo de trabajo de las guías K/DOQI sugiere que la cantidad total de calcio elemental (incluido aquel que viene con los alimentos) no debe de exceder 2.000 mg/día así que la cantidad de calcio elemental administrado no debe superar por tanto 1.500 mg/diarios. Esos significa que la dosis máxima de acetato cálcico son 6 g y de Carbonato cálcico 4 g. Incluso estas dosis de calcio producen un balance cálcico positivo en el caso de que el paciente esté recibiendo vitamina D lo que puede tener consecuencias a largo plazo. Asimismo en las guías K/DOQI se recomienda que los compuestos quelantes del fósforo con calcio no deben de usarse en pacientes en diálisis que estén hipercalcémicos (un calcio sérico corregido > 10 mg/dl) o en los que los valores de hormona paratiroidea sean < 150 picog/ml).
Controversias sobre la indicación de productos cálcicos en pacientes con enfermedad renal crónica
Existen muchas controversias respecto a la utilización de fármacos quelantes del fósforo con compuestos cálcicos. Es complejo analizar el motivo de las mismas pero indudablemente hay hechos muy razonables que aconsejan el empleo de sales cálcicas como quelantes del fósforo10 y otras que lo desaconsejan11 aunque hay que asumir que existe una importante presión comercial al respecto. Entre las razones por las cuales Friedman10 aconseja que el empleo de estos compuestos de calcio son apropiados para la enfermedad renal crónica se encuentra el que no existen ensayos clínicos claros que aconsejen el reemplazamiento de estos productos por el Sevelamer en concreto que es el producto no cálcico que se encontraba en ese momento en el mercado. Asimismo Friedman afirma que existe una muy débil evidencia de que la ingesta oral de calcio module la calcificación vascular o cardíaca, que los ensayos clínicos que refuerzan la seguridad y eficacia de los quelantes del fósforo compuestos de calcio son numerosos y finalmente el extraordinario costo del Sevelamer. Reconociendo que también estos nuevos quelantes del fósforo no compuestos de calcio están bajo una evaluación clínica en el momento, es necesario en su opinión reflexionar claramente con una mente abierta sobre lo que realmente conocemos en la literatura y la forma en la que muchos ensayos clínicos están perfilados en intereses económicos de una determinada marca.
Por otra parte Moe11 afirma que hay evidencia suficiente de forma prospectiva y en ensayos aleatorizados de que el uso de los compuestos de calcio como quelantes del fósforo contribuyen a la coronariopatía progresiva y a una calcificación de la aorta cuando se comparan con los productos no cálcicos como el Sevelamer. En su opinión hay también evidencia biológica de que la hiperfosfatemia y una administración exógena de calcio pueden acelerar la calcificación vascular. No hay desgraciadamente un test a la cabecera de la cama que pueda determinar cual puede ser la cantidad de sales cálcicos bien como tratamiento de mantenimiento o como dosis acumulativas que puedan ser administrados con seguridad y desgraciadamente la concentración del calcio sérico no refleja el balance cálcico. Su opinión es que los quelantes cálcicos deben ser restringidos, en muchos sino en todos los pacientes, que se encuentran en diálisis.
En mi opinión, los compuestos cálcicos utilizados con una dosificación no superior a 1.500 mg/diarios de calcio elemental (ya hemos visto que cada gramo de Carbonato Cálcico tiene un 40% de Ca elemental y Acetato Cálcico un 25% de Ca elemental), y siempre que se mantenga las concentraciones recomendadas de calcio por debajo de 10 mg/dl, son productos eficaces y especialmente baratos por lo que no veo razón alguna para desaconsejarlos en beneficio de otros productos extraordinariamente caros. Tan solo me parece razonable evitar su prescripción en aquellos casos de bajo turnover óseo con PTH inferior al rango normal considerado para estos pacientes según el método empleado (< 100 pg/ml). La concentración de calcio en el líquido de diálisis debe reducirse a 2,5 mEq/l y así permitir el hecho de que la ingesta de calcio pueda ser segura, manteniendo el efecto quelante, y sin producir una excesiva ganancia del mismo.
Sevelamer
El Sevelamer es un polímero no absorbible que no contiene ni calcio ni aluminio y que liga al fosfato a través de un intercambio iónico. Este producto es resistente a la degradación digestiva y liga al fósforo de la dieta liberando cloro12. Por otra parte además liga los ácidos biliares y disminuye el colesterol LDL13.
Existen muchos trabajos que evalúan la efectividad del Sevelamer para descender los niveles de fósforo sérico12-22 y aunque todos encuentran que Sevelamer fue efectivo existen publicaciones que discuten la relativa eficacia cuando se compara con otros quelantes del fósforo. Hay un estudio prospectivo llamado «Treat to Goal» con 200 pacientes en hemodiálisis que recibieron Sevelamer y compuestos de calcio19. Se vio en este estudio que al término de un año los niveles de fósforo sérico fueron similares entre ambos agentes (5,1 mg/dl). Sin embargo el Sevelamer tuvo algunos beneficios asociados como una menor incidencia de hipercalcemia (5 versus 16%) una disminución mínima en la concentración de calcio sérico (9,5 versus 9,7 mg/dl), menor incidencia de niveles de PTH bajos (30% versus 57%), inferior colesterol LDL (65 versus 103 mg/dl) y mucho menor porcentaje en el «score» medio absoluto de calcio en las arterias coronarias (5% versus 25%) y aorta (5% versus 28%). Asimismo en estudios posteriores también se evidenció que el Sevelamer conducía a una disminución en la proteína C reactiva23. Este estudio Treat to Goal ha sido criticado porque el número de pacientes que se salieron del mismo es alto, el estudio no es ciego y los pacientes recibieron diferentes niveles de concentraciones de calcio en líquido de diálisis.
En otro estudio llamado CARE (Calcium Acetate Renal Evaluation) los autores encontraron que el acetato cálcico controló mejor el fósforo y el producto fosfocálcico que el Sevelamer24 aunque los niveles de calcio fueron más elevados. Se trata de un estudio a corto plazo pero apunta al acetato cálcico como costo efectivo en la primera línea de tratamiento del control del metabolismo fosfocálcico.
Existen algunos estudios relacionados con el efecto de la mortalidad del Sevelamer. El estudio DCOR evaluó la mortalidad entre 2.103 pacientes en HD que recibieron Sevelamer o quelantes del fósforo con compuesto cálcico. Alos 45 meses no se encontró ninguna diferencia en las causas de mortalidad25.
Un aspecto a considerar del Sevelamer es que induce acidosis metabólica por lo que no debe ser utilizado en pacientes que no estén en diálisis. Se trata de un producto (Sevelamer HCl) que ofrece hidrogeniones. En el futuro aparecerá una variedad con carbonato para evitar este problema.
Revisión sistemática de la eficacia clínica y seguridad de Sevelamer en pacientes en diálisis
Recientemente ha aparecido un estudio que recoge las diferentes publicaciones que comparan el Sevelamer con otro tipo de tratamientos o con placebo en pacientes en diálisis26. Los autores identifican 14 publicaciones de ensayos aleatorizados (3.193 participantes) que fueron elegibles para el análisis de eficacia. Encontraron que en los diez estudios que reportan los niveles de fósforo y calcio (2.501 participantes) el fósforo sérico fue significativamente inferior con los quelantes cálcicos por 0,12 mmol/l (95% de intervalo de confianza) comparado con Sevelamer. El producto fosfocálcico no fue significativamente diferente en los pacientes que recibieron los compuestos cálcicos comparados con el Sevelamer. La diferencia media en el calcio sérico fue significativamente más baja con Sevelamer (0,10 mmol/l) y respecto al bicarbonato fue significativamente menor en aquellos que recibieron Sevelamer con 2,8 mmol/l. En los 5 ensayos que reportaron todas las causas de mortalidad (2.429 pacientes) las diferencias de riesgo para todas las causas de mortalidad en estos cinco ensayos fueron similares entre los tratamientos. En los tres ensayos en los que encontraron serias complicaciones secundarias hubo una tendencia hacia un menor riesgo en aquellos pacientes que recibieron quelantes con calcio. Los autores concluyen que el uso de Sevelamer en pacientes en diálisis, al ser comparado con los quelantes compuestos de calcio, se asocia con un similar o ligeramente más elevado nivel de fósforo sérico, similar producto fosfocálcico y ligeramente inferior nivel de calcio sérico. No hay evidencia de que el Sevelamer reduzca todas las causas de mortalidad, la mortalidad cardiovascular, la frecuencia de enfermedad ósea sintomática o la calidad de vida de los pacientes27.
En el mismo número de la revista aparece un editorial («Sevelamer a Promising and unproven drug»)27 en el que se reconoce que el Sevelamer tiene una ventaja potencial sobre los compuestos cálcicos consistente en la mejoría de la calcificación vascular. Sin embargo el traslado de estos efectos específicos de esta droga hacia una mejor supervivencia en los pacientes con enfermedad renal crónica no se ha demostrado todavía.
Carbonato de lantano
El carbonato de lantano pertenece a un grupo conocido como «lantánidos» y tiene una baja solubilidad. En el medio ácido del estómago y en la parte proximal del intestino se disocia suficientemente para quelar el fósforo. En estudios experimentales se ha demostrado que el lantano es tan efectivo como el hidróxido de aluminio y más efectivo que el carbonato cálcico o que el Sevelamer en estudios comparados28.
Del carbonato de lantano hay diferentes estudios que han demostrado que es efectivo y bien tolerado en voluntarios sanos y también en pacientes en HD29-33. No obstante el tratamiento con carbonato de lantano en dosis entre 1.500 y 3.000 mg/día fue incapaz de descender el fósforo sódico por debajo de 5,5 mg/dl en muchos de los estudios.
Uno de los problemas con el lantano es que la seguridad a largo plazo y particularmente sus efectos en el hueso o en otros órganos no parece muy claro34-35. Concretamente en el hígado se han encontrado niveles 100 veces superiores en las ratas urémicas que ingirieron lantano versus las ratas que tomaron una dieta control aunque no parece que existan signos de hepatotoxicidad al término de 4 años de tratamiento36, como tampoco parece haber toxicidad en el hueso a largo plazo.
La impresión general es que la utilización de carbonato de lantano será similar a la del Sevelamer teniendo en cuenta el alto costo. Se podrá utilizar en pacientes con hipercalcemia, en pacientes con PTH por debajo de los niveles normales o como tratamiento adicional a los 1.500 mg de productos quelantes del fósforo con compuestos cálcicos si el fósforo supera los 5,5 mg/dl. Como ventajas considerar que es más potente captor del fósforo, que al parecer su precio será elevado aunque algo inferior al Sevelamer y que el número de pastillas serán de tres al día por 8 comprimidos diarios de Sevelamer necesarios para aportar 6,4 g/día.
RAZONES DEL FRACASO DEL TRATAMIENTO CON QUELANTES DEL FÓSFORO
Pueden observarse en la tabla I donde vemos que la mayor parte de ellas son por incumplimiento o dosificación inadecuada en las diferentes comidas.
LO QUE HEMOS DE PENSAR A LA HORA DE PRESCRIBIR UN CAPTOR DEL FÓSFORO
Pues bien sencillo: eficacia y seguridad , coste beneficio y número de pastillas necesarias. Una prescripción «automática» derivada de la influencia de la industria farmacéutica apoyada en algún artículo científico relevante (pero sin evidencia fuerte como hemos visto) puede aumentar el gasto de forma inaceptable para el beneficio obtenido.
Además el cumplimiento de las prescripciones terapéuticas de los captores del fósforo es bastante bajo. Hay que tener en cuenta que un paciente en diálisis recibe una prescripción de múltiples medicamentos y sabemos que en enfermedades crónicas el cumplimiento no supera el 50%. Muchas veces en muchos pacientes el empleo de estos fármacos se asocia con problemas gastrointestinales y el exceso número de pastillas conduce al incumplimiento, a la pérdida de apetito y sus consecuencias nutricionales y a la pérdida de la calidad de vida.
En un estudio que realizamos en varias unidades de diálisis de España, para describir las características de las alteraciones del metabolismo mineral realizamos asimismo un análisis económico para documentar el costo del tratamiento y determinar si fue asociado al estado mineral. Se recogieron 1.312 pacientes de los que un 51% recibían quelantes del calcio, un 21% Sevelamer (en la actualidad esta cifra llega al 49% en una muestra del estudio ANSWER de 2.500 pacientes incidentes en diálisis al cabo de un año) 16% hidróxido de aluminio y el 29% no recibieron quelantes. Un 33% de los pacientes recibían calcitriol. Con este grupo de pacientes de estas unidades españolas la prevalencia de pacientes fuera de los objetivos KDOQI fueron para el calcio el 50%, un 46% para el fósforo (en el caso del Answer con un 49% de pacientes recibiendo Sevelamer un 44% tenían fósforo sérico superior a 5,5 mg/dl) un 33% para el calcio-fósforo y un 77% para la PTH. Aquellos pacientes peor controlados fueron los que más costo adicional supusieron en fármacos relacionados con el control del fosfato37.
Los productos que hay en el mercado español considerando los más utilizados son:
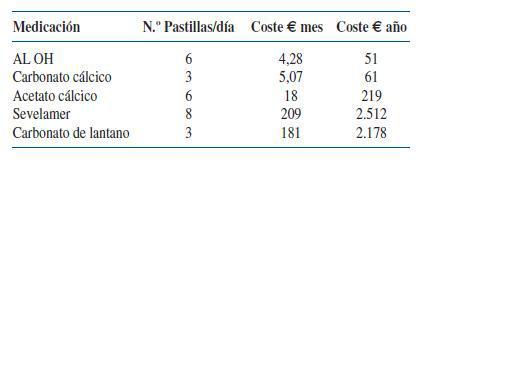
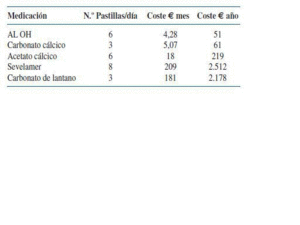
1. Hidróxido de Aluminio: comprimidos de 233 mg. Envase con 50 comprimidos. Precio 1,18 euros. Media comprimidos utilizados 6. Total coste diario 0,141 euros.
2. Acetato Cálcico: cápsulas de 500 mg (125 mg de calcio elemental). Envase con 120 cápsulas. Precio 12,04 euros. Media de comprimidos utilizados 6. Total coste diario 0,6 euros.
3. Carbonato Calcico: comprimidos de 1.250 mg (500 mg de Ca elemental). Envase con 90 comp. Precio 5,01 euros. Media de comprimidos utilizados 3. Total coste diario 0,167 euros.
4. Sevelamer: comprimidos de 800 mg. Envase con 180 comp. PVL 157,03 euros. Media de comprimidos utilizados 8. Total coste diario 7 euros.
5. Carbonato de lantano: no comercializado en el momento de escribir estas líneas todavía en España. Comprimidos de 750 mg. Envase con 90 comp. PVL 181,48 euros. Media de comprimidos recomendados 3. Total coste diario 6 euros.
Considerando el número de pastillas (se hace un cálculo medio basado en la frecuencia de prescripción y ficha técnica) por mes y por año y los precios actuales en 2007, y suponiendo que los pacientes hicieran un cumplimiento perfecto a lo prescrito (nunca es así y algunos calculan un 80% de cumplimiento que tambien es exagerado) la decisión de prescribir uno u otro fármaco quelante del fósforo supone:(ver tabla 2)
Hay un estudio económico muy interesante de Manns y cols.38, comparando el uso de Sevelamer con carbonato cálcico en una cohorte simulada de pacientes americanos en diálisis utilizando costos y supervivencia. La conclusión no favorece el uso de Sevelamer.
El nefrólogo debe conocer que la prescripción de un producto no aluminico ni cálcico para control de la hiperfosfatemia en diálisis (Sevelamer en el momento de escribir estas líneas) puede suponer aumentar los costos en 209 euros mensuales de media. Si consideramos que cada año inician diálisis 5.000 pacientes de los que un 50% de ellos presentan un P > a 5,5 mg/dl el costo tan solo de estos pacientes incidentes no controlados si fueran tratados con quelantes no cálcicos sería de más de 6 millones de euros al año. Y recordemos que los prevalentes en diálisis son cerca de 23.000 pacientes. En su conjunto y aplicando información que poseemos la facturación en nuestro país del único producto no alumínico ni cálcico que disponemos (ahora desde hace unos días también disponemos del carbonato de Lantano) para quelar el fósforo se acerca a los 20 millones de euros anuales. Y ese gasto no parece acompañarse ni de disminución en la hospitalización ni en eventos cardiovasculares ni en la morbi-mortalidad.
RECOMENDACIONES DEL AUTOR PARA LA PRESCRIPCIÓN DE QUELANTES DEL FÓSFORO (P > 5,5 MG/DL)
La primera medida después de revisar la dieta y la eficacia de la diálisis es reducir o suspender el tratamiento con Vitamina D o análogos en aquellos que lo reciben. Tras un par de meses o tres, siempre valorando la repetición de la cifra de fósforo > 5.5 mg/dl (es la tendencia y no una cifra aislada lo que debe motivarnos cambios en la prescripción).
PTH < 100
¿ Sevelamer (salvo en pacientes no diálisis) o carbonato de lantano.
PTH > 100
¿ Calcio sérico < 10 mg/dl:
1. Acetato cálcico o carbonato cálcico.
2. Asociar hidróxido de aluminio (si Ca > 10 mg/dl o P sérico continúa > 5,5 mg/dl) durante un tiempo que depende del control del P y de las características de cada paciente.
3. Si no hay control asociar carbonato de lantano (3 comp.)`o Sevelamer (8 comp.).
¿ Ca sérico > 10 mg/dl:
1. Si PTH > 500 pg/ml debe iniciarse tratamiento con calcimimético (reducción de fósforo sérico esperable un 15%). Con iPTH entre 300 pg/ml y 500 pg/ml hay diferentes opiniones.
2. Hidróxido de aluminio durante un tiempo que depende del control del P y de las características de cada paciente.
3. Asociar Sevelamer o carbonato de lantano.
Tabla 1.
Tabla 2.