Desde el descubrimiento anatómico de la glándula paratiroides en 1825 hasta que Collip demostró que la administración de la hormona paratiroidea (PTH) prevenía la tetania y normalizaba el calcio plasmático1,2, pasó un siglo. De manera mucho más rápida, en las dos últimas décadas se han ido conociendo mecanismos moleculares y añadiendo muchos factores que actúan coordinadamente en la glándula paratiroides para conseguir regular el calcio sérico. La identificación y clonación de los receptores de la PTH, del calcio y de la vitamina D y el conocimiento de los desórdenes hereditarios relacionados, han permitido avanzar en el conocimiento de este complicado entramado. Se ha evidenciado también que el fósforo tiene un papel protagonista en la regulación de la PTH. Sin embargo, aún desconocemos la existencia de receptores específicos para el mismo en la glándula paratiroides3. Recientemente, los estudios en ratones knock-out nos ha permitido conocer las conexiones del factor de crecimiento fibroblástico (FGF 23) con el fósforo, la vitamina D y la PTH4. Por último, como otra pieza más en este complicado puzzle, existen evidencias recientes que apuntan a que fragmentos de la PTH pueden ejercer un papel antagónico de la molécula intacta, ejerciendo una función hipocalcemiante.
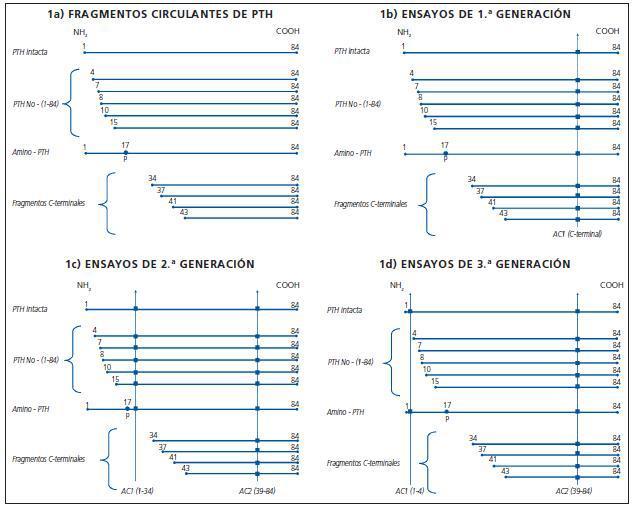
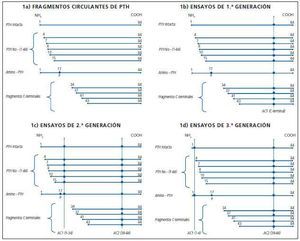
Existen, diversos péptidos paratiroideos circulantes, con diferente función e incluso que actúan a través de diferente receptor. La figura 1a muestra un esquema de los diferentes fragmentos de PTH circulantes conocidos en la actualidad:
¿ La PTH intacta (PTH 1-84) está constituida por un péptido de 84 aminoácidos (AA), que se obtiene por proteolisis consecutiva de 2 péptidos más largos de 115 AA y 90 AA respectivamente.
¿ Los fragmentos carboxi-terminales son todos aquellos que conservan la porción C-terminal y les falta una serie de AAen la porción N-terminal. Se diferencian dos grupos:
1. Los más largos, «N-truncados» han perdido una serie de AA en cualquier lugar del segmento comprendido entre los AA 1 a 34. Su existencia ha sido descubierta en los últimos años5 y se han denominado «PTH no 1-84» (fig. 1a).
2. Existe otro grupo de fragmentos C-terminales: aquellos a los que les falta un segmento que va más allá del AA 34 y empiezan su N estructura en la posición 34, 37, 41 y 43. Estos fragmentos son los denominados clasicamente «C-terminales» (fig. 1a).
¿ Otro fragmento recientemente descubierto se denomina «amino PTH» y tiene una secuencia de AA similar a la molécula intacta (1-84) pero presenta una fosforilización en el AA 176. Se desconoce su función. Recientemente se ha observado que existe en mayor proporción en pacientes con carcinoma paratiroideo y en pacientes con hiperparatiroidismo primario y secundario severo7.
Debido a que los fragmentos C-terminales son biológicamente activos y actúan a través de un receptor diferente, algunos autores han propuesto el término de «polihormona paratiroidea»8. Estos péptidos paratiroideos tienen diferentes acciones y mecanismos de regulación y metabolismo:
La PTH intacta o fragmento 1-84 es la responsable de las funciones clásicas sobre hueso y riñón y sobre la enzima «vitamina D-1 alfa hidroxilasa», induciendo la síntesis de calcitriol. Todas estas acciones tienen un único objetivo: elevar el calcio plasmático. En la glándula paratiroidea, el receptor sensor del calcio (RSCa)9 está directamente implicado en el mecanismo responsable de modular la liberación de la hormona paratiroidea en función del nivel de calcio extracelular. Así, en situaciones de hipocalcemia, se estimula la síntesis y liberación de PTH. La hiperfosfatemia también es un potente estimulador de su síntesis y secreción. Por el contario, el calcitriol a través de su receptor (VDR) tiene un efecto inhibidor. Las acciones clásicas de la PTH 1-84 están mediadas por un receptor (PTHR1) común para la PTH y la proteína relacionada con la PTH (PTH rP), presente en muchos tejidos. Es necesaria para su activación la secuencia amino-terminal, constituida por los 34 primeros AA (estructura N-terminal). La interacción de la porción amino-terminal con el reptor PTHR1 activa la vía de la Protein kinasa A y C en los tejidos diana.
En estudios experimentales se ha observado que los fragmentos denominados «no-1-84», entre los que el fragmento 7-84 es el más abundante, tienen efectos biólogicos antagónicos a los de la molécula intacta. En efecto, poseen efectos hipocalcemiantes, hiperfosfatémicos e hipofosfatúricos. Por otra parte, antagonizan el efecto hipercalcemiante de la PTH (1-34) y de la PTH (1-84). Además, son inhibidores de la osteoclastogénesis inducida por la vitaminaD10. Todos los fragmentos de tipo carboxiterminal de la molécula de PTH se unen a un nuevo tipo de receptor de la hormona en las células óseas (CPTHR), distinto del receptor PTHR1 que necesita la zona aminoterminal 1-34 de la PTH intacta para su activación11.
Los estudios in vivo, se han realizado en ratas paratiroidectomizadas. La administración de PTH 7-84, disminuye el calcio y fosfato sérico e inhibe la fosfaturia inducida por la PTH 1-84, sugiriendo que favorece la entrada de calcio y fosfato dentro del hueso11. Slatopolsky y cols.12, demostraron que las ratas tiroparatiroidectomizadas se hacen hipercalcemicas cuando se les administra PTH 1-84 y el fragmento 1-34 (Teriparatide) y que la administración simultánea de PTH 7-84 bloquea este efecto e induce hipocalcemia. Además demostraron que la administración de PTH 7-84 se acompaña de una disminución del número de osteoclastos y osteoblastos y que la formación ósea inducida por PTH 1-84 es anulada cuando se administra simultáneamente PTH 7-84, por lo que parece que las diferencias provocadas en los niveles séricos de calcio se deben a un efecto directo sobre el hueso. Los autores sugieren la interesante hipótesis de que el acumulo de estos fragmentos en la uremia sea responsable en parte de la resistencia esquelética a la PTH12.
Aún no se han identificado las acciones de los fragmentos carboxi-terminales (incluidos los no 1-84) en contextos fisiológicos y patológicos. Probablemente su efecto biológico tenga mayor relieve en la insuficiencia renal debido a que se alcanzan mayores niveles circulantes. Experimentalmente se ha comprobado que en situaciones de hipocalcemia aguda se favorece la excreción de PTH 1-84 sobre la de fragmentos carboxi-terminales y la inducción de hipercalcemia aguda invierte la proporción. En situaciones de hipocalcemia crónica, cuanto más PTH se necesita para mantener el Ca (por ejemplo, en la insuficiencia renal crónica con déficit de vitamina D), más PTH 1-84 es secretada a todos los valores de calcio y menos fragmentos carboxi-terminales. Lo mismo ocurre en la situación inversa. Cuanto menos PTH se necesita (por ejemplo en la hipercalcemia provocada por la vitamina D), se secreta menos proporción de PTH 1-84 y más fragmentos carboxiterminales10. Por tanto, ya que los cambios en calcio sérico regulan el cociente de PTH 1-84/C- PTH, secretada en glándulas paratiroides, es lógico deducir que algún papel fisiológico deben tener los fragmentos carboxi-terminales13,14.
Los fragmentos carboxi- terminales ejercen su acción a través de un receptor diferente (CPTHR) del PTHR1 que aún no está bien definido ni clonado. Se ha demostrado que está presente en la membrana citoplasmática de las células renales de pollo, células de osteosarcoma de rata y osteocite-like cells de hueso de ratón. Estas células, con ablación del PTH R1, se han usado para demostrar la afinidad de los fragmentos carboxi-terminales por este receptor. No existen hasta la fecha datos in vivo que demuestren la existencia del receptor15, 16.
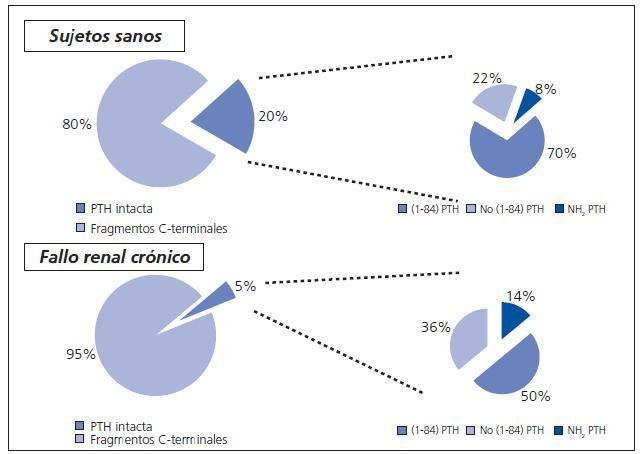
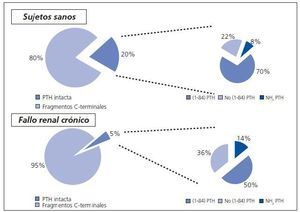
La regulación y metabolismo de los diferentes fragmentos condiciona sus niveles plasmáticos. En individuos sanos la cantidad de C-PTH circulante es muy superior (80%) a la de la molécula intacta (20%). Esta desproporción probablemente está justificada por la vida media más corta de esta última (5-8 minutos). Los fragmentos carboxi-terminales se eliminan por vía renal y se acumulan cuando existe disminución del filtrado glomerular. Por ello, en la insuficiencia renal, se acumulan este tipo de fragmentos que se encuentran en una proporción del 95%14. La figura 2 muestra las diferentes proporciones de fragmentos circulantes de PTH en individuos sanos y en la insuficiencia renal.
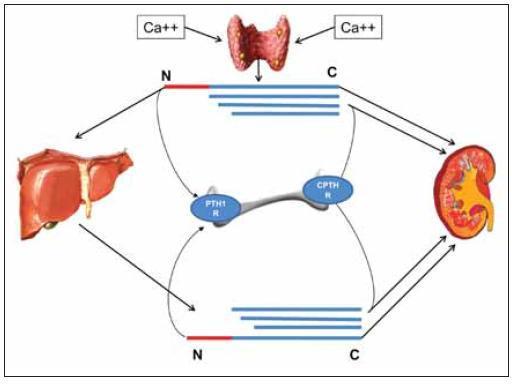
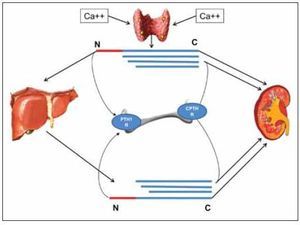
La secreción y metabolismo de los diferentes fragmentos de la PTH se ilustra de manera integrada en la figura 3. La glándula paratiroidea libera PTH 1-84 y fragmentos C-PTH en cantidades proporcionales al calcio sérico. En situación de hipocalcemia la proporción de PTH 1-84 secretada es mayor y por el contrario la hipocalcemia incrementa la cantidad de fragmentos C-PTH secretados. Todos ellos, ejercen su efecto en el hueso interaccionando con sus receptores específicos (PTHR1 o CPTHR) o son eliminados por el riñón e hígado. En las células de Kupffer hepáticas, la PTH 1-84 es rápidamente degradada en una serie de fragmentos carboxi-terminales idénticos a los secretados por la paratiroides, que vuelven de nuevo a la circulación13.
Dado que la existencia de muchos de estos fragmentos de PTH era desconocida hasta fechas relativamente recientes, los ensayos existentes para la cuantificación de la PTH 1-84 presentaban y presentan valores cruzados con otros péptidos paratiroideos. Este hecho puede representar un problema clínico importante a la hora de evaluar la situación de niveles de esta hormona, de cara a establecer un tratamiento, especialmente en el caso de los pacientes con enfermedad renal crónica.
Las primeras determinaciones de los niveles de PTH en suero se realizaron por la técnica de radioinmunoanálisis (RIA) alrededor del año 1980. Se trataba de ensayos montados en los propios laboratorios donde se generaban los anticuerpos y se marcaba la hormona con I-125. En el ensayo se utilizaba un único anticuerpo anti-PTH que detectaba diferentes fragmentos de la hormona, dependiendo de la zona de la misma que reconociera. Así, existían radioinmunoanálisis (RIAs) amino-terminales, medios o carboxi-terminales de PTH. Los carboxi-terminales eran los más utilizados, pero como muestra la figura 1b, además de la PTH 1-84 se valoraban todos los demás fragmentos de PTH circulantes, con lo cual se sobreestimaba ampliamente el verdadero valor de la PTH fisiológicamente activa («intacta»), especialmente en los pacientes con insuficiencia renal, en que la proporción de fragmentos circulantes C-terminales era mucho mayor que en los sujetos con una función renal normal.
La situación para los laboratorios fue mejorando, porque comenzaron a existir kits comerciales para la determinación de PTH, con lo que no era necesario marcar la hormona ni fabricar los anticuerpos para realizar la determinación, aunque el problema de la sobrevaloración de niveles continuaba siendo el mismo. Estos ensayos se han denominado de primera generación (fig. 1b).
Un salto cualitativo muy importante se dio en 198717, cuando el Nichols Institute Diagnostic Inc desarrolló un ensayo inmunorradiométrico (IRMA) para la detección de la PTH, el primero de los denominados análisis de «PTH-intacta». El ensayo utilizaba dos anticuerpos: uno dirigido contra la zona amino-terminal (epítopo 1-34) y otro contra la carboxiterminal (39-84). Para ser cuantificado, un determinado fragmento tenía que unirse simultáneamente a ambos anticuerpos. Dado que en esas fechas se desconocía la existencia de los fragmentos de PTH denominados «no 1-84», descubiertos más recientemente5, y del fragmento «amino-PTH»6, la creencia generalizada era que sólo se estaban valorando los niveles de la PTH 1-84 intacta y, por la tanto, de la fisiológicamente activa.
Teóricamente, el ensayo era tan perfecto, que a partir de diversos estudios realizados comparando histomorfometría con niveles de PTH por el IRMA de Nichols18-20 se elaboraron las guías de la «National Kidney Foundation/Kidney-Dialysis Outcomes Quality Initiative (NKF/K-DOQI)21 recomendando mantener los niveles de PTH de los pacientes con osteodistrofia renal entre 150 y 300 ng/l.
La figura 1c muestra todos los fragmentos de PTH detectados por los IRMAs denominados de «PTH intacta». Como puede observarse, además de la verdadera PTH 1-84, detectan los fragmentos de la PTH «no 1-84» y la «amino-PTH», quedando fuera de su valoración únicamente los fragmentos de PTH C-terminales.
Diversas casas comerciales desarrollaron a lo largo del tiempo sus propios kits del tipo IRMA o electroquimioluminiscencia de la denominada «PTH-intacta». En general, todos utilizan anticuerpos dirigidos contra los mismos epítopos de la casa Nichols, salvo el ensayo de Roche denominado Elecsys, que utiliza anticuerpos contra las zonas 26-32 y 55-64 de la PTH, y que es el único que no detecta el fragmento de amino-PTH, aunque sí todos los «no 1-84», al igual que los ensayos de este tipo de las demás casas comerciales. Estos ensayos se han denominado de 2ª generación (fig. 1c).
A raíz del descubrimiento de los fragmentos de PTH «no 1-84», la propia casa Nichols (desaparecida en la actualidad del mercado), y otras casas comerciales como Scantibodies, desarrollaron nuevos métodos con dos anticuerpos, en que se conservaba el dirigido contra la zona carboxiterminal clásico, pero el de la zona aminoterminal iba dirigido contra los 4 ó 5 primeros aminoácidos de la molécula de PTH, con lo cual ya no se detectaban todos los fragmentos «no 1-84», aunque aún se cuantificaba el «amino-terminal». La figura 1d, muestra los fragmentos detectados por este tipo de ensayos, que se han denominado de tercera generación, de detección de «bio-PTH» o de detección de «PTH entera». Como es fácil deducir, el análisis de una muestra por un ensayo de tercera generación ofrece cifras mucho menores que si se realiza por un ensayo de 2ª generación, ya que no se están midiendo todos los fragmentos de tipo «no 1-84». Su determinación no se ha generalizado en la práctica clínica debido a que es un método técnicamente laborioso. Otra limitación para trasladarlo a la práctica clínica es que no existen estudios que correlacionen sus valores con la histopatología ósea en la enfermedad renal crónica, como ocurre con la «PTH intacta»22,23. Por otro lado, el hecho de que los niveles de «bio-PTH» y «PTH intacta» se correlacionen muy estrechamente ha favorecido el que no se imponga este método. Algunos autores propusieron que la ratio PTH 1-84/PTH «entera» podría ser de utilidad en el diagnóstico diferencial del bajo y alto recambio óseo, pero los estudios realizados en series cortas de pacientes, no han cumplido las expectativas24,25.
De este modo, si la cuantificación de bio-PTH o PTH entera es actualmente inviable en la rutina clínica, debemos ser conscientes de que la concentración de PTH que nos proporciona el laboratorio se ha cuantificado mediante un ensayo de segunda generación y por tanto corresponde a la suma de PTH 1-84 y PTH «no 1-84» (en algunos casos también de amino-PTH, aunque es minoritaria), péptidos paratiroideos que presentan efectos antagónicos.
Con ser serio el problema de la sobrevaloración de la verdadera PTH 1-84, existe otro problema añadido que complica aún más la utilización de los resultados de estos ensayos por los clínicos: la falta de homogeneidad de los distintos fabricantes a la hora de calibrar sus determinaciones. Al no utilizar los mismos estándares de PTH, los resultados numéricos de una misma muestra realizada por diferentes técnicas pueden variar de modo muy significativo. Con lo que el intervalo «150-300 ng/l» de las guías K/DOQI, deja de ser válido. Y así lo han constatado JC Souberbielle y cols.22, en un estupendo trabajo publicado en 2006. Esta variabilidad inter-método provoca que, dependiendo del método utilizado, exista un porcentaje diferente de pacientes que requieran tratamiento farmacológico o incluso paratiroidectomía, si asumimos que los valores de nuestro laboratorio se corresponden con los utilizados en las guías K/DOQI. Este error metodológico comporta toma de decisiones clínicas inadecuadas, lo que conlleva repercusiones en salud y debido a los desmesurados precios de los fármacos utilizados en el tratamiento del hiperparatiroidismo, también un considerable impacto económico26.
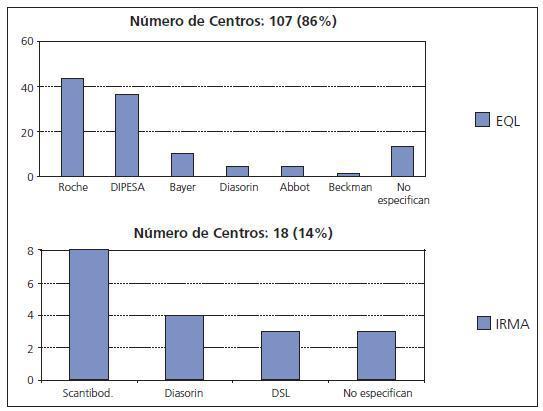
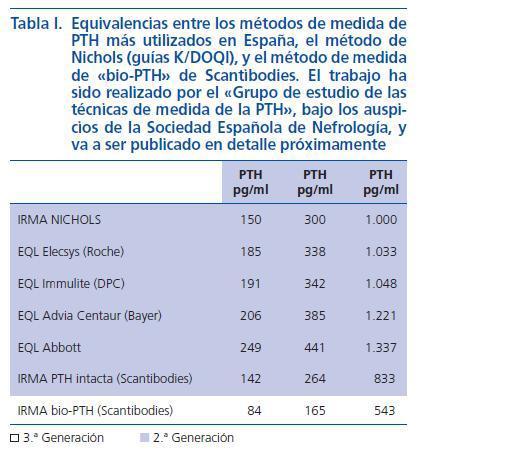
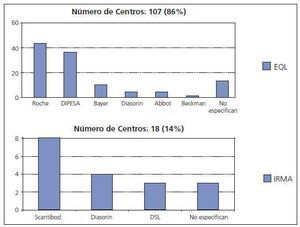
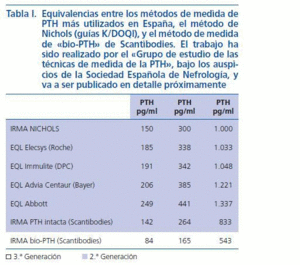
Por todo ello, bajo los auspicios de la Sociedad Española de Nefrología, el grupo de estudio de medidas de PTH, formado por expertos en metabolismo mineral y en análisis clínicos, ha realizado una encuesta entre los Servicios de Nefrología españoles para conocer los métodos utilizados en nuestro país. Ante la gran variabilidad existente (fig. 4), este grupo se planteó también calcular la variabilidad inter-métodos para proporcionar a los nefrólogos los factores de corrección que deben aplicarse para obtener los valores que obtendrían con la Allegro intact PTH de Nichols (utilizada para los rangos de referencia de las K/DOQI) y con la «bio PTH» de Scantibodies. Aunque este trabajo está aún en elaboración, ya disponemos de resultados preliminares que avanzamos ya que pueden ser de utilidad en la práctica clínica. La tabla I muestra los resultados obtenidos al analizar los niveles de PTH en 150 pacientes en hemodiálisis en los que se determinó la PTH de manera simultánea y en los laboratorios de la Fundación Jiménez Díaz, Hospital de La Paz y Hospital Gómez Ulla, utilizando los seis métodos más empleados en nuestro país. Llama la atención la amplia variabilidad inter-método que invalida las referencias de las K/DOQI. Los nefrólogos deberán en adelante informarnos del método utilizado en nuestro laboratorio para aplicar los factores de corrección correspondientes. Ello, permitirá a los clínicos seguir utilizando las mismas referencias y guías hasta que existan otras alternativas válidas.
Figura 1.
Figura 2.
Figura 3.
Figura 4.
Tabla 1.