Después de años sin ensayos clínicos aleatorizados y controlados en el ámbito de la insuficiencia renal aguda (IRA) en pacientes críticos, se han publicado recientemente los resultados de 2importantes ensayos clínicos, AKIKI1 y ELAIN2, que tratan de resolver las dudas acerca del mejor momento para iniciar la diálisis en pacientes graves con IRA.
A pesar de décadas de investigación, la incidencia de IRA continúa aumentando y la mortalidad se mantiene persistentemente elevada3–5. A principios de los años 2000, el principal objetivo de estudio fue la dosis de diálisis, basándose en la hipótesis de que a mayor dosis, se obtendrían mejores resultados renales y de supervivencia, en pacientes con IRA diálisis-dependiente. El estudio de Bouman et al.6 fue uno de los primeros en poner en duda esta hipótesis, y demostró que la dosis de diálisis no mejora la supervivencia de estos pacientes: esta hipótesis fue definitivamente rechazada tras la publicación de los resultados de los estudios ATN7 y RENAL8. Además, Bouman et al. no hallaron diferencias, en términos de supervivencia, con un inicio precoz de la terapia sustitutiva renal6.
Actualmente, la duda más relevante es el mejor momento para iniciar diálisis en este tipo de pacientes… ¿iniciar diálisis de manera temprana mejoraría los resultados renales y la supervivencia?
Las evidencias de las que disponíamos hasta este momento derivan de estudios observacionales8–11. Dos metaanálisis12,13 señalan beneficio en supervivencia asociado al inicio precoz de diálisis. El beneficio se explicaría por un mejor control de la fluidoterapia, las alteraciones hidroelectrolíticas y la eliminación de toxinas que facilitarían la prevención de complicaciones como la hemorragia digestiva y la encefalopatía14.
La mayor limitación de estos estudios observacionales es que no cuentan con grupo control: todos los pacientes reciben terapia renal sustitutiva. Por otro lado, la posibilidad de que, al indicar inicio de tratamiento tardío, se esté facilitando la recuperación espontánea renal no ha sido estudiada.
Los resultados de ambos estudios, como detallaremos a continuación, son contradictorios y no acaban de proporcionar una respuesta clara. En el estudio Artificial kidney initiation in kidney injury (AKIKI), el inicio precoz de diálisis en pacientes sépticos no aportó ningún beneficio sobre el inicio tardío, y en el estudio Early versus delayed initiation of renal replacement therapy in AKI (ELAIN), en pacientes quirúrgicos con IRA menos grave, el inicio muy precoz de una técnica sustitutiva renal podría ser beneficiosa.
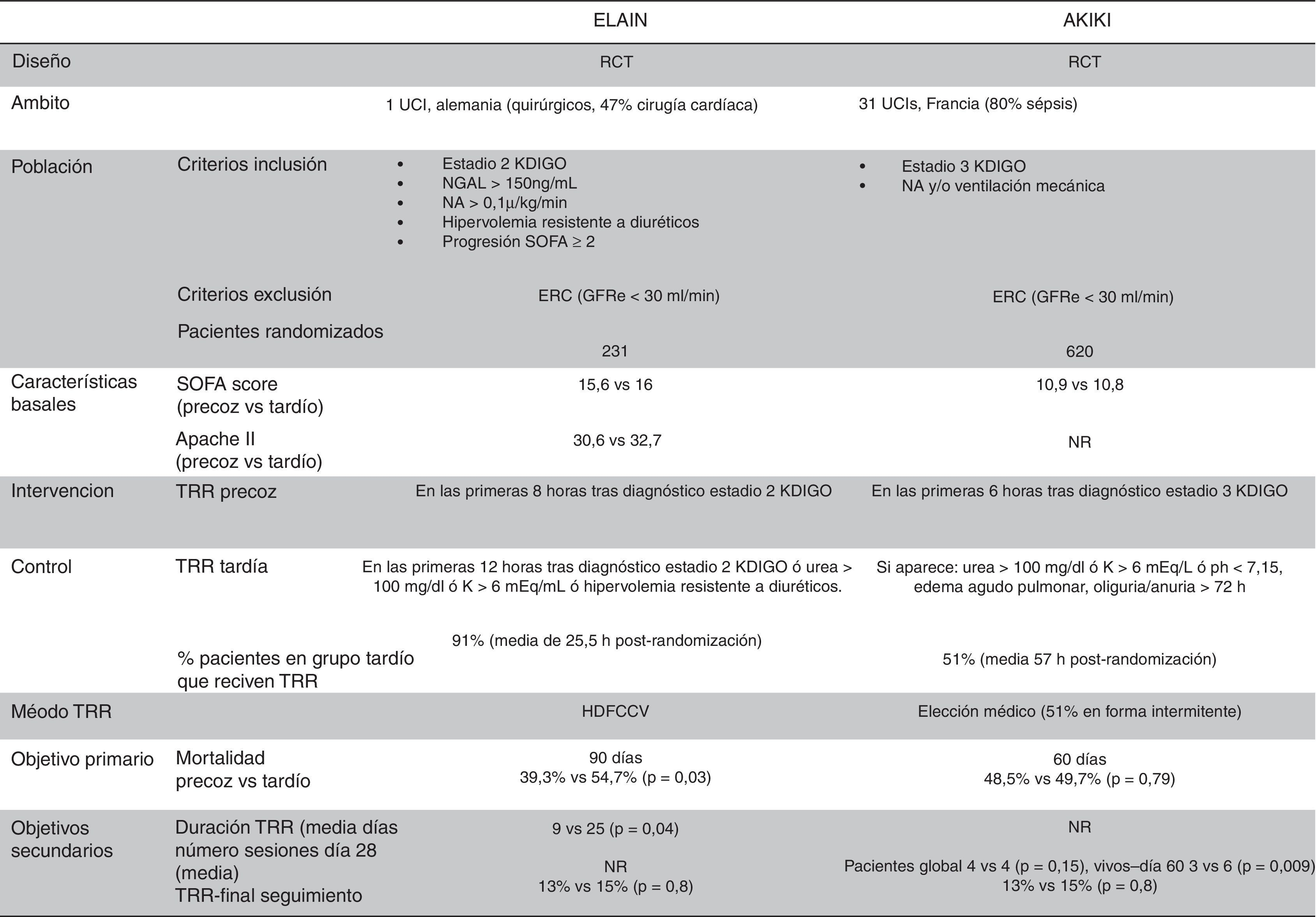
Estudio Artificial kidney initiation in kidney injuryEl primer estudio que intenta contestar esta pregunta es el estudio francés AKIKI, multicéntrico, aleatorizado, abierto, en el que se compara el inicio precoz versus tardío del tratamiento con diálisis en pacientes graves con IRA. El objetivo primario era la supervivencia de los pacientes a los 60 días. Los pacientes se aleatorizaron 1:1 en el momento del diagnóstico de IRA estadio 3 KDIGO, al grupo de inicio de tratamiento precoz (tan pronto como fue posible) o tardío (cuando el paciente alcanzó uno de los criterios considerados como indicadores de diálisis urgente que se habían utilizado antes de la aleatorización como criterios de exclusión del estudio).
Los criterios de exclusión fueron: oliguria durante más de 72 h, BUN elevado, hipercaliemia, acidosis importante, edema agudo de pulmón por sobrecarga de volumen que produzca hipoxemia con requerimientos de flujo de oxígeno a pesar de tratamiento diurético.
La elección de la técnica de hemodiálisis (continua o intermitente) y la duración e intervalo entre sesiones fue prerrogativa de cada centro. Se trataba de pacientes adultos ingresados en Unidad de Cuidados Intensivos, con el diagnóstico de IRA secundaria a necrosis tubular aguda isquémica o por nefrotoxicidad en estadio 3 KDIGO. Todos los pacientes estaban intubados o bien en tratamiento con fármacos vasopresores.
Un total de 620 pacientes fueron aleatorizados, 312 al grupo precoz y 308 al grupo tardío. El 80% de los pacientes en la cohorte global tenían diagnóstico de sepsis y el 63% fueron diagnosticados de IRA secundaria a nefrotoxicidad; el 80% estaban en tratamiento con fármacos vasoactivos y un porcentaje similar de pacientes requirieron soporte ventilatorio mediante intubación orotraqueal. En el grupo precoz, los pacientes iniciaron hemodiálisis con una media de 4,3 h tras el diagnóstico de IRA estadio KDIGO 3. De los pacientes del grupo tardío, solo el 50% recibieron diálisis, que iniciaron tras una media de 57 h después del diagnóstico y la aleatorización. El 50% de los pacientes siguieron tratamiento con técnicas intermitentes de hemodiálisis y en el 30% se utilizaron terapias continuas. Respecto al objetivo primario, la mortalidad fue del 50% a los 60 días tras la aleatorización, similar en ambos grupos. No se hallaron diferencias en las complicaciones potencialmente relacionadas con la técnica de diálisis, a excepción de las infecciones asociadas a catéter, que fueron más frecuentes en el grupo precoz, y la hipofosfatemia, más frecuente en el grupo tardío. Aunque las curvas de supervivencia fueron similares en ambos grupos, la recuperación de la función renal, definida como recuperación de la diuresis, fue más rápida en el grupo tardío. En este estudio, la estrategia de retrasar el inicio de diálisis en pacientes graves con IRA,la hizo innecesaria en el 50% de los pacientes.
Estudio Early versus delayed initiation of renal replacement therapy in AKIEl segundo estudio fue un ensayo clínico realizado en un centro alemán que comparó el inicio precoz versus tardío del tratamiento con diálisis en pacientes graves con IRA; el objetivo primario fue la supervivencia de los pacientes a los 90 días. Los criterios de inclusión fueron: edad 18-90 años, diagnóstico de IRA estadio 2 KDIGO, niveles plasmáticos de NGAL (lipocalina asociada a gelatinasa de neutrófilos) >150ng/ml y una de las siguientes condiciones: sepsis severa, necesidad de catecolaminas, edema pulmonar refractario a tratamiento diurético o progresión del score SOFA.
Los criterios de exclusión fueron la existencia de enfermedad renal crónica previa grados 4 o 5, o la IRA debida a otras causas diferentes a la necrosis tubular aguda (trombótica, intersticial, glomerular u obstructiva). Los pacientes fueron aleatorizados al grupo de inicio precoz de hemodiálisis, en el cual se iniciaba tratamiento en las siguientes 8 h tras la aleatorización, o bien al grupo de inicio tardío, con inicio de diálisis en las 12 h tras la progresión a estadio 3 KDIGO o cuando aparecía uno de los criterios absolutos de inicio de diálisis (urea elevada, hipercaliemia, hipermagnesemia, diuresis <200ml/12h o anuria, o bien edema resistente a tratamiento diurético. Los pacientes fueron predominantemente quirúrgicos, el 47% con antecedentes de cirugía cardíaca y un alto porcentaje con ventilación mecánica y necesidad de fármacos vasoactivos. Todos recibieron tratamiento mediante técnicas continuas de diálisis utilizando el mismo protocolo para asegurar la uniformidad en el tratamiento.
Un total de 231 pacientes fueron aleatorizados, 112 pacientes al grupo precoz y 119 pacientes al grupo tardío; todos los del grupo precoz recibieron diálisis, por solo el 89% (n=108) en el tardío. El tiempo medio desde cumplir todos los criterios de inclusión hasta el inicio de diálisis fue de 6 h en el grupo precoz y de 25,5 h en el grupo tardío. En el momento de la aleatorización, no existieron diferencias entre la función renal de ambos grupos. La mortalidad a los 90 días fue menor en el grupo precoz (44/112) que en el tardío (65/119), HR 0,66 (IC 0,045–0,97; p=0,03). El grupo de inicio temprano de diálisis mostró una mayor recuperación renal a los 90 días, reducción del tiempo con ventilación mecánica y disminución del tiempo de ingreso hospitalario, comparado con el grupo de inicio tardío.
Resultados contradictoriosA la hora de analizar los resultados contradictorios entre ambos estudios, resulta esencial estudiar detenidamente las diferencias entre ambos (tabla 1). Además de las diferencias obvias en el número de pacientes incluidos y en el número de centros participantes en cada estudio, existe una importante diferencia entre el tipo de pacientes de cada estudio: el estudio AKIKI incluye pacientes médicamente graves, predominantemente sépticos, aunque con menor incidencia de fallo multiorgánico (SOFA ∼11) que en la cohorte ELAIN; esta última está constituida por pacientes quirúrgicos con mayor incidencia de fallo multiorgánico (SOFA ∼16) y elevada gravedad medida por la escala APACHE (∼30). Existen diferencias también respecto a la indicación de diálisis: en el estudio AKIKI se indica de manera «precoz», en estadio 3 KDIGO, mientras que en el ELAIN se indica de manera «muy precoz», en estadio 2 KDIGO. También existen sutiles diferencias entre los grupos de indicación tardía de ambos estudios, de tal manera que en el estudio ELAIN está formado por pacientes en estadio 3 KDIGO (85%) o pacientes con unas determinadas alteraciones metabólicas (15%), lo que hace que, en la práctica, el grupo de indicación tardía del estudio ELAIN sea prácticamente igual al de indicación precoz del estudio AKIKI. Por consiguiente, a los grupos de indicación de diálisis podríamos cambiarles la denominación como sigue: ELAIN «indicación muy precoz» versus «indicación precoz», mientras que en AKIKI «indicación precoz» versus «indicación convencional». Además no conseguimos explicar por qué un pequeño retraso en el inicio de la terapia, en el estudio ELAIN, puede dar como resultado una importante disminución tanto en la duración de la terapia como en el número de días de ingreso hospitalario. Existen también diferencias respecto a tipo y dosis de diálisis: en el estudio AKIKI los decidía cada médico, y las modalidades y dosificaciones exactas no aparecen detalladas en el texto publicado. En el estudio ELAIN, tanto la modalidad como la dosis estaban definidas: hemodialfiltración veno-venosa continua, 30ml/kg/h con 100% predilución, pero, a diferencia del estudio AKIKI, en el estudio alemán no se especifican los criterios para mantener o retirar la terapia a los pacientes.
Respecto a la validez de los datos ofrecidos por ambos estudios, los autores del estudio AKIKI formulan la siguiente hipótesis: el tratamiento renal sustitutivo tardío puede conferir un beneficio absoluto en supervivencia de al menos el 15%, con un poder estadístico del 90% y un nivel de significación del 5%. Los autores del estudio ELAIN formulan la hipótesis prácticamente contraria: el tratamiento renal sustitutivo precoz puede conferir una supervivencia absoluta del 18% con un poder estadístico de 80% y el mismo nivel de significación.
En conclusión, en el estudio AKIKI, el inicio precoz de una técnica dialítica en pacientes sépticos, con IRA grave, no aportó ningún beneficio sobre el inicio tardío, más convencional. En el estudio ELAIN, de menor volumen, importancia y calidad, y realizado en pacientes quirúrgicos con IRA menos grave, parece que el inicio muy precoz de una técnica sustitutiva renal puede ser beneficiosa.
Un metaanálisis de 9 ensayos clínicos aleatorizados en los que se comparó el inicio precoz de diálisis versus práctica estándar, en pacientes críticos ingresados en UCI con IRA, confirmó que no había diferencias en la mortalidad entre ambos grupos15. A pesar de los importantes esfuerzos realizados, la duda del mejor momento para iniciar tratamiento dialítico en el paciente con IRA persiste. La búsqueda con los términos «acute kidney injury» AND «renal replacement therapy» en ClinicalTrials.gov aporta un total de 208 proyectos centrados en múltiples aspectos como modalidad técnica, biomarcadores, etc.; solamente 2se preguntan sobre el mejor momento para iniciar la diálisis en estos pacientes. Uno de ellos se realizó en Canadá a partir de un estudio piloto aleatorizado16 que ha dado claves para el diseño de un ensayo a gran escala que está en pleno desarrollo (NCT02568722). El otro, limitado a pacientes con shock séptico, es un ensayo multicéntrico francés que aún está en fase de inclusión de pacientes (NCT01682590)17. Una muestra amplia, una cierta uniformidad en los diagnósticos basales, con validación de los sistemas de clasificación18,19, una aleatorización muy controlada y la aplicación de biomarcadores como variables subrogadas20,21 son requisitos esenciales para generar respuestas de alta calidad.