El tratamiento de la glomerulonefritis membranosa (GNM) idiopática requiere una estrategia global que debe de basarse forzosamente en la distinción de sus diferentes formas de evolución. Esta afirmación, que debiera de ser aplicada a todas las enfermedades glomerulares, cobra especial relevancia en la GNM dado que su historia natural, en ausencia de tratamientos inmunosupresores, varía enormemente de unos pacientes a otros. Por ello es necesario analizar cuidadosamente los datos disponibles en la literatura acerca de la historia natural de esta enfermedad antes de discutir las distintas opciones terapéuticas. Insistimos en este concepto porque siguen publicándose esquemas terapéuticos basados en una estrategia del «todo o nada» absolutamente alejados de un análisis individualizado de cada enfermo. Así, se han propuesto posturas «nihilistas», de no tratar a ningún paciente con GNM con fármacos inmunosupresores dado que un elevado porcentaje presenta una evolución benigna1. Por el contrario, otras autoridades en el campo mantienen posiciones radicalmente distintas, propugnando el tratamiento de todas las GNM con síndrome nefrótico con esteroides y citostáticos2. Creemos que la posición más correcta se sitúa en un término medio entre ambas posturas extremistas, por lo que vamos a tratar de sustentar tal idea en este artículo. En él describimos la política actual de tratamiento de la GNM en el Servicio de Nefrología del Hospital 12 de Octubre. Obviamente, las opiniones y recomendaciones aquí expresadas deben de interpretarse como síntesis de nuestra política global, basada en una experiencia acumulada importante, con diversas fases históricas y con estudios retrospectivos y prospectivos recogidos en diversas publicaciones. Pero no debe de olvidarse la escasez de estudios prospectivos controlados en el tratamiento de la GNM, lo que hace discutibles y opinables las recomendaciones aquí expresadas.
HISTORIA NATURAL DE LA GNM
Un hecho diferencial y característico de la GNM es que un elevado porcentaje de casos presenta, de manera espontánea y en ausencia de tratamientos con esteroides u otros inmunosupresores, una remisión completa o parcial del síndrome nefrótico. Las series de pacientes publicadas en las décadas de los 70-80 del pasado siglo son muy ilustrativas a este respecto, dado que la mayoría de los enfermos con GNM idiopática demostrada por biopsia renal no recibían tratamientos específicos. En base a estas series y algunas otras publicadas más recientemente (revisado en 3) se puede situar el porcentaje de remisiones espontáneas en torno a un 30-45% de los casos.
Por el contrario, otro porcentaje estimable de casos (en torno a 30-35%)3 desarrolla insuficiencia renal progresiva terminando en diálisis crónica a no ser que se logre revertir el proceso con fármacos, como comentaremos más adelante. Dentro de esta evolución desfavorable habría que distinguir dos formas distintas de evolución: un porcentaje variable de casos, que podríamos situar en torno al 20%, desarrolla insuficiencia renal de manera rápida, en un espacio de pocos meses y en ocasiones iniciándose ya en el momento del diagnóstico. Estos casos, que podríamos llamar, a tenor de su curso, «GNM agresivas» o «rápidamente progresivas», cursan siempre con proteinurias masivas acompañando al rápido deterioro de función renal4,5. En otro porcentaje variable entre el 15-25%, el desarrollo de insuficiencia renal se produce de manera más lenta, tras un período prolongado (años) de proteinuria nefrótica.
Esta dicotomía evolutiva4 es muy característica de la GNM y presenta una serie de particularidades de gran importancia clínica, que deben siempre de tenerse en cuenta a la hora de diseñar un esquema terapéutico global para esta entidad:
¿ Tanto la evolución benigna (remisión espontánea) como la agresiva comienzan a definirse rápidamente en una mayoría de enfermos: es sobre todo en los 12-24 primeros meses tras el comienzo de la enfermedad cuando se asiste al inicio de remisión espontánea o de deterioro de función renal. Existen casos con definiciones más tardías, pero su probabilidad va disminuyendo con el paso del tiempo.
¿ El desarrollo de insuficiencia renal se asocia de manera constante con la presencia de proteinuria masiva. En los casos con remisión parcial (definida como proteinuria superior a 0,3-0,5 pero inferior al rango nefrótico de 3,5 g/24 h) el pronóstico a largo plazo es bueno6. Incluso en aquellos casos que mantienen proteinuria nefrótica pero no superior a 4-5 g/24 h y no acompañada por hipoalbuminemia importante, es raro observar deterioros rápidos de función renal, aunque a largo plazo la probabilidad de insuficiencia renal lentamente progresiva se va haciendo mayor.
Por lo dicho, simplificando las distintas variantes evolutivas de la GNM no tratada, podríamos distinguir tres grandes grupos: 1) las benignas, caracterizadas por la aparición de remisiones espontáneas completas o parciales. 2) las agresivas o «rápidamente progresivas», caracterizadas por el desarrollo de insuficiencia renal rápida (en pocos meses) acompañada de síndrome nefrótico masivo, y 3) las persistentes, que mantienen síndrome nefrótico durante períodos prolongados de tiempo sin observarse deterioro de función renal ni remisión espontánea. También simplificando, cada una de estas variantes representaría aproximadamente 1/3 del total de pacientes con GNM. Lógicamente, el abordaje terapéutico debiera de ser distinto en estas diferentes formas evolutivas.
REMISIONES ESPONTÁNEAS EN LA GNM
Como decíamos anteriormente, entre un 30-45% de los casos (amplias diferencias de unas series a otras) remiten de forma espontánea, es decir, sin el uso previo de esteroides o de fármacos inmunosupresores. Un corolario obligado de este hecho debiera ser el instaurar un período de observación en todo paciente con GNM, a no ser que su función renal muestre un deterioro evidente no achacable a factores funcionales. Durante este período de observación deben de prescribirse las medidas generales de tratamiento de un síndrome nefrótico: reposo relativo, dieta sin sal, diuréticos en función de la evolución del paciente, tratamiento de la hiperlipidemia con estatinas y prescripción de un IECA o un bloqueante de receptores de angiotensina (ARB) para lograr TA inferiores a 130/80 mmHg y aprovechar su efecto antiproteinúrico. Las consecuencias de la hipercoagulabilidad de los pacientes con síndrome nefrótico debe de ser prevenida (riesgo de trombosis venosa profunda/tromboembolismo pulmonar), mediante heparinas de bajo peso molecular en los pacientes con anasarca o en los pacientes encamados.
Diversos trabajos, sobre todo del grupo de Cattran, han demostrado que el sexo masculino, la edad superior a 50 años y la presencia de proteinuria > 8 g/día de forma sostenida durante más de 6 meses son criterios de mal pronóstico y por tanto asociados a una menor probabilidad de remisión espontánea7. Sin embargo, es posible que la incidencia de remisiones espontáneas en la GNM haya aumentado en los últimos años, quizá en relación con el uso generalizado desde el diagnóstico de IECA y/o ARB y de estatinas. En un análisis preliminar de nuestro grupo (datos no publicados), hemos observado que la incidencia de remisión espontánea fue significativamente superior entre los pacientes tratados precozmente con IECA/ARB y que incluso enfermos que reunían los criterios de mal pronóstico arriba indicados, podían remitir espontáneamente en ausencia de tratamientos inmunosupresores.
La duración del período de observación con tratamiento conservador es difícil de definir dada la ausencia de estudios específicos en este campo, pero en la práctica clínica de nuestro grupo la situamos en torno a 12 meses8. No obstante, es necesaria una flexibilidad amplia en estos límites, porque en casos de tendencia evidente a la disminución de proteinuria, aunque ésta aún se mantenga en rango nefrótico, es conveniente extender este período más allá del primer año, para ver si el paciente entra en remisión al menos parcial sin ningún tratamiento agresivo. Lógicamente, si prolongamos el período de observación aumentará la probabilidad de remisiones espontáneas (aunque cada vez menos frecuentes con el paso del tiempo) pero también la de complicaciones específicas del síndrome nefrótico y de deterioro de función renal. Por ello, en casos con proteinuria masiva sostenida, sin ninguna tendencia a la disminución, con mala tolerancia al síndrome nefrótico, puede ser razonable acortar el período de observación a 6-9 meses3 y decidir medidas terapéuticas específicas, que veremos más adelante.
FORMAS AGRESIVAS DE GNM
Del anterior concepto de observación conservadora deberían exceptuarse aquellos casos que, casi siempre asociada a una proteinuria masiva, inician un deterioro rápido de función renal. Al igual que en las remisiones espontáneas, es en los primeros 12-24 meses tras el diagnóstico cuando más frecuentemente se ven estas formas de presentación agresiva. Antes de establecer este diagnóstico es preciso descartar que el deterioro de la función renal sea debido a factores funcionales (exceso de diuréticos, efecto colateral de IECA/ARB, etc.) Aunque no existen estudios prospectivos controlados específicamente dirigidos a este tipo de pacientes, sí disponemos de estudios de cohortes históricas que muestran un pésimo pronóstico en los casos que no recibieron tratamientos inmunosupresores en comparación con los casos tratados9,10. En nuestra experiencia9 prácticamente todos los casos históricos no tratados evolucionaron hacia la IR terminal o fallecieron, mientras que en los casos tratados la supervivencia renal a 8 años alcanzó el 90%.
¿Qué tipo de tratamiento inmunosupresor es preferible en estas formas agresivas? El esquema de inmunosupresión más popular en la GNM es sin duda el del grupo de Ponticelli, basado en esteroides en altas dosis (meses impares) alternando con clorambucil (meses pares) durante un período de 6 meses2. Nosotros hemos usado un esquema similar al de Ponticelli, pero simplificado, administrando esteroides exclusivamente por vía oral (prednisona 1 mg/kg/día con reducción paulatina de la dosis durante 6 meses) más clorambucil (0,15 mg/kg/día) durante las primeras 14 semanas9. Otros autores prefieren esteroides más ciclofosfamida, administrada de forma más prolongada10, teniendo en cuenta que la ciclofosfamida ha mostrado un perfil de eficacia y seguridad superior al clorambucil en un estudio controlado11.
Los anticalcineurínicos (ciclosporina) han demostrado un efecto favorable en casos de GNM con deterioro de función renal en un estudio prospectivo controlado12. Sin embargo, en nuestra experiencia, el manejo de anticalcineurínicos en pacientes con insuficiencia renal, sobre todo si ésta es rápidamente progresiva, es particularmente difícil, por lo que, en ausencia de estudios comparativos controlados, preferimos esquemas inmunosupresores clásicos (esteroides más clorambucil o ciclofosfamida) en estas formas de presentación.
El concepto aquí defendido9,10 de inmunosupresión «específica o restringida», es decir, limitada a los pacientes con deterioro rápido de función renal, es ciertamente un tema debatido, pues choca con la propuesta (defendida principalmente por Ponticelli) de un tratamiento inmunosupresor a todos los casos con síndrome nefrótico, sin período de observación como el propuesto por nosotros. No obstante, creemos necesario recalcar que estos abordajes terapéuticos se acompañan de frecuentes y serios efectos adversos9, por lo que parecería lógico restringir su empleo a aquellos casos con una peor evolución. Por otra parte, el grupo de Nijmegen, Holanda, que defiende una actitud superponible a la nuestra10, ha mostrado en un análisis cuidadoso que el uso restrictivo de estos esquemas inmunosupresores no disminuye en nada su eficacia, mientras que libra de los efectos secundarios de estos fármacos a un importante número de pacientes que espontáneamente van a evolucionar a la remisión10.
FORMAS CON SÍNDROME NEFRÓTICO PERSISTENTE
Como decíamos antes, aproximadamente 1/3 de los casos de GNM van a mostrar un síndrome nefrótico persistente durante años, sin mostrar remisión espontánea pero tampoco deterioro de función renal.
Como en todos los aspectos terapéuticos de la GNM, también existe controversia acerca de la mejor actitud ante tales casos. Una actitud puramente conservadora podría ser defendida, teniendo en cuenta la posibilidad de remisiones espontáneas tardías, pero cómo decíamos arriba, tal probabilidad va disminuyendo con el tiempo. Por el contrario, el daño estructural causado por una proteinuria nefrótica sostenida ha sido claramente refrendado en los últimos años con modelos experimentales y estudios clínicos13.
Los estudios de Ponticelli, con su esquema de esteroides más clorambucil o ciclofosfamida, continuan siendo una referencia obligada, dado que en ellos se demostró de forma prospectiva y controlada la eficacia del tratamiento respecto a los no tratados2,11. Recientemente, otro trabajo prospectivo, randomizado y con un largo período de seguimiento mostró que el tratamiento con esteroides y ciclofosfamida era superior al no tratamiento en la GNM14. No obstante, como decíamos, el principal defecto de estos trabajos es que incluyen a todos los pacientes con síndrome nefrótico sin un período cautelar de observación y sin un empleo generalizado de IECA o ARB que hoy en día parece obligado en todo paciente con glomerulopatías proteinúricas como la GNM.
La otra alternativa terapéutica que se ha consolidado en los últimos años en pacientes con síndrome nefrótico y función renal mantenida son los anticalcineurínicos. En un estudio controlado multicéntrico se demostró que los pacientes tratados con esteroides y ciclosporina durante 6 meses presentaban una mayor tasa de remisiones (68% versus 22%) que los tratados sólo con esteroides. Al año de la suspensión del tratamiento, la diferencia se había reducido (43 vs 19%) por las frecuentes recidivas al suspender la ciclosporina, aunque seguía siendo significativa15.
En un estudio multicéntrico español recientemente publicado16 se demostró que la monoterapia con tacrolimus, a dosis relativamente bajas (dosis inicial 0,05 mg/kg/día) conseguía una tasa de remisiones completas o parciales significativamente mayor que en el grupo control no tratado: 58, 82 y 94% a los 6, 12 y 18 meses de tratamiento en el grupo tratado, versus 10, 24 y 35% en el control. Un dato importante fue que el número de pacientes retirados por deterioro de función renal fue significativamente menor en el grupo tratado (un sólo paciente, versus 6 en el grupo control). Los efectos secundarios del tacrolimus fueron escasos, sin diferencias con el grupo control. Sin embargo, tras la suspensión del tacrolimus, el síndrome nefrótico reapareció en 47% de los pacientes que habían entrado en remisión con el fármaco. Novedades importantes de este estudio fueron la administración de tacrolimus sin esteroides acompañantes, la exigencia de un período de observación en todos los pacientes para asegurar la persistencia del síndrome nefrótico y la administración de IECA o ARB a todos los pacientes de ambos grupos antes y durante el período de tratamiento.
Para resolver qué tipo de tratamiento inmunosupresor (esteroides + citostáticos o anticalcineurínicos) es más eficaz en estos casos de GNM, sería necesario un estudio prospectivo y controlado. No obstante, existen estudios piloto comparativos que muestran un mejor perfil de los anticalcineurínicos: mayor porcentaje de remisiones, mayor rapidez en la aparición de las mismas y menos efectos secundarios a corto y largo plazo17,18.
En nuestro centro, dada la experiencia acumulada y los buenos resultados obtenidos, tratamos este tipo de enfermos con síndrome nefrótico persistente con tacrolimus. No obstante, el principal problema es la recaída tras la suspensión del fármaco, que aparece aproximadamente en la mitad de los casos en los meses siguientes a la supresión. Esta experiencia es similar a la obtenida en el estudio de Cattran con ciclosporina15 y a la de otros estudios de reciente aparición que han confirmado la eficacia del tacrolimus pero también acompañado de frecuentes recidivas post-tratamiento19. La reanudación de los anticalcineurínicos va generalmente seguida de una nueva remisión, existiendo así enfermos «anticalcineurínico-dependientes», con el consiguiente peligro de nefrotoxicidad a largo plazo.
Una alternativa terapéutica que permitiera la supresión del anticalcineurínico, una vez lograda la remisión, sin recidiva del síndrome nefrótico sería de enorme importancia para el manejo de esta enfermedad.
FORMAS CON INSUFICIENCIA RENAL CRÓNICA O CON INTOLERANCIA O FALTA DE RESPUESTA A ANTICALCINEURÍNICOS Y CITOSTÁTICOS
No es excepcional el detectar pacientes con IRC ya establecida, por diagnósticos tardíos, manejo previo inadecuado o abandono por el paciente de los controles rutinarios que son imprescindibles en esta enfermedad. Por otra parte, los tratamientos referidos hasta ahora, fundamentalmente esteroides + citostáticos o anticalcineurínicos no siempre son eficaces y en ocasiones no son tolerados por el paciente. Es en estos casos donde un estudio multicéntrico de nuestro país recientemente publicado20, ha demostrado la eficacia del micofenolato administrado como «terapéutica de rescate» en diversas enfermedades glomerulares: en los casos con GNM (n = 21), tras 12 meses de tratamiento la proteinuria se redujo de 7,9 ± 2,1 a 3 ± 1,4 g/24 h y un 52% de los casos entraron en remisión parcial con estabilización de función renal.
OTRAS OPCIONES TERAPÉUTICAS
En los últimos años, trabajos preliminares han descrito la posible utilidad del rituximab y de las inyecciones de ACTH en la GNM21,22. Creemos que, aunque muy interesantes, estas opciones deben de ser corroboradas con estudios prospectivos controlados. Es conveniente destacar que los esteroides administrados aisladamente, no en unión de citostáticos o anticalcineurínicos, no han mostrado efecto beneficioso en estudios controlados prospectivos23.
RESUMEN Y RECOMENDACIONES
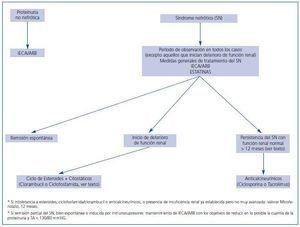
En el algoritmo de la figura 1 esquematizamos la política actual de tratamiento de la GNM en nuestro Servicio, basada en los argumentos discutidos anteriormente. Creemos que en todo paciente con GNM debe de prescribirse un tratamiento general conservador del síndrome nefrótico, que incluya IECA o ARB y estatinas, y esperar un período de tiempo razonable (en torno a 12 meses) por si se produce una remisión espontánea completa o parcial. En casos con proteinuria masiva sin tendencia a disminuir y sobre todo si se trata de varones de edad > 50 años, es razonable acortar este período de observación. En los casos agresivos, con proteinurias masivas y que inician deterioro progresivo de función renal no achacable a factores funcionales, nuestra política se basa en la administración de un ciclo de esteroides más clorambucil, aunque los ciclos de esteroides + ciclofosfamida parecen igualmente eficaces y quizá con mejor tolerancia. En los casos con síndrome nefrótico persistente y función renal normal, que se mantiene más allá de un período de observación razonable, comenzamos con tacrolimus en monoterapia, mantenida aproximadamente 12 meses, para iniciar después una reducción paulatina durante otros 6 meses. En los casos con recidiva del síndrome nefrótico tras la suspensión del tacrolimus, reanudamos éste a las dosis más bajas suficiente para mantener al enfermo en remisión al menos parcial. Por último, en los casos resistentes a las medidas comentadas, o que no las toleren, consideramos un ciclo de micofenolato de 1 año, con reducción lenta de dosis durante otros 6-12 meses en caso de respuesta. En los pacientes con insuficiencia renal crónica establecida (diagnóstico tardío, abandono del seguimiento) y datos evidentes de cronicidad, así como en los casos (infrecuentes) de proteinuria no nefrótica se prescribe sólo tratamiento general conservador. La optimización del bloqueo del sistema renina-angiotensina con IECA, ARB, o tratamiento combinado IECA/ARB, buscando la menor cuantía de proteinuria posible es fundamental en estos últimos casos y también en aquellos que han desarrollado remisiones parciales, bien espontáneas o inducidas por tratamientos inmunosupresores.
Figura 1.