INTRODUCCIÓN
La cistinosis nefropática infantil (OMIM 219800) es una enfermedad genético-metabólica de baja prevalencia (incidencia anual de 1/100.000-200.000 recién nacidos), de transmisión autosómica recesiva. El gen responsable de la enfermedad se denomina CTNS y está localizado en la región cromosómica 17p13. Este gen codifica la proteína de la membrana lisosómica, cistinosina, de 367 aminoácidos con 7 dominios transmembrana. Se ha demostrado que la cistinosina constituye, en efecto, el transportador lisosómico de cistina. Consecuentemente, el defecto en la síntesis de esta proteína se caracteriza bioquímicamente por la acumulación de cistina libre en los lisosomas de la mayor parte de las células del organismo, lo que conduce a un deterioro progresivo de los órganos afectados, en especial el riñón. Desde el descubrimiento de la cisteamina, compuesto capaz de entrar en el lisosoma y favorecer la salida de cistina, la cistinosis forma parte de las pocas enfermedades lisosómicas para las que se dispone de un tratamiento eficaz.
ASPECTO HISTÓRICO
Desde los cristales de cistina hasta la cistinosina
En 1952, Bickel, et al.1 propusieron el nombre de Lignac-Fanconi para el síndrome en el que se produce una acumulación intracelular de cistina acompañada de aminoaciduria generalizada en el curso de un síndrome de Fanconi. En 1957, Cogan2 describe una forma de cistinosis del adulto (OMIM 219750), forma benigna de la enfermedad que comienza tardíamente, sin afectación renal y con afectación principalmente ocular (depósitos corneales de cistina).
Los diagnósticos iniciales se basaban en poner en evidencia los cristales de cistina en diferentes órganos en las autopsias y, posteriormente, en la córnea, con lámpara de hendidura o en la biopsia conjuntival, en la médula ósea, en los ganglios linfáticos y en la biopsia rectal.
A partir de 1967, Schneider3 describe la determinación de cistina intraleucocitaria, esencial para el diagnóstico. Durante la década de 1980, diversos trabajos caracterizaron el sistema de transporte lisosómico de cistina, que es específico, diferente del transportador de la membrana citoplasmática, y que se estimula en presencia de ATP4,5. En fibroblastos L-929 existe un segundo sistema de transporte no específico que funcionaría únicamente a altas concentraciones de cistina intralisosomal6.
En 1998 se identificó el gen de la cistinosis, al que se ha denominado CTNS7, y que codifica una proteína llamada cistinosina8. El gen tiene 23 kb, comprende 12 exones, y se expresa de manera importante en el riñón, en el páncreas, en el músculo esquelético, y, en menor intensidad, en la placenta, en el corazón, en el pulmón, en el hígado, y aún más débilmente en el cerebro. La cistinosina, compuesta de 367 aminoácidos, tiene 7 dominios transmembránicos y una señal potencial de dirección al lisosoma en su parte C-terminal. Además, su parte amino-terminal, antes del primer dominio transmembránico, contiene 7 sitios potenciales de glicosilación. El conjunto de dichas características permite deducir que se trata de una proteína de membrana lisosómica. Dicha proteína actúa de transportador lisosómico específico de cistina. Gracias al conocimiento del defecto genético se ha podido desarrollar un modelo animal en ratones (Ctns -/-) en el que se produce un síndrome de Fanconi y evolución hacia la insuficiencia renal9.
Consecuencias fisiopatológicas del defecto de transporte lisosómico de cistina
Los diversos estudios biópsicos y autópsicos en diferentes tejidos realizados en individuos con cistinosis han puesto en evidencia la presencia de cristales de cistina en prácticamente todos los tejidos y células10. Dichos cristales son detectables bajo luz polarizada y, al microscopio electrónico, puede apreciarse su localización intracelular. El tejido renal es especialmente sensible a los efectos de la acumulación de cistina, y es el que se ve afectado más precozmente, con lesiones características en el túbulo proximal, consistentes en una atrofia en forma de «cuello de cisne», aspecto muy irregular del epitelio tubular con alternancia de células atróficas y de células gigantes. Esta fase inicial corresponde al desarrollo del síndrome de Fanconi, cuando las lesiones glomerulares que afectan a los podocitos y a la cápsula de Bowman son escasas11. Sin embargo, a medida que la enfermedad progresa van apareciendo lesiones degenerativas no específicas consistentes en fibrosis intersticial, lesiones glomerulares con presencia de células epiteliales gigantes multinucleadas, aumento del espesor de las áreas mesangiales, hipertrofia y vacuolización de los podocitos y, finalmente, en fases tardías, aparición de lesiones de hialinosis y esclerosis. En la fase terminal, los riñones están muy atróficos, y se aprecia la presencia de gran cantidad de cristales de cistina en las células intersticiales de la unión corticomedular.
Ninguna de las lesiones específicas tubulares o glomerulares de la cistinosis se ha observado en los riñones trasplantados. Sin embargo, la aparición de cristales se ha demostrado en las células intersticiales renales y, raramente, en situación mesangial12.
Toxicidad de la cistina
Los polinucleares y los monocitos de los pacientes cistinóticos presentan una serie de alteraciones del metabolismo oxidativo secundarias al aumento de la concentración de cistina intracelular y, de forma indirecta, a alteraciones del ciclo del glutatión (fundamental en el control del estado de óxido-reducción intracelular). Los cambios del metabolismo oxidativo conducen a un aumento de los radicales libres de oxígeno, cuya toxicidad se manifiesta con una disminución de la movilidad y la capacidad de adherencia de los polinucleares13 y con aumento de la capacidad supresora de los monocitos sobre la síntesis de inmunoglobulinas por los linfocitos B activados14. Además, se produce un aumento de la producción de cisteinil-leucotrienos (LTC4)15.
Se ha postulado que el aumento de la concentración intralisosomal de cistina determinaría un incremento del fenómeno de apoptosis, sobre todo en las células tubulares proximales16,17, autofagia mitocondrial18, y también una depleción de glutatión19 y de adenosín trifosfato (ATP)20. Para otros autores, en cambio, el potencial redox intracelular en fibroblastos cistinóticos en cultivo se mantiene inalterado21.
CLÍNICA
Manifestaciones renales
La afectación renal es la más precoz y la más característica de la cistinosis nefropática.
Dependiendo del grado de afectación renal y de la edad de presentación, podemos diferenciar tres formas clínicas de cistinosis: infantil, juvenil, y la forma del adulto o benigna.
La forma más frecuente (representa aproximadamente el 95% de los casos), y la más grave, es la forma infantil22, con una edad de presentación a partir de los 3-6 meses de vida, en forma de síndrome de Fanconi. La concentración de cistina intraleucocitaria es superior a la de las otras formas y oscila entre 5 y 15 nmol de hemicistina/mg de proteína. El inicio de la enfermedad puede diferirse hasta los 12-18 meses, y es generalmente a partir de los 6 años cuando empieza a declinar la función renal; la evolución natural, sin tratamiento específico, es hacia la insuficiencia renal terminal aproximadamente a los 10 años de vida, en promedio23.
La forma juvenil, también denominada intermedia o de inicio tardío (OMIM 219900), es muy poco frecuente, y se presenta entre los 12 y los 17 años. La afectación renal tubular es menos importante que en la forma infantil y suele diagnosticarse por la afectación glomerular, con proteinuria, que evoluciona también hacia la insuficiencia renal terminal, entre la segunda y la tercera décadas de la vida. La concentración de cistina intraleucocitaria oscila entre 3 y 6 nmol de hemicistina/mg de proteína. La forma del adulto2, aún más rara, se diferencia fundamentalmente por la falta de afectación renal, y de todo el resto de manifestaciones sistémicas, de ahí su denominación de benigna (también se llama forma ocular o «no nefropática»). El diagnóstico suele realizarse por la presencia de cristales de cistina en la córnea, detectados por un oftalmólogo con motivo de molestias visuales como fotofobia y lagrimeo. La concentración de cistina intraleucocitaria se encuentra comprendida entre 1 y 3,5 nmol de hemicistina/mg de proteína.
En la cistinosis infantil, la afectación renal es precoz e importante, y se caracteriza inicialmente por la presencia de un síndrome de Fanconi (figura 1), en general a partir de los 4-6 meses. La cistinosis es la causa más frecuente de síndrome de Fanconi hereditario, y debe llevarse a cabo el diagnóstico diferencial con otras anomalías genéticas24 (tabla 1). El síndrome de Fanconi se caracteriza por un defecto generalizado de las funciones tubulares proximales con una pérdida excesiva de múltiples solutos como glucosa, fosfatos, bicarbonato, aminoácidos, carnitina, sodio, potasio, y otras pequeñas moléculas, que determinan el cuadro clínico habitual de poliuria, acidosis metabólica, retraso de crecimiento y raquitismo resistente a la vitamina D.
La primera manifestación suele ser la poliuria, que puede facilitar los episodios de deshidratación, sobre todo coincidiendo con gastroenteritis agudas. La fosfaturia es el condicionante principal del raquitismo y, junto con la acidosis metabólica, determinan un importante retraso de crecimiento. Desde el punto de vista biológico, se puede apreciar sobre todo hipofosfatemia, aumento de las fosfatasas alcalinas, y PTH normal o elevada. Hacia la edad de un año, aproximadamente, el retraso pondoestatural es evidente, con una talla alrededor de las –3 desviaciones estándar (DE). Existen hiperaminoaciduria generalizada y acidosis metabólica hiperclorémica, con una pérdida importante de bicarbonato habitual de la acidosis tubular proximal tipo 2. Asimismo, hay que prestar atención a la pérdida de sodio y de potasio, y puede existir también proteinuria moderada25. La evolución espontánea de la enfermedad es inexorablemente hacia la insuficiencia renal, con elevación progresiva de la creatinina plasmática a partir de los 4-6 años. En ausencia de tratamiento específico, la edad media de aparición de la insuficiencia renal terminal es de 9,2 años23.
Manifestaciones extrarrenales
Las manifestaciones extrarrenales más características son el retraso muy importante del crecimiento, la aparición de cristales de cistina en la córnea y el hipotiroidismo (tabla 2).
Los pacientes con cistinosis tienen una talla normal al nacer, pero suele descender al percentil 3 al año de vida, y posteriormente, la talla final se sitúa en 143 cm de promedio para los hombres y 128 cm para las mujeres26. En ausencia de tratamiento, la afectación ocular, caracterizada por el depósito de cristales de cistina en la córnea y en la conjuntiva, determina la aparición de fotofobia a partir de los 3-4 años, seguida, a veces, de blefarospasmo por microulceraciones corneales a partir de los 7 años. A esta edad puede apreciarse también una despigmentación progresiva de la retina, con disminución de la visión de los colores a partir de los 10 años, y posteriormente, déficit de agudeza visual, que puede evolucionar a la ceguera a partir de los 15-20 años27.
Un hipotiroidismo, secundario a la acumulación de cristales de cistina en el tiroides, puede desarrollarse a partir de los 10 años. En ausencia de tratamiento específico, a partir de los 18 años, el 70-80% de los pacientes requieren tratamiento hormonal sustitutivo28.
Otras alteraciones que se van sumando con el paso de los años, generalmente después de haber recibido un trasplante renal, son las siguientes: retraso puberal con hipogonadismo hipergonadotrófico en los hombres, miopatía distal progresiva, con atrofia muscular, sobre todo de la musculatura de la mano, y, en ocasiones, con disfonía y disfagia, afectación pancreática con diabetes mellitus, afectación hepática con hipertensión portal e hiperesplenismo, que en ciertos casos justifica una esplenectomía, y afectación neurológica, que puede manifestarse en forma de convulsiones, atrofia cerebral discreta, anomalías de la percepción visual y espacial, y disminución de la memoria visual. La inteligencia global es normal, aunque, tardíamente, pueden aparecer signos de encefalopatía con signos cerebelosos o piramidales. En la piel se aprecia habitualmente una hipopigmentación, en los de raza caucásica, y envejecimiento cutáneo precoz causado por una elastopatía progresiva irreversible.
Diagnóstico bioquímico
Consiste en la determinación de la cistina intracelular, habitualmente intraleucocitaria, en general a partir de leucocitos totales obtenidos de sangre periférica. La técnica más utilizada es la cromatografía de intercambio iónico, aunque los métodos específicos en los que se emplean una proteína fijadora de cistina29 (CBP: cystine binding protein) y la espectrometría de masas en tándem son más sensibles. En controles normales, la concentración de cistina intraleucocitaria es inferior a 0,2 nmol de hemicistina/mg de proteína, mientras que en los pacientes con cistinosis nefropática las concentraciones son superiores a 2 nmol de hemicistina/mg de proteína. El diagnóstico prenatal puede realizarse en amniocitos o vellosidades coriales30, tanto por el método de incorporación de cistina marcada con 35S, como por cuantificación directa31 o por estudios de ADN fetal, cuando la mutación del gen CTNS ha sido identificada previamente en la familia.
Diagnóstico molecular
Aparentemente, todos los pacientes con cistinosis presentan mutaciones en el gen CTNS. Se han descrito más de 100 mutaciones diferentes, y la más común, en la forma de cistinosis infantil, es una deleción de aproximadamente 57 kb, que afecta a los 10 primeros exones del gen, que se encuentra aproximadamente en el 60-70% de los pacientes cistinóticos, prácticamente todos con ascendente norteeuropeo32. La mayoría de las mutaciones puntuales son inactivadoras, y conducen a una ausencia de proteína o a una proteína truncada probablemente no funcional. En las formas infantiles, estas mutaciones afectan a los aminoácidos localizados en la parte carboxiterminal de la proteína, lo que sugiere que estas regiones son las más importantes desde el punto de vista funcional33. Asimismo, las mutaciones de las formas de inicio tardío afectan a los aminoácidos de la parte aminoterminal de la proteína, en regiones funcionalmente menos importantes.
TRATAMIENTO
El tratamiento de la cistinosis (tabla 3) puede dividirse en sintomático y específico, pero globalmente hay que remarcar que la efectividad de dicho tratamiento depende de un diagnóstico precoz y de un tratamiento adecuado durante la primera infancia para evitar el rápido desarrollo de la insuficiencia renal terminal, con la consiguiente necesidad de diálisis y/o de trasplante renal.
Tratamiento sintomático
Se basa fundamentalmente en el control de los trastornos hidroelectrolíticos, asegurando un correcto estado nutricional e impidiendo el establecimiento del raquitismo, con lo que mejora el crecimiento. En cuanto a los cambios hidroelectrolíticos, en la fase de mayor expresividad del síndrome de Fanconi existe una importante poliuria con pérdida de bicarbonato, sodio y potasio, que puede requerir aportes de bicarbonato sódico o citrato sódico/citrato potásico con importantes cantidades de agua (1 a 3 litros/día), con lo que se corregirían la pérdida de iones y la acidosis metabólica.
Respecto al raquitismo, hay que prestar atención a la pérdida de fosfatos; se precisa un aporte de fosfato de 1-4 g/día, además de la forma activa de la vitamina D (1, 25 o 1 alfa vitamina D), para evitar el hiperparatiroidismo.
En el curso del síndrome de Fanconi, se ha evidenciado una pérdida de carnitina con aparición de un déficit plasmático y muscular de carnitina que puede requerir aporte de L-carnitina suplementario (50-100 mg/kg/día)34.
La indometacina, inhibidor de la síntesis de prostaglandinas, utilizada a dosis moderadas de 1-3 mg/kg/día, puede presentar una efectividad espectacular, y corregir la poliuria y el estado de deshidratación crónica, junto con un aumento de peso y mejoría del estado general35. También se ha utilizado la hidroclorotiacida para mejorar la acidosis tubular renal y el raquitismo36. El aporte nutricional correcto puede estar fuertemente dificultado por la presencia de anorexia, a veces en relación con la alta ingestión de líquidos, vómitos y diarreas. En algunas situaciones es necesaria la alimentación por sonda nasogástrica o la colocación de gastrostomía.
Se han podido constatar los efectos beneficiosos de la utilización de hormona de crecimiento (rhGH), sobre todo cuando se emplea precozmente junto con el resto del tratamiento conservador, antes de que aparezca la insuficiencia renal terminal37.
Tratamiento específico
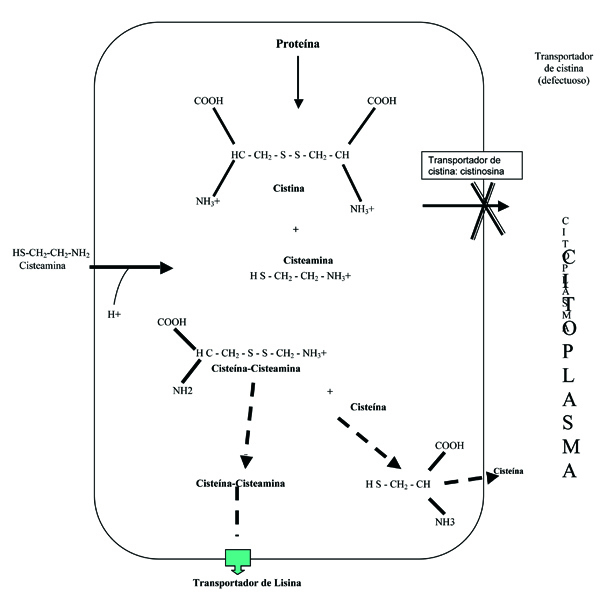
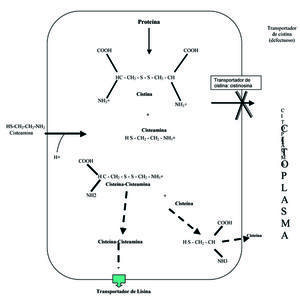
La cisteamina es, actualmente, el fármaco de elección38. El mecanismo de acción comprende la entrada de la cisteamina al interior del lisosoma a través de un transportador específico, reducción de la cistina a cisteína a través de la formación de un compuesto disulfuro mixto de cisteína y cisteamina, que puede salir del lisosoma a través del transportador de lisina (figura 2), y posterior reducción por el glutatión, en el citoplasma39. La instauración precoz del tratamiento con cisteamina retrasa el deterioro del filtrado glomerular40 y permite una mejoría del crecimiento41. Con el uso de la cisteamina, muchos pacientes con cistinosis han llegado a la tercera década de la vida sin necesitar un trasplante renal. Sin embargo, a pesar de la utilización precoz de la cisteamina, la afectación tubular sigue presentándose.
Respecto al efecto extrarrenal de la cisteamina, su utilización en forma de colirio ha demostrado ser efectiva para el tratamiento de los cristales corneales42. Una nueva formulación oftálmica en gel parece que podrá ofrecer una efectividad similar, pero con mayor comodidad de administración43. Asimismo, el tratamiento con cisteamina ha disminuido de manera significativa el hipotiroidismo, lo que sugiere que la cisteamina puede ser útil para evitar las complicaciones tardías postrasplante renal44.
Se recomienda introducir el tratamiento de manera progresiva, empezando con dosis de 10 mg/kg/d, repartido en cuatro dosis al día, y aumentar 10 mg/kg cada 2 semanas hasta llegar a la dosis de 60-90 mg/kg/día (hasta 20 kg de peso), que equivale a 1,3-1,95 mg/m2/día. Las dosis necesarias pueden ser variables; el principal objetivo es la reducción de la cistina intraleucocitaria a concentraciones inferiores a 1 nmol de hemicistina/mg de proteína45. La obtención de la muestra de sangre debe hacerse de 5-6 horas después de la toma. Recientemente, se han descrito efectos similares con la administración de un preparado de cisteamina (cisteamina RP103 microencapsulada de liberación entérica en estudio clínico fase III), administrada cada 12 h46.
Los efectos secundarios más frecuentes son de intolerancia digestiva (náuseas y vómitos)47, por hipersecreción ácida gástrica que puede presentarse hasta en el 14% de los casos, y mal olor del aliento y del sudor. En los niños pequeños incapaces de deglutir las cápsulas, su contenido puede disolverse en zumo de fruta, en leche, o incluso en productos con almidón, como las patatas. El fármaco es mejor tolerado justo después de las comidas o con éstas. En algunos pacientes que toman dosis elevadas de cisteamina se ha observado angioendoteliomatosis cutánea, con alteración de las fibras del colágeno.
Trasplante renal
Sin tratamiento específico, la evolución de la cistinosis es hacia la insuficiencia renal terminal a la edad de 9-10 años, aunque actualmente, gracias al tratamiento con cisteamina, esta complicación se ha desplazado a la segunda-tercera décadas de la vida. El trasplante renal, tratamiento de elección de la insuficiencia renal terminal, ha permitido una mejoría importante de la esperanza de vida en niños con cistinosis. El primer trasplante renal en un paciente con cistinosis se realizó en 196848. No se han objetivado problemas de supervivencia del injerto con trasplantes emparentados (padre o madre) heterocigotos obligados. De hecho, varios estudios indican que la supervivencia del injerto en los pacientes con cistinosis es mejor que en los trasplantados por otras causas de insuficiencia renal49. Uno de los motivos que explicarían estos resultados es la alteración de la respuesta inmune existente en los leucocitos de los pacientes con cistinosis19,20.
En resumen, la cisteamina debe utilizarse lo más precozmente posible y debe considerarse su empleo en todo paciente que haya sido trasplantado, con la esperanza de mejorar su calidad de vida al prevenir las complicaciones extrarrenales de la enfermedad.
Futuras opciones terapéuticas
El trasplante de precursores hematopoyéticos, la terapia de reemplazamiento proteico y la terapia génica constituyen tres vías terapéuticas en fase de investigación. Para la primera de ellas se ha establecido ya la «prueba de concepto», con resultados positivos en el modelo animal Ctns -/-50.
Recomendaciones para el seguimiento
Especialmente durante la fase más florida de tubulopatía, los pacientes deben ser seguidos muy de cerca, inicialmente cada mes, y una vez estabilizado el cuadro clínico, cada 3 meses, para controlar los aspectos metabólicos y hidroelectrolíticos, crecimiento y nutrición, además de las concentraciones de cistina intraleucocitaria y la adaptación de las dosis de cisteamina a esta última y al peso o superficie corporal del paciente. Un estudio oftalmológico que incluya fondo de ojo y lámpara de hendidura debe realizarse al menos una vez al año, incluso en pacientes que ya hayan sido trasplantados. Debe vigilarse la posible aparición de complicaciones extrarrenales, sobre todo a partir de los 10 años.
CONCEPTOS CLAVE
1. La cistinosis es una enfermedad autosómica recesiva secundaria a mutaciones en el gen CTNS que codifica la proteína cistinosina, transportador lisosómico de cistina
2. La alteración del transporte intracelular de cistina conduce a una serie de cambios en el ciclo del glutatión y del metabolismo oxidativo que abocan a un incremento de la apoptosis celular.
3. La forma nefropática infantil se caracteriza clínicamente por una afectación tubular renal proximal precoz, y es la causa genética más frecuente de síndrome de Fanconi. La evolución natural de la enfermedad es a la insuficiencia renal terminal hacia la segunda década de la vida.
4. El trastorno del metabolismo intracelular de la cistina determina el desarrollo de una enfermedad multisistémica con afectación extrarrenal, especialmente ocular, de tiroides, del músculo, del sistema nervioso central, del páncreas, así como afectación grave del crecimiento.
5. La cistinosis constituye uno de los primeros ejemplos de enfermedad de depósito lisosómico con tratamiento específico eficaz, como es la cisteamina, sobre todo si se instaura precozmente.
Figura 2. Mecanismo de acción de la cisteamina en el lisosoma cistinótico
10910_18717_15483_es_tema_10_t1.doc
Tabla 1. Diagnóstico diferencial del síndrome de Fanconi hereditario asociado a diversas anomalías genéticas
10910_18107_15484_es_10910_18717_15484_es_tema_10_f1.doc
Figura 1. Aproximación diagnóstica ante cuadro clínico con sospecha de tubulopatía.
10910_18107_15485_es_10910_18717_15485_es_tema_10_t3.doc
Tabla 3. Tratamiento de la cistinosis
10910_18107_15486_es_10910_18717_15486_es_tema_10_t2.doc
Tabla 2. Complicaciones extrarrenales en la cistinosis: su frecuencia aumenta con el paso de los años, y es menor en los pacientes tratados con cisteamina