Introducción: Se ha descrito una disminución de los niveles de 25 hidroxivitamina D (25[OH]D) en los pacientes con enfermedad renal crónica (ERC). Conocemos que el efecto pleiotrópico de la vitamina D va más allá del metabolismo mineral. Objetivos: Los objetivos del estudio fueron: 1) determinar los niveles de 25(OH) D en pacientes con ERC seguidos en consulta de prediálisis, y 2) analizar características clínicas y bioquímicas de los pacientes con respecto a los niveles de 25(OH)D y los posibles factores predictivos de la deficiencia en 25(OH)D. Pacientes y métodos: Realizamos un estudio observacional en 79 pacientes con ERC. Analizamos datos clínicos y parámetros bioquímicos en cuanto a nutrición, inflamación y metabolismo mineral en relación con los niveles de 25(OH)D. Se consideró deficiencia de 25(OH)D si los niveles eran inferiores a 15 ng/ml. Resultados: Cuarenta y un pacientes (52%) presentaron deficiencia de 25(OH)D. Comparando los datos analizados según los niveles de vitamina 25(OH)D mayores o menores de 15 ng/ml, el grupo de pacientes con deficiencia en 25(OH)D tenían: más edad (70 ± 11,97 frente a 61 ± 14,5; p = 0,005), mayor índice de masa corporal (IMC) (30 ± 4,06 frente a 27,1 ± 5,08; p = 0,017), y mayor proteinuria (1,42 g/24 h [0,53-2,96] frente a 0,51 [0,20-1,48]; p = 0,009). La hormona paratiroidea (PTH) se encontraba más elevada (359 [239-658] frente a 233 [129-323]; p = 0,000), y más pacientes recibieron tratamiento con calcitriol oral (28 [62%] frente a 17 [37,8%]; p = 0,024). El porcentaje de diabéticos fue mayor en este grupo (20 [76,9%] frente a 6 [23%]; p = 0,002). En el análisis multivariante, la presencia de diabetes (OR: 5,713; IC95% [1,43-22,77]; p = 0,014), el aumento de PTH (OR: 13,38; IC95% [2,94-60,89]; p = 0,001), y la proteinuria más elevada (OR: 4,41; IC95% [1,12-17,25]; p = 0,033) fueron factores predictivos independientes de la deficiencia en 25(OH)D. Conclusiones: Los pacientes con ERC tienen alta prevalencia de deficiencia de 25(OH)D. El aumento de PTH, la elevación de la proteinuria, y la presencia de diabetes fueron factores predictivos independientes de la deficiencia en 25(OH)D.
Introduction: Decreased levels of 25 hydroxyvitamin D (25[OH]D) have been reported in patients with chronic kidney disease (CKD). The pleiotropic effects of vitamin D are known to go beyond mineral metabolism. Objetives: The aims of this study were to: 1) Determine the 25(OH)D levels in predialysis outpatients. 2) Find out the clinical and biochemical characteristics of patients with 25(OH)D deficiency, and predictive factors for the deficiency. Patients and methods: An observational study in 79 predialysis outpatients was performed. Clinical and biochemical parameters were analysed in terms of nutrition, inflammation and mineral metabolism in relation to serum levels of 25(OH)D. Levels of 25(OH)D lower than 15ng/ml were considered to be deficient. Results: Serum levels of 25(OH)D were deficient in 41 patients (52%). The comparative study regarding levels of vitamin 25(OH)D showed the group of patients with a deficiency, i.e. those with less than 15ng/ml, were older (70 ± 11.97 vs. 61 ± 14.5; p = 0.005), had a greater body mass index, BMI, (30±4.06 vs. 27.1 ± 5.08; p = 0.003) and increased proteinuria (1.42g/24h (0.53-2.96) vs. 0.51 (0.20-1.48), p = 0.009). This group included a greater number of diabetic patients: 20 (76.9%) vs. 6 (23%), p = 0.002. They had a higher level of parathyroid hormone (PTH): 359 (239-658) vs. 233 (129-323), p = 0.000; and more patients were under treatment with Calcitriol: 28 (62.2%) vs. 17 (37.8%), p = 0.024. In the multivariate analysis, high levels of PTH (OR 13.38; CI 95% [2.94-60.89]; p=0.001), increased proteinuria (OR 4.41; CI 95% [1.12-17.25]; p = 0.033); and being diabetic (OR 5.713; CI 95% [1.43-22.77]; p = 0.014) were independent predictor factors for patients with 25(OH)D deficiency. Conclusions: In our study, we observed a high prevalence of 25(OH)D deficiency among patients with CKD. The increased levels of PTH, the increase of proteinuria and the presence of diabetes were independent predictors for 25(OH)D deficiency.
INTRODUCCIÓN
La piel y determinados alimentos son las fuentes de la vitamina D. La acción de los rayos UV sobre la piel produce provitamina D (colecalciferol D3). En este proceso intervienen factores como la edad y la pigmentación de la piel1. La vitamina D a partir de la dieta depende de la ingestión de productos lácteos, pescado y cereales enriquecidos, produciéndose ergocalciferol D22.
Posteriormente, la vitamina D se transporta en la sangre unida a proteínas y en el hígado se produce la hidroxilación en el carbono 25, con la formación de (25[OH]D) calcidiol. Este último no está regulado hormonalmente; los niveles sólo dependen de la disponibilidad del sustrato, siendo el 25(OH)D(calcidiol), el indicador de la deficiencia de vitamina D.
En un segundo paso, se produce una segunda hidroxilación en el riñón, mediante la enzima 1-alfahidroxilasa, que da lugar a la formación de (1-25[OH]2 D) (calcitriol), la forma activa de la vitamina D3. Tanto el calcidiol como el calcitriol pueden activar los receptores de vitamina D difundidos ampliamente en el organismo, ejerciendo su acción prodiferenciación, antiproliferativa e inmunomoduladora, produciéndose múltiples efectos fisiológicos4. El 80% de la vitamina D se utiliza en estas acciones, aunque la acción más conocida de la vitamina D es la regulación del metabolismo mineral.
El conocimiento de la vitamina D, sustrato 25(OH)D y la forma activa 1-25 (OH)2 D cobra mayor interés debido a sus acciones pleiotrópicas. La implicación de la vitamina D en el estado de salud de la población general es cada vez más conocido5,6.
La deficiencia de 25(OH)D se ha relacionado con la enfermedad cardiovascular, con la diabetes, con la progresión de la enfermedad renal crónica (ERC) y con alteraciones del sistema inmunológico7.
Los pacientes con ERC tienen déficit del sustrato 25(OH) D y de la forma activa 1-25(OH)2D. El déficit del sustrato 25(OH)D en la ERC8-11, como en la población general12, se ha relacionado con la edad, con la pérdida del apetito y con factores que afectan a la síntesis cutánea, como son la baja exposición solar13 y el tipo de pigmentación de la piel14.
El déficit de la forma activa 1-25(OH)2 D se produciría por disminución del sustrato 25(OH)D y por disminución de la actividad de la enzima 1-alfahidroxilasa al disminuir la masa renal15. Actualmente, con el descubrimiento del factor de crecimiento de fibroblasto (FGF)-23, se han abierto otras vías para entender las alteraciones del metabolismo mineral desde estadios iniciales de la ERC. El FGF-23 es un aminoácido-proteína producido en los huesos, que actúa en los riñones produciendo fosfaturia y suprimiendo la expresión de la enzima 1-alfahidroxilasa con la disminución de la producción de 1-25(OH)2D16,17. El FGF-23 aumenta en paralelo a la disminución de la función renal; el incremento del fósforo derivado de la dieta estimularía el FGF-23 y se produciría una disminución de 1-25(OH)2D desde estadios iniciales de la ERC.
Por otra parte, la presencia de actividad de la enzima 1-alfahidroxilasa en otros tejidos nos hace pensar en la conveniencia de mantener los niveles óptimos de 25(OH)D.
Los objetivos del estudio fueron los siguientes:
1. Determinar los niveles de 25(OH)D en pacientes estables con ERC seguidos en la consulta de prediálisis.
2. Comparar datos clínicos y analíticos respecto a nutrición, inflamación y metabolismo mineral con respecto a los niveles de 25(OH)D.
3. Analizar los posibles factores predictivos de la deficiencia en 25(OH)D.
MATERIAL Y MÉTODOS
Población estudiada
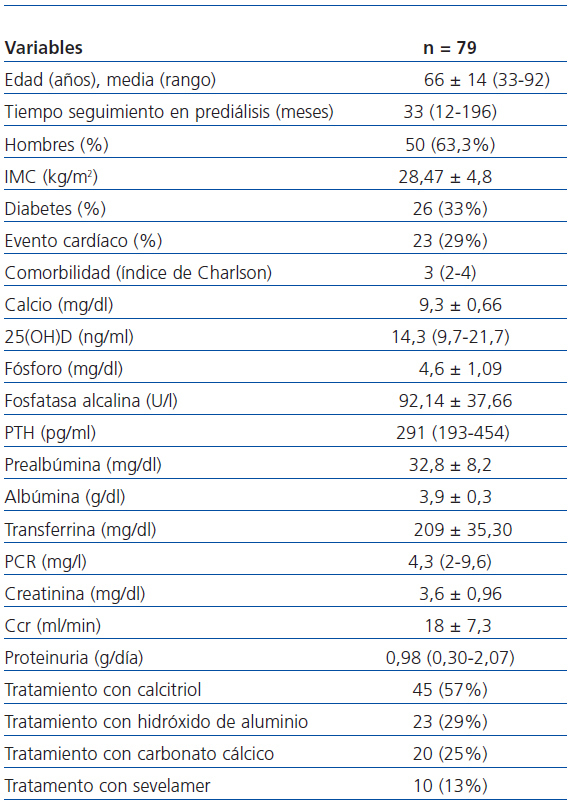
Se realizó un estudio observacional que incluyó a un total de 79 pacientes estables con ERC seguidos en la consulta de prediálisis.
El período de inclusión de los pacientes fue el comprendido entre marzo y septiembre de 2008; se excluyeron aquellos pacientes con un proceso infeccioso o una patología vascular durante dicho período. Entre febrero y marzo de 2008 se realizó la medición de 25(OH)D por su carácter estacional.
El tiempo medio de seguimiento en la consulta de prediálisis fue de 33 meses, con un rango de 12-196 meses. Veintiséis pacientes (33%) eran diabéticos y 76 (97,4%) eran hipertensos. Treinta y dos pacientes (40,5%) habían presentado algún evento cardiovascular y 23 pacientes presentaron sólo eventos cardíacos (29%). Estos últimos fueron: angina (10 pacientes), infarto agudo de miocardio (3 pacientes), episodios de insuficiencia cardíaca (4 pacientes), taquiarritmias (5 pacientes) y pericarditis (un paciente).
Recibieron tratamiento con quelantes del fósforo (hidróxido de aluminio, 23 pacientes [29%], sevelamer, 10 pacientes [13%] y carbonato cálcico, 20[25%]). Recibieron calcitriol oral como única forma de vitamina D 45 pacientes (57%).
Parámetros analizados
Del metabolismo mineral determinamos: niveles de 25(OH)D, el análisis incluía D2 y D3. También analizamos calcio (Ca), fósforo (P), fosfatasa alcalina (FA) y hormona paratiroidea (PTH).
Parámetros de función renal
Se midieron creatinina plasmática (crp), aclaramiento de creatinina (Ccr) y proteinuria de 24 horas.
Parámetros nutricionales
Obtuvimos en todos los pacientes el peso y talla para calcular el índice de masa corporal (IMC), y determinamos los niveles de albúmina, prealbúmina y transferrina (TF).
El estado inflamatorio fue determinado por la proteína C reactiva (PCR) por inmunotubidimetría. Los valores de referencia fueron 0-10 mg/l.
La comorbilidad fue analizada mediante el índice de comorbilidad de Charlson.
El análisis de sangre se obtuvo en todos los pacientes en ayunas, tras la recogida de orina las 24 horas previas. Los datos bioquímicos fueron analizados en el laboratorio central del hospital.
La PTH se midió por quimioluminiscencia y los valores de referencia fueron 16-87 pg/ml.
Los niveles de vitamina 25(OH)D se midieron por radioinmunoanálisis quimioluminiscente (CLIA) (Dia-Sorin LIAISON); su concentración es nanomolar, sólo un 3% se encuentra libre, circula en suero mayoritariamente unida a proteínas de naturaleza lipofílica. Los valores de referencia fueron 8-60 ng/ml. Consideramos deficiencia de 25(OH) D niveles menores de 15 ng/ml; insuficiencia si los niveles estaban comprendidos entre 15 y 30 ng/ml, y valores normales cuando los niveles eran mayores de 30 ng/ml, según las Guías K-DOQI18.
Análisis estadístico
Se determinó la normalidad de las variables mediante el test de Kolmogorov-Smirnov. Las variables que siguieron una distribución normal se expresaron como media ± DE y las variables que siguieron una distribución no normal como mediana y percentiles 25-75. Las variables categóricas se expresaron como número y porcentaje.
La comparación entre variables continuas se realizó mediante el test de la U de Mann-Whitney. Cuando existían más de dos grupos se compararon mediante el test de Kruskal-Wallis. Las variables categóricas se compararon mediante el test de de la chi cuadrado.
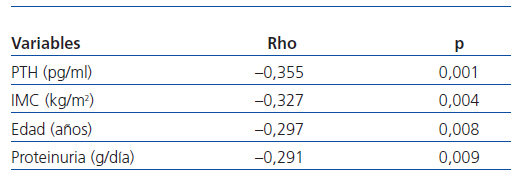
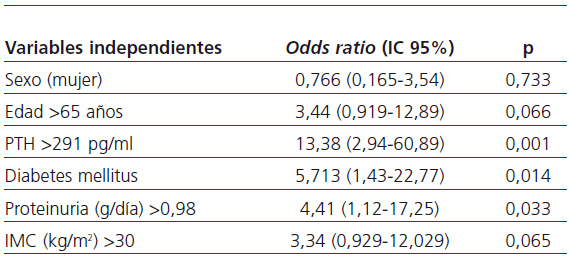
La correlación bivariada de Spearman se utilizó para determinar la asociación de los datos analizados con los niveles de 25(OH)D. Las variables que alcanzaron significación estadística fueron seleccionadas como posibles variables predictivas independientes de la deficiencia de 25(OH)D para el análisis multivariante de regresión lineal logística binaria, siendo la variable dependiente la deficiencia o no de 25(OH)D. Las variables independientes introducidas con los siguientes puntos de corte fueron: la mediana de PTH 291 pg/ml, la mediana de la proteinuria 0,98 g/24 h, la edad mayor de 65 años, el IMC mayor de 30 kg/m2, el sexo femenino y la presencia de diabetes.
Todos los análisis estadísticos se realizaron con el programa estadístico SPSS versión 15 (SPSS). Los valores de p <0,05 se consideraron significativos.
RESULTADOS
Los estadios de la ERC en los 79 pacientes fueron: estadio 3: 6 pacientes (8%), estadio 4: 50 pacientes (63%) y estadio 5: 23 pacientes (29%).
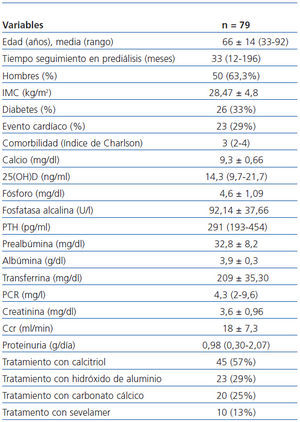
Los datos clínicos y bioquímicos de los 79 pacientes se exponen en la tabla 1.
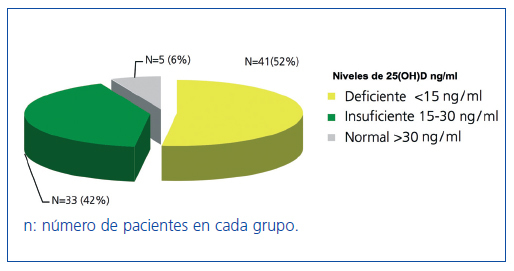
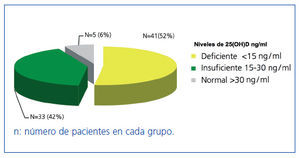
Los niveles de 25(OH)D en los 79 pacientes seguían la siguiente distribución: 41 pacientes (52%) tenían niveles deficientes (menores de 15 ng/ml), 33 (42%), niveles insuficientes (entre 15 y 30 ng/ml), y en sólo 5 pacientes (6%), los niveles fueron normales (mayores de 30 ng/ml) (figura 1).
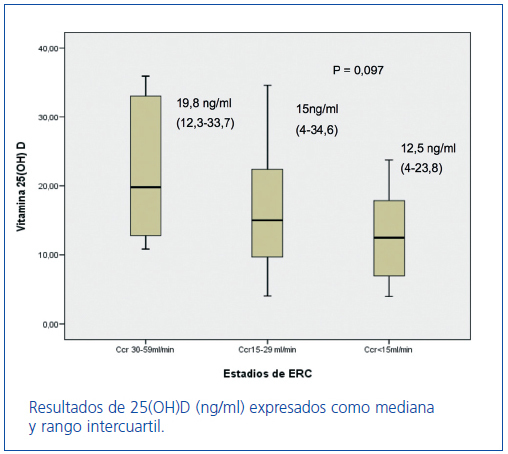
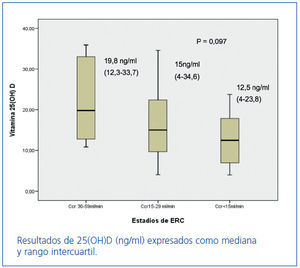
Los niveles de 25(OH)D, en los estadios 3, 4 y 5 de ERC, expresados en mediana y rango intercuartílico, fueron: estadio 3: 19,8 ng/ml (12,3-33,7), estadio 4: 15 ng/ml (4-34,6) y estadio 5: 12,5 ng/ml (4-23,8). Observamos niveles disminuidos en todos los estadios de ERC, con una tendencia a disminuir según avanza el grado de ERC (p = 0,097) (figura 2).
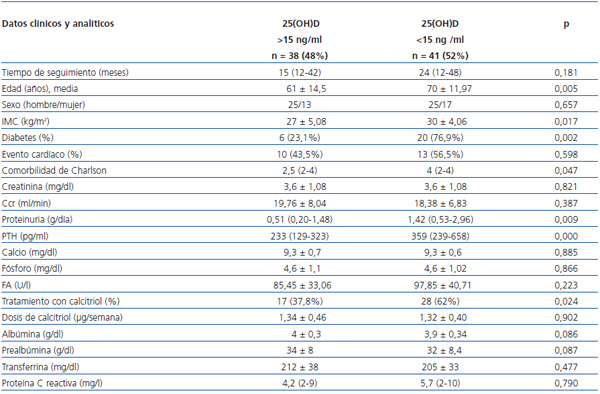
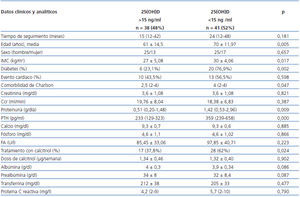
En la tabla 2 comparamos los datos analizados con respecto a los niveles de 25(OH)D con el punto de corte mayor o menor de 15 ng/ml. El grupo de pacientes con deficiencia en 25(OH) D tenían más edad (70 ± 11,97 frente a 61 ± 14,5 años; p = 0,005) y mayor IMC (30 ± 4,06 frente a 27 ± 5,08; p = 0,017). El porcentaje de diabéticos fue mayor 20 (76,9%) frente a 6 (23%) (p = 0,002), sin diferencias en el número de eventos cardíacos 10 (43,5%) frente a 13 (56,5%) (p = 0,598).
No existían diferencias en la función renal, medida por la creatinina plasmática y el aclaramiento de creatinina; la proteinuria fue mayor en este grupo, 1,42 g/24 h (0,53-2,96) frente a 0,51 (0,20-1,48) (p = 0,009).
En cuanto al metabolismo mineral, las cifras de PTH fueron más elevadas, 359 (239-658) frente a 234 (129-323) (p = 0,000), sin diferencias en los niveles de calcio, fósforo y fosfatasa alcalina. Más pacientes recibieron tratamiento con calcitriol, 28 (62,2%) frente a 17 (37,8%) (p = 0,024), sin diferencia en la dosis recibida.
Los parámetros nutricionales, albúmina (3,9 ± 0,34 frente a 4 ± 0,3) (p = 0,086), prealbúmina (32 ± 8,4 frente a 34 ± 8) (p = 0,087) y transferrina (205 ± 33 frente a 212 ± 38) (p = 0,477) no mostraron diferencias con respecto a los niveles de 25(OH)D. El estado inflamatorio medido por la PCR, 4 (2-9) frente a 5,75 (2-10) (p = 0,790), tampoco fue diferente con respecto a los niveles de 25(OH)D.
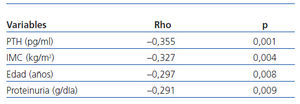
En el análisis univariante (tabla 3), los niveles de 25(OH) D se correlacionaban de forma inversa con la PTH (r = —0,355; p = 0,001), con la edad (r = —0,297; p = 0,008), con el IMC (r = —0,327; p = 0,004) y con la proteinuria (r = —0,291; p = 0,009).
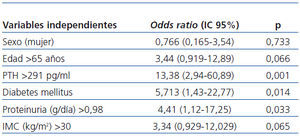
En el análisis multivariante (tabla 4), la presencia de diabetes (OR: 5,713; IC95% [1,43-22,77]; p = 0,014), el aumento de PTH (OR: 13,38; IC95% [2,94-60,89]; p=0,001), y más proteinuria (OR: 4,41; IC95% [1,12-17,25]; p = 0,033) fueron factores predictivos independientes de la deficiencia en 25(OH)D.
DISCUSIÓN
Confirmamos una alta prevalencia de insuficiencia de 25(OH)D en los pacientes con ERC7,10,11; sólo un 6% de los 79 pacientes tenían niveles considerados como normales.
En la ERC existe una asociación del déficit de 25(OH)D con la edad, como ocurre en la población general12; esto se explicaría por un conjunto de factores como son mala alimentación, trastornos gastrointestinales o falta de síntesis en la piel por baja exposición solar1. En los pacientes con ERC, la restricción alimentariía y la pérdida de apetito por la uremia pueden ser factores más determinante del déficit en25(OH)D.
Los niveles de 25(OH)D no podemos considerarlos un marcador de malnutrición global; los parámetros nutricionales analizados no diferían con respecto a los niveles de 25(OH)D.
El IMC fue más elevado en los pacientes con niveles de 25(OH)D disminuidos; la obesidad se ha asociado con disminución de 25(OH)D19, aunque la causa no es bien conocida. La vitamina D es liposoluble y podría ser metabólicamente activa dentro de la grasa almacenada (adipocitos) y, por ello, a mayor IMC los niveles plasmáticos de vitamina 25(OH)D estarían disminuidos; por lo contrario, en un estudio realizado en pacientes obesos y con sobrepeso20, se ha encontrando una relación inversa de los niveles de vitamina D3 con el peso y con el IMC, pero no con la grasa corporal medida por bioempedancia.
El número de paciente diabéticos en el grupo con deficiencia de 25(OH)D fue mayor y la diabetes fue, entre otros, un factor predictivo de la deficiencia en 25(OH)D.
Se han demostrado receptores de vitamina D en las células beta del páncreas endocrino, asociándose el déficit de vitamina D con alteraciones celulares en el páncreas endocrino, que darían lugar a obesidad y resistencia a la insulina, lo cual favorecería el estado diabético21-23.
La proteinuria fue mayor en el grupo de pacientes con deficiencia en 25(OH) D y también fue un factor predictivo del déficit de vitamina D. Sabemos que la vitamina D circula mayoritariamente unida a proteínas; por ello, a mayor proteinuria los niveles de 25(OH)D estarán más disminuidos24.
Se ha documentado una deficiencia de 25(OH) D en otros estados con pérdidas proteicas, como el síndrome nefrótico25 y el tratamiento con diálisis peritoneal26,27.
En los pacientes diabéticos con nefropatía diabética, la proteinuria sería un factor que debe tnerse en cuenta en la deficiencia de 25(OH)D que presentan.
En la última década, la enfermedad cardiovascular se ha asociado con el déficit de 25(OH)D28. El efecto inhibitorio de los receptores de vitamina D sobre la expresión del sistema renina-angiotensina-aldosterona protegería contra la hipertrofia cardíaca, aumentando la contractibilidad del ventrículo izquierdo29,30. En los pacientes estudiados no encontramos diferencias en el número de eventos cardíacos en relación con los niveles de 25(OH)D, probablemente las características del diseño del estudio y el número de pacientes determinen estos resultados.
El déficit de 25(OH)D no pareció influir en el estado inflamatorio de los pacientes medido por la PCR.
En cuanto al metabolismo mineral, las cifras de calcio y fósforo estaban controladas. En el grupo con deficiencia en 25(OH)D, la PTH estaba más elevada y más pacientes habían recibido tratamiento con calcitriol oral. Los niveles aumentados de PTH fueron otro factor independiente predictivo de la deficiencia.
Se ha demostrado que el déficit de 25(OH) D produce, por un lado, alteraciones de la mineralización ósea que son independientes de las cifras de PTH y de la forma activa 1-25(OH)2D31, y, por otro lado, los niveles de 25(OH)D regulan directamente la PTH con independencia de la forma activa 1-25(OH)2D32.
A partir de nuestros resultados llegamos a la conclusión de que existe una alta prevalencia de deficiencia y de insuficiencia de 25(OH)D en pacientes con ERC y que el aumento de PTH y proteinuria y la presencia de diabetes fueron factores predictivos independientes de la deficiencia en 25(OH)D.
El déficit de 25(OH)D debería ser corregido en los diferentes estadios de ERC33,34, con especial atención a los pacientes diabéticos y con más proteinuria. Si el déficit de 25(OH)D se mantiene, estaremos despreciando sus acciones pleiotrópicas y potenciaremos el desarrollo del hiperparatiroidismo secundario.
Son necesarios estudios a largo plazo para evaluar el impacto de mantener los niveles adecuados de 25(OH)D en los distintos estadios de ERC.
Figura 1. Distribución de los pacientes según los niveles de 25(OH)D.
Figura 2. Niveles de 25(OH)D en los estadios 3-4 y 5 de ERC
Tabla 1. Características clínicas y bioquímicas de los pacientes
Tabla 2. Comparacion de datos clínicos y bioquímicos respecto a los niveles de 25(OH)D
Tabla 3. Correlación bivariada (Spearman) entre niveles de 25(OH)D y variables estudiadas
Tabla 4. Análisis multivariante de regresión lineal logística: posibles factores predictivos de la deficiencia en vitamina 25(OH)D