En la práctica clínica habitual la prescripción de análogos de vitamina D (AVD) en la enfermedad renal crónica (ERC) se asocia con frecuencia a un descenso de la función renal estimada cuyo origen no es bien conocido.
ObjetivosAnalizar el efecto de la suspensión de un tratamiento previo con AVD en ERC avanzada, y determinar los factores asociados con los cambios de función renal.
Material y métodosEstudio de cohorte retrospectivo en pacientes adultos incidentes con ERC avanzada. El subgrupo caso estaba siendo tratado con AVD y esta medicación fue suspendida en la primera visita. El subgrupo control no había sido tratado con AVD y fueron elegidos por criterios de coincidencia para datos relevantes relacionados con la progresión de la ERC. La variable de resultado principal fue el cambio de filtrado glomerular, tanto el estimado (FG-MDRD) como el medido (media del aclaramiento de creatinina y urea), con respecto al siguiente control analítico. Parámetros basales relacionados con el metabolismo mineral y la generación de creatinina fueron analizados como determinantes potenciales de los cambios de la función renal.
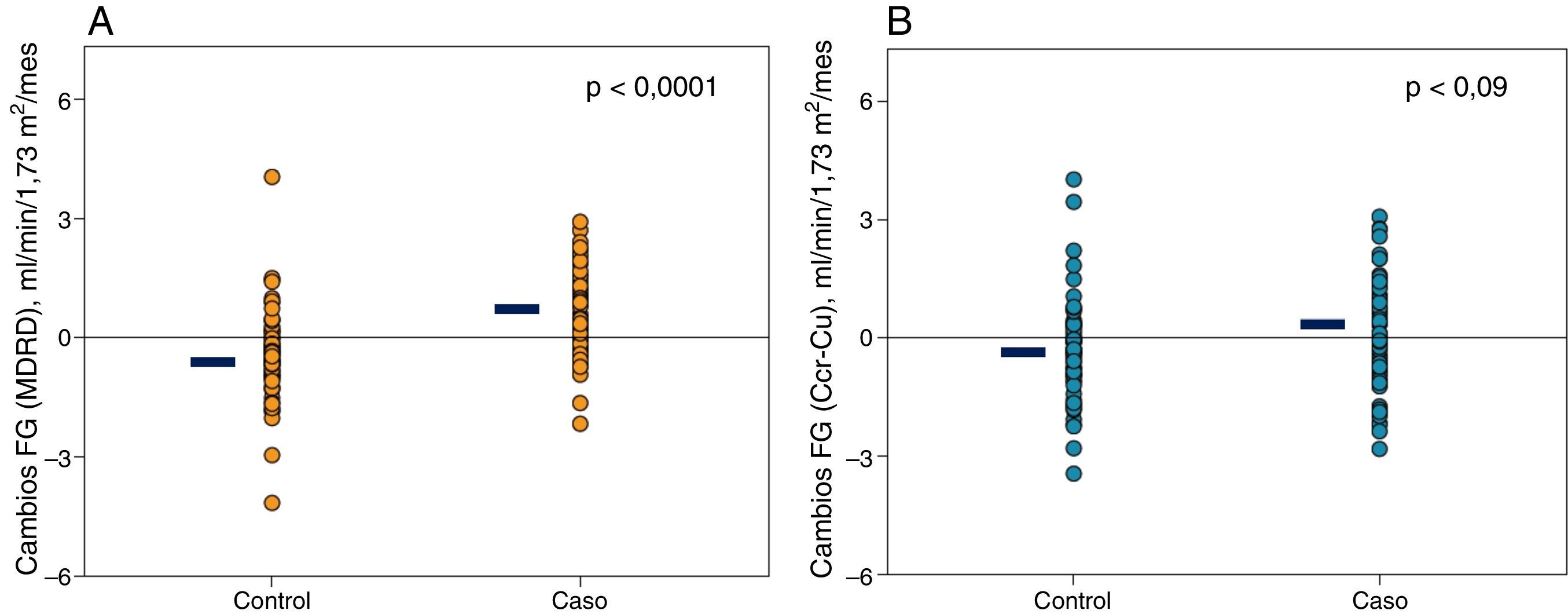
ResultadosSe incluyeron 67 pacientes casos y otros 67 controles. El 67% de los casos mejoró la función renal, mientras que el 72% de los controles empeoró (p<0,0001). El cambio FG-MDRD en casos y controles fue +0,455±0,997 vs. −0,436±1,103ml/min/1,73 m2/mes (p<0,0001), respectivamente. La excreción total de creatinina era ligeramente superior en los casos, pero la diferencia con respecto a los controles no fue significativa.
Por regresión logística y lineal multivariante, el calcio sérico total basal fue uno de los principales determinantes tanto de la recuperación de la función renal (odds ratio=3,49; p=0,001), como de la magnitud de esta recuperación (beta=0,276; p=0,001).
ConclusionesLa suspensión de AVD en pacientes con ERC se asocia con una mejoría significativa de la función renal estimada. La magnitud de estos cambios se relaciona principalmente con la calcemia basal.
In routine clinical practice, the prescription of vitamin D analogues (VDA) in patients with chronic kidney disease (CKD) is often associated with a decline of the estimated renal function. The reason for this is not fully understood.
AimsTo analyse the effects of VDA discontinuation in advanced CKD and to determine the factors associated with changes in renal function.
Material and methodsRetrospective cohort study of adult patients with advanced CKD. The case subgroup was treated with VDA and this medication was discontinued at baseline (the first visit). The control subgroup was not treated with VDA and they were selected according to comparability principles for CKD progression by propensity score matching. The primary outcome measure was a change to both the estimated glomerular filtration rate (MDRD-GFR) and the measured glomerular filtration rate (mGFR by combined creatinine and urea clearances). Baseline parameters related to mineral metabolism and creatinine generation were analysed as potential determinants of renal function changes.
ResultsThe study sample consisted of 67 cases and 67 controls. Renal function improved in 67% of cases and worsened in 72% of controls (p<0.0001). Changes in MDRD-GFR for the case subgroup and the control subgroup were +0.455±0.997 vs. −0.436±1.103ml/min/1.73 m2/month (p<0.0001), respectively. Total creatinine excretion was slightly higher in cases than in controls but the difference was not significant.
According to multivariate logistic and linear regression analyses, baseline total serum calcium was one of the best determinants of both renal function recovery (Odds ratio=3.49; p=0.001), and of the extent of renal function recovery (beta=0.276; p=0.001).
ConclusionsDiscontinuation of VDA treatment in CKD patients is associated with significant recovery of estimated renal function. The extent of these changes is mainly associated with baseline total serum calcium.
Los análogos o formas activas de la vitamina D (AVD) (calcitriol, paricalcitol, 22-oxacalcitriol, etc.) son una parte esencial del tratamiento de la enfermedad óseo-mineral asociada a la enfermedad renal crónica (ERC). Además de sus reconocidos beneficios terapéuticos sobre el hiperparatiroidismo, numerosos estudios experimentales y clínicos han observado que estos fármacos también podrían tener efectos pleiotrópicos consistentes en la inhibición del sistema renina-angiotensina1-4 y la modulación de los mecanismos de inflamación y fibrogénesis5-11, lo que en teoría podría conferirles efectos protectores renales y cardiovasculares.
Un efecto clínicamente demostrable de la prescripción de AVD en pacientes con ERC es la reducción significativa de la proteinuria1-4. Sin embargo, no se ha podido demostrar hasta el momento que estos fármacos mejoren algunos parámetros cardiovasculares de relevancia12,13. Además, el efecto de los AVD sobre la supervivencia en la ERC es controvertido y escasamente estudiado14-18 y, a pesar de la disminución de la proteinuria, es frecuente observar una reducción significativa de la función renal tras su prescripción1,4,12,19-25.
Este efecto adverso, habitualmente reversible tras la suspensión del fármaco, ha sido interpretado por algunos investigadores como una alteración en el metabolismo de la creatinina (aumento de la generación endógena), basados en los resultados de estudios que presentaban irregularidades metodológicas y análisis incompleto de resultados26-28.
Los objetivos del presente estudio fueron analizar los cambios de la función renal tras la suspensión de los AVD en pacientes con ERC avanzada (ERCA), determinar los factores asociados con la mejoría de la función renal (reversibilidad del posible efecto adverso del fármaco), aportar explicaciones alternativas a las ya publicadas sobre el origen de este efecto adverso y proponer algunas medidas prácticas que podrían evitar consecuencias indeseables por el uso de AVD en la ERCA.
Material y métodosEstudio de cohortes con recogida retrospectiva de datos, en pacientes adultos, sin diferencias raciales (todos caucásicos), incidentes en la consulta de ERCA durante el periodo comprendido entre enero de 2013 y diciembre de 2015.
El subgrupo de casos lo formaban pacientes adultos que habían sido remitidos a la consulta ERCA desde otras consultas externas de Nefrología o Medicina Interna por deterioro progresivo de la función renal, hasta alcanzar los estadios 4 o 5 (FG<30ml/min/1,73 m2 en todos los pacientes), y que estaban siendo tratados con AVD (calcitriol o paricalcitol) al menos 3 meses antes de la remisión. A todos estos pacientes se les suspendió el tratamiento con AVD en la primera visita a la consulta ERCA de forma protocolizada. Esta modificación del tratamiento se realiza en nuestra consulta desde hace más de 10 años por razones estrictamente clínicas basadas en la observación repetida de mejoría de la función renal, y así se informa a los pacientes. También se prescribieron captores de fósforo o bicarbonato sódico según requerimientos analíticos. No se incluyó a los pacientes que habían experimentado una reagudización reciente de la ERC.
Además de los datos demográficos y clínicos relevantes, se recogieron los siguientes parámetros bioquímicos en sangre analizados por métodos convencionales de laboratorio clínico (Advia Chemistry, Siemens Healthcare Diagnostics, Nueva York, EE. UU.): calcio total, fósforo, magnesio (colorimetría con azul xilidilo), fosfatasa alcalina, albúmina, PTH (molécula 7-84, inmunoanálisis quimioluminiscente automatizado DiaSorin, Italia), bicarbonato y calcio iónico (ABL800 FLEX, Radiometer Ibérica, España). En orina de 24 h se determinaron los siguientes parámetros: proteinuria (expresada como g/g de creatinina), calcio, fósforo y excreción total de creatinina y urea.
El filtrado glomerular se estimó mediante la fórmula abreviada MDRD-429 y, además, se midió con los aclaramientos de urea y creatinina (mitad de la suma de ambos aclaramientos)30. Todos los análisis se realizaron en un mismo laboratorio (Servicio de Análisis Clínicos del Hospital Infanta Cristina) y las calibraciones y trazabilidad de la creatinina se realizaron conforme a las recomendaciones de estándares internacionales (LWG-NKDEP). La tasa de catabolismo proteico se calculó a través de la excreción urinaria de nitrógeno ureico mediante la fórmula de Maroni et al.31.
Los análisis bioquímicos fueron repetidos en la segunda visita, a los 2-3 meses de la primera.
El subgrupo de controles lo formaban pacientes adultos de la misma cohorte que habían sido remitidos a la consulta ERCA, pero que no estaban siendo tratados con AVD. El procedimiento de selección se basó en criterios de coincidencia para datos basales relevantes relacionados con la progresión de la ERC (ver más adelante en métodos estadísticos). Según estudios previos en nuestra población ERCA, los factores relacionados más significativamente con la velocidad de progresión de la insuficiencia renal son: edad, sexo, índice de masa corporal, presión arterial sistólica, proteinuria y el tratamiento con fármacos con potencial efecto iatrogénico (además de los antiinflamatorios no esteroideos, el alopurinol en determinados pacientes, fibratos, doble bloqueo del sistema renina-angiotensina y difosfonatos).
No se incluyó a ningún paciente (ni en casos ni en controles) que estuviera siendo tratado o al que se le hubiera suspendido en la primera visita alguno de estos fármacos.
A todos los pacientes controles también se les prescribieron captores de fósforo o bicarbonato sódico según requerimientos, y se les realizó el mismo estudio bioquímico que a los casos, con repetición de ellos 2-3 meses después.
Tanto en casos como en controles se estimó de forma basal y en el siguiente control la excreción urinaria teórica total de creatinina según las fórmulas descritas por Ix et al.32 que tienen en cuenta la edad, el sexo y la raza. Para normalizar la excreción real total de creatinina en cada paciente, esta se expresó como porcentaje de la excreción teórica estimada.
Diseño del estudio y análisis estadísticoEste estudio analiza el efecto que sobre la función renal tiene la suspensión de AVD en una cohorte de pacientes expuestos a los mismos factores de riesgo de progresión de la ERC que los controles.
El procedimiento de selección de los controles se realizó mediante emparejamiento por puntuación de propensión, habiéndose excluido previamente a aquellos pacientes en los que se modificaron otros fármacos con influencia potencial sobre el deterioro de la función renal. La puntuación de propensión se obtuvo mediante regresión logística en la que se incluyeron como «covariables» de predicción de la progresión de la insuficiencia renal: la edad, sexo, índice de masa corporal, tensión arterial sistólica y proteinuria. Las diferencias estandarizadas de las medias de estas variables y el cociente de varianzas en las «covariables» continuas se muestran en la tabla 1.
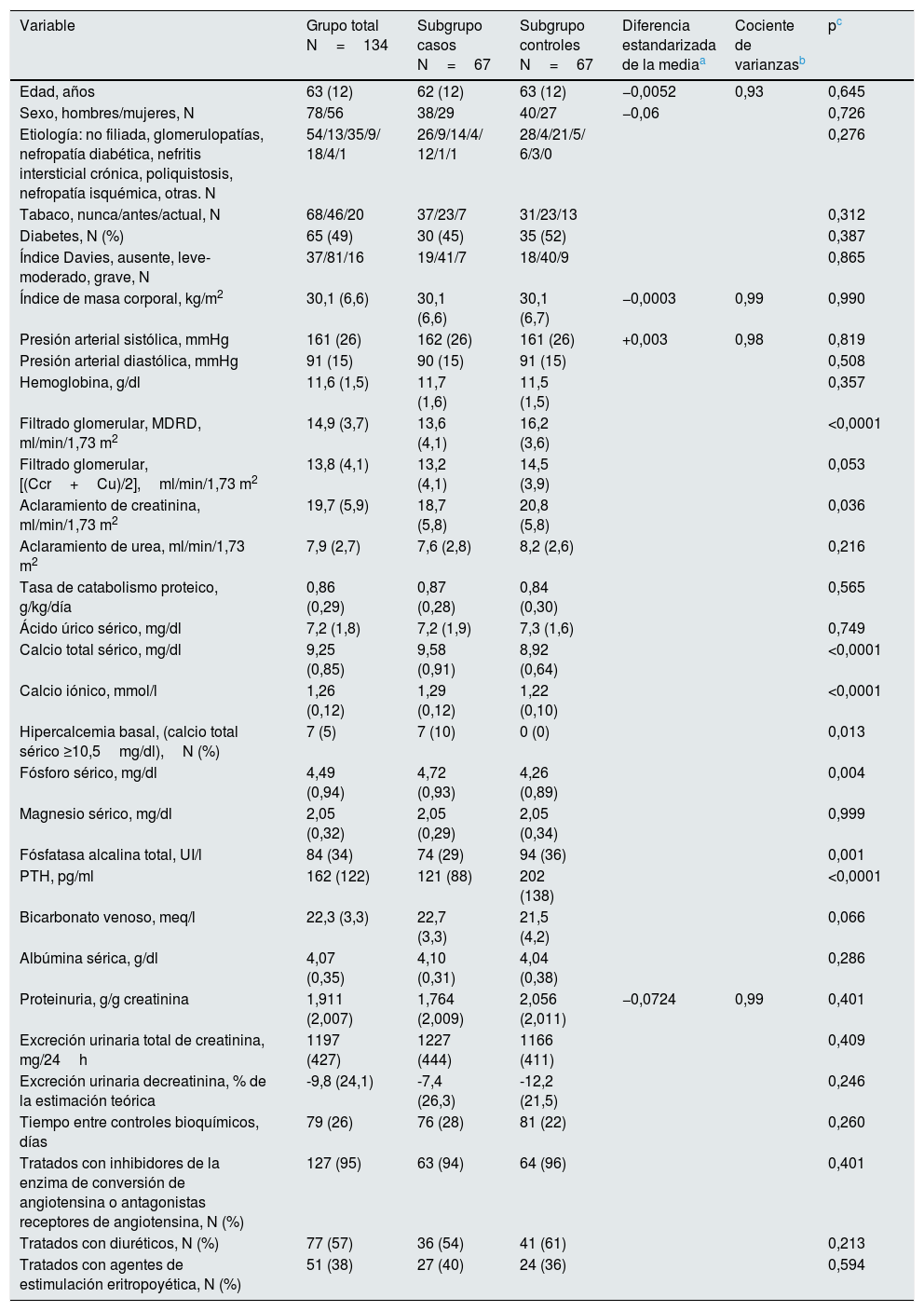
Características de los pacientes según subgrupos. En las variables que fueron elegidas para el proceso de selección de los controles se muestran las diferencias estandarizadas de la media y el cociente de varianzas con respecto a los valores de los casos
| Variable | Grupo total N=134 | Subgrupo casos N=67 | Subgrupo controles N=67 | Diferencia estandarizada de la mediaa | Cociente de varianzasb | pc |
|---|---|---|---|---|---|---|
| Edad, años | 63 (12) | 62 (12) | 63 (12) | −0,0052 | 0,93 | 0,645 |
| Sexo, hombres/mujeres, N | 78/56 | 38/29 | 40/27 | −0,06 | 0,726 | |
| Etiología: no filiada, glomerulopatías, nefropatía diabética, nefritis intersticial crónica, poliquistosis, nefropatía isquémica, otras. N | 54/13/35/9/ 18/4/1 | 26/9/14/4/ 12/1/1 | 28/4/21/5/ 6/3/0 | 0,276 | ||
| Tabaco, nunca/antes/actual, N | 68/46/20 | 37/23/7 | 31/23/13 | 0,312 | ||
| Diabetes, N (%) | 65 (49) | 30 (45) | 35 (52) | 0,387 | ||
| Índice Davies, ausente, leve-moderado, grave, N | 37/81/16 | 19/41/7 | 18/40/9 | 0,865 | ||
| Índice de masa corporal, kg/m2 | 30,1 (6,6) | 30,1 (6,6) | 30,1 (6,7) | −0,0003 | 0,99 | 0,990 |
| Presión arterial sistólica, mmHg | 161 (26) | 162 (26) | 161 (26) | +0,003 | 0,98 | 0,819 |
| Presión arterial diastólica, mmHg | 91 (15) | 90 (15) | 91 (15) | 0,508 | ||
| Hemoglobina, g/dl | 11,6 (1,5) | 11,7 (1,6) | 11,5 (1,5) | 0,357 | ||
| Filtrado glomerular, MDRD, ml/min/1,73 m2 | 14,9 (3,7) | 13,6 (4,1) | 16,2 (3,6) | <0,0001 | ||
| Filtrado glomerular, [(Ccr+Cu)/2],ml/min/1,73 m2 | 13,8 (4,1) | 13,2 (4,1) | 14,5 (3,9) | 0,053 | ||
| Aclaramiento de creatinina, ml/min/1,73 m2 | 19,7 (5,9) | 18,7 (5,8) | 20,8 (5,8) | 0,036 | ||
| Aclaramiento de urea, ml/min/1,73 m2 | 7,9 (2,7) | 7,6 (2,8) | 8,2 (2,6) | 0,216 | ||
| Tasa de catabolismo proteico, g/kg/día | 0,86 (0,29) | 0,87 (0,28) | 0,84 (0,30) | 0,565 | ||
| Ácido úrico sérico, mg/dl | 7,2 (1,8) | 7,2 (1,9) | 7,3 (1,6) | 0,749 | ||
| Calcio total sérico, mg/dl | 9,25 (0,85) | 9,58 (0,91) | 8,92 (0,64) | <0,0001 | ||
| Calcio iónico, mmol/l | 1,26 (0,12) | 1,29 (0,12) | 1,22 (0,10) | <0,0001 | ||
| Hipercalcemia basal, (calcio total sérico ≥10,5mg/dl),N (%) | 7 (5) | 7 (10) | 0 (0) | 0,013 | ||
| Fósforo sérico, mg/dl | 4,49 (0,94) | 4,72 (0,93) | 4,26 (0,89) | 0,004 | ||
| Magnesio sérico, mg/dl | 2,05 (0,32) | 2,05 (0,29) | 2,05 (0,34) | 0,999 | ||
| Fósfatasa alcalina total, UI/l | 84 (34) | 74 (29) | 94 (36) | 0,001 | ||
| PTH, pg/ml | 162 (122) | 121 (88) | 202 (138) | <0,0001 | ||
| Bicarbonato venoso, meq/l | 22,3 (3,3) | 22,7 (3,3) | 21,5 (4,2) | 0,066 | ||
| Albúmina sérica, g/dl | 4,07 (0,35) | 4,10 (0,31) | 4,04 (0,38) | 0,286 | ||
| Proteinuria, g/g creatinina | 1,911 (2,007) | 1,764 (2,009) | 2,056 (2,011) | −0,0724 | 0,99 | 0,401 |
| Excreción urinaria total de creatinina, mg/24h | 1197 (427) | 1227 (444) | 1166 (411) | 0,409 | ||
| Excreción urinaria decreatinina, % de la estimación teórica | -9,8 (24,1) | -7,4 (26,3) | -12,2 (21,5) | 0,246 | ||
| Tiempo entre controles bioquímicos, días | 79 (26) | 76 (28) | 81 (22) | 0,260 | ||
| Tratados con inhibidores de la enzima de conversión de angiotensina o antagonistas receptores de angiotensina, N (%) | 127 (95) | 63 (94) | 64 (96) | 0,401 | ||
| Tratados con diuréticos, N (%) | 77 (57) | 36 (54) | 41 (61) | 0,213 | ||
| Tratados con agentes de estimulación eritropoyética, N (%) | 51 (38) | 27 (40) | 24 (36) | 0,594 |
En las variables continuas (±DE).
Una vez puntuado, la elección de parejas en proporción 1:1 se realizó por elemento afín (nearest neighbor) sin reemplazamiento y ponderación de elección con relación a la distancia (ancho de calibrado menor a 0,2). Tras el emparejamiento, ambos grupos mostraron una distribución de las puntuaciones de propensión muy similar.
Se compararon los siguientes parámetros evolutivos renales entre casos y controles: 1. Cambio de trayectoria evolutiva (empeoramiento o recuperación de la función renal) en el siguiente control analítico. 2. Magnitud de los cambios de función renal (filtrado glomerular estimado y medido, expresados como±ml/min/mes), proteinuria, parámetros metabolismo mineral y excreción urinaria total de creatinina (porcentaje de la estimada teórica) en el siguiente control analítico. 3. Pendiente de la regresión lineal entre filtrado glomerular y tiempo de evolución, hasta el inicio de diálisis o final de seguimiento, expresada en±ml/min/mes. 4. Curvas de supervivencia sin diálisis entre casos y controles.
Para la comparación descriptiva de las variables continuas y dependiendo de sus características se emplearon pruebas paramétricas o no paramétricas, y para las variables categóricas se utilizó la prueba χ2. Para determinar si la distribución de una variable cuantitativa seguía un patrón normal se utilizó la prueba de Kolmogorov-Smirnov.
En la cohorte total de estudio se analizaron los mejores determinantes de un cambio favorable de trayectoria (recuperación de la función renal en el siguiente control analítico) mediante regresión logística multivariante. También se investigaron los mejores determinantes de la magnitud de estos cambios de función renal mediante regresión lineal múltiple.
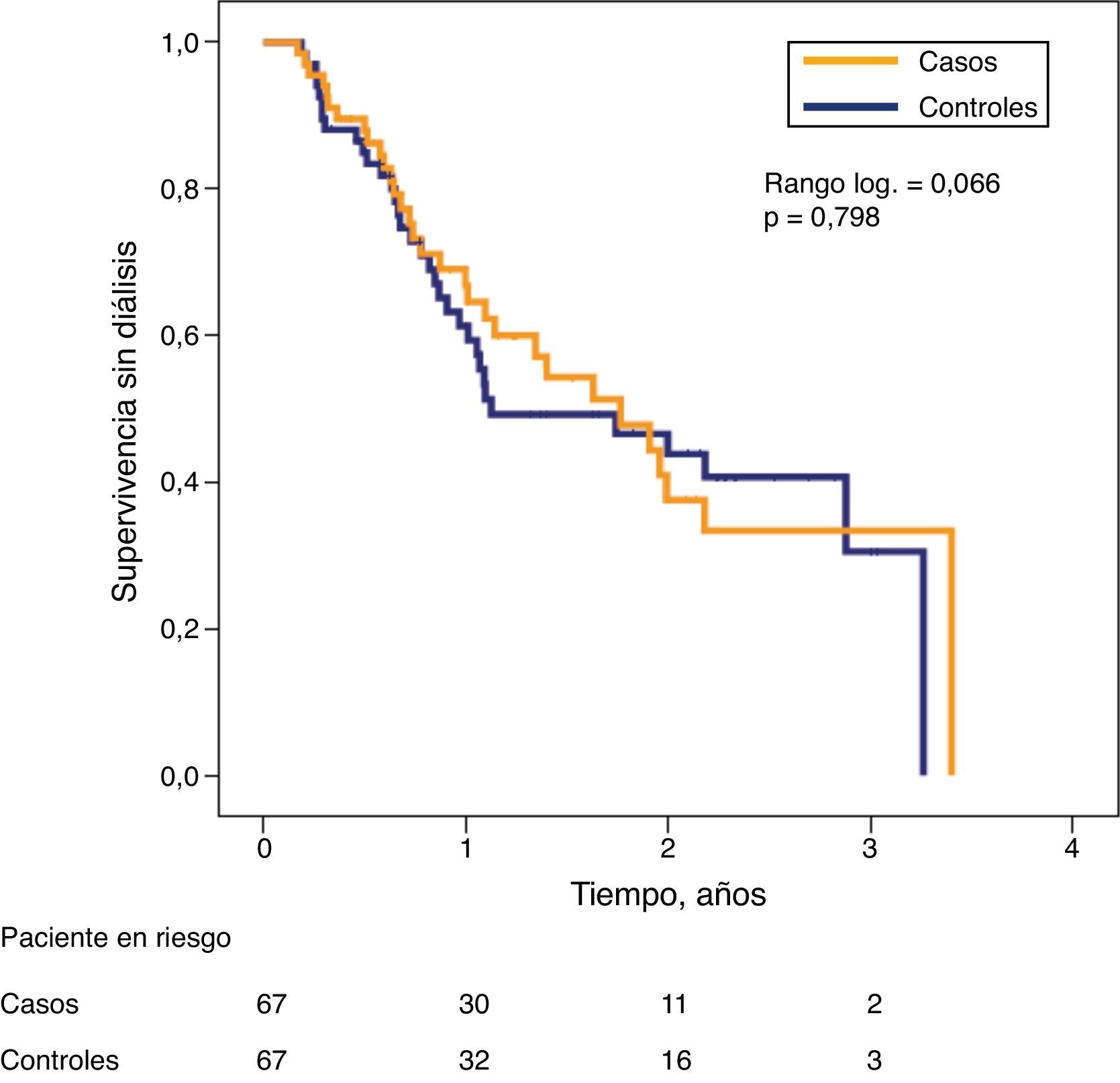
Para analizar las diferencias en la supervivencia sin diálisis entre pacientes casos y controles se emplearon curvas de Kaplan-Meier, y se compararon con la prueba del rango logarítmico de Mantel-Haenszel. Para analizar la influencia de las principales variables de estudio sobre la evolución combinada de inicio de diálisis o mortalidad (supervivencia sin diálisis) se utilizó un modelo multivariante de riesgo proporcional de Cox, que se ajustó mediante el proceso de eliminación progresiva condicional hacia atrás. Los pacientes fueron censurados en el momento del fallecimiento, pérdida del seguimiento, inicio de diálisis o final del seguimiento.
Una p<0,05 fue considerada como estadísticamente significativa, y todos los valores de p que se muestran son bilaterales. Los análisis estadísticos se realizaron con el software IBM SPSS Statistics 21.0 (IBM Corp. Armonk, EE. UU.).
ResultadosCaracterísticas basales de los pacientesDurante el periodo de inclusión fueron remitidos y estudiados por primera vez en la consulta ERCA un total de 266 pacientes. De ellos, 134 pacientes se incluyeron en el estudio, 67 pacientes «caso» y otros 67 pacientes «control» con las características demográficas, clínicas y bioquímicas que se muestran en la tabla 1.
Los pacientes casos estaban siendo tratados con los siguientes AVD: 60 pacientes con paricalcitol (dosis de 1μg diario en 56 pacientes y dosis de 2μg diario en 4 pacientes), y 7 pacientes con calcitriol (4 con dosis de 0,25μg diario y 3 con 0,50μg diario).
Las diferencias más destacables entre estos 2subgrupos fueron: la significativa menor función renal de los casos, posiblemente relacionada con el deterioro acelerado e imprevisto del filtrado glomerular en aquellos que estaban siendo tratados con AVD, y las esperables diferencias bioquímicas relacionadas con el tratamiento previo con AVD caracterizadas por una mayor calcemia y fosforemia, y menores concentraciones de fosfatasa alcalina y PTH en los casos en comparación con los controles.
No hubo otras diferencias significativas en factores y parámetros de importancia predictiva sobre la progresión de la ERC entre ambos subgrupos. Los pacientes caso tenían una proteinuria media ligeramente menor a la de los controles y tanto la excreción urinaria total de creatinina como el porcentaje de excreción sobre el estimado teórico fueron ligeramente superiores en los caso frente a los controles, pero estas diferencias no alcanzaron significación estadística.
El tiempo medio entre los 2controles bioquímicos fue muy similar entre ambos subgrupos, y no se observaron diferencias en el porcentaje de pacientes tratados con otros medicamentos de interés (diuréticos, inhibidores de la enzima de conversión de la angiotensina o antagonistas de la angiotensina y agentes de estimulación eritropoyética).
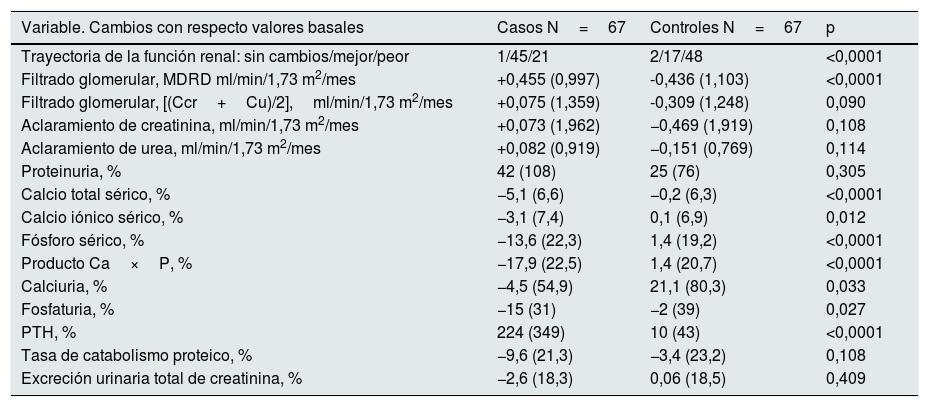
Diferencias en la evolución de la función renal y datos bioquímicos entre subgrupos de estudioEn la tabla 2 se muestran todos los cambios evolutivos que se observaron en los parámetros de estudio entre los 2subgrupos.
Evolución de los parámetros bioquímicos de interés en la siguiente control según grupos
| Variable. Cambios con respecto valores basales | Casos N=67 | Controles N=67 | p |
|---|---|---|---|
| Trayectoria de la función renal: sin cambios/mejor/peor | 1/45/21 | 2/17/48 | <0,0001 |
| Filtrado glomerular, MDRD ml/min/1,73 m2/mes | +0,455 (0,997) | -0,436 (1,103) | <0,0001 |
| Filtrado glomerular, [(Ccr+Cu)/2],ml/min/1,73 m2/mes | +0,075 (1,359) | -0,309 (1,248) | 0,090 |
| Aclaramiento de creatinina, ml/min/1,73 m2/mes | +0,073 (1,962) | −0,469 (1,919) | 0,108 |
| Aclaramiento de urea, ml/min/1,73 m2/mes | +0,082 (0,919) | −0,151 (0,769) | 0,114 |
| Proteinuria, % | 42 (108) | 25 (76) | 0,305 |
| Calcio total sérico, % | −5,1 (6,6) | −0,2 (6,3) | <0,0001 |
| Calcio iónico sérico, % | −3,1 (7,4) | 0,1 (6,9) | 0,012 |
| Fósforo sérico, % | −13,6 (22,3) | 1,4 (19,2) | <0,0001 |
| Producto Ca×P, % | −17,9 (22,5) | 1,4 (20,7) | <0,0001 |
| Calciuria, % | −4,5 (54,9) | 21,1 (80,3) | 0,033 |
| Fosfaturia, % | −15 (31) | −2 (39) | 0,027 |
| PTH, % | 224 (349) | 10 (43) | <0,0001 |
| Tasa de catabolismo proteico, % | −9,6 (21,3) | −3,4 (23,2) | 0,108 |
| Excreción urinaria total de creatinina, % | −2,6 (18,3) | 0,06 (18,5) | 0,409 |
PTH: hormona paratiroidea.
En las variables continuas (± desviación estándar).
Un 67% de los pacientes caso mejoró la función renal en el segundo control con respecto al basal, mientras que en un 72% de los controles empeoró la función renal.
Cuando la magnitud de estos cambios de función renal se estimó mediante la fórmula MDRD, la diferencia fue muy significativa (tabla 2 y fig. 1A), mientras que cuando el filtrado glomerular se midió por aclaramientos, las diferencias también fueron apreciables, aunque no alcanzaron significación estadística (tabla 2 y fig. 1B).
Representación gráfica de los cambios individuales de función renal. A) Filtrado glomerular MDRD en los pacientes casos y controles. B) Aproximación del filtrado glomerular (mitad de la suma de aclaramientos de creatinina y urea) en los pacientes casos y controles. Las líneas negras horizontales representan la media de los valores respectivos.
Otros cambios de interés fueron: el aumento de la proteinuria en ambos subgrupos, más en los casos, pero sin diferencias significativas con respecto a los controles; y las reducciones significativas de calcemia total e iónica, fosfatemia, producto calcio-fósforo, calciuria y fosfaturia en el subgrupo caso.
No se observaron diferencias significativas en los cambios de la tasa de catabolismo proteico, ni en la excreción urinaria de creatinina entre ambos subgrupos.
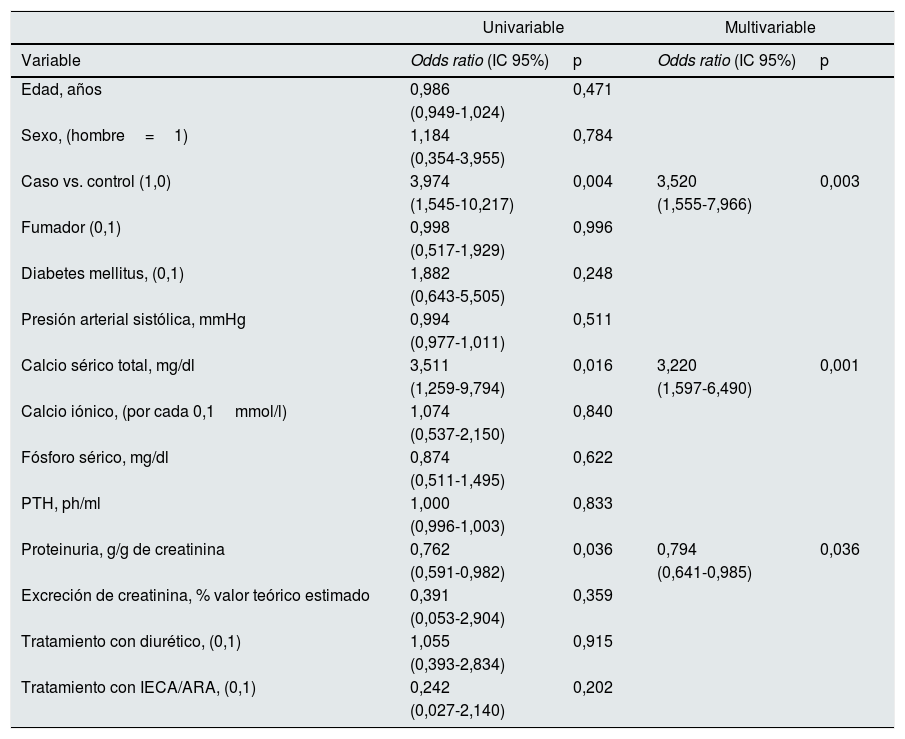
Determinantes de la trayectoria evolutiva y de la magnitud de los cambios de función renal en la cohorte total de estudioEn la tabla 3 se muestran los mejores determinantes de un cambio de trayectoria favorable de la función renal según una regresión logística uni- y multivariante en la cohorte total de estudio.
Regresión logística uni- y multivariante. Determinantes de la mejoría de función renal en el segundo control evolutivo (valor categórico=1) frente al empeoramiento de la función renal (valor categórico=0)
| Univariable | Multivariable | |||
|---|---|---|---|---|
| Variable | Odds ratio (IC 95%) | p | Odds ratio (IC 95%) | p |
| Edad, años | 0,986 | 0,471 | ||
| (0,949-1,024) | ||||
| Sexo, (hombre=1) | 1,184 | 0,784 | ||
| (0,354-3,955) | ||||
| Caso vs. control (1,0) | 3,974 | 0,004 | 3,520 | 0,003 |
| (1,545-10,217) | (1,555-7,966) | |||
| Fumador (0,1) | 0,998 | 0,996 | ||
| (0,517-1,929) | ||||
| Diabetes mellitus, (0,1) | 1,882 | 0,248 | ||
| (0,643-5,505) | ||||
| Presión arterial sistólica, mmHg | 0,994 | 0,511 | ||
| (0,977-1,011) | ||||
| Calcio sérico total, mg/dl | 3,511 | 0,016 | 3,220 | 0,001 |
| (1,259-9,794) | (1,597-6,490) | |||
| Calcio iónico, (por cada 0,1mmol/l) | 1,074 | 0,840 | ||
| (0,537-2,150) | ||||
| Fósforo sérico, mg/dl | 0,874 | 0,622 | ||
| (0,511-1,495) | ||||
| PTH, ph/ml | 1,000 | 0,833 | ||
| (0,996-1,003) | ||||
| Proteinuria, g/g de creatinina | 0,762 | 0,036 | 0,794 | 0,036 |
| (0,591-0,982) | (0,641-0,985) | |||
| Excreción de creatinina, % valor teórico estimado | 0,391 | 0,359 | ||
| (0,053-2,904) | ||||
| Tratamiento con diurético, (0,1) | 1,055 | 0,915 | ||
| (0,393-2,834) | ||||
| Tratamiento con IECA/ARA, (0,1) | 0,242 | 0,202 | ||
| (0,027-2,140) | ||||
ARA: antagonistas de los receptores de la angiotensina; IC: 95%: intervalo de confianza al 95%; IECA: inhibidores de la enzima de conversión de la angiotensina.
Los pacientes caso tenían 3veces y media más probabilidades que los controles de mejorar de forma inmediata la función renal. Además de la proteinuria, la concentración de calcio sérico total determinaba la probabilidad de mejoría inmediata de la función renal.
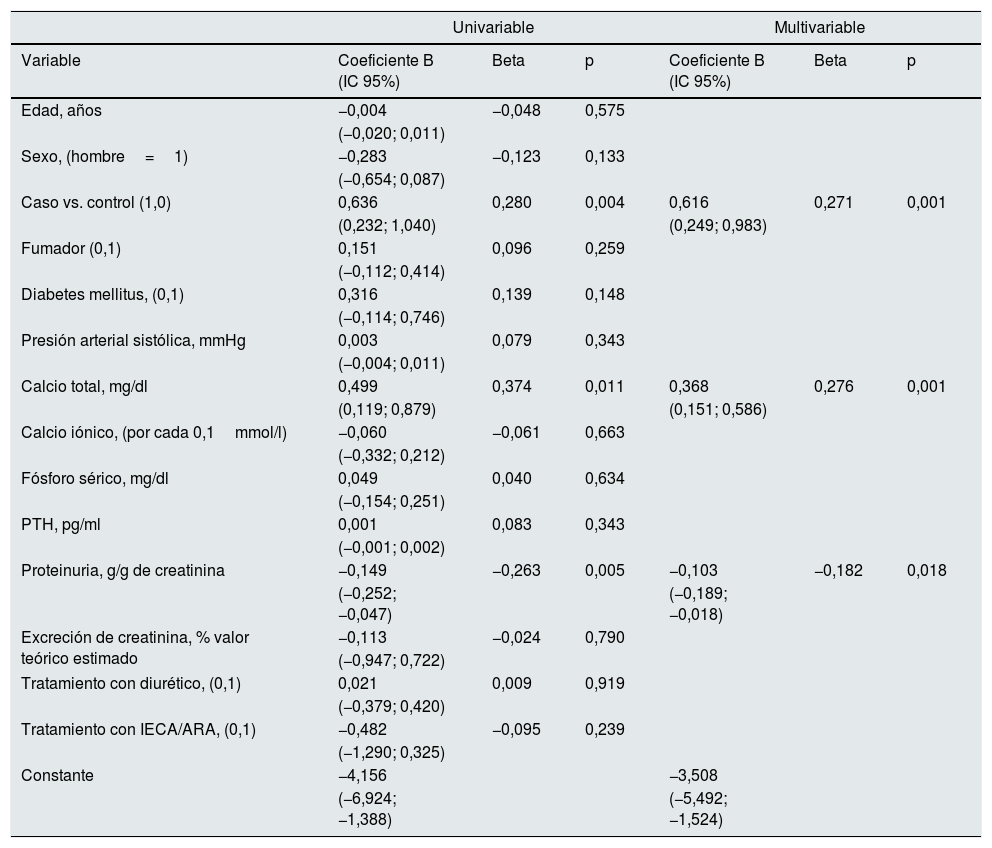
En la tabla 4 se muestran los principales determinantes de la magnitud de los cambios de filtrado glomerular (MDRD). Además de la suspensión de los AVD y la proteinuria, la calcemia total basal también fue determinante significativo de estos cambios. Esto es, cuanto más elevada era la calcemia total basal, mayor fue la recuperación de la función renal tras la suspensión de AVD.
Regresión lineal multivariante. Determinantes de la magnitud de los cambios de función renal (filtrado glomerular MDRD en ml/min/1,73 m2/mes) en el segundo control evolutivo
| Univariable | Multivariable | |||||
|---|---|---|---|---|---|---|
| Variable | Coeficiente B (IC 95%) | Beta | p | Coeficiente B (IC 95%) | Beta | p |
| Edad, años | −0,004 | −0,048 | 0,575 | |||
| (−0,020; 0,011) | ||||||
| Sexo, (hombre=1) | −0,283 | −0,123 | 0,133 | |||
| (−0,654; 0,087) | ||||||
| Caso vs. control (1,0) | 0,636 | 0,280 | 0,004 | 0,616 | 0,271 | 0,001 |
| (0,232; 1,040) | (0,249; 0,983) | |||||
| Fumador (0,1) | 0,151 | 0,096 | 0,259 | |||
| (−0,112; 0,414) | ||||||
| Diabetes mellitus, (0,1) | 0,316 | 0,139 | 0,148 | |||
| (−0,114; 0,746) | ||||||
| Presión arterial sistólica, mmHg | 0,003 | 0,079 | 0,343 | |||
| (−0,004; 0,011) | ||||||
| Calcio total, mg/dl | 0,499 | 0,374 | 0,011 | 0,368 | 0,276 | 0,001 |
| (0,119; 0,879) | (0,151; 0,586) | |||||
| Calcio iónico, (por cada 0,1mmol/l) | −0,060 | −0,061 | 0,663 | |||
| (−0,332; 0,212) | ||||||
| Fósforo sérico, mg/dl | 0,049 | 0,040 | 0,634 | |||
| (−0,154; 0,251) | ||||||
| PTH, pg/ml | 0,001 | 0,083 | 0,343 | |||
| (−0,001; 0,002) | ||||||
| Proteinuria, g/g de creatinina | −0,149 | −0,263 | 0,005 | −0,103 | −0,182 | 0,018 |
| (−0,252; −0,047) | (−0,189; −0,018) | |||||
| Excreción de creatinina, % valor teórico estimado | −0,113 | −0,024 | 0,790 | |||
| (−0,947; 0,722) | ||||||
| Tratamiento con diurético, (0,1) | 0,021 | 0,009 | 0,919 | |||
| (−0,379; 0,420) | ||||||
| Tratamiento con IECA/ARA, (0,1) | −0,482 | −0,095 | 0,239 | |||
| (−1,290; 0,325) | ||||||
| Constante | −4,156 | −3,508 | ||||
| (−6,924; −1,388) | (−5,492; −1,524) | |||||
ARA: antagonistas receptores de la angiotensina; IECA: inhibidores de la enzima de conversión de la angiotensina.
Valor negativo o positivo significa deterioro o mejoría de la función renal, respectivamente.
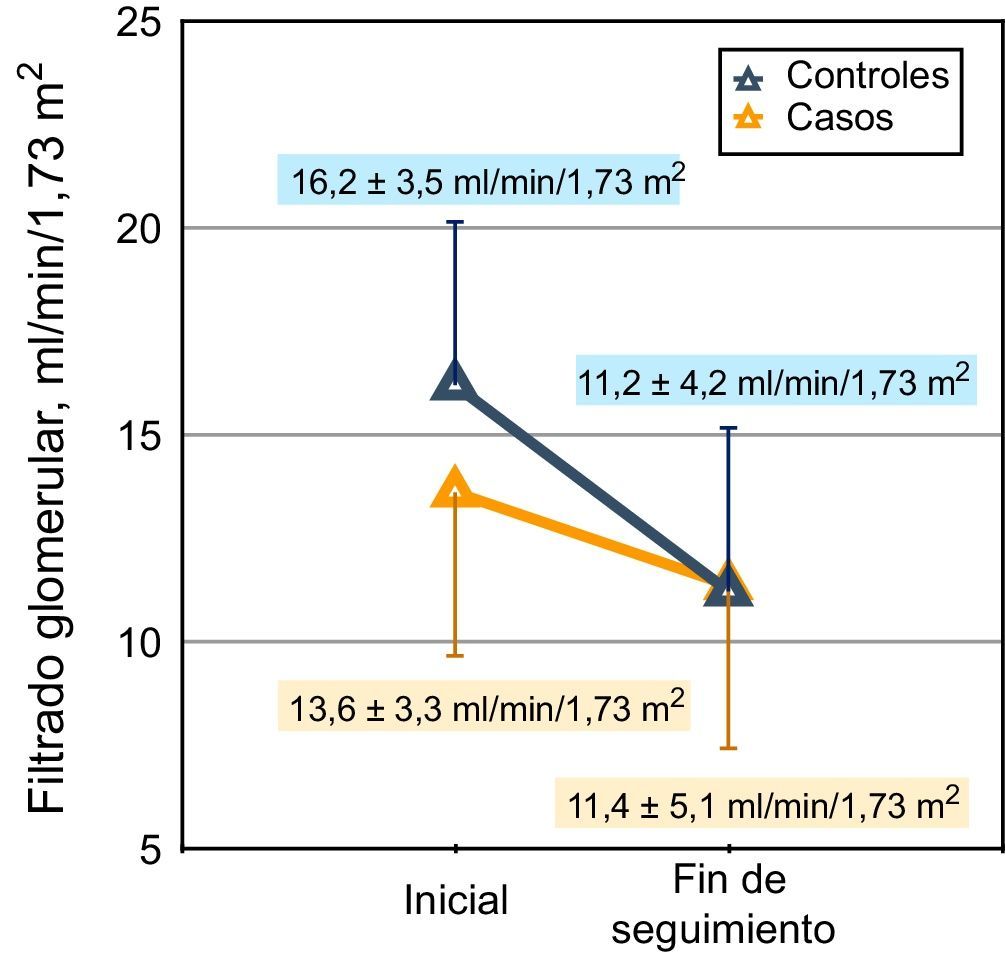
Cuando los cambios de función renal se midieron mediante aclaramientos, la calcemia total basal fue de nuevo un determinante, incluso más significativo, de esta recuperación (beta=0,466; p<0,0001) (fig. 2).
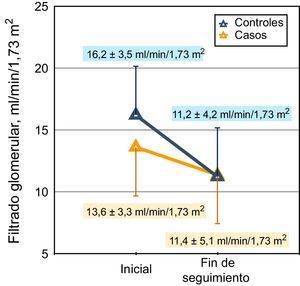
Representación gráfica de la pendiente de descenso del filtrado glomerular (MDRD) en casos y controles. Los valores del filtrado glomerular de inicio y final de seguimiento se muestran en el gráfico. La mediana de seguimiento en el grupo caso fue de 318 días y en el grupo control, de 331 días.
Los pacientes de ambos subgrupos fueron seguidos en su evolución (fallecimiento, inicio de la diálisis, pérdida de seguimiento o fin del estudio) durante una mediana de 325 días (rangos intercuartílicos 210-639 días). No hubo diferencias significativas en el tiempo de seguimiento entre casos (mediana 318 días) y controles (mediana 331 días).
La tasa de descenso del filtrado glomerular (pendiente de la regresión lineal entre filtrado glomerular por MDRD y tiempo) en los subgrupos caso y control fue (mediana y rangos intercuartílicos): −0,19 (−0,47; −0,006) y −0,39 (−0,76; −0,21) ml/min/mes, respectivamente (p=0,001; prueba de Mann-Whitney) (fig. 3).
Cuando la tasa de filtrado glomerular se midió por aclaramientos combinados, las diferencias no alcanzaron significación estadística (mediana y rangos intercuartílicos): −0,17 (−0,37; −0,01) y −0,30 (−0,56; −0,07) ml/min/mes, respectivamente (p=0,059; prueba de Mann-Whitney).
Durante este periodo de seguimiento, en el subgrupo caso: 31 pacientes necesitaron iniciar diálisis, un paciente falleció y no hubo pérdidas de seguimiento. En el subgrupo control, 29 necesitaron iniciar diálisis, 4 fallecieron y en 2 se perdió el seguimiento.
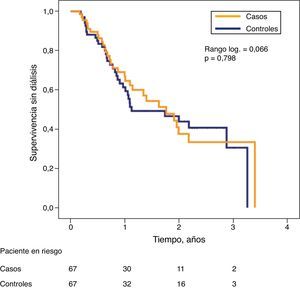
A pesar de las diferencias significativas del filtrado glomerular entre ambos subgrupos en la fase inicial del estudio, la probabilidad de supervivencia sin diálisis fue muy similar.
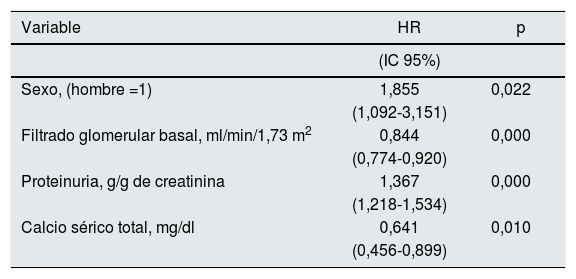
Mediante un modelo de regresión de riesgo proporcional de Cox se determinaron las covariables asociadas con una peor evolución combinada (muerte o inicio de diálisis), que se muestran en la tabla 5. Además de los variables más esperables (sexo, función renal basal, proteinuria), el calcio sérico total, de nuevo, mostró una asociación positiva con la supervivencia sin diálisis.
Regresión de riesgo proporcional de Cox de asociación con fallecimiento o inicio de diálisis (supervivencia sin diálisis)
| Variable | HR | p |
|---|---|---|
| (IC 95%) | ||
| Sexo, (hombre =1) | 1,855 | 0,022 |
| (1,092-3,151) | ||
| Filtrado glomerular basal, ml/min/1,73 m2 | 0,844 | 0,000 |
| (0,774-0,920) | ||
| Proteinuria, g/g de creatinina | 1,367 | 0,000 |
| (1,218-1,534) | ||
| Calcio sérico total, mg/dl | 0,641 | 0,010 |
| (0,456-0,899) |
HR: hazard ratio o cociente de riesgos instantáneos; IC 95%: intervalos de confianza del 95%.
Variables incluidas en el análisis conjunto pero no seleccionadas para la mejor ecuación predictiva: edad, grupo caso o control, fumador, diabetes mellitus, presión arterial sistólica, fósforo sérico, calcio iónico, PTH, excreción urinaria total de creatinina, tratamiento con diurético, tratamiento con IECA/ARA.
Los resultados de este estudio muestran que la suspensión de un tratamiento con AVD en la ERCA mejora de forma inmediata la función renal estimada y lentifica su progresión. Este cambio de trayectoria evolutiva de la ERC se puede predecir por la calcemia basal: cuanto más elevado sea el calcio sérico basal más probabilidades de recuperación de la función renal hay.
Tras la suspensión de AVD, no se observaron cambios significativos en la excreción urinaria total de creatinina y no hubo diferencia en la comparación de este parámetro entre casos y controles.
Desde los primeros ensayos clínicos con AVD en pacientes con ERC se observó que este tratamiento se asociaba a un descenso significativo de la función renal cuyo origen no estaba claro20,21, e incluso esta observación también podía ser demostrada en animales de experimentación de forma dosis-dependiente22. No obstante, en algunos otros estudios no se observaba esta caída del filtrado glomerular y sus mismos autores atribuían esta excepción a la moderación de las dosis prescritas de AVD y al seguimiento meticuloso de sus pacientes33,34.
En un intento más reciente por aclarar este preocupante problema, Agarwall et al.28 realizaron un estudio en tan solo 16 pacientes con ERC, la mayoría en estadio 3, que consistía en administrar 2μg de paricalcitol diarios durante 7 días. Sin embargo, las irregularidades metodológicas de este estudio (número de pacientes, tiempo de estudio y seguimiento), el análisis incompleto de los resultados (¿por qué en unos pacientes sí descendía de manera importante el filtrado glomerular medido por yodotalamato y en otros no?) y una interpretación poco fundamentada (aumento de la producción de creatinina por aumento de la masa muscular) no permiten aclarar suficientemente el tema, aunque este estudio es referencia principal en la literatura.
En los últimos años hemos observado un incremento en la frecuencia de prescripción precoz (ERC estadio 3-4) de AVD entre nuestros pacientes, en muchos casos persiguiendo teóricos beneficios pleiotrópicos. La observación de deterioros inesperados de la función renal en relación temporal con esta prescripción y la consecuente remisión de estos pacientes a la consulta ERCA propició que de forma protocolizada se suspendieran todos los AVD a los incidentes en esta consulta, y se analizara la repercusión sobre la función renal de esta intervención.
En este estudio la mejoría inmediata de la función renal y la progresión más lenta tras la suspensión de AVD comparada con los controles no se pudo explicar por los cambios en la excreción de creatinina. Esta hipótesis es la que proponen algunos autores para atribuir el aumento de la creatinina sérica a un incremento en la generación muscular de creatinina26-28. El origen de este aumento de la creatinina tampoco está muy claro y se debería tener en cuenta para su correcta interpretación que la excreción urinaria de creatinina como indicador de la masa magra no es fiable en situaciones en las que el filtrado glomerular oscila (descenso y recuperación) significativamente en poco tiempo, y la excreción de solutos no se encuentra en un estado de equilibrio (steady state), como podría haber ocurrido en el experimento de Agarwall et al.28. Tampoco es muy creíble que los AVD puedan tener un efecto anabólico muscular tan rápido y efectivo como para aumentar significativamente la masa muscular y generación de creatinina en una sola semana.
Otra explicación posible podría estar relacionada con un efecto inhibitorio de los AVD sobre la secreción tubular de creatinina27, semejante al que causan otros fármacos, como la cimetidina o trimetoprima, y que elevan los niveles de creatinina sérica, provocando de esta forma infraestimación del filtrado glomerular por ecuaciones. Este mecanismo podría ayudar a explicar las diferencias que fueron observadas en nuestro estudio entre el filtrado glomerular estimado y el medido por aclaramientos combinados de creatinina y urea, que estrecharon la significación de los cambios de la función renal entre casos y controles.
¿Qué otras hipótesis podrían explicar los cambios de función renal asociados a los AVD en la ERCA? Según los resultados de nuestro estudio, el nivel sérico de calcio total se relacionó muy significativamente con la recuperación de la función renal.
Un aumento de la calcemia y la calciuria pueden estimular el receptor sensible al calcio, situado a nivel tubular renal en la rama ascendente del asa de Henle, y este estímulo provoca un efecto semejante al de un diurético de asa (aumento de la excreción urinaria de sodio, cloro, calcio y magnesio)35. Así, un efecto de depleción de volumen (diurético) vinculado a un aumento de la calcemia podría ayudar a explicar el descenso reversible del filtrado glomerular asociado a AVD.
Otra hipótesis estaría en relación con el efecto de los AVD sobre la inhibición del sistema renina-angiotensina-aldosterona (SRAA)36. Mientras que esta inhibición podría ser útil para reducir la proteinuria1-4, al mismo tiempo también podría ser causante de una disminución del filtrado glomerular por bajada de la presión tanto en el capilar glomerular como en la circulación posglomerular, que puede ser más intensa aún si el paciente estuviera siendo tratado con otros fármacos anti-SRAA o diuréticos, como ocurre en la mayoría de estos pacientes. El efecto negativo del doble bloqueo farmacológico del SRAA sobre el deterioro y la progresión de la ERC ya ha sido descrito en otros estudios37,38.
La administración farmacológica de AVD puede provocar incrementos significativos de FGF2339. Se ha observado una asociación entre niveles elevados de FGF23 y una progresión más rápida de la ERC39. Aunque en el presente estudio no se midieron las concentraciones de FGF23, sería interesante descartar su mediación en futuros estudios sobre los efectos de los AVD sobre la función renal.
Por último, la hipótesis de una relación entre el control del hiperparatiroidismo por sí mismo y el descenso de la función renal en aquellos tratados con AVD también debe ser considerada. Esta relación clínica es bien conocida en los trasplantados renales que presentan deterioros muy significativos del filtrado glomerular cuando se revierte un hiperparatiroidismo terciario mediante paratiroidectomía40-43. Parte de este deterioro se ha atribuido a la prescripción de AVD en el postoperatorio41, aunque el origen de este fenómeno es hasta el momento desconocido y se especula con el efecto de la PTH sobre la regulación de la perfusión renal y del filtrado glomerular41,42.
Una consecuencia práctica derivada de los resultados del presente estudio es la posibilidad de modificar o influir en la velocidad de progresión en los estadios avanzados de la ERC sopesando los riesgos-beneficios de la prescripción de un tratamiento con AVD. La suspensión de esta medicación podría lentificar la progresión de la insuficiencia renal avanzada y permitir periodos más prolongados de supervivencia sin diálisis.
Sin embargo, este estudio tampoco debe interpretarse como un alegato contra el uso de los AVD en la ERCA. Estos fármacos son la base terapéutica fundamental para el control del hiperparatiroidismo secundario, aunque su indicación basada en sus efectos pleiotrópicos debería fundamentarse con evidencias clínicas más sólidas.
Las recomendaciones que nos permitimos proponer para evitar que un tratamiento con AVD provoque efectos indeseables en el curso clínico de la ERC en estadios avanzados son: 1. Actualizar y flexibilizar los valores objetivo de PTH en la ERCA que se presentan en las actuales guías clínicas. 2. No iniciar ningún tratamiento con AVD si no existe un control adecuado del fósforo sérico. 3. Las dosis de AVD al inicio del tratamiento deben ser menores que las que se prescriben de forma habitual en pacientes ya en diálisis. 4. Una vez iniciado un tratamiento con AVD, los controles analíticos deben ser frecuentes (2-3 meses), ajustando las dosis según respuesta y efectos secundarios esperables (hipercalcemia, hiperfosforemia, etc.). 5. En caso de caída inesperadamente rápida de la función renal, suspender los AVD y comprobar la recuperación del filtrado glomerular a corto plazo. 6. También podría ser útil incluir marcadores alternativos a la creatinina como estimadores del filtrado glomerular (por ejemplo, cistatina C).
Este estudio tiene limitaciones. Debido a su diseño retrospectivo, no se pueden establecer relaciones causales firmes. Además de las diferencias ya comentadas entre casos y controles, podrían existir otros factores de confusión no tenidos en cuenta en el análisis e interpretación de los resultados.
En el proceso de selección de controles hubo algún problema con la distribución de las etiologías de la ERC. Aunque no existió ninguna diferencia estadísticamente significativa, en los casos hubo un mayor número de poliquistosis renal y en los controles, de diabetes mellitus. Esta disparidad podría estar justificada por la diferente propensión a desarrollar hiperparatiroidismo secundario —menor en pacientes diabéticos44— y, por tanto, con diferente probabilidad de ser tratado precozmente con AVD. No obstante, ambas etiologías de ERC en sus estadios más avanzados tienen un patrón de progresión similar45, por lo que es improbable que este sesgo de selección pudiera influir de forma significativa en la evolución de la función renal.
La medición del filtrado glomerular no se realizó por métodos de máxima fiabilidad (aclaramiento de sustancias exógenas) y, por tanto, los cambios observados podrían no ser reales o estar sujetos a artefacto. No obstante, desde un punto de vista práctico, estos métodos de máxima fiabilidad tampoco se utilizan en la clínica habitual: son la creatinina y las fórmulas de estimación del filtrado glomerular derivadas de su concentración sérica las que se toman como criterio para valorar la progresión de la insuficiencia renal e indicar la necesidad de inicio de diálisis. De este modo, cualquier factor que altere la concentración de creatinina sérica también podría influir en decisiones terapéuticas importantes sobre estos pacientes.
En conclusión, la suspensión de AVD en pacientes con ERCA se asocia con una mejoría significativa e inmediata de la insuficiencia renal estimada y lentifica su progresión. Estos cambios no se relacionan con la excreción urinaria de creatinina y sí con la calcemia basal.
Son necesarios más estudios para establecer los mecanismos por los que los AVD podrían alterar las concentraciones séricas de creatinina o reducir de forma real el filtrado glomerular, cuyas consecuencias en la ERCA pueden ser más graves (inicio prematuro de diálisis).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.