La angiografía coronaria rotacional (ACR) permite reducir la cantidad de contraste administrado y puede prevenir el desarrollo de nefropatía inducida por contraste (NIC) durante los procedimientos coronarios invasivos. El objetivo del estudio es evaluar el impacto de la ACR en la aparición de NIC (aumento de creatinina ≥0,5mg/dL o ≥25%) tras un síndrome coronario agudo.
MétodosDe abril a septiembre de 2016 se seleccionaron prospectivamente pacientes con síndrome coronario agudo remitidos para coronariografía diagnóstica con posibilidad de angioplastia ad hoc, que fueron estudiados con ACR o angiografía coronaria convencional (ACC) según criterio del operador. Se compararon la NIC (variable de valoración primaria), variables analíticas, angiográficas y clínicas.
ResultadosDe 235 pacientes reclutados, 116 pacientes fueron estudiados con ACR y 119 pacientes con ACC. El grupo de ACR presentaba mayor edad (64,0±11,8 vs. 59,7±12,1 años; p=0,006), más mujeres (44,8 vs. 17,6%; p<0,001) y peor filtrado glomerular estimado (76±25 vs. 86±27 mL/min/1,73 m2; p=0,001), con menos angioplastias (p<0,001). Asimismo, el grupo de ACR recibió menos contraste (113±92 vs. 169±103 mL; p<0,001), diferencias que se mantuvieron en los procedimientos diagnósticos (54±24 vs. 85±56 mL; p<0,001) y diagnóstico-terapéuticos (174±64 vs. 205±98 mL; p=0,049). El grupo de ACR presentó menos NIC (4,3 vs. 22,7%; p<0,001): en el análisis de regresión se objetivó que continuaba relacionándose con menor desarrollo de NIC (riesgo relativo ajustado: 0,868; IC 95%: 0,794-0,949; p=0,002). No hubo diferencias en las variables clínicas.
ConclusionesLa ACR se asoció con menor administración de contraste durante procedimientos coronarios invasivos tras un síndrome coronario agudo, lo que resultó en una menor aparición de NIC.
Rotational coronary angiography (RCA) requires less contrast to be administered and can prevent the onset of contrast-induced nephropathy (CIN) during invasive coronary procedures. The aim of the study is to evaluate the impact of RCA on CIN (increase in serum creatinine ≥0.5mg/dl or ≥25%) after an acute coronary syndrome.
MethodsFrom April to September 2016, patients suffering acute coronary syndromes who underwent diagnostic coronary angiography, with the possibility of ad hoc coronary angioplasty, were prospectively enrolled. At the operator's discretion, patients underwent RCA or conventional coronary angiography (CCA). CIN (primary endpoint), as well as analytical, angiographic and clinical endpoints, were compared between groups.
ResultsOf the 235 patients enrolled, 116 patients received RCA and 119 patients received CCA. The RCA group was composed of older patients (64.0±11.8 years vs. 59.7±12.1 years; p=0.006), a higher proportion of women (44.8 vs. 17.6%; p<0.001), patients with a lower estimated glomerular filtration rate (76±25 vs. 86±27ml/min/1.73 m2; p=0.001), and patients who underwent fewer coronary angioplasties (p<0.001) compared with the CCA group. Furthermore, the RCA group, received less contrast (113±92 vs. 169±103ml; p<0.001), including in diagnostic procedures (54±24 vs. 85±56ml; p<0.001) and diagnostic-therapeutic procedures (174±64 vs. 205±98ml; p=0.049) compared with the CCA group. The RCA group presented less CIN (4.3 vs. 22.7%; p<0.001) compared to the CCA group, and this finding was maintained in the regression analysis (Adjusted relative risk: 0.868; 95% CI: 0.794-0.949; p=0.002). There were no differences in clinical endpoints between the groups.
ConclusionsRCA was associated with lower administration of contrast during invasive coronary procedures in acute coronary syndrome patients, resulting in lower incidence of CIN, in comparison with CCA.
La nefropatía inducida por contraste (NIC), que se presenta desde un 1% hasta un 33% de los pacientes derivados para procedimientos angiográficos coronarios invasivos, es una de las causas más comunes de fracaso renal agudo en los pacientes cardiológicos, especialmente en caso de síndrome coronario agudo (SCA)1-4. El desarrollo de NIC tras un procedimiento coronario invasivo se asocia con una hospitalización prolongada, un destacado incremento en la morbimortalidad, así como un aumento en los costos sanitarios2,5.
Los ensayos clínicos publicados hasta la fecha no se han centrado en técnicas específicas de reducción de contraste para la prevención de la aparición de la NIC, sino en estrategias de hidratación o en la administración de fármacos periprocedimiento. Es de resaltar que, aparte de la hidratación, la mayoría de los estudios previos en la prevención de la NIC han tenido efectos neutrales, efectos deletéreos o, como en el caso de la N-acetilcisteína, se han reportado resultados contradictorios6–15.
La angiografía coronaria es la técnica de referencia para la evaluación de las arterias coronarias. La angiografía coronaria convencional (ACC) requiere varias proyecciones angiográficas y obliga, en múltiples casos, a realizar proyecciones adicionales para obtener una adecuada evaluación del árbol coronario16. Debido a que el volumen de contraste yodado utilizado en los procedimientos coronarios invasivos se relaciona estrechamente con la aparición de NIC, surge la angiografía coronaria rotacional (ACR) de doble eje (cráneo-caudal e izquierda-derecha) que debido a su rápido movimiento rotacional en ambos ejes permite realizar un estudio completo con una única inyección de contraste para cada arteria coronaria17–19. Sin embargo, a pesar de sus potenciales beneficios, la ACR no es utilizada rutinariamente en la mayoría de los centros, dada la falta de evidencia de que su realización se asocie con mejoría de las variables de valoración clínica como la NIC. Por este motivo las guías de práctica clínica no hacen mención de esta técnica como terapia de prevención para la NIC20.
Por tanto, el objetivo de nuestro estudio es comparar 2técnicas angiográficas: la ACR y la ACC, con el objetivo de determinar si la reducción en el volumen de contraste yodado al realizar la ACR permite reducir la aparición de la NIC en pacientes con SCA tratados con procedimientos coronarios invasivos.
Material y métodosPoblación y diseño del estudioEste estudio evaluó de forma observacional y prospectiva el desarrollo de NIC en 2 cohortes de pacientes consecutivos con SCA (angina inestable o infarto agudo de miocardio [IAM])4 remitidos para procedimientos coronarios invasivos en 2instituciones: el Hospital Universitario Nuestra Señora de Candelaria (Santa Cruz de Tenerife, España) y el Hospital Universitario de Canarias (San Cristóbal de La Laguna, Tenerife, España). El tipo de angiografía se realizó según el criterio del operador. Se seleccionaron pacientes con SCA consecutivos con indicación de coronariografía invasiva que no estuvieran en terapia de sustitución renal y que no presentasen un IAM con elevación del segmento ST de menos de 12 h de evolución, ya que la realización de una coronariografía emergente no permite un procedimiento reglado en múltipes ocasiones.
El Comité Ético y de Investigación Clínica del Hospital Universitario Nuestra Señora de Candelaria y el del Hospital Universitario de Canarias aprobaron la realización del presente estudio, al cumplir con la normativa ética y legal vigente.
Criterios de inclusión- -
Indicación de coronariografía invasiva por SCA seguida o no de intervención coronaria percutánea.
- -
Consentimiento informado.
- -
Pacientes<18 años.
- -
Pacientes con terapia de sustitución renal previa.
- -
Mujeres con posibilidades de estar embarazadas.
- -
Alergia al contraste yodado conocida previamente, que no pueda recibir premedicación.
- -
Exposición a contraste yodado en los 10 días previos.
- -
Cirugía de revascularización miocárdica previa.
- -
IAM con elevación del segmento ST<12 h de evolución.
- -
Shock cardiogénico.
- -
Incapacidad para comprender la naturaleza del estudio o incapacidad médica o social que pueda interferir con la recolección de los datos o impedir el seguimiento.
- -
Inclusión en otros ensayos clínicos o registros.
- -
NIC: incremento de creatinina ≥0,5mg/dL o ≥25% con respecto al nivel basal evaluado entre las 48 y 72 h tras la realización del procedimiento21.
- -
NIC con criterio de fracaso renal agudo inducido por contraste yodado (FRA-CI): incremento en la creatinina tras el procedimiento, entre las 48 y 72 h, >50% o >0,3mg/dL con respecto a la creatinina basal22.
- -
NIC con criterio de filtrado glomerular estimado (FGe): descenso en el FGe después del procedimiento coronario, entre las 48-72 h, ≥25% con respecto a la FGe basal23.
- -
Variable de valoración clínica combinada que comprendía los siguientes ítems: mortalidad global, nuevo infarto, accidente cerebrovascular y necesidad de diálisis intrahospitalaria y a 30 días. También se valoró cada uno de los ítems previos por separado durante el ingreso y a 30 días. La mortalidad por todas las causas incluía la muerte cardiaca, la muerte vascular y la muerte no cardiovascular24. El nuevo infarto fue definido como la nueva aparición de un infarto de miocardio tras la realización de un procedimiento coronario invasivo según la tercera definición universal de infarto de miocardio (tipo 1)25. El accidente cerebrovascular fue definido como un episodio de disfunción focal de inicio agudo cerebral o monocular persistente en el tiempo o transitorio, causado por una trombosis o embolia arterial. No se requirió la presencia de alteraciones en técnicas de imagen específicas26. La necesidad de diálisis se definió como la necesidad de iniciar terapia de sustitución renal mediante hemodiálisis en caso de empeoramiento severo de la función renal27.
- -
La nueva hospitalización fue definida como la necesidad de nuevo ingreso hospitalario >24 h de duración para el tratamiento o diagnóstico de cualquier condición médica tras la realización del procedimiento coronario invasivo24.
- -
Dermatitis por radiación se definió como cualquiera de las siguientes alteraciones cutáneas: eritema, edema, sangrado, ulceración o necrosis cutánea, en las zonas de incidencia del haz de rayos X acaecida tras la realización de un procedimiento coronario invasivo en ausencia de causa alternativa28.
Los pacientes recibieron tratamiento para el SCA según la práctica clínica estándar. En caso de que presentasen una creatinina basal ≥1,5mg/dL, los pacientes debían recibir hidratación con solución salina normal (cloruro de sodio al 0,9%) a un ritmo de 1ml/kg/h durante las 12 h previas y las 24 posteriores al procedimiento, a no ser que tuvieran alguna contraindicación para ello20.
La ACC se realizó según las siguientes recomendaciones: un mínimo de 6 proyecciones para la coronaria izquierda y un mínimo de 3 proyecciones para la coronaria derecha. No obstante, el número final de proyecciones para una correcta valoración de las arterias coronarias o planificación de la intervención coronaria percutánea se dejó a criterio del operador. El volumen de contraste utilizado fue de 8 a 4mL/s para la coronaria izquierda y de 5 a 3mL/s para la coronaria derecha. La ACR se realizó según la práctica recomendada. Para obtener imágenes de calidad óptima mediante ACR, se decidió que en la coronaria izquierda se realizase un giro de 5,8 s y una inyección de 14 a 2,5mL/s. Para la coronaria derecha se realizó un giro de 4 s con una inyección de 10 a 2mL/s19.
La realización de intervencionismo coronario percutáneo ad hoc se dejó a criterio del equipo médico tratante y se realizó según la práctica clínica habitual. La realización de ventriculografía también quedó a criterio del operador. En caso de considerarlo adecuado, debía realizarse mediante la inyección de 45 a 15mL/s o de 36 a 12mL/s en función del grado de disfunción renal. Se utilizó un contraste de tercera generación: iomeron 350 (Iomeprol; Bracco Corporate, Milán, Italia) y, para uniformizar la administración de contraste, esta se realizó con la inyectora robotizada de contraste ACIST CVi® (ACIST Medical Systems, Eden Prairie, MN, Estados Unidos). Se dejó a discreción del operador la elección de los catéteres coronarios. La adquisión de las imágenes se realizó según la práctica recomendada para la ACR19.
Recolección de datos y seguimientoSe tomaron muestras basales para determinar el nivel basal de creatinina (con el método de Jaffé) y el FGe mediante la fórmula de CK-EPI y a las 48-72 h del procedimiento para evaluar la variación29,30. En caso de los pacientes que fueran dados de alta en menos de 48 h tras el procedimiento, se realizó una visita presencial para la toma de muestras en el periodo de tiempo especificado en el estudio. Asimismo, se recogieron datos relacionados con el procedimiento, variables clínicas, angiográficas (localización y número de vasos coronarios con estenosis >50%), de radiación, analíticas y también la duración de la estancia hospitalaria (días).
Los pacientes fueron visitados a los 30 días para evaluar la aparición de variables clínicas. Todos los datos generados fueron recogidos de forma prospectiva e introducidos en una base de datos computarizada específicamente diseñada.
Cálculo del tamaño muestralUtilizando el software GRANMO (Institut Municipal d’Investigació Mèdica, Barcelona, España), el tamaño muestral se calculó para demostrar una reducción desde el 25% en la cohorte de pacientes analizados con ACC hasta al menos el 10% en la cohorte de pacientes analizados con ACR (riesgo relativo ACR/ACC ≤ 0,4), con una razón de pacientes entre los grupos de 1:1 y una proporción de pérdidas en el seguimiento del 3%. Utilizando un test χ2 para tablas 2×2, con un riesgo alfa de 0,05 y un riesgo beta inferior a 0,2 (poder estadístico del 80%) en un contraste bilateral, se requerían 116 sujetos por brazo para detectar como estadísticamente significativa la diferencia entre 2proporciones (232 pacientes en total)31.
Análisis estadísticoSe utilizó el software SPSS Statistics 24.0 (SPSS Inc., Chicago, IL, Estados Unidos) para el análisis de los datos. Todos los valores de p se evaluaron a 2colas, considerándose estadísticamente significativos aquellos valores de p<0,05. Se exploró la normalidad de las variables continuas mediante el test de Kolmogorov-Smirnov. Las variables categóricas se expresaron como número (porcentaje). Las variables de valoración categóricas se compararon mediante el test exacto de Fisher o el de chi-cuadrado, según correspondiese. Las variables continuas distribuidas normalmente, expresadas como media (desviación estándar), fueron comparadas usando test t para 2muestras; y las variables continuas no distribuidas normalmente, expresadas como mediana (rango intercuartílico), fueron analizadas mediante el test no paramétrico de Wilcoxon (rank-sum).
También se desarrollaron modelos de regresión logística binaria para establecer los predictores independientes de NIC. Se realizó un análisis exploratorio univariado, introduciéndose en el modelo las covariables que presentaban un valor de p<0,10. Debido al reducido número de eventos acaecidos en la variable de valoración primaria (NIC), únicamente se añadieron al modelo 2covariables de gran relevancia clínica: la presencia de disfunción renal previa (FGe <60mL/min/1,73 m2) y la realización de intervencionismo coronario percutáneo2,3. El modelo final constó de las siguientes variables: ACR, diabetes mellitus, volumen de contraste ≥300mL, producto dosis-área ≥50Gy.cm2, intervencionismo coronario percutáneo y FGe <60mL/min/1,73 m2. El resultado fue reportado como odds ratio (OC) con un intervalo de confianza al 95% (IC 95%).
Finalmente, para evaluar la asociación entre la ACR (variable de exposición) y la NIC (variable de valoración primaria), se realizó una regresión de Poisson introduciendo las variables predictoras independientes de NIC en el modelo. El resultado fue reportado como riesgo relativo (RR) ajustado con un IC 95%.
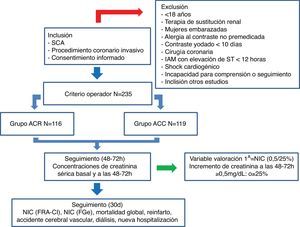
ResultadosEntre abril y septiembre de 2016 un total de 235 pacientes con SCA remitidos para coronariografía fueron seleccionados para nuestra investigación e incluidos en el análisis final. De ellos, 116 pacientes fueron estudiados con ACR (49,4%) y 119 con ACC (50,4%). El diagrama de flujo del estudio se representa en la figura 1.
Diagrama de flujo del Estudio CINERAMA.
ACC: arteriografía coronaria convencional; ACR: arteriografía coronaria rotacional; CA: síndrome coronario agudo; FGe: filtrado glomerular estimado; FRA-CI: contrast-induced acute kidney injury; IAM: infarto agudo de miocardio; NIC: nefropatía inducida por contraste.
Las características basales de ambos grupos se presentan en la tabla 1. El grupo de ACR presentaba mayor edad (64,0±11,8 vs. 59,7±12,1; p<0,001) y mayor porcentaje de población femenina (44,8 vs. 17,6%; p<0,001) y de hipertensión arterial (71,6 vs. 58,0%; p=0,030). Asimismo, presentaba menor proporción de tabaquismo (p=0,014) y de IAM como forma de presentación clínica (63,8 vs. 76,5%; p=0,034).
Características clínicas basales
| Rotacional (n=116) | Convencional (n=119) | p | |
|---|---|---|---|
| Edad, (años), media (DE) | 64,0 (11,8) | 59,7 (12,1) | 0,006 |
| Sexo femenino, n (%) | 52 (44,8) | 21 (17,6) | <0,001 |
| Índice de masa corporal, (kg/m2), media (DE) | 27,9 (4,4) | 28,0 (5,0) | 0,947 |
| Hipertensión arterial, n (%) | 83 (71,6) | 69 (58,0) | 0,030 |
| Dislipidemia, n (%) | 78 (67,2) | 67 (56,3) | 0,085 |
| Diabetes mellitus, n (%) | 37 (31,9) | 32 (26,9) | 0,400 |
| Tabaquismo, n (%) | 0,014 | ||
| No fumador | 57 (49,1) | 37 (31,1) | |
| Exfumador | 25 (21,6) | 40 (33,6) | |
| Fumador actual | 34 (29,3) | 42 (35,3) | |
| IAM previo, n (%) | 20 (17,2) | 19 (16,0) | 0,793 |
| Angioplastia previa, n (%) | 19 (16,4) | 22 (18,5) | 0,670 |
| Accidente vascular cerebral previo, n (%) | 7 (6,0) | 5 (4,2) | 0,523 |
| Enfermedad renal crónica, n (%) | 7 (6,0) | 6 (5,0) | 0,739 |
| Fracción de eyección ventricular izquierda, n (%) | 56,6 (10,0) | 55,4 (12,4) | 0,428 |
| Presentación clínica, n (%) | 0,034 | ||
| Angina inestable | 42 (36,2) | 28 (23,5) | |
| IAM | 74 (63,8) | 91 (76,5) | |
DE: desviación estándar; IAM: infarto agudo de miocardio.
En la tabla 2 se presenta el manejo médico recibido por los pacientes seleccionados. No se detectaron diferencias significativas en cuanto a las principales terapias médicas que han demostrado beneficio en el escenario del SCA.
Tratamientos médicos administrados
| Características | Rotacional (n=116) | Convencional (n=119) | p |
|---|---|---|---|
| Hidratación periprocedimiento, n (%) | 24 (20,7) | 17 (14,3) | 0,196 |
| Ácido acetilsalicílico, n (%) | 116 (100) | 117 (98,3) | 0,161 |
| Inhibidores de PY212, n (%) | 112 (96,6) | 113 (95,0) | 0,545 |
| Anticoagulantes orales, n (%) | 15 (12,9) | 8 (6,7) | 0,109 |
| Betabloqueantes, n (%) | 95 (81,9) | 95 (79,8) | 0,688 |
| Inhibidores del eje renina-angiotensina, n (%) | 68 (58,6) | 69 (58,0) | 0,921 |
| Inhibidores de los mineralocorticoides, n (%) | 8 (6,9) | 14 (11,8) | 0,200 |
| Estatinas, n (%) | 114 (98,3) | 114 (95,8) | 0,264 |
Inhibidores de PY212: inhibidores de la proteína Y 212.
Los datos que comparan los parámetros angiográficos y de radiación entre ambos grupos se presentan en la tabla 3.
Variables de valoración angiográficas y dosis de radiación
| Rotacional (n=116) | Convencional (n=119) | p | |
|---|---|---|---|
| Vasos coronarios enfermos | 0,012 | ||
| 0 vasos | 30 (25,9) | 13 (10,9) | |
| 1 vaso | 53 (45,7) | 54 (45,4) | |
| 2 vasos | 20 (17,2) | 30 (25,2) | |
| 3 vasos | 13 (11,2) | 22 (18,5) | |
| Enfermedad del tronco común, n (%) | 4 (3,4) | 9 (7,6) | 0,254 |
| Enfermedad de la descendente anterior, n (%) | 46 (39,7) | 61 (51,3) | 0,074 |
| Enfermedad de la circunfleja, n (%) | 46 (39,7) | 54 (45,4) | 0,375 |
| Enfermedad de la coronaria derecha, n (%) | 40 (34,5) | 61 (51,3) | 0,009 |
| Terapia | <0,001 | ||
| Manejo médico | 58 (50,0) | 28 (23,5) | |
| Stent convencional | 15 (12,9) | 23 (19,3) | |
| Stent farmacoactivo | 36 (31,0) | 52 (43,7) | |
| Scaffold bioabsorbible | 0 (0,0) | 3 (2,5) | |
| Cirugía coronaria | 7 (6,0) | 13 (10,9) | |
| Volumen de contrast en mL, media (DE) | 113 (92) | 169 (103) | <0,001 |
| Tiempo de escopia en min, media (DE) | 8,2 (7,3) | 10,2 (8,9) | 0,057 |
| Tiempo de procedimiento en min, media (DE) | 52 (26) | 60 (23) | 0,054 |
| Radiación producto dosis-área en Gy.cm2, mediana [RIC] | 38,65 [21,39-80,28] | 51,04 [32,06-89,65] | 0,155 |
| Radiación kerma-aire en mGy, mediana [RIC] | 745 [496-2.225] | 1.046 [587-1727] | 0,123 |
| Número de adquisiciones, n (%) | 11 (9) | 17 (9) | <0,001 |
| Ventriculografía, n (%) | 3 (2,6) | 2 (1,7) | 0,681 |
| Procedimientos diagnósticos | Rotacional(n=65) | Convencional (n=35) | |
| Volumen de contraste procedimientos diagnósticos en mL, media (DE) | 52 (24) | 85 (56) | <0,001 |
| Procedimiento diagnóstico-terapéuticos | Rotacional (n=51) | Convencional (n=84) | |
| Volumen de contraste procedimientos diagnóstico-terapéuticos en mL, media (DE) | 174 (64) | 205 (98) | 0,049 |
| Número de stents implantados, n, media (DE) | 1,61 (0,90) | 1,48 (0,69) | 0,342 |
DE: desviación estándar; RIC: rango intercuartílico.
Los pacientes analizados con ACR presentaron menor extensión de enfermedad coronaria (p=0,012) y recibieron intervencionismo coronario en menor proporción que los pacientes que fueron tratados con ACC (p<0,001).
La cohorte de pacientes tratados con ACR recibió menor cantidad de contraste durante los procedimientos que la cohorte de ACC (113±92 vs. 169±103mL; p<0,001). Dicha reducción de contraste se mantenía tanto en los procedimientos diagnósticos (52±24 vs. 85±56mL; p<0,001) como en los procedimientos combinados diagnósticos y terapéuticos (174±64 vs. 205±98mL; p=0,049). Asimismo, también se objetivó menor número de adquisiciones en el grupo de ACR (11±9 vs. 17±9; p<0,001).
Es de reseñar que también se observó en los pacientes de ACR una tendencia a un menor tiempo de escopia (8,2±7,3 vs. 10,2±8,9min; p=0,057) y un menor tiempo de procedimiento (52±26 vs. 60±23min; p=0,054).
Variables de valoración analíticas y de NICEn la tabla 4 se exponen los datos comparativos de las variables de valoración analíticas y de NIC (variable de valoración primaria), de la NIC con criterio FRA-CI, de la NIC con criterio FGe y del resto de las variables de valoración analíticas.
Variables de valoración analíticas y de NIC
| Rotacional (n=116) | Convencional (n=119) | p | |
|---|---|---|---|
| Creatinina basal en mg/dL, media (DE) | 1,02 (0,42) | 0,96 (0,29) | 0,168 |
| Creatinina 48-72 h en mg/dL, media (DE) | 1,08 (0,41) | 1,04 (0,34) | 0,411 |
| FGe basal en mL/min/1,73 m2, media (DE) | 75,58 (24,87) | 86,14 (27,32) | 0,001 |
| FGe 48-72 h en mL/min/1,73 m2, media (DE) | 70,24 (23,62) | 79,44(25,93) | 0,003 |
| Glucemia basal en mg/L, media (DE) | 140 (78) | 138 (68) | 0,845 |
| Na+ basal en mEq/L, media (DE) | 139 (6) | 138 (13) | 0,708 |
| K+ basal en mEq/L, media (DE) | 4,15 (0,59) | 4,23 (1,11) | 0,475 |
| Hemoglobina basal en g/dL, media (DE) | 13,9 (1,8) | 14,3 (1,8) | 0,060 |
| Variable de valoración primaria: NIC, n (%) | 5 (4,3) | 27 (22,7) | <0,001 |
| NIC con criterio FRA-CI, n (%) | 3 (2,6) | 15 (12,6) | 0,006 |
| NIC con criterio FGe, n (%) | 4 (3,4) | 20 (16,8) | 0,004 |
DE: desviación estándar; FGe: filtrado glomerular estimado; FRA-CI: fracaso renal agudo inducido por contraste iodado; K+: potasio; Na+: sodio; NIC: nefropatía inducida por contraste.
El grupo de ACR presentó menor FGe basal que el grupo de ACC (75,58±24,87 vs. 86,14±27,32mL/min/1,73 m2; p=0,001). En el posprocedimiento se continuó observando que el grupo de ACR presentaba menor FGe (70,24±23,62 vs. 79,44±25,93mL/min/1,73 m2; p=0,003).
En cuanto a la variable de valoración primaria, NIC, se objetivó que la cohorte de ACR presentaba menor aparición (4,3 vs. 22,7%; p<0,001). Asimismo, también se objetivó que la cohorte presentaba menor porcentaje de NIC con criterio FRA-CI (2,6 vs. 12,6%; p=0,006) y de NIC con criterio FGe (3,4 vs. 16,8%; p=0,004).
En el análisis de regresión logística para la detección de predictores independientes de NIC (incremento de creatinina ≥0,5mg/dL o ≥25%), la ACR continuó mostrándose como factor protector (OR: 0,154; IC 95%: 0,053-0,445; p=0,001). Asimismo, tanto la diabetes mellitus (OR: 3.378; IC 95%: 1.395-8.197; p=0,007) como la administración de contraste ≥300mL (OR: 4.566; IC 95%: 1.346-15.385; p=0,015) se mantuvieron como factores de riesgo para la aparición de NIC (ver tabla 5).
Predictores independientes de NIC (incremento de creatinina ≥0,5mg/dL o ≥25%)
| Análisis univariado | Análisis multivariado | |||||
|---|---|---|---|---|---|---|
| n (%) | NIC (n=32) | No NIC (n=203) | OR (IC 95%) | p | OR (IC 95%) | p |
| ACR | 5 (15,6) | 111 (54,7) | 0,153 (0,057-0,414) | <0,001 | 0,154 (0,053-0,445) | 0,001 |
| Diabetes mellitus | 15 (46,9) | 54 (26,6) | 2,435 (1,138-5,211) | 0,035 | 3,378 (1,395-8,197) | 0,007 |
| Contraste ≥ 300mL | 7 (21,9) | 9 (4,4) | 6,190 (2,112-18,137) | 0,002 | 4,566 (1,346-15,385) | 0,015 |
| Producto dosis-área ≥50Gy.cm2 | 20 (62,5) | 77 (37,9) | 2,857 (1,267-6,442) | 0,010 | ||
| FGe basal <60mL/min/1,73 m2 | 4 (12,5) | 50 (24,6) | 0,437 (0,146-1,307) | 0,175 | ||
| Intervencionismo coronario percutáneo | 20 (62,5) | 109 (53,7) | 1,275 (0,592-2,748) | 0,570 | ||
| Edad ≥ 75 años | 7 (21,9) | 39 (19,2) | 1,177 (0,475-2,919) | 0,810 | ||
| Género femenino | 8 (25,0) | 65 (32,0) | 0,708 (0,3431,661) | 0,539 | ||
| Hipertensión arterial | 22 (68,8) | 130 (64,0) | 1,250 (0,555-2,751) | 0,693 | ||
| Tabaquismo (previo o actual) | 20 (62,5) | 121 (59,6) | 1,129 (0,524-2,436) | 0,847 | ||
| Presentación clínica: IAM | 24 (75,0) | 141 (69,5) | 1,319 (0,562-3,099) | 0,678 | ||
| Enfermedad de 3 vasos | 5 (15,6) | 30 (14,8) | 1,068 (0,381-2,991) | 1,000 | ||
| Hidratación periprocedimiento | 5 (15,6) | 36 (17,7) | 0,859 (0,310-2,382) | 1,000 | ||
ACR: angiografía coronaria rotacional; FGe: filtrado glomerular estimado; IAM: infarto agudo de miocardio; IC 95%: intervalo de confianza al 95%; NIC: nefropatía inducida por contraste; OR: odds ratio.
Finalmente, en el análisis de regresión de Poisson se determinó que la ACR continuaba asociándose con menor aparición de NIC, definida como incremento de creatinina ≥0,5mg/dL o ≥25% (RR ajustado: 0,868; IC 95%: 0,794-0,949; p=0,002).
Eventos clínicosNo se observaron diferencias entre los grupos de comparación en cuanto a las variables de valoración clínicas. La tabla 6 muestra los datos de las variables de valoración clínica.
Eventos clínicos
| Rotacional (n=116) | Convencional (n=119) | p | |
|---|---|---|---|
| Mortalidad global, nuevo infarto, accidente cerebral vascular, necesidad de diálisis | |||
| Intrahospitalaria | 3 (2,6) | 5 (4,2) | 0,722 |
| A 30 días | 3 (2,6) | 6 (5,0) | 0,500 |
| Mortalidad global | |||
| Intrahospitalaria | 0 (0) | 1 (0,8) | 1,000 |
| A 30 días | 0 (0) | 2 (1,7) | 0,498 |
| Nuevo infarto | |||
| Intrahospitalario | 1 (0,9) | 3 (2,5) | 0,622 |
| A 30 días | 1 (0,9) | 3 (2,5) | 0,622 |
| Accidente cerebral vascular | |||
| Intrahospitalario | 2 (1,7) | 2 (1,7) | 1,000 |
| A 30 días | 2 (1,7) | 2 (1,7) | 1,000 |
| Necesidad de diálisis | |||
| Intrahospitalaria | 0 (0) | 0 (0) | * |
| A 30 días | 0 (0) | 1 (0,8) | 1,000 |
| Duración de la hospitalización en días, mediana [RIC] | 4 [3-7] | 5 [3-8] | 0,509 |
| Nueva hospitalización a 30 días | 5 (4,3) | 10 (8,5) | 0,286 |
| Dermatitis por radiación a 30 días | 0 (0) | 1 (0,8) | 1,000 |
RIC: rango intercuartílico.
Los hallazgos más notables de nuestro estudio fueron los siguientes: a) por primera vez en la literatura médica, la realización de ACR en pacientes tratados con procedimientos coronarios invasivos por SCA se asoció con menor aparición de NIC; b) a pesar de las diferencias basales entre los grupos de estudio, la realización de ACR se relacionó con menor desarrollo de NIC en el análisis de regresión y c) la presencia de diabetes mellitus y la administración de al menos 300mL de contraste yodado durante la realización de procedimientos coronarios invasivos fueron factores predictores independientes de riesgo para el desarrollo de NIC.
Los datos acerca de la incidencia de la NIC son muy variables en las publicaciones médicas: oscilan entre el 1 y el 33% en diferentes series1–4. Tal variabilidad entre los diferentes estudios parece estar relacionada con la utilización de diferentes criterios para definir la NIC y también con la falta de protocolos estrictos para su detección32. Una de las fortalezas de la presente investigación es el estudio exhaustivo realizado para detectar la NIC. Todos los pacientes fueron analizados mediante un despistaje de NIC, lo cual nos da una idea muy realista de la aparición de NIC tanto en el grupo de pacientes tratados con ACC como en el de los tratados con ACR. Por dicho motivo, la aparición de NIC en nuestro trabajo es superior a la de algunos estudios en los que no se realizaba una despistaje tan intenso de la NIC. En nuestro estudio, se utilizaron 3criterios distintos para identificar la NIC21–23. El criterio de NIC que se utilizó como variable de valoración primaria fue un incremento de creatinina ≥0,5mg/dL o ≥25% con respecto al nivel basal evaluado entre las 48 y 72 h tras la realización del procedimiento, debido a que esta definición es la que más se asocia con la aparición de eventos adversos21,33. No obstante, se utilizaron 2criterios adicionales de NIC como variables de valoración secundaria tales como la NIC con criterio FRA-CI y la NIC con criterio de FGe22,23. En todas las definiciones utilizadas se detectó una reducción significativa en el grupo de ACR.
El presente trabajo objetiva que la realización sistemática de la ACR permite reducir la cantidad de contraste utilizado, tanto en procedimientos diagnósticos como combinados (diagnósticos y terapéuticos). La gran mayoría de los trabajos comparativos en ACR y ACC se restringían únicamente al escenario de la angiografía coronaria diagnóstica, lo cual está alejado de la práctica clínica habitual, en la que la realización de angioplastia coronaria inmediatamente después del procedimiento diagnóstico es la práctica habitual34. Nuestros datos confirman que la realización de ACR seguida o no de angioplastia ad hoc continúa mostrando una reducción en el volumen total de contraste yodado empleado en cualquier tipo de procedimiento coronario invasivo. En el análisis de predictores independientes para el desarrollo de NIC, junto con la presencia de diabetes mellitus también se mostró que la administración de cantidades elevadas de contraste (≥300mL) se mostraba como un factor de riesgo para su aparición. Ello reafirma la idea de que la realización de la ACR permite reducir la aparición de NIC, mediada por el ahorro de contraste que esta técnica conlleva. Sin embargo, nuestros resultados no muestran que la disfunción renal se haya mostrado como factor predictor independiente de NIC y ello puede ser debido al escaso número de pacientes con disfunción renal presentes en nuestra muestra.
También es interesante referir que la ACR es una técnica simple y reproducible que no difiere en gran medida de la técnica convencional, ya que tanto los catéteres empleados como la técnica de punción y de canulación de las arterias coronarias son similares y previsiblemente sería de fácil generalización en la práctica habitual18,19,35,36. No obstante, debe tenerse en consideración que, dado que la inyección requerida para visualizar cada arteria coronaria necesita de mayor cantidad de contraste, hay que ser extremadamente cuidadoso para obtener un canulación coaxial de los ostia coronarios con el objetivo de evitar inducir posibles disecciones del árbol coronario. Sin embargo, en consonancia con la evidencia publicada18,19,34, en el Estudio CINERAMA no se ha objetivado un aumento de las complicaciones relacionadas con la realización de la técnica.
Asimismo, la NIC se relaciona de forma muy importante con la morbimortalidad y con el gasto sanitario y, por ello, se ha convertido en un grave problema de salud. La principal aportación de nuestro estudio consiste en ser el primero en objetivar que una estrategia generalizada de ahorro de contraste, como la realización de la ACR, se asocia con menor aparición de NIC y de las potenciales consecuencias negativas derivadas de ella. Dado que la NIC es una complicación con una elevada incidencia, cualquier mejora que permita reducir su incidencia puede ser de gran relevancia clínica. Y aunque se necesitan futuros ensayos clínicos para terminar de confirmar y ampliar los resultados de nuestra investigación, la plausibilidad biológica de nuestra estrategia así como la simplicidad de la técnica podrían tener un amplio impacto en la práctica asistencial.
La ACR se trata también de una técnica que podría suponer un ahorro monetario para el sistema sanitario. Es previsible que la reducción en la incidencia de un efecto adverso importante como la NIC redundaría en un menor gasto sanitario, como corrobora el estudio de Aubry et al.37. En dicho estudio, que evaluó más de un millón de hospitalizaciones en el sistema nacional de salud de francés, se observó que los pacientes que desarrollaban NIC presentaban un hospitalización mucho más prologada (20,5 vs. 4,7 días; p<0,001) y con un coste mucho más elevado (15.654 vs. 3.352 euros; p<0,001). Además, es previsible que el ahorro no se circunscribiría únicamente a la estancia hospitalaria sino también al derivado de la menor mortalidad y morbilidad que comporta la menor aparición de NIC, con lo que los costes totales de atención a los enfermos podrían incluso reducirse en mayor medida.
Limitaciones del estudioPrimera, este estudio es un análisis observacional y prospectivo (estudio de cohortes) con los sesgos inherentes a ellos. Sin embargo, es el primer estudio en evaluar el impacto de la ACR en el desarrollo de la NIC. Segunda, la ausencia de aleatorización condujo a que las variables basales (edad, sexo, FGe…) y las terapias recibidas (porcentaje de stents implantados…) no estuvieran homogéneamente distribuidas entre ambos grupos de estudio, lo cual pudo haber influido en la aparición de la variable de valoración primaria (NIC). No obstante, tras el ajuste por los factores de confusión, los resultados son favorables a la ACR. Tercera, nuestros datos se refieren a la población de las islas Canarias y, por lo tanto, no pueden ser completamente extrapolables a otras áreas geográficas. Cuarta, el protocolo de procedimiento de la ACC puede diferir entre las distintas Unidades de Hemodinámica y Cardiología Intervencionista. No obstante, consideramos que el protocolo de realización de la ACC se puede considerar conservador en cuanto a la administración de contraste, al limitar la realización de ventriculografías y el número inicial de proyecciones angiográficas para cada arteria coronaria y, por este motivo, el volumen final de contraste administrado en el grupo de ACC no debería estar sobrestimado. Quinta, el seguimiento clínico de los pacientes fue limitado en el tiempo (un mes), lo que puede estar relacionado con la ausencia de diferencias en las variables de valoración clínica entre los grupos de estudio.
ConclusionesLa realización de ACR en pacientes con SCA tratados mediante manejo invasivo se relacionó con menor administración de contraste yodado, lo que se tradujo en una menor incidencia de NIC. Se requieren ulteriores estudios aleatorizados para confirmar los presentes resultados, tanto en el SCA como en otros escenarios clínicos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.