Análisis Crítico de: Pfeffer MA, Burdmann EA, Chen CY, et al., for the TREAT investigators. A trial of darbepoetin alfa in type 2 diabetes and chronic kidney disease. N Engl J Med 2009;361:2019-2032; D.O.I: 10.1056/NEJMoa0907845
¿ Tipo de diseño y seguimiento
Ensayo controlado y aleatorizado, doble ciego, multicéntrico con seguimiento a 29 meses.
¿ Asignación
Aleatorizada, mediante sistema informático, con bloques permutados, en proporción 1:1, y estratificada por el centro de estudio, la proteinuria basal (proteinuria/creatinina >1 en muestra aislada de orina) y los antecedentes de enfermedad cardiovascular (ECV).
¿ Enmascaramiento
Doble ciego desde el inicio.
¿ Ámbito
Estudio multicéntrico con pacientes procedentes de 623 centros en 24 países.
¿ Pacientes
Criterios de inclusión: se incluyeron 4.047, todos ellos con diabetes tipo 2 y:
- Enfermedad renal crónica (ERC) con filtrado glomerular (FG) estimado mediante la fórmula MDRD-4 de 20 a 60 ml/min/1,73 m2.
- Anemia definida como hemoglobina (Hb) <11 g/dl.
- Saturación de transferrina >15%.
Criterios de exclusión: hipertensión arterial no controlada, trasplante renal previo o que tuviera programado trasplante de donante vivo, tratamiento actual con antibióticos i.v., quimioterapia o radioterapia, neoplasia (excepto carcinoma de piel de células basales o escamosas), infección por VIH, sangrado activo, enfermedad hematológica y embarazo. También se excluyeron aquellos pacientes que hubieran tenido un evento cardiovascular, crisis de «gran mal», cirugía mayor o tratamiento con agentes estimulantes de la eritropoyesis (AEES) en las 12 semanas previas a la aleatorización.
¿ Intervenciones
Asignación aleatoria a dos grupos, sin periodo de lavado previo:
- Darbepoetina alfa subcutánea: 2.016 pacientes. Administrada inicialmente cada 2 semanas a dosis de 0,75 µg/kg y, posteriormente ajustada para conseguir y mantener la Hb en 13 g/dl. La dosis máxima mensual se preestableció en 600 µg. Tras obtener Hb de 12-13,5 g/dl durante dos determinaciones consecutivas, se pasó a una dosis mensual de darbepoetina.
- Placebo: 2.031 pacientes. Ante cualquier cifra de Hb <9 g/dl, se administraba una dosis única de darbepoetina alfa subcutánea, 0,45 µg/kg y posteriormente se ajustaba la dosis cada 2 semanas hasta que la Hb fuera >9 g/dl, momento en el que se pasaba nuevamente a placebo.
Los ajustes de dosis se hicieron mediante un sistema de respuesta de voz interactivo, que en el caso del grupo placebo, simulaba los cambios que se realizaban en el grupo de darbepoetina alfa.
Tras el ajuste de dosis inicial, las visitas y determinaciones de Hb se realizaron mensualmente, y otros controles analíticos cada 4 o 6 meses. El análisis de acontecimientos se realizó en las semanas 1, 13, 25 y, posteriormente, cada 24 semanas.
¿ Variables de resultado
Principal:
-Tiempo al primer suceso, definido como la variable combinada de muerte por cualquier causa o acontecimiento de origen cardiovascular (IAM, insuficiencia cardiaca, ACVA u hospitalización por isquemia miocárdica), o:
-Tiempo a la variable combinada de muerte por cualquier causa o enfermedad renal terminal (necesidad de tratamiento renal sustitutivo).
Secundarias:
-Tiempo hasta la muerte.
-Mortalidad de origen cardiovascular.
-Eventos cardiovasculares.
-Tasa de descenso del FG.
-Cambios en dos cuestionarios de calidad de vida desde la semana 25: FACT-Fatigue (Functional Assessment of Cancer Therapy-Fatigue) y 36-Item Short-Form General Health Survey questionnaire (SF-36).
¿ Tamaño muestral
Se calculó que serían necesarios 1.203 sucesos para detectar, con un poder estadístico del 80%, un 20% de reducción de riesgo en el grupo tratado con darbepoetina alfa, suponiendo una tasa anual de acontecimientos del 12,5% en el grupo placebo, un 15% de pérdida anual de seguimiento y una atenuación del efecto del tratamiento por el uso anticipado de agentes estimulantes de la eritropoyesis en pacientes que progresaran a insuficiencia renal terminal. Se consideró un error tipo I del 0,048 para la estimación del tamaño muestral y se efectuaron análisis intermedios una vez registrados el 20, 40, 60 y 80% del total de eventos cardiovasculares esperados.
¿ Análisis estadístico
Se efectuó por intención de tratar mediante curvas de Kaplan-Meier y comparaciones basadas en el test de log-rank, estratificadas en función de la proteinuria basal y la presencia o ausencia de historia de enfermedad cardiovascular. Los hazard ratios e IC 95% se estimaron con el modelo estratificado de riesgos proporcionales de Cox.
¿ Ética y registro
Protocolo aprobado por los comités éticos de cada centro participante. Se obtuvo consentimiento informado escrito en todos los pacientes. Estudio registrado en ClinicalTrials.gov con el número NCT00093015.
¿ Promoción
Estudio financiado por Amgen. Los autores hacen declaración de conflictos de intereses. Dos de ellos son empleados de Amgen y el resto declaran haber recibido honorarios por diferentes actividades de varios laboratorios farmacéuticos.
¿ RESULTADOS PRINCIPALES
Nueve pacientes (cuatro en el grupo tratado con darbepoetina alfa y cinco en el de placebo) fueron eliminados del análisis porque sus centros no cumplieron con las Guías de Buena Práctica Clínica.
ANÁLISIS BASAL DE LOS GRUPOS
Los dos grupos tuvieron características basales similares. La edad media fue de 68 años, con un 57,3% de mujeres. La mediana del tiempo de duración conocida de la diabetes fue 15,4 años. El 65,4% tenían enfermedad cardiovascular previa.
El grupo tratado con darbepoetina tenía una proporción de insuficiencia cardiaca inferior a la del grupo control (31,5 frente al 35,2%; p = 0,01). No hubo diferencias en el resto de variables demográficas, clínicas o de laboratorio.
La mediana de Hb basal fue de 10,4 g/dl (intervalo intercuartílico [IQ]: 9,8-10,9), la saturación de transferrina fue del 23% en ambos grupos y la ferritina de 131 frente a 137 µg/l. Recibían suplementos orales de hierro oral el 41,8 frente al 42,7%, hierro intravenoso el 1,4 frente al 1,6% y habían recibido con anterioridad un factor estimulante de la eritropoyesis el 8,8 frente al 10,2% (grupo de darbepoetina respecto al grupo control).
Al cierre de la base de datos, se habían perdido para el seguimiento 153 pacientes (7,6%) del grupo de darbepoetina y 164 (8,1%) del grupo placebo.
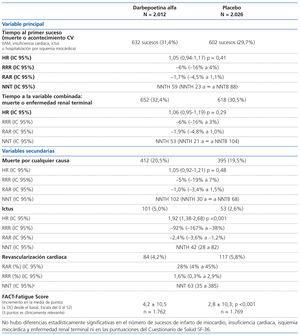
VARIABLES PRINCIPAL Y SECUNDARIAS (ver tabla 1)
El antecedente de enfermedad cardiovascular (RR 1,32; IC: 1,20-1,45) y la proteinuria >1 mg/mg (cociente proteína/creatinina en muestra aislada de orina) (RR 2,03; IC: 1,20-1,45) identificaron a una población en mayor riesgo de fallecer o de presentar un primer evento cardiovascular, independientemente del grupo asignado, tratamiento o placebo. La ausencia de efecto del tratamiento con darbepoetina se observó en cada subgrupo preespecificado, sin interacciones significativas con edad, sexo, grupo étnico, región o FG basal.
En el seguimiento de los grupos:
1. La mediana de la Hb desde el tercer mes hasta el final del estudio fue de 12,5 g/dl (IQ: 12,0-12,8) en el grupo de darbepoetina y de 10,6 g/dl (IQ: 9,9-11,3) en el grupo placebo.
2. La mediana de dosis mensual de darbepoetina en los dos grupos fue de 176 µg (IC: 104-305) y 0 (IQ: 0-5).
3. El 46% de los pacientes asignados a placebo recibieron al menos una dosis de darbepoetina como terapia de rescate.
4. El grupo placebo recibió más hierro intravenoso (20,4 frente al 14,8%; p <0,001). No hubo diferencias en la proporción de pacientes que recibieron hierro oral (66,8 frente al 68,6%; p = 0,25).
5. El grupo placebo precisó más transfusiones: 496 (24,5%) frente a 297 (14,8%); HR: darbepoetina frente a placebo: 0,56; (IC: 49-0,65); p <0,001.
6. La presión arterial diastólica fue superior en los tratados con darbepoetina. Media: 73 mmHg (IQ: 67-78) frente a 71 mmHg (65-77); p <0,001.
EFECTOS SECUNDARIOS
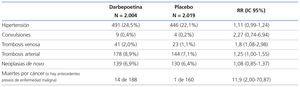
Las principales diferencias entre los dos grupos fueron una mayor tasa de trombosis venosa y arterial en el grupo de darbepoetina y una mayor mortalidad por cáncer en aquellos pacientes tratados con darbepoetina con antecedentes de neoplasia (ver tabla 2).
¿ CONCLUSIONES DE LOS AUTORES
El tratamiento con darbepoetina alfa en pacientes con diabetes, con ERC no en diálisis y con anemia moderada no reduce el riesgo combinado de muerte o de presentación de un evento cardiovascular, ni tampoco el de muerte e inclusión en tratamiento renal sustitutivo, y sí se asocia con un incremento en el riesgo de ictus.
¿ COMENTARIOS DE LOS REVISORES
El estudio TREAT es un ensayo multicéntrico, aleatorizado, doble ciego, con una metodología rigurosa, que muestra la ausencia de beneficios del tratamiento con darbepoetina alfa, en términos de mortalidad, eventos cardiovasculares y progresión a la enfermedad renal terminal, en la población objetivo del estudio: diabéticos con ERC y anemia (Hb <11 g/dl) y con una muy elevada tasa de morbimortalidad cardiovascular (30% en 29 meses de seguimiento), que se corresponde con la estimada en el cálculo del tamaño muestral. Plantea por otra parte, serias dudas sobre la idoneidad de normalizar la Hb en esta población, ya que aumenta el riesgo de ictus, fenómenos trombóticos y, en aquellos pacientes con antecedentes de neoplasias, el riesgo de mortalidad por cáncer.
El ensayo TREAT confirma los hallazgos de otros ensayos no enmascarados como el CREATE y el CHOIR. En estos ensayos se usaron agentes estimulantes de la eritropoyesis en pacientes con ERC para conseguir dos dianas terapéuticas, Hb: 11 o 13-15 g/dl y tampoco mostraron beneficios en términos de un menor riesgo de mortalidad o de acontecimientos cardiovasculares. En concreto, el CHOIR refirió una mayor morbimortalidad cardiovascular en el grupo de Hb alta. En estos dos ensayos clínicos, los grupos con Hb más alta habían recibido más suplementos de hierro, lo que hizo sugerir que el tratamiento con hierro podría haber sido un factor de confusión en los resultados obtenidos. Sin embargo, en el ensayo TREAT, el grupo con Hb más baja fue el que recibió más suplementos de hierro, lo que no apoyaría esta hipótesis.
Los beneficios mostrados en el estudio TREAT en el grupo de intervención (menor riesgo de recibir transfusiones, menor tasa de revascularización coronaria y un discreto incremento en la puntuación de uno de los cuestionarios de calidad de vida), o la sensibilización alogénica en potenciales receptores de trasplantes renales por el mayor número de transfusiones en el grupo control, se comparan desfavorablemente con los efectos secundarios descritos (mayor riesgo de ictus y de fenómenos trombóticos, mayor mortalidad por cáncer si hay antecedentes de neoplasias). Este perfil de seguridad desfavorable concuerda con el comunicado en otros ensayos clínicos en otras poblaciones, en especial las oncológicas.
Sin embargo, hay algunas cuestiones del estudio TREAT que deben tenerse en cuenta. La primera es referente a la evolución de la anemia del grupo placebo, con una mediana de 10,4 g/dl y que aumentó a 10,6 g/dl en el seguimiento, lo que implica que muchos de los pacientes del grupo placebo no tendrían anemia subsidiaria de tratamiento con agentes estimulantes de la eritropoyesis, de acuerdo a las recomendaciones actuales de las guías de práctica clínica. No se describe en el estudio, por no ser uno de sus objetivos, si los pacientes del grupo placebo con hemoglobinas persistentemente bajas y que son los que, en la práctica clínica, plantean la idoneidad de la intervención, evolucionan mejor o peor que el grupo tratado.
El segundo aspecto es relativo a las dosis utilizadas de darbepoetina en el grupo de intervención, 176 µg/mes (IQ: 104-305), que indica que muchos pacientes recibieron dosis superiores a las que habitualmente se emplean en pacientes con ERC que no están en diálisis. Estudios observacionales y subanálisis de estudios como el CHOIR indican que a mayor dosis de epoetina necesaria para conseguir dianas de Hb mayor es el riesgo de complicaciones. No se describe si esta tendencia también se aplica a los pacientes del ensayo TREAT, y probablemente sea objeto de análisis en otros trabajos.
¿ CONCLUSIONES DE LOS REVISORES
Este ensayo, junto a la evidencia disponible, muestra que el tratamiento con factores estimulantes de la eritropoyesis para intentar normalizar los niveles de Hb en pacientes diabéticos con ERC no en diálisis no aporta beneficios en términos de morbimortalidad y genera dudas sobre la seguridad de esta estrategia.
¿ CLASIFICACIÓN
Tema: Nefrología clínica.
Subtema: Enfermedad renal crónica.
Tipo de artículo: Tratamiento.
Palabras clave: Enfermedad renal crónica. Anemia. Epoetina. Diabetes mellitus. Mortalidad. Enfermedad cardiovascular.
NIVEL DE EVIDENCIA: Alto.
GRADO DE RECOMENDACIÓN: Fuerte.
Sistema GRADE (www.gradeworkinggroup.org)
Tabla 1. VARIABLES PRINCIPAL Y SECUNDARIAS
Tabla 2. EFECTOS SECUNDARIOS