Justificación: La enfermedad cardiovascular (ECV) es la primera causa de mortalidad en pacientes con enfermedad renal crónica (ERC). La valoración del riesgo cardiovascular a partir de los factores tradicionales es poco útil en esta población debido al fenómeno de «reverse epidemiology» y a la existencia de factores específicos derivados de la uremia. En este trabajo presentamos el protocolo del proyecto NEFRONA, un estudio prospectivo con el objetivo de evaluar la utilidad de técnicas de imagen y biomarcadores en la predicción de la ECV en la ERC. Métodos: A partir de noviembre 2009 se reclutarán 2.661 adultos asintomáticos con ERC (estadios 3-5D) procedentes de consultas ambulatorias de nefrología y centros de diálisis distribuidos a lo largo del territorio español. Asimismo, se incluirán 843 participantes sin ERC (grupo control). Además, semestralmente se registrará la aparición de acontecimientos cardiovasculares y mortalidad. Un equipo itinerante realizará una ecografía carotídea para valorar el grosor íntima-media y la presencia de placas, y determinará el índice tobillo-brazo para la clasificación de la enfermedad ateromatosa. Para el estudio de las calcificaciones vasculares se utilizará un score basado en la presencia de calcificaciones en las arterias carótidas, femorales y braquiales, y en las válvulas cardíacas, mediante ecografía. Finalmente, se recogerán muestras de sangre para la determinación de biomarcadores. Discusión: El proyecto NEFRONA nos permitirá evaluar la utilidad de las técnicas de imagen y biomarcadores en la valoración de la enfermedad ateromatosa y su valor predictivo en la población española con ERC.
Background: Cardiovascular disease (CVD) is the leading cause of morbidity and mortality in patients with chronic kidney disease (CKD). Cardiovascular risk assessment in this population is hampered by the failure of traditional risk factors to fully account for the elevated CVD risk, mainly due to the reverse epidemiology effect, and the presence of risk factors specifically related to uremia. Hereby, we present the protocol of a prospective study aimed to assess the predictive value of imaging techniques and biomarkers for CVD in patients with CKD. Methods: From November 2009, 2.661 asymptomatic adult patients with stages 3-5D CKD will be recruited from nephrology services and dialysis units throughout Spain. Eight-hundred forty-three participants without CKD (control group) will be also recruited. During the follow-up, CVD events and mortality will be recorded from all CKD patients. One trained itinerant team will carry out a carotid ultrasound to assess intima-media thickness and presence of plaques. A composite atherosclerosis score will be constructed based on carotid ultrasound data and ankle-brachial index. Presence and type of calcifications will be assessed in carotid, femoral and brachial arteries, and in cardiac valves, by ultrasound. Finally, blood samples will be collected from all participants to study biomarkers. Discussion: The NEFRONA study will allow us to examine the usefulness of imaging techniques and biomarkers to assess atherosclerosis development and their predictive value in a Spanish population with CKD.
INTRODUCCIÓN
La enfermedad cardiovascular (ECV) es la primera causa de muerte en la enfermedad renal crónica (ERC)1. Esto ha llevado a considerar a los pacientes con ERC como de alto riesgo, equiparándolos a los pacientes con enfermedad coronaria2. En la práctica clínica habitual se utilizan diferentes algoritmos diagnósticos para la predicción del riesgo cardiovascular global basados en la información proporcionada por los factores de riesgo tradicionales. Sin embargo, en la ERC, los modelos de prevención extrapolados de la población general no son aplicables debido al fenómeno de «reverse epidemiology»3 y al impacto de factores específicos derivados de la uremia4. Por lo tanto, es necesaria la utilización de herramientas diagnósticas adicionales que nos ayuden a predecir el riesgo cardiovascular más allá de los factores tradicionales5.
De entre estas técnicas, destacan la ecografía carotídea y el índice tobillo-brazo (ITB) por ser pruebas no invasivas, reproducibles y de bajo coste que valoran la aterosclerosis carotídea y la presencia de enfermedad periférica, respectivamente6,7. Varios estudios prospectivos en la población general8,9 han demostrado de forma concluyente que el aumento del grosor íntima-media (GIM) y/o un ITB patológico son factores de riesgo independientes de la incidencia de ECV. Hasta ahora, pocos estudios prospectivos han examinado el valor predictivo del GIM10-12 o ITB13,14 en pacientes con ERC. En este sentido, el estudio INVADE10 ha analizado recientemente el valor predictivo del GIM en 3.364 pacientes con ERC. A pesar de la naturaleza del estudio, el reducido rango de edad de los pacientes incluidos (a partir de los 55 años), la falta de valoración de pacientes en tratamiento renal sustitutivo y el relativo corto periodo de seguimiento (2 años) fueron las principales limitaciones de este estudio10. Por otra parte, otros autores han analizado el valor predictivo del GIM11,12 o ITB13,14 en pacientes en tratamiento renal sustitutivo con diálisis. Sin embargo, los resultados de estos estudios11-14 han sido poco concluyentes debido en gran parte al pequeño tamaño muestral considerado (< 100 pacientes) y al corto periodo de seguimiento (12-15 meses). Por lo tanto, no disponemos hasta el momento de amplios estudios prospectivos que hayan evaluado el valor predictivo de las técnicas mencionadas en pacientes con ERC incluyendo todos los estadios de la enfermedad renal. Asimismo, mediante ecografía podemos estudiar la presencia y localización del calcio. En la ERC, la presencia de calcio en la pared arterial y en las válvulas cardíacas se ha asociado con un aumento de la morbilidad y mortalidad por ECV15,16. Sin embargo, el estudio de su valor predictivo dependiendo de la extensión y el tipo de calcificación (íntima frente a media) continúa siendo desconocido17,18. Por lo tanto, la necesidad de plantear un estudio epidemiológico sobre la patología arterial en pacientes con ERC se justifica tanto por su elevada tasa de morbimortalidad cardiovascular como por la falta de grandes estudios epidemiológicos que hayan identificado factores de riesgo específicos. En este estudio nos planteamos valorar la utilidad de las técnicas de imagen junto con la determinación de biomarcadores en la predicción de la ECV en pacientes con ERC.
MÉTODOS
Diseño del estudio
Estudio observacional, prospectivo (seguimiento a 4 años) y multicéntrico. Entre noviembre de 2009 y abril de 2011, se reclutarán 2.661 pacientes con ERC (filtrado glomerular estimado <60 ml/min/1,73 m2), en estadios 3-5, procedentes de consultas ambulatorias de nefrología y centros de diálisis del territorio español. La selección de los pacientes renales se realizará mediante muestreo consecutivo de los pacientes que llegan a las consultas ambulatorias de nefrología y que representan el conjunto asistencial de la red pública española con capacidad para atender a estos pacientes. Se aceptarán pacientes de ambos sexos y edades comprendidas entre los 18 y 74 años, en ausencia de ECV previa. Se excluirán los pacientes que tengan una enfermedad intercurrente que presuponga una ausencia de seguimiento o expectativa de supervivencia menor a un año y los sometidos a trasplante renal. Asimismo, se incluirán 843 sujetos sin ERC (grupo control) procedentes de diferentes centros españoles de atención primaria, de los que sólo se recogerá información de la visita basal. El protocolo del estudio ha sido aprobado por el Comité Ético del Hospital Arnau de Vilanova de Lleida.
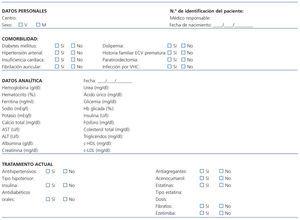
Tras obtener consentimiento informado, en todos los participantes se efectuará una historia clínica, que incluirá variables sociodemográficas, datos específicos de la enfermedad renal, de comorbilidad y tratamientos médicos actuales (tabla 1 y tabla 2). Un equipo itinerante compuesto por 2 técnicos y una enfermera registrará el hábito tabáquico y consumo de alcohol en gramos/día y realizará una exploración física, que comprenderá talla en centímetros, peso en kilogramos, cintura en centímetros, índice de masa corporal en kg/m2, y medida de la presión arterial sistólica y diastólica en milímetros de mercurio (media de 2 determinaciones con un intervalo de 5 minutos, con el sujeto sentado, mediante monitor automático OMRON).
Análisis de laboratorio
Las determinaciones analíticas sistemáticas (hemograma, bioquímica y perfil lipídico) (Apartado «Datos analítica» de Tabla 1) se realizarán en un periodo comprendido entre 3 meses anteriores ó posteriores a la exploración vascular. Asimismo, el día de la exploración vascular se extraerán muestras de sangre en condiciones de 6 horas de ayuno en todos los participantes del estudio (en los que sea posible) para la obtención de suero, plasma, ADN y ARN. Dichas muestras se enviarán al biobanco de la Red de Investigación Renal (REDinRen) donde se procesarán siguiendo un protocolo estándar y se almacenarán para la posterior determinación de biomarcadores. Se analizarán biomarcadores cardiovasculares (homocisteína, lipoproteína[a], cardiotrofina, adiponectina, troponina T y cistatina C), inflamatorios [(proteína C reactiva ultrasensible, interleuquina-6, interleuquina-1, factor de necrosis tumoral alfa, metaloproteinasas (MMPs) 2, 8, 9, 10 y inhibidor metaloproteinasas (TIMP1)] y biomarcadores relacionados con el metabolismo mineral [(FGF23, osteoprotegerina, osteocalcina, 25 (OH) vitamina D, 1,25 (OH)2 vitamina D y ligando receptor del activador del factor nuclear Kappa-B (RANKL)]. Asimismo, se determinarán los siguientes polimorfismos genéticos: APOB_A618V, APOC3_3238C>G,APOE_C130R,APOE_R176C, CDKN2A/B_116191G>C, CXCL12_111738T>C, IL6_-174C>G, LPL_D9N, LPL_N291S, LPL_S447X y NOS3_i19342A>G.
Seguimiento
El equipo itinerante realizará visitas de seguimiento a los 2 y 4 años del estudio. Durante las mismas se realizarán los mismos procedimientos que en la visita basal.
Morbilidad y mortalidad cardiovascular
Todos los pacientes con ERC serán monitorizados cada 6 meses hasta un total de 4 años. En cada control se registrará la aparición de ECV en función de la novena versión de la Clasificación Estadística Internacional de Enfermedades (CIE-9) que incluye: angina de pecho, infarto de miocardio, accidente isquémico transitorio, accidente cerebrovascular, fallo cardíaco, arritmia, enfermedad arterial periférica y aneurisma de aorta. Asimismo, se registrará la causa de muerte del paciente, tanto cardiovascular (infarto de miocardio, arritmia, fallo cardíaco, accidente vascular cerebral, aneurisma aorta, infarto mesentérico y muerte súbita) como no cardiovascular (infecciones, tumores, accidentes y enfermedad renal). Todos los datos sobre eventos y mortalidad serán recogidos por el nefrólogo responsable de cada centro.
Ecografía carotídea
La exploración ecográfica se realizará con un ecógrafo Vivid i modelo BT09 (General Electric) con un transductor lineal tipo 8L-RS/13-6 MHz. El territorio carotídeo se evaluará con un protocolo previamente descrito19. El equipo itinerante examinará 3 segmentos predeterminados de las arterias de ambos lados: carótida primitiva (1 cm proximal al bulbo carotídeo), bifurcación/bulbo (1-2 cm) y carótida interna (1 cm distal a la bifurcación). Los vasos se estudiarán con ecografía en tiempo real y Doppler color mediante secciones longitudinales y transversales, con rotación de la cabeza 45º hacia el lado contralateral al explorado y con el cuello en situación neutra y en dirección anteroposterior. En cada estudio se evaluarán el GIM y las placas de ateroma. El GIM, definido como la distancia existente entre la interfase luz carotídea-íntima y la interfase media-adventicia de la pared distal, se determinará en los 3 territorios descritos. Las placas se definirán como engrosamientos focales del GIM con una altura >1,2 mm o superior al 50% del GIM adyacente. Para identificarlas en todo el territorio carotídeo accesible, se realizarán secciones longitudinales y transversales en el estudio en modo B, y a continuación se efectuará la exploración con Doppler color, ajustando los parámetros técnicos (ganancia, frecuencia de repetición de pulsos y rango de velocidades) a las velocidades existentes en el vaso. El proceso de lectura será centralizado, y 2 observadores independientes que desconocerán las características clínicas de los participantes realizarán las lecturas. Para ello se utilizará el EchoPAC de GE equipado con el software automático de medida de IMT QIMT®.
Índice tobillo-brazo (ITB)
Emplearemos un Doppler vascular tipo MD2 Hungleigth con un transductor de 8 MHz y un manguito para la toma manual de la presión arterial. La determinación de la presión arterial se realizará en la arteria braquial en ambos brazos y en ambos pies, habitualmente en la arteria tibial posterior y de la arteria pedia dorsal. Para el cálculo del índice tobillobrazo (ITB) se utilizará la presión arterial braquial más elevada o la más próxima en el tiempo a la de la toma maleolar.
Clasificación de la enfermedad ateromatosa (EA)
A partir de los valores obtenidos por la ecografía carotídea e ITB, estratificaremos la carga de enfermedad aterosclerótica en cuatro estadios (figura 1):
Estadio 0: sujetos con ITB >0,9 y GIM carotídeo <80% según intervalo de referencia (IR)19.
Estadio 1: ITB entre 0,7-0,9 y/o GIM carotídeo >80% según IR.
Estadio 2: placa carotídea con estenosis <125 cm/s.
Estadio 3: ITB <0,7 y/o placa carotídea con estenosis >125 cm/s.
Ecografía femoral
Se realizará una ecografía de las arterias femorales para identificar la presencia de placas de ateroma y calcificaciones en la pared vascular. Mediante el estudio transversal se pretende identificar anatómicamente la arteria femoral común (1 cm proximal a la bifurcación), femoral superficial (1 cm distal a la bifurcación) y la presencia de placas de ateroma.
Ecografía braquial
Se llevará a cabo siempre que sea posible, en la extremidad sin el acceso vascular. Se realizará un corte longitudinal para identificar la presencia de placas de ateroma, así como la presencia y localización de calcio en la pared vascular.
Score de calcio
Definiremos el score de calcio como presencia/ausencia en cada uno de los territorios estudiados (carotídeo, femoral y braquial), y en todas las regiones exploradas (carótida común, bulbo y carótida interna en ambos lados; femoral común y femoral superficial en ambas extremidades, y arteria braquial). De acuerdo con los resultados de las ecografías, establecemos un rango de 0 (ausencia de calcificaciones en todos los territorios estudiados) a 11 (presencia de calcio en todas las regiones estudiadas). Además, diferenciamos la localización del calcio en cada territorio estudiado: calcificación de la íntima, calcificación de la media o ambas. Las placas hiperecogénicas que producen sombra de ecos se consideran calcificación vascular (placa calcificada).
Ecocardiograma
Emplearemos un ecógrafo Vivid i modelo BT09 (General Electric) con un transductor vectorial tipo 3S-RS. Se valorará la presencia de hipertrofia del ventrículo izquierdo (HVI), el tipo de HVI (concéntrica, excéntrica o remodelado concéntrico) y la presencia o no de calcificaciones valvulares. El proceso de lectura será centralizado, y 2 observadores independientes que desconocerán las características clínicas de los participantes realizarán las lecturas.
Tamaño de la muestra
El tamaño de la muestra de los pacientes con ERC se ha calculado a partir de datos de incidencia de ECV descritos en esta población y en función de su estadio1. El cálculo de la muestra se basa en el número de casos que deben estudiarse para poder obtener un número de acontecimientos mínimo para ajustar los resultados del modelo multivariante por 15 variables. Se han asumido unos errores I y II del 5 y del 10%, respectivamente, y un porcentaje acumulado de pérdidas de seguimiento del 25%. Se espera incluir a un total de 2.661 pacientes distribuidos en los siguientes estadios: 1.325 (estadio 3), 713 (estadios 4 y 5) y 623 en diálisis. Asimismo, se incluirán 843 sujetos sin enfermedad renal (grupo control). El objetivo principal para el que se ha definido la n en el grupo control es el de detectar diferencias significativas en la presencia de placas entre los enfermos renales para cada estadio de la enfermedad renal y los sujetos sin enfermedad renal (datos pendientes de publicación).
Análisis estadístico
Los datos se introducirán en una base de datos diseñada para tal efecto y analizados mediante el programa estadístico SPSS v.17.0. Se presentarán las frecuencias absolutas y los porcentajes con las variables cualitativas, y la media y la desviacióntípica para las cuantitativas que sigan una distribución normal y mediana y percentiles 5 y 95 para las variables continuas que no sigan una distribución normal. Se utilizarán las pruebas de la χ2 y ANOVA para el estudio de comparaciones entre variables cualitativas y/o cuantitativas, respectivamente. En el caso de que no pueda asumirse la normalidad de la distribución, se aplicarán las pruebas no paramétricas de U de Mann-Whitney o Kruskal-Wallis. La relación entre variables cuantitativas se analizará mediante el cálculo de los coeficientes de correlación de Pearson o Spearman, en función de su distribución. Para la asociación entre los valores del GIM o ITB con los factores de riesgo clásicos se utilizarán modelos de regresión lineal múltiple. Las variables que recojan los factores de riesgo recibirán la transformación adecuada para que cumplan con los supuestos exigidos por la técnica de regresión lineal, en especial cuando exista relación entre las variables que no sea de tipo lineal. De cara a la selección del modelo final, se evitará la posible multicolinealidad mediante un algoritmo de selección por pasos hacia adelante. La presencia o no de placas se analizará mediante un modelo de regresión logística. Además, se analizará si existen diferencias entre el grupo control y el grupo de ERC en las variables que predicen las placas ateromatosas por medio de la estimación de las odds ratio por separado. En el estudio longitudinal, se analizarán la incidencia de ECV, la mortalidad cardiovascular y la mortalidad por cualquier causa, en función de los parámetros de imagen y biomarcadores estudiados mediante regresión de Cox. La significación estadística se considerará como un riesgo alfa del 5% (p <0,05).
DISCUSIÓN
El proyecto NEFRONA es el primer estudio prospectivo que evaluará la utilidad de las técnicas de imagen y biomarcadores para la valoración de la EA y su valor predictivo de episodios y mortalidad por ECV en una gran muestra de pacientes renales (aproximadamente 3.000) en diferentes estadios y representativa del territorio español. Dada la paradójica asociación entre los factores de riesgo tradicionales y el riesgo de ECV en la población con ERC, es necesario el empleo de otras herramientas diagnósticas como las técnicas de imagen y/o biomarcadores que nos permitan la identificación precoz de los pacientes renales con un riesgo elevado de presentar un episodio cardiovascular, antes de que éste tenga lugar.
Nuestra hipótesis es que establecer la prevención de la ECV basándose en el diagnóstico precoz mediante la observación de la pared arterial (ecografía carotídea), la presencia y localización del calcio en la pared arterial (ecografía carotídea-femoral-braquial) y estructuras valvulares (ecocardiograma), junto con la determinación del ITB y biomarcadores, nos permitirá:
1. Conocer la historia natural de la patología arterial y los factores de riesgo específicos en cada estadio de la ERC.
2. Valorar el impacto de todos los parámetros de imagen en la morbimortalidad cardiovascular de estos pacientes, y establecer criterios homogéneos de medida y cuantificación.
3. Validar un método homogéneo de valoración de la enfermedad aterosclerótica que facilitará su utilización generalizada y la extrapolación de los resultados a otros estudios.
4. Identificar la localización del calcio en la pared arterial mediante ecografía permitirá profundizar en la fisiopatología de la calcificación arterial y los factores inductores de la misma.
5. Identificar biomarcadores específicos que pueden completar la información obtenida con las técnicas de imagen.
6. Finalmente, el análisis conjunto de todos estos parámetros permitirá construir un modelo matemático de predicción del riesgo cardiovascular, diferente para cada estadio de ERC.
Por lo tanto, mediante este estudio, se espera cambiar el paradigma de prevención de la ECV en pacientes con ERC mediante la práctica de la ecografía arterial y ecocardiograma, la determinación del ITB y de biomarcadores emergentes. Estos valores serán de gran utilidad, tanto para su comparación entre los diferentes estadios de la ERC como para su posterior comparación con los valores obtenidos en una cohorte de sujetos sin ERC (grupo control). Sin embargo, para lograr los objetivos propuestos, este proyecto requiere de un elevado poder estadístico y una rigurosidad metodológica. Para ello, nos planteamos la participación mayoritaria de los servicios de nefrología de toda España, así como una homogeneidad en los procedimientos de realización y valoración tanto de las técnicas de imagen como de los biomarcadores mediante la realización de todas las pruebas de imagen por un equipo itinerante, la creación de estaciones de lectura y el procesamiento de las muestras en un biobanco centralizado. Por lo tanto, constituiremos un biobanco de muestras biólogicas, genéticas y de imagen representativo de todo el territorio español, que podrá ser utilizado de manera reglada por diferentes grupos de investigación y nos permitirá realizar nuevos análisis incluyendo los biomarcadores que puedan identificarse en el futuro.
Agradecimientos
Trabajo financiado por Laboratorios Abbott.
NOTA DEL EDITOR
«PROTOCOLOS DE INVESTIGACIÓN» es una nueva sección de la revista NEFROLOGÍA, que ya existe en otras revistas biomédicas y que tiene como finalidad divulgar protocolos de investigación clínica, ya en marcha o a punto de iniciarse, sobre algún aspecto de nuestra especialidad.
La sección tendrá una periodicidad variable y constará de los siguientes apartados: título; título en inglés; resumen y palabras clave en español e inglés; introducción justificativa del proyecto, en la que consten claramente los objetivos del mismo; metodología, donde se debe incluir, además de la descripción metodológica requerida en todo proyecto de investigación, la constatación expresa de su aceptación por un Comité Ético de Investigación Clínica y las fuentes de financiación (bien por una Agencia Oficial de Promoción de la Investigación, Fundación de Investigación o Empresa); discusión, y referencias bibliográficas. La extensión máxima será de 4.000 palabras.
Para ser editado, el protocolo de investigación debe incluir los siguientes requisitos:
-Haber sido aprobado por algún Comité Ético de Investigación Clínica.
-Ser avalado por la Comisión de Investigación de la Sociedad Española de Nefrología (aval que será gestionado por la Revista).
-Contar con la aprobación del Comité Editorial de NEFROLOGÍA tras el proceso de revisión por pares.
-Mostrar que se dispone de financiación para su realización.
-Indicar el plazo estimado de comienzo y terminación.
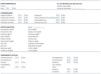
Tabla 1. Datos clínicos en pacientes con enfermedad renal crónica (ERC)
Tabla 2. Datos clínicos en pacientes sin enfermedad renal crónica (grupo control)
Figura 1.