Introducción: La nefropatía membranosa (NM) es la causa más frecuente de síndrome nefrótico en adultos. El diagnóstico se basa en los hallazgos típicos observados con el microscopio electrónico (ME) y el estudio de inmunofluorescencia (IF). En algunas ocasiones, sólo se dispone de tejido para estudio de microscopio óptico (MO); en estos casos puede ser complicado diferenciar entre una NM y una enfermedad por cambios mínimos (ECM). Recientemente se está extendiendo el estudio con C4d por inmunohistoquímica. Existe muy poca información sobre el depósito de C4d en la NM. Nuestro estudio consistió en analizar si el depósito de C4d realizado en la muestra en parafina podría ser útil en el diagnóstico de NM. Material y métodos: Estudio retrospectivo que incluyó a todos los pacientes diagnosticados de NM mediante biopsia renal en nuestra unidad entre enero de 2001 y octubre de 2008. Se incluyeron sólo adultos con un diagnóstico certero de NM y ECM idiopática que dispusieran de estudios con MO, IF y ME. En octubre de 2008, secciones de 3 µm de tejido renal fijado en formaldehído fueron deparafinadas y rehidratadas. Después se tiñeron mediante inmunohistoquímica con C4d usando un anticuerpo policlonal antihumano obtenido de conejo. Resultados: Se incluyeron finalmente 19 pacientes con ECM y 21 con NM. Ningún depósito de C4d fue observado en ninguno de los glomérulos de los pacientes con ECM y el 100% de estos pacientes fueron clasificados como negativos. Sin embargo, el depósito de C4d se detectó en el 100% de los pacientes con NM y en todos los glomérulos con una distribución uniforme y granular dibujando todas las asas capilares. Conclusiones: El depósito de C4d mediante inmunohistoquímica es una herramienta muy útil en el diagnóstico de NM.
Introduction: membranous nephropathy (MN) is the most common cause of nephrotic syndrome in adults. The diagnosis is based on typical findings observed using electron microscope (EM) and immunofluorescence (IF) studies. On some occasions, tissues are only available for analysis using an optical microscope (OM); in these cases, it can be difficult to differentiate between MN and minimal change disease (MCD). Recently, the use of C4d immunohistochemical staining has spread. Very little information is available regarding C4d deposits in MN. Our study consisted of analysing whether C4d staining of samples embedded in paraffin could be useful for diagnosing MN. Material and Method: Ours was a retrospective study including all patients diagnosed with MN by renal biopsy in our unit between January 2001 and October 2008. We only included adult patients with a definitive diagnosis of MN or idiopathic MCD by OM, IF, and ME studies. In October 2008, 3µm sections of renal tissue fixed in formaldehyde were removed from paraffin and rehydrated. The samples were then stained for C4d immunohistochemical analysis using anti-human polyclonal antibodies obtained from rabbits. Results: Our study included a final sample of 19 patients with MCD and 21 with MN. No C4d deposits were observed in any of the glomeruli in patients with MCD, and 100% of these patients were classified as negative. However, C4d deposits were detected in 100% of patients with MN, and were observable in all glomeruli with a uniform granular distribution, demarcating all capillary loops. Conclusions: C4d immunohistochemical staining is a very useful tool for diagnosing MN.
INTRODUCCIÓN
La nefropatía membranosa (NM) es la causa más frecuente de síndrome nefrótico en adultos1. El diagnóstico se basa en los hallazgos típicos observados con el microscopio electrónico (ME) y el estudio de inmunofluorescencia (IF). En algunos pacientes es posible que sólo se disponga de tejido para estudio de microscopio óptico (MO); en estos casos es muy difícil, a veces imposible, diferenciar con seguridad entre una enfermedad de cambios mínimos (ECM) y la NM. En estas ocasiones, sería muy útil disponer de una técnica diagnóstica que se pudiera realizar con el tejido renal fijado en parafina.
La detección mediante inmunohistoquímica del producto de degradación del complemento C4d en las enfermedades renales ha despertado un considerable interés clínico en los últimos años. Su estudio se ha centrado en las biopsias de trasplante como un indicador de rechazo humoral2. En las nefropatías glomerulares la información es muy escasa. Recientemente hemos demostrado que el depósito mesangial de C4d se puede utilizar como un factor de mal pronóstico en la nefropatía IgA3.
El C4d es un fragmento de C4 que se produce durante la activación del complemento por la vía clásica o de las lectinas. Este fragmento, el C4d, es muy estable y se une covalentemente a las superficies celulares, y puede ser detectado con los reactivos que hoy día ya están disponibles.
La patogenia de la MN está mediada por la formación in situ de depósitos inmunes con la consiguiente activación del complemento. Por lo tanto, podríamos esperar encontrar depósitos de C4d como un marcador de activación del complemento en la NM, pero no en la ECM.
El objetivo de nuestro estudio fue determinar si la detección por inmunohistoquímica de C4d en los pacientes con NM puede ser útil como una herramienta diagnóstica.
MATERIAL Y MÉTODOS
Este estudio incluyó a todos los pacientes consecutivos que fueron sometidos a biopsia renal en nuestra institución entre enero de 2001 y octubre de 2008. El estudio fue aprobado por el Comité de Ética e Investigación de nuestra institución. La información del paciente se manejó de acuerdo con el Reglamento de protección de datos. Sólo los pacientes adultos con un diagnóstico de ECM y NM idiopática y basada en la evaluación histológica de la biopsia renal con estudios de MO, IF y ME se consideraron para su inclusión en el estudio. Para la evaluación de la MO, se tiñeron con hematoxilina y eosina, ácido periódico de Schiff y plata metenamina cortes histológicos de 2 micras preparados a partir del tejido fijado en formol e incluido en parafina. El estudio de IF se realizó con anticuerpos anti-IgG, IgM, IgA, C3, C1q, cadena ligera κ, λ, fibrinógeno y albúmina. El estudio de ME se realizó con el tejido renal fijado en glutaraldehído y procesados para análisis ultraestructural de acuerdo con los protocolos estándar de laboratorio. En la NM se utilizó la clasificación histológica de Ehrenreich et al.4 Cinco pacientes se encontraban en estadio I, quince pacientes en estadio II y un paciente en estadio III.
Fueron excluidos 13 pacientes porque no se obtuvieron glomérulos para el estudio de C4d. Finalmente, fueron incluidos en el estudio 19 pacientes con ECM y 21 con MN que cumplían los criterios de inclusión.
DETECCIÓN MEDIANTE INMUNOHISTOQUÍMICA DE C4D EN EL TEJIDO FIJADO EN PARAFINA
Todas las biopsias renales fueron procesadas rutinariamente para MO, IF y ME cuando se llevaron a cabo, entre enero de 2001 y octubre de 2008. En octubre de 2008, secciones de 3 micras fijadas en formaldehído fueron teñidas mediante inmunohistoquímica con el anticuerpo policlonal de conejo antihumano C4d (Biomedica, Viena, Austria).
Las secciones histológicas de todos los pacientes fueron revisadas sin el conocimiento de la información clínica o patológica. Los detalles de estos procedimientos han sido publicados anteriormente3. Los pacientes fueron clasificados como «positivo» cuando más del 75% de los glomérulos fueron positivos para C4d y «negativo» cuando menos del 25% de los glomérulos fueron positivos para C4d.
En dos pacientes con ECM y cinco con NM, diagnosticados después de octubre de 2008, el C4d también fue analizado por IF con anticuerpos monoclonales (Biogénesis, Vitro SA, Sevilla).
RESULTADOS
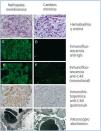
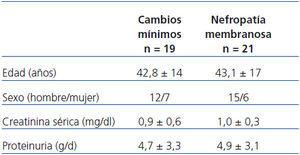
La tabla 1 muestra la edad, el sexo, la creatinina sérica y la proteinuria en el momento de la biopsia renal en los pacientes diagnosticados de ECM y NM antes de octubre de 2008. No se observó depósito de C4d en ninguno de los glomérulos de los pacientes con ECM, y el 100% de estos pacientes (n = 19) fueron clasificados como «negativo». Sin embargo, el C4d se detectó en el 100% de los pacientes (n = 21) con NM (y en el 100% de los glomérulos) (figura 1) en la forma de un depósito con una distribución granular uniforme que dibuja el contorno de todas las asas capilares (figura 2 y figura 3). No existía depósito a nivel mesangial.
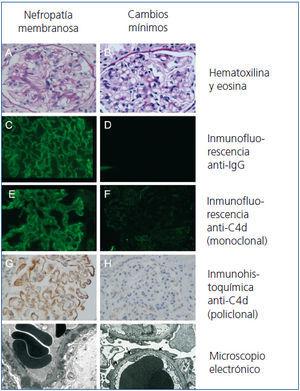
En otros 5 pacientes diagnosticados de NM después de octubre de 2008, también se realizó el estudio de C4d mediante IF con anticuerpos monoclonales. En todos ellos, el depósito de C4d fue positivo (figura 4), tanto con el estudio de IF como con inmunohistoquímica.
La figura 4 muestra el estudio de hematoxilina y eosina (A y B), los estudios de IF con anti-IgG (C y D), el estudio de IF con anti-C4d (monoclonal) (E y F), el estudio de inmunohistoquímica con anticuerpos anti-C4d (policlonal) (G y H) y los estudios de ME en dos pacientes representativos con ECM (B, D, F, H y J) y NM (A, C, E, G e I).
DISCUSIÓN
El depósito del complemento, visualizado por IF, inmunohistoquímica o ME, es una característica frecuente de ciertas formas de glomerulonefritis (membranoproliferativa, posestreptocócica, nefropatía IgA, NM, nefritis lúpica y algunas formas de glomerulonefritis rápidamente progresiva), por lo general en paralelo con el depósito de anticuerpos5-7. Estos depósitos de complemento, en general, contienen tanto C4 como C3 y son característicos de la activación del complemento por la vía clásica, o bien sólo C3 o sin los primeros componentes, en cuyo caso son reflejo de la activación de la vía alternativa.
El C4d es el producto de la rotura del C4, que se activa y degrada como parte de la activación del complemento por la vía clásica que normalmente está mediada por anticuerpos. Esto tiene más valor y aplicación en esta enfermedad, ahora que recientemente se ha identificado el anticuerpo responsable de más del 50-70% de estos casos, un anticuerpo dirigido frente al receptor de la fosfolipasa A2 tipo M8. El C4d también puede ser generado cuando el complemento se activa por la vía de las lectinas. Una vez generado, el C4d se une covalentemente a elementos de tejido en el sitio de activación y es, por lo tanto, un biomarcador de la activación de la vía clásica o de las lectinas. El depósito de C4d en los capilares del injerto renal fue descrito por primera vez en 1993 por Feucht et al.2 Más recientemente, en un número creciente de estudios de trasplante, la detección inmunohistoquímica de C4d en los capilares peritubulares ha sido reconocida como un índice sensible del rechazo mediado por anticuerpos9,10.
Existen muy pocos estudios que hayan analizado el depósito de C4d en las enfermedades glomerulares. En la nefritis lúpica, el depósito de C4d glomerular es un hallazgo esperado y se cree que es el resultado de la activación mediada por complejos inmunes de la vía clásica del complemento11,12. En la nefropatía IgA, Roos et al.13 mostraron que, cuando existe activación de la vía de las lectinas (y depósito de C4d a nivel mesangial), la histología renal es más severa. Más tarde, nuestro grupo demostró que el depósito mesangial de C4d puede ser utilizado como factor pronóstico en pacientes con nefropatía por IgA3. La supervivencia renal a los 10 años fue del 43,9% en pacientes positivos para C4d, frente al 90,9% en los pacientes negativos para C4d (p = 0,0005), sugiriendo que una distinta activación del complemento (clásica o de las lectinas) tiene un importante papel patogénico. En la NM idiopática, a diferencia de la secundaria al lupus, no existe depósito de C1q. En estos casos, con NM idiopática, la presencia de C4d probablemente esté indicando que el complemento se está activando a través de la vía de las lectinas.
La información del papel del C4d en la NM se limita a un estudio publicado en 1989. En este estudio14, el C4d se determinó por IF en 12 pacientes con NM idiopática y se detectó en 11 de ellos.
La detección de C4d por inmunohistoquímica utilizando la técnica de inmunoperoxidasa descrita en nuestro estudio tiene la gran ventaja de realizar el estudio en tejido incluido en parafina y poder diagnosticar aquellos casos en los que no se disponga de tejido para el estudio de IF o ME. Suzuki et al.15 demostraron que la detección de C4d por inmunohistoquímica fue comparable a la detección por IF. Nuestros datos con 5 pacientes coinciden con esta idea.
El lugar donde se deposita el C4d también merece algún comentario. En la nefropatía IgA, la tinción para C4d se observó en un patrón predominantemente mesangial, indicando con probabilidad el sitio de origen de la activación local del complemento3,13. En este estudio en pacientes con MN, el depósito de C4d se localiza en las asas capilares, respetando el mesangio y además con una distribución granular. La NM se caracteriza por una acumulación de depósitos inmunes en la cara externa de la membrana basal glomerular, lo que provoca un engrosamiento de la membrana. Estos depósitos inmunes se han identificado como IgG, a menudo IgG416,17, y el complejo de ataque a la membrana del complemento C5b-918. Nosotros pensamos que el C4d forma parte de estos depósitos inmunes. Por otro lado, se ha sugerido que la activación del complemento no juega ningún papel en la patogénesis de la ECM. Nuestro estudio proporciona apoyo a estas dos teorías. En el 100% de los pacientes con NM se observó depósito de C4d en la membrana basal glomerular, mientras que los resultados fueron negativos en el 100% de los casos con ECM.
En resumen, nuestros datos indican que la demostración de C4d por medio de inmunohistoquímica es una herramienta muy útil para el diagnóstico diferencial de la NM y la ECM en adultos. Este hallazgo es particularmente relevante, ya que el diagnóstico puede ser realizado en pacientes en los que sólo se dispone de tejido para MO.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 1. Datos clínicos y analíticos en el momento de la biopsia renal
Figura 2. Estudio de inmunohistoquímica con anticuerpos anti-C4d de un paciente con nefropatía membranosa (40x)
Figura 1. Estudio de inmunohistoquímica con anticuerpos anti-C4d de un paciente con nefropatía membranosa (10x)
Figura 3. Estudio de inmunohistoquímica con anticuerpos anti-C4d de un paciente con nefropatía membranosa (100x)
Figura 4. Estudios de hematoxilina y eosina, inmunofluorescencia con anticuerpos anti-IgG y anti-C4d (monoclonal), inmunohistoquímica con anti-C4d (policlonales) y microscopía electrónica en dos pacientes representativos con enfermedad de cambios mínimos y nefropat