Hay abundantes datos experimentales que sustentan la participación de la aldosterona y la estimulación del receptor mineralcorticoide (RM) en la génesis y progresión de la enfermedad renal crónica (ERC) y en el daño cardiovascular.
Muchos estudios han demostrado que en la ERC diabética y no diabética el bloqueo del sistema renina angiotensina-aldosterona (SRAA) con inhibidores de enzima de conversión (iECA) o antagonistas del receptor de angiotensina II (ARA2) disminuye la proteinuria, la progresión de la ERC y la mortalidad, pero persiste todavía un importante riesgo residual de desarrollo de estos eventos.
En sujetos tratados con iECA o ARA2 puede haber un escape de la aldosterona cuya prevalencia en sujetos con ERC puede alcanzar el 50%. Diversos estudios han demostrado que, en la ERC, los fármacos antialdosterónicos clásicos (espironolactona, eplerenona) añadidos a iECA o ARA2 reducen la proteinuria, pero aumentan el riesgo de hipercaliemia. Otros estudios en sujetos tratados con diálisis sugieren un posible efecto beneficioso de los antialdosterónicos sobre eventos CV y mortalidad. Los nuevos ligadores intestinales de K+pueden prevenir o reducir la hipercaliemia inducida por el bloqueo del SRAA y disminuir la desprescripción o la reducción de dosis de fármacos bloqueantes del SRAA.
Los bloqueantes del RM no esteroideos, con más potencia y selectividad que los clásicos, reducen la proteinuria y tienen menos riesgo de hipercaliemia. Varios ensayos clínicos, actualmente en realización, determinarán el efecto de los bloqueantes clásicos del RM sobre eventos CV y mortalidad en sujetos con ERC estadio 3b y en enfermos en diálisis, y si en enfermos con diabetes mellitus tipo 2 y ERC, óptimamente tratados y con elevado riesgo de eventos CV y renales, la adición de finerenona a su tratamiento produce beneficios cardiorrenales.
Los inhibidores del cotransportador sodio-glucosa tipo 2 (iSGLT2) han demostrado reducir la mortalidad y el desarrollo y la progresión de la nefropatía diabética y no diabética. Hay argumentos fisiopatológicos que suscitan la posibilidad de que la triple combinación iECA o ARA2, iSGLT2 y antagonista de aldosterona ofrezca mayor protección renal y vascular.
There are many experimental data supporting the involvement of aldosterone and mineralcorticoid receptor (MR) activation in the genesis and progression of chronic kidney disease (CKD) and cardiovascular damage.
Many studies have shown that in diabetic and non-diabetic CKD, blocking the renin- angiotensin-aldosterone (RAAS) system with conversion enzyme inhibitors (ACEi) or angiotensin II receptor blockers (ARBs) decreases proteinuria, progression of CKD and mortality, but there is still a significant residual risk of developing these events.
In subjects treated with ACEi or ARBs there may be an aldosterone breakthrough whose prevalence in subjects with CKD can reach 50%. Several studies have shown that in CKD, the aldosterone antagonists (spironolactone, eplerenone) added to ACEi or ARBs, reduce proteinuria, but increase the risk of hyperkalemia. Other studies in subjects treated with dialysis suggest a possible beneficial effect of antialdosteronic drugs on CV events and mortality. Newer potassium binders drugs can prevent / decrease hyperkalemia induced by RAAS blockade, and may reduce the high discontinuation rates or dose reduction of RAAS-blockers.
The nonsteroidal MR blockers, with more potency and selectivity than the classic ones, reduce proteinuria and have a lower risk of hyperkalemia. Several clinical trials, currently underway, will determine the effect of classic MR blockers on CV events and mortality in subjects with stage 3b CKD and in dialysis patients, and whether in patients with type 2 diabetes mellitus and CKD, optimally treated and with high risk of CV and kidney events, the addition of finerenone to their treatment produces cardiorenal benefits.
Large randomized trials have shown that sodium glucose type 2 cotransporter inhibitors (SGLT2i) reduce mortality and the development and progression of diabetic and nondiabetic CKD. There are pathophysiological arguments, which raise the possibility that the triple combination ACEi or ARBs, SGLT2i and aldosterone antagonist provide additional renal and cardiovascular protection.
Muchas evidencias implican al sistema renina-angiotensina-aldosterona (SRAA) en la progresión de la enfermedad renal crónica (ERC) .El bloqueo de la generación y acción de la angiotensina ii (AII) mediante los inhibidores del enzima de conversión de AII (iECA) y de los bloqueantes de receptores AT1 de la AII (ARA2) ha demostrado su utilidad en la reducción de la progresión de la nefropatía diabética y no diabética1-5 y en la disminución de la morbimortalidad cardiovascular (CV) y de mortalidad total6. El bloqueo del receptor mineralcorticoide (RM) con espironolactona y epleronona añade un efecto antiproteinúrico cuando se asocian a iECA o ARA2. Hasta ahora, sin embargo, no hay evidencias consistentes que demuestren beneficio del bloqueo del RM en la progresión de la ERC ni en la reducción de eventos CV y de mortalidad total en la ERC. En cardiología, sin embargo, el bloqueo del RM en sujetos con insuficiencia cardiaca con fracción de eyección (FE) deprimida disminuye los eventos CV y la mortalidad7-9.
Fisiología/fisiopatología de aldosterona/RMLa aldosterona fue aislada en el año 1953 por Simpson et al.10. Es producida, fundamentalmente, por las células de la capa glomerulosa de las glándulas suprarrenales. En determinadas circunstancias, se produce aldosterona en corazón, vasos sanguíneos y adipocitos11,12. En coronarias humanas de donantes multiórgano se ha demostrado un aumento de la expresión de la aldosterona sintetasa (AS). que es mayor en sujetos con insuficiencia renal y que se correlaciona con la expresión vascular del factor de transformación osteoblástica core binding factor alpha 1 (CBFA1)13.
La AII y los valores elevados de K+ son los principales secretagogos de aldosterona. Sin embargo, otros factores como ACTH, catecolaminas, endotelina, y productos derivados del adipocito, como leptina, adiponectina y C1qTNF-related protein 1 (CTRP1), también estimulan la secreción suprarrenal de aldosterona12,14.
En cultivo de células musculares vasculares lisas de aorta, la presencia de fósforo en el medio induce un aumento de la expresión vascular de AS13. Este hecho puede ser relevante en la ERC. Por otra parte, se ha demostrado colocalización de klotho-AS en suprarrenales y en animales haplodeficientes en klotho hay un aumento de la expresión de AS15.
En 1997 se clonó el RM16. Es una proteína de 107kD codificada por un gen localizado en el cromosoma 14. Tiene 3 dominios: un dominio N-terminal, otro que se une al ADN y un tercero que se ensambla con el ligando. En algunos dominios se unen determinados coactivadores y correpresores que pueden ser tejido-específicos y modular acciones peculiares en determinados órganos17. Hay RM en el túbulo colector renal y el colon (sitios clásicos), y también en otras localizaciones18-25 (tabla 1).
Localizaciones del receptor mineralcorticoide
| Túbulo contorneado distal y conector | Miocardiocitos |
|---|---|
| Mácula densa | Adipocitos |
| Podocitos | Fibroblastos |
| Mesangio | Macrófagos |
| Colon | Neuronas límbicas del hipotálamo |
| Células musculares lisas vasculares | Glándulas salivales |
| Células endoteliales | Glándulas sudoríparas |
El cortisol también se une al RM. En las células epiteliales y en el endotelio vascular la enzima 11-βOH-esteroide deshidrogenasa convierte el cortisol en cortisona impidiendo su unión al RM.
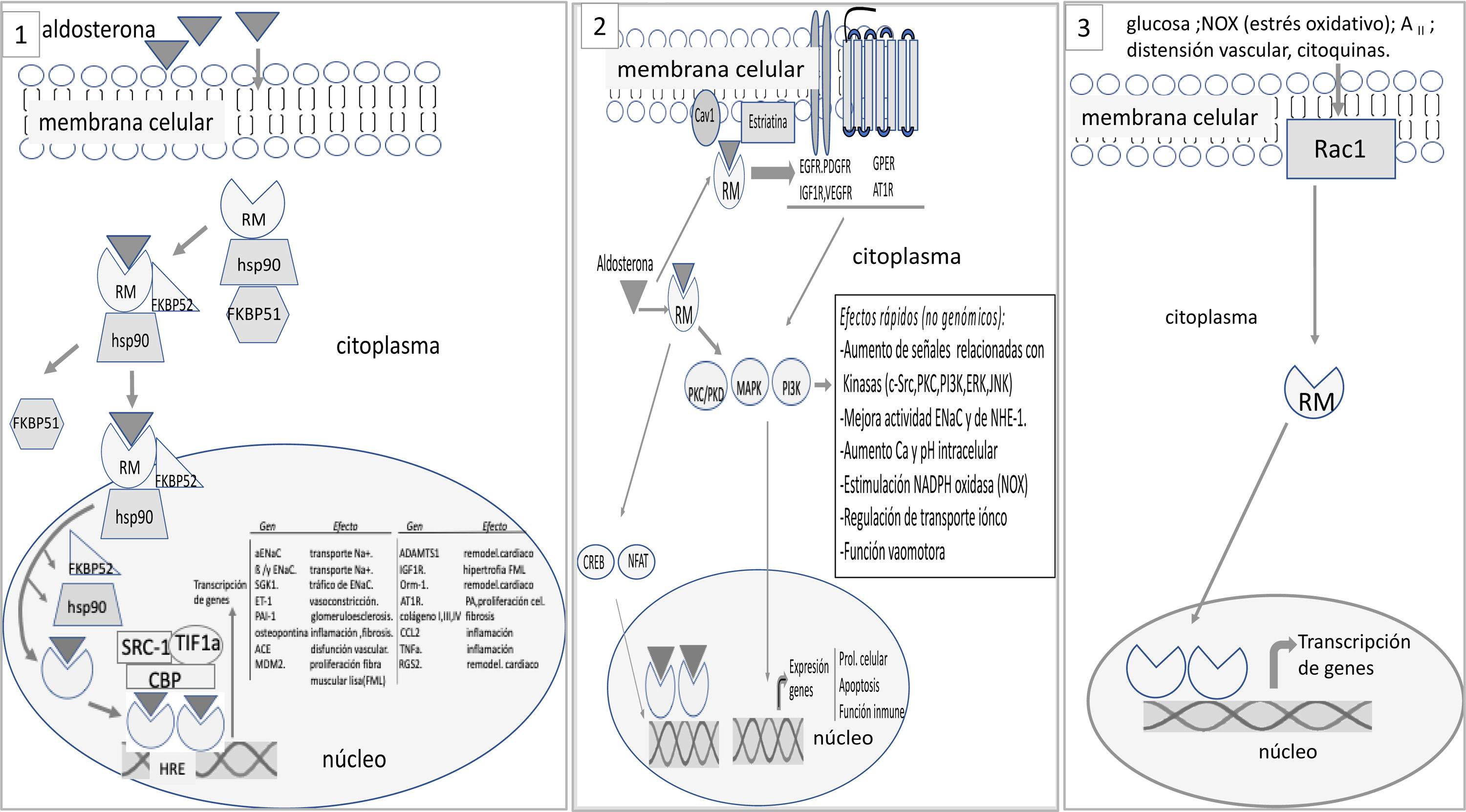
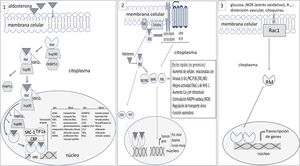
El RM no está insertado directamente en la membrana celular. En estado basal, no unido al ligando, el RM se localiza, predominantemente, en el citoplasma unido a chaperonas que facilitan su unión al ligando y sirven como lanzaderas del complejo RM-ligando al núcleo25. La unión aldosterona-RM promueve varios efectos: 1) el complejo RM y su ligando son translocados al núcleo donde se dimeriza y activa genes que codifican determinadas proteínas (efectos genómicos) (fig. 1); puede haber interacción con otros factores de transcripción citoplasmáticos como nuclear factor of activated T-cells (NAFT) y cAMP response element-binding protein (CREB) que pueden modificar las señales genómicas; 2) además de estos efectos genómicos, puede haber efectos no genómicos, más rápidos; el complejo aldosterona-RM pueden activar cinasas citoplasmáticas directamente y, frecuentemente, a través de su interacción con receptores de membrana25,26. La aldosterona se une al RM que está anclado en la membrana por caveolina y estriatina e interacciona con receptores de membrana como epidermal growth factor receptor (EGFR), platelet derived growth factor receptor (PDGFR), insulin like growth factor receptor (IGF1R), vascular endotelial growth factor receptor (VEGFR), G protein coupled estrogen receptor (GPER) y angiotensin II receptor type I (AT1R). Esta interacción es responsable de los efectos no genómicos de la aldosterona relacionados sobre todo con el transporte de electrólitos y la función vasomotora (fig. 1).
1) En situación basal, el receptor mineralcorticoide (RM) se localiza predominantemente en el citoplasma formando parte de un complejo con la chaperona heat shock protein (Hsp90), que facilita su unión al ligando, y con la inmunofilina FK506-binding protein of 51 kDa (FKBP51). Tras su unión al ligando, la inmunofilina FKBP51 es sustituida por la FBBP52, que facilita el tránsito del complejo RM-ligando desde el citoplasma al núcleo. Una vez en el nucleoplasma, el RM-ligando se disocia de la chaperona y de la inmunofilina para unirse al ADN y formar dímeros. El RM se une a secuencias específicas de ADN denominadas hormone response element (HRE) para regular la transcripción de genes diana (en la figura se exponen algunos de ellos). La actividad transcripcional mediada por RM puede ser aumentada o reprimida por proteínas reguladoras como steroid receptor coactivator 1 (SRC1), cAMP-response element binding protein (CBP) y transcriptional intermediary factor 1a (TIF1a), entre otros. 2. El complejo RM-ligando pueden interactuar con otros factores de transcripción como cAMP response element-binding protein (CREB) y nuclear factor of activated T-cells (NFAT), que pueden influir en la transcripción. La aldosterona también se une al RM anclado en la membrana celular por caveolina (Cav1) y estriatina transactivando receptores de membrana como epidermal growth factor receptor (EGFR), platelet derived growth factor receptor (PDGFR), insulin like growth factor receptor (IGF1R), vascular endotelial growth factor receptor (VEGFR), G protein coupled estrogen receptor (GPER) y angiotensin II receptor type I (AT1R). Todo ello promueve señales que implican, entre otros efectos, activación de cinasas. Estos eventos son responsables de los efectos rápidos, no genómicos, de la aldosterona. 3. Es posible la activación del receptor RM sin concurso del ligando. La activación de Ras-related C3 botulinum toxin substrate 1 (Rac1) por estímulos como estrés oxidativo, glucosa, AII, entre otros, puede promover la translocación del RM al núcleo y su actividad transcripcional.
Las señales genómicas de la aldosterona-RM pueden estar modificadas por señales epigenéticas y sufrir cambios postranscripcionales. También el estatus redox y la cantidad de reactive oxygen species (ROS) influyen en los procesos celulares iniciados por la activación de RM e incluso en el mecanismo de activación.
Es posible la activación y la acción transcripcional del RM sin que ocurra su unión con el ligando (aldosterona o cortisol). La activación de ras-related C3 botulinum substrate 1 (Rac1) puede producir estimulación del RM y su actividad transcripcional independientemente de la aldosterona27 (fig. 1). Rac1 es un miembro de la subfamilia RhoGTPasa que transduce señales extracelulares desde receptores acoplados a proteína G, integrinas y de factores de crecimiento a moléculas efectoras que modulan múltiples vías de señalización. Diversos estímulos, como estiramiento mecánico, citocinas inflamatorias, factores de crecimiento, glucosa, aldosterona y estrés oxidativo, entre otros, activan Rac128. Estudios in vitro evidencian que Rac1 mejora la actividad transcripcional del RM aumentando su translocación nuclear29. En estudios en modelos animales con aumento de activación de Rac1, la interacción Rac1-RM, se asocia a proteinuria y daño podocitario, sin observarse cambios en los valores de aldosterona. La intervención farmacológica con un inhibidor específico de Rac o con antagonistas del RM inhibe la hiperactividad del RM y reduce las alteraciones histológicas renales y la proteinuria29.
En cultivo de células mesangiales concentraciones elevadas de glucosa aumentan la actividad Rac1 y, además de potenciar la actividad transcripcional del RM inducida por la aldosterona, incrementan actividad transcripcional del RM en ausencia de aldosterona en el medio30. En modelos animales de nefropatía diabética relacionada con obesidad en los que hay un aumento de la concentración plasmática de aldosterona y de la actividad de Rac1 renal, la administración de un inhibidor específico de Rac suprimía Rac1 renal, disminuía la activación del RM y atenuaba el daño renal, todo ello sin cambios en la concentración de aldosterona30. En modelo murino de HTA sensible a sal, la dieta alta en sal aumenta la actividad Rac1 renal y la activación del RM a nivel renal, e induce HTA y daño renal pese a valores bajos de aldosterona plasmática. La inhibición de Rac prevenía la HTA y el daño renal. La infusión de aldosterona potenciaba la activación del RM por Rac1, evidenciando así un efecto aditivo de Rac1 y aldosterona31.
En la mayoría de estos estudios, el aumento de la actividad transcripcional de RM inducida por Rac1 se debía a un aumento de la translocación nuclear del RM. Otros mecanismos podrían estar implicados en el aumento de las señales del RM mediadas por Rac1: cambios en la cantidad y modificaciones (fosforilación, acetilación, sumoilación (small ubiquitin-related modifier) del RM, cambios en su eficacia tras su activación por modificaciones epigenéticas o reclutamiento de correguladores, entre otros28.
La modulación del RM por Rac1 independiente de aldosterona puede tener mucha relevancia no solo por potenciar la activación del RM ejercida por la aldosterona, sino también por activar el RM propiciando la disfunción de órganos en situaciones en las que la concentración plasmática de aldosterona es normal o reducida, como ocurre frecuentemente en la DM con afectación renal y en la HTA sensible a sal, entre otras circunstancias. También explicaría que el efecto de los antagonistas del RM no se correlaciona en muchas ocasiones con la concentración plasmática de aldosterona.
Efectos tubulares renales de aldosteronaLa primera acción descrita de aldosterona fue la ejercida sobre las células principales del túbulo colector renal. Tras su transporte al núcleo, el complejo aldosterona-RM interactúa con gran número de genes que codifican proteínas como la subunidad alfa del canal epitelial del sodio (ENaC) y serum and gluco-corticoid-regulated kinase 1 (SGK1), que controlan la cantidad y la actividad del ENaC en la parte apical de la membrana y de la bomba Na-K-ATPasa en la membrana basolateral. El aumento electrogénico de la reabsorción tubular de Na+ secundario a la activación del ENaC favorece la secreción de K+ por los canales renal outer medullary K+channel (ROMK)32. Hallazgos recientes demuestran que, en presencia de hipocaliemia, la aldosterona activa la pendrina, la secreción de H+ dependiente de ATPasa vacuolar y el cotransportador Na+-Cl− (NCC) sensible a tiazida33-35.
La aldosterona ejerce efectos tubulares que inciden en la arteriola aferente y, por tanto, en el filtrado glomerular (FG). Hay RM en mácula densa (MD) cuya activación por aldosterona aumenta la producción de óxido nítrico con atenuación de la respuesta del feedback túbulo-glomerular (FTG) (disminución de la respuesta vasoconstrictora de arteriola aferente inducida por el aporte de Na+ a MD)36. Por otra parte, al activar el ENaC y aumentar la reabsorción distal de Na+, induce vasodilatación de la arteriola aferente (feedback túbulo conector-glomérulo [FTCG]), que también antagoniza el FTG37,38.
Efectos vasculares de aldosteronaAdemás de este efecto indirecto sobre la hemodinámica glomerular, la aldosterona tiene impacto directo sobre la vasculatura sistémica y renal. Hay RM en el endotelio y la célula muscular lisa. En los vasos sanguíneos, regula genes implicados en la fibrosis, la calcificación y la inflamación. El grado de regulación depende de otros factores, como tipo de flujo (laminar/turbulento) y estrés oxidativo, entre otros. La activación de RM endotelial produce un aumento de la expresión del ENaC endotelial, intensifica el estrés oxidativo y la inflamación contribuyendo a la disfunción endotelial y al aumento de la rigidez arterial39,40.
En la célula muscular lisa vascular la activación de RM contribuye a la regulación del tono vascular mediante una serie de eventos (activación Src cinasa, Rho cinasa y placental growth factor [PlGF], entre otros) que inducen proliferación, fibrosis, remodelamiento y aumento de rigidez arterial26,39. Consecuentemente, la activación del RM vascular produce daño de órganos diana, HTA, disfunción vascular coronaria, fibrosis cardiaca, alteraciones de la hemodinámica renal y daño renal. Muchos de estos efectos de activación del RM no son genómicos26. Hay íntima interacción y sinergia entre efectos genómicos y no genómicos de la aldosterona de tal forma que los efectos no genómicos pueden dar soporte a acciones genómicas.
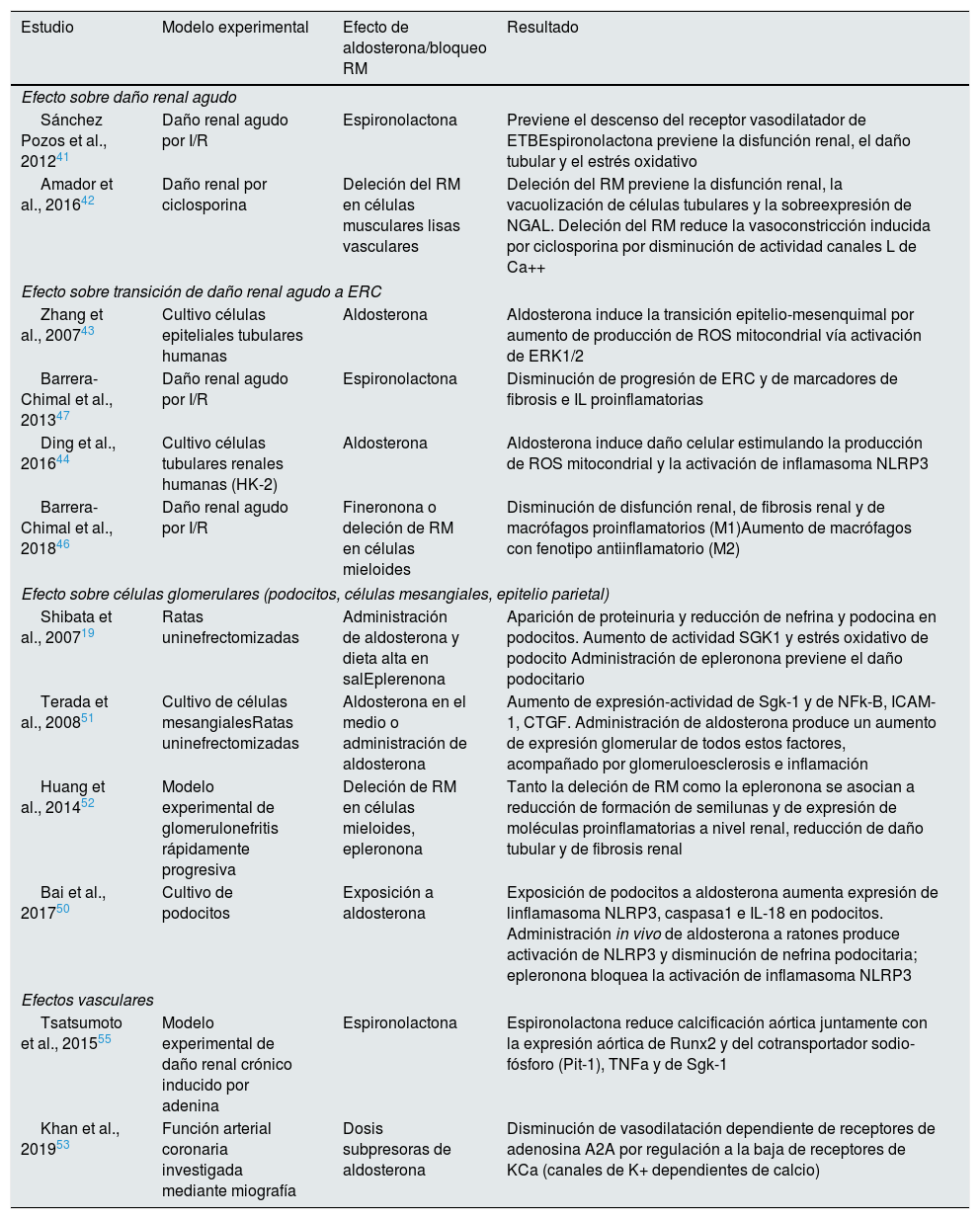
Datos experimentales de los efectos de la aldosterona y del bloqueo del RM en modelos de daño renalHay muchos estudios básicos sobre el efecto de la aldosterona y del bloqueo farmacológico o deleción del RM en modelos animales de daño renal e investigaciones in vitro con diversas células renales (tabla 2). Destacamos los más relevantes en las diferentes estructuras renales y en la vasculatura sistémica.
Algunos datos experimentales de efectos renales de aldosterona y del bloqueo/deleción del receptor mineralcorticoide (RM)
| Estudio | Modelo experimental | Efecto de aldosterona/bloqueo RM | Resultado |
|---|---|---|---|
| Efecto sobre daño renal agudo | |||
| Sánchez Pozos et al., 201241 | Daño renal agudo por I/R | Espironolactona | Previene el descenso del receptor vasodilatador de ETBEspironolactona previene la disfunción renal, el daño tubular y el estrés oxidativo |
| Amador et al., 201642 | Daño renal por ciclosporina | Deleción del RM en células musculares lisas vasculares | Deleción del RM previene la disfunción renal, la vacuolización de células tubulares y la sobreexpresión de NGAL. Deleción del RM reduce la vasoconstricción inducida por ciclosporina por disminución de actividad canales L de Ca++ |
| Efecto sobre transición de daño renal agudo a ERC | |||
| Zhang et al., 200743 | Cultivo células epiteliales tubulares humanas | Aldosterona | Aldosterona induce la transición epitelio-mesenquimal por aumento de producción de ROS mitocondrial vía activación de ERK1/2 |
| Barrera-Chimal et al., 201347 | Daño renal agudo por I/R | Espironolactona | Disminución de progresión de ERC y de marcadores de fibrosis e IL proinflamatorias |
| Ding et al., 201644 | Cultivo células tubulares renales humanas (HK-2) | Aldosterona | Aldosterona induce daño celular estimulando la producción de ROS mitocondrial y la activación de inflamasoma NLRP3 |
| Barrera-Chimal et al., 201846 | Daño renal agudo por I/R | Fineronona o deleción de RM en células mieloides | Disminución de disfunción renal, de fibrosis renal y de macrófagos proinflamatorios (M1)Aumento de macrófagos con fenotipo antiinflamatorio (M2) |
| Efecto sobre células glomerulares (podocitos, células mesangiales, epitelio parietal) | |||
| Shibata et al., 200719 | Ratas uninefrectomizadas | Administración de aldosterona y dieta alta en salEplerenona | Aparición de proteinuria y reducción de nefrina y podocina en podocitos. Aumento de actividad SGK1 y estrés oxidativo de podocito Administración de epleronona previene el daño podocitario |
| Terada et al., 200851 | Cultivo de células mesangialesRatas uninefrectomizadas | Aldosterona en el medio o administración de aldosterona | Aumento de expresión-actividad de Sgk-1 y de NFk-B, ICAM-1, CTGF. Administración de aldosterona produce un aumento de expresión glomerular de todos estos factores, acompañado por glomeruloesclerosis e inflamación |
| Huang et al., 201452 | Modelo experimental de glomerulonefritis rápidamente progresiva | Deleción de RM en células mieloides, epleronona | Tanto la deleción de RM como la epleronona se asocian a reducción de formación de semilunas y de expresión de moléculas proinflamatorias a nivel renal, reducción de daño tubular y de fibrosis renal |
| Bai et al., 201750 | Cultivo de podocitos | Exposición a aldosterona | Exposición de podocitos a aldosterona aumenta expresión de linflamasoma NLRP3, caspasa1 e IL-18 en podocitos. Administración in vivo de aldosterona a ratones produce activación de NLRP3 y disminución de nefrina podocitaria; epleronona bloquea la activación de inflamasoma NLRP3 |
| Efectos vasculares | |||
| Tsatsumoto et al., 201555 | Modelo experimental de daño renal crónico inducido por adenina | Espironolactona | Espironolactona reduce calcificación aórtica juntamente con la expresión aórtica de Runx2 y del cotransportador sodio-fósforo (Pit-1), TNFa y de Sgk-1 |
| Khan et al., 201953 | Función arterial coronaria investigada mediante miografía | Dosis subpresoras de aldosterona | Disminución de vasodilatación dependiente de receptores de adenosina A2A por regulación a la baja de receptores de KCa (canales de K+ dependientes de calcio) |
CTGF; connective tissue growth factor; ERC: enfermedad renal crónica; ETB: endotelina B; ERK1/2: extracellular signal-regulated kinases; HK-2: human kidney 2; I/R: isquemia/reperfusión; ICAM-1: intercellular adhesion molecule-1; IL: interleucinas; NFk-B: nuclear factor kappa-light chain enhancer of activated B cells; NGAL: neutrophil gelatinase-associated lipocalin; NLRP3: nucleotide-binding domain and leucine-rich repeat containing PYD-3; RM: receptor mineralcorticoide; ROS: reactive oxygen species; Runx2: runt-related transcription factor 2; Sgk-1: serum and glucocorticoid regulated kinase 1; TNFa: tumor necrosis factor alpha.
La aldosterona produce vasoconstricción renal aumentando la actividad Rho cinasa, la endotelina y los receptores AT1 de la AII. En modelos animales de daño renal por isquemia-reperfusión, la administración de espironolactona previamente al inicio de la isquemia o en el plazo de 6 h de la misma atenúa la hipoperfusión renal, reduce el estrés oxidativo y previene el daño estructural (necrosis tubular) y disminuye los marcadores de daño tubular como kidney injury molecule (KIM-1) y heat shock protein (HSP72)41. En el modelo de daño renal inducido por ciclosporina, en el que se produce vasoconstricción de la arteriola aferente, también participa el RM de las células musculares lisas vasculares modulando la fosforilación de sus proteínas contráctiles y la actividad de sus canales L de calcio. La deleción del RM de la célula muscular lisa vascular previene el daño histológico, la vacuolización de las células tubulares proximales y la sobreexpresión de neutrophil gelatinase-associated lipocalin (NGAL), marcador de daño tubular42.
Efecto sobre el intersticio renal. Producción de fibrosis intersticialSon varios los mecanismos que intervienen en la génesis de la fibrosis intersticial renal y el daño renal crónico: conversión de células tubulares en células mesenquimales, inflamación y fenómenos de una inadecuada reparación tras daño renal agudo (DRA). Se ha demostrado que todos ellos participan en los efectos profibróticos renales de la aldosterona. Células tubulares proximales humanas expuestas a aldosterona experimentan transformación epitelio-mesenquimal por activación de extracellular regulated kinases (ERK1 y 2) secundaria a generación de ROS mitocondrial43. Este aumento de ROS mitocondrial también es responsable de la activación del inflamasoma nucleotide-binding domain and leucine-rich repeat containing PYD-3 (NLRP3), con aumento de las interleucinas fibrogénicas IL-1b e IL-18 que se observa cuando células tubulares proximales HK-2 se cultivan en un medio con aldosterona. Tanto la transición mesenquimal como la activación del inflamasoma son bloqueadas por antagonistas de la aldosterona43,44.
Hay evidencias de que el DRA puede ser un factor de desarrollo de fibrosis intersticial y ERC45. Esta interconexión DRA-fibrosis intersticial está mediada, en parte, por la aparición precoz de células inflamatorias que desempeñan un papel importante en la reparación defectuosa tras el DRA. En modelo de DRA por isquemia-reperfusión finerenona, antagonista del RM, disminuye la fibrosis intersticial activando la señales mediadas por receptor IL-4, aumentando los macrófagos M2 antiinflamatorios y disminuyendo el fenotipo de macrófagos proinflamatorios46. En modelos animales de DRA por isquemia, la administración de espironolactona, antes o después de la isquemia, previene el desarrollo de ERC evitando la activación de procesos inflamatorios y profibróticos47.
Efecto sobre las células glomerularesLa aldosterona participa en las alteraciones de diversas células glomerulares que poseen RM y promueve alteraciones funcionales y estructurales del glomérulo.
El podocito es un componente fundamental de la barrera de filtración glomerular. Las alteraciones de la función y la estructura podocitaria constituyen la base fisiopatológica de muchas nefropatías glomerulares incluyendo la nefropatía diabética48. El podocito participa en el daño glomerular inducido por aldosterona. En modelos animales uninefrectomizados y alimentados con dieta rica en sal, la administración de aldosterona induce proteinuria, alteraciones estructurales del podocito y descenso de la expresión génica de las proteínas podocitarias nefrina y podocina. El daño podocitario se asocia a un aumento del estrés oxidativo y activación de SGK1. El tratamiento con epleronona previene el daño podocitario49. En cultivo de podocitos la aldosterona estimula el estrés oxidativo y la expresión de SGK1, que es inhibida por epleronona y por una superóxido dismutasa, lo que sugiere que la aldosterona modula la función podocitaria a través del estrés oxidativo y de SGK149.
El inflamasoma NLRP3 también está implicado en el daño podocitario inducido por la aldosterona. El inflamasoma activa la procaspasa 1 y esta induce la activación de la IL-1b y IL-18. En cultivo de podocitos incubados con aldosterona se observa un aumento de la expresión de NLRP3 y de su actividad (aumento de la expresión de caspasa 1 y de la concentración de IL-1b e IL-18). El aumento del estrés oxidativo participa en la activación de la NLRP3, ya que se atenúa cuando en el medio hay N-acetilcisteína50. Resultados similares se observan en experimentos in vivo. La administración de aldosterona a animales de experimentación induce también un aumento de la expresión de NLPR3 en podocitos y daño podocitario con pérdida de nefrina y podocina, alteraciones que no se observan en animales con deleción del gen NLRP350.
La aldosterona participa en la inflamación y la fibrosis glomerular que son los 2procesos fundamentales implicados en la esclerosis glomerular. Tanto in vivo como in vitro, la aldosterona estimula en el mesangio la expresión y actividad de SGK1 que interviene en la transcripción del factor de crecimiento del tejido conectivo (CTGF) y de la molécula de adhesión intercelular (ICAM-1), relacionados con la fibrosis y la inflamación glomerular, respectivamente. Estos fenómenos son atenuados por la administración de epleronona51.
La aldosterona también contribuye a la inflamación glomerular observada en las glomerulonefritis (GN) experimentales. En modelos animales de GN rápidamente progresiva, la deleción del RM en las células mieloides, al igual que la terapia con antagonistas del RM. reducen la infiltración glomerular precoz por neutrófilos y el reclutamiento glomerular más tardío de macrófagos con disminución de la expresión de citocinas proinflamatorias dependiente de aquellos, descenso del número de semilunas y una mejor preservación de función renal52.
Efectos vasculares sistémicosLa aldosterona ejerce efectos vasculares sistémicos que pueden tener importancia en la morbimortalidad CV de los pacientes con ERC. La aldosterona aumenta el estrés oxidativo, promueve cambios fenotípicos en las células musculares lisas vasculares y fibrosis de la pared vascular39.
La infusión de aldosterona en animales de experimentación empeora la función endotelial y la vasodilatación mediada por adenosina por disminución del receptor A2a dependiente de canales de K activados por calcio53. Este hecho es relevante ya que la disfunción microvascular evidenciada por descenso de la reserva coronaria mediada por A2a predice la mortalidad CV en pacientes con ERC en diálisis54.
Por otra parte, son muy frecuentes las calcificaciones vasculares en los diferentes estadios de la ERC, calcificaciones que tienen repercusiones hemodinámicas y predicen eventos CV y mortalidad. Es interesante la observación de que, en la ERC inducida por adenina en animales, modelo de calcificaciones vasculares asociadas a la uremia, la administración de espironolactona atenúa las calcificaciones vasculares por supresión de la transdiferenciación osteógenica de las células musculares lisas vasculares55.
Efectos del bloqueo del RM en la ERC. Estudios clínicosBloqueo de RM e HTAUno de los factores que incide en la aparición y progresión de la ERC es la HTA. La aldosterona favorece la retención de Na+, aumenta la volemia, produce vasoconstricción, disfunción endotelial, incrementa la rigidez arterial y altera la respuesta barorrefleja. El bloqueo del RM disminuye la presión arterial (PA)56,57. En la HTA resistente, la adición de espironolactona a la tríada terapéutica diurético-bloqueo SRA-calcioantagonista redujo la PA mucho más que cuando se añadió doxazosina o betabloqueante58.
En la ERC es frecuente la HTA resistente. Incluso en la ERC con PA bien controlada, la administración de espironolactona disminuye la velocidad de pulso, marcador de la rigidez arterial y la HVI59. El descenso de la rigidez arterial es beneficioso para el corazón por disminución de la PA sistólica central y también favorece al riñón. Ante una aorta rígida que no es capaz de amortiguar el flujo pulsátil generado por la eyección ventricular, las fluctuaciones pulsátiles se trasmitirán sin mitigar hasta los capilares en aquellos órganos en los que la resistencia es menor como el riñón. El aumento de la rigidez arterial se asocia a descenso del FG60.
Valores plasmáticos de aldosterona y expresión renal del RM en la ERCEn la ERC hay un aumento de aldosterona plasmática relacionado inversamente con el FG61. Aunque hay una relación inversa entre ingesta de Na+ y aldosterona. como ocurre en sujetos normales, en presencia de insuficiencia renal se observa una inadecuada supresión de la aldosterona62. La ERC con descenso del FG es un estado de hiperaldosteronismo relativo. La causa subyacente del aumento de aldosterona cuando disminuye el FG, y que persiste pese al bloqueo con iECA o ARA2, no está aclarada63. Existe una relación directa entre PTH/FGF23 y aldosterona, e inversa entre klotho y aldosterona64. Un descenso de los valores de klotho puede aumentar la síntesis de aldosterona15. La existencia de valores elevados imperceptibles de K+ podría también contribuir a elevación de aldosterona. En otro sentido, la asociación entre valores elevados de aldosterona y descenso del FG podría derivar de los efectos nefropáticos de aquella.
En las nefropatías proteinúricas también se ha demostrado una mayor expresión renal del RM que se correlaciona con la presencia de marcadores de inflamación65.
Todo ello, juntamente con los datos experimentales, reafirma la asociación entre ERC y aldosterona, y suscita un probable efecto nefroprotector de la disminución de los valores de aldosterona o del bloqueo de sus efectos.
Escape de aldosterona con fármacos que bloquean el SRAEl secretagogo más importante de la aldosterona es la AII. El uso y la optimización de dosis de fármacos que bloquean la generación o la acción de la AII se asocia a disminución del desarrollo y progresión de la ERC y de muerte66,67. El bloqueo dual del SRA (iECA+ARA2) reduce, comparado con la monoterapia, la proteinuria, pero se asocia a mayor riesgo de hipercaliemia68. En todos estos estudios persiste, pese a la terapia con iECA, ARA2 o su combinación, un elevado riesgo residual de progresión de ERC y de muerte.
A este riesgo residual puede contribuir el denominado «escape» de aldosterona: elevación de los valores plasmáticos de aldosterona, tras un descenso inicial, cuando se administra un bloqueante del SRA. Su frecuencia, en casos de ERC, es del 40-53%69 y se asocia a reaparición o aumento de proteinuria y descenso del FG70,71. La causa del escape de aldosterona se desconoce. Un aumento del K+ sérico y de la ACTH, una disminución del péptido natriurético auricular72 o una falta de inhibición del receptor AT1 de la AII unido a β-arrestina1 pueden contribuir al escape73. La implicación de la aldosterona en este fenómeno se refuerza por la comprobación de que la administración de espironolactona reduce la proteinuria tras su reaparición70.
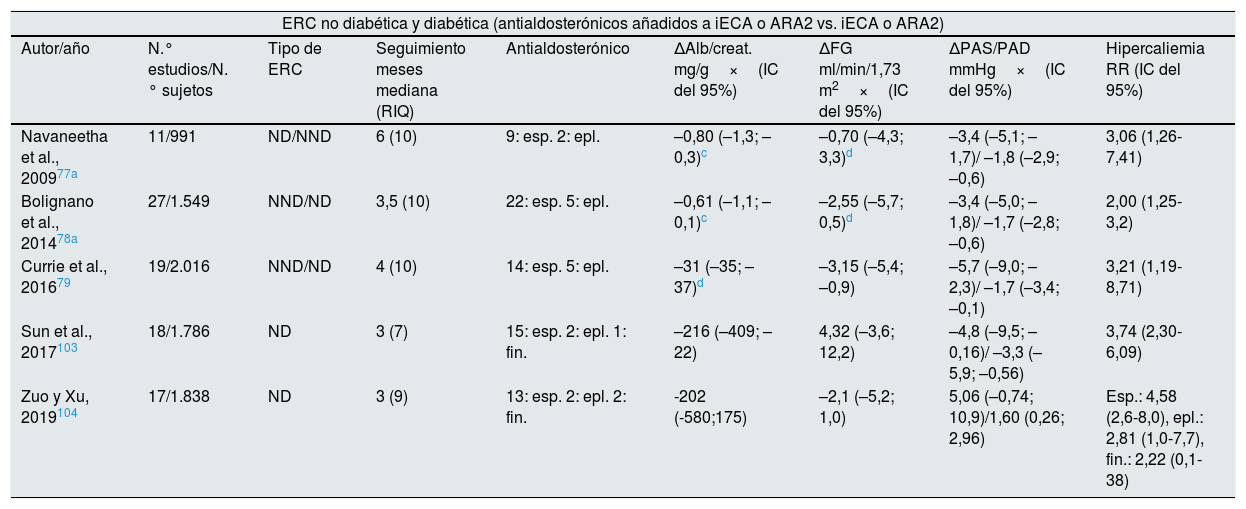
Efecto del bloqueo del RM sobre proteinuria y FG en la ERCEl primer estudio sobre el efecto de bloqueo de RM en nefropatía proteinúrica incluía a 8 enfermos. La adición de espironolactona a iECA conseguía una reducción de la proteinuria de un 45%, sin modificaciones de la PA74. En otro estudio con 165 enfermos con nefropatía proteinúrica no diabética tratados con iECA o ARA2, 25mg/día de espironolactona durante un año, reducían un 50% la proteinuria. En el grupo que recibía espironolactona se observó que el FG descendía inicialmente con posterior estabilización, mientras que en el grupo control se observó una disminución progresiva del FG75. Este patrón de comportamiento del FG remeda al comprobado con fármacos que reducen la hiperfiltración, efecto que, en caso de los bloqueantes del RM, deriva, probablemente, de su acción sobre la hemodinámica glomerular36-38. En otro estudio en sujetos en tratamiento con bloqueantes del SRA y proteinuria residual, la terapia adicional con espironolactona durante 2 años produjo una reducción progresiva de la proteinuria, que alcanzó el 63%. La evolución del FG fue mejor en aquellos en los que el descenso inicial fue mayor76. Diversos metaanálisis han demostrado que los antagonistas de aldosterona añadidos a iECA o ARA2 producen una disminución significativa de la proteinuria, reducción de la PA y un aumento del riesgo de hipercaliemia (tabla 3)77-79.
Metaanálisis de efectos renales y sobre la mortalidad de antialdosterónicos en la ERC
| ERC no diabética y diabética (antialdosterónicos añadidos a iECA o ARA2 vs. iECA o ARA2) | ||||||||
| Autor/año | N.° estudios/N.° sujetos | Tipo de ERC | Seguimiento meses mediana (RIQ) | Antialdosterónico | ΔAlb/creat. mg/g×(IC del 95%) | ΔFG ml/min/1,73 m2×(IC del 95%) | ΔPAS/PAD mmHg×(IC del 95%) | Hipercaliemia RR (IC del 95%) |
| Navaneetha et al., 200977a | 11/991 | ND/NND | 6 (10) | 9: esp. 2: epl. | –0,80 (–1,3; –0,3)c | –0,70 (–4,3; 3,3)d | –3,4 (–5,1; –1,7)/ –1,8 (–2,9; –0,6) | 3,06 (1,26-7,41) |
| Bolignano et al., 201478a | 27/1.549 | NND/ND | 3,5 (10) | 22: esp. 5: epl. | –0,61 (–1,1; –0,1)c | –2,55 (–5,7; 0,5)d | –3,4 (–5,0; –1,8)/ –1,7 (–2,8; –0,6) | 2,00 (1,25-3,2) |
| Currie et al., 201679 | 19/2.016 | NND/ND | 4 (10) | 14: esp. 5: epl. | –31 (–35; –37)d | –3,15 (–5,4; –0,9) | –5,7 (–9,0; –2,3)/ –1,7 (–3,4; –0,1) | 3,21 (1,19-8,71) |
| Sun et al., 2017103 | 18/1.786 | ND | 3 (7) | 15: esp. 2: epl. 1: fin. | –216 (–409; –22) | 4,32 (–3,6; 12,2) | –4,8 (–9,5; –0,16)/ –3,3 (–5,9; –0,56) | 3,74 (2,30-6,09) |
| Zuo y Xu, 2019104 | 17/1.838 | ND | 3 (9) | 13: esp. 2: epl. 2: fin. | -202 (-580;175) | –2,1 (–5,2; 1,0) | 5,06 (–0,74; 10,9)/1,60 (0,26; 2,96) | Esp.: 4,58 (2,6-8,0), epl.: 2,81 (1,0-7,7), fin.: 2,22 (0,1-38) |
| ERC avanzada en terapia con diálisis (antialdosterónicos vs. placebo o terapia convencional) | |||||||
|---|---|---|---|---|---|---|---|
| Autor/año | N.° estudios/N.° sujetos | Seguimiento meses mediana (RIQ) | Antialdosterónico | Mortalidad CV RR (IC del 95%) | Mortalidad de cualquier causa RR (IC del 95%) | Hipercaliemia RR (IC del 95%) | Ginecomastia RR (IC del 95%) |
| Li et al., 2019117 | 10/1.172 | 6 (18) | 9: esp. 1: epl. | 0,42 (0,26-0,65) | 0,46 (0,32-0,66) | 1,70 (1,0-2,9) | 8,0 (2,4-26) |
| Quach et al., 2016116 | 9/829 | 6 (20) | 8: esp. 1: epl. | 0,34 (0,15-0,75) | 0,40 (0,23-0,69) | 3,05 (1,2-7,7) | 5,6 (1,3-24)b |
Alb/creat: albúmina/creatinina en orina; ARA2: antagonista del receptor de angiotensina II; RIQ: rango intercuartil; Epl: eplerenona; ERC: enfermedad renal crónica; esp: espironolactona; iECA: inhibidor del enzima de conversión de angiotensina; ND: nefropatía diabética; NND: nefropatía no diabética; PAS: presión arterial sistólica; PAD: presión arterial diastólica; RR(IC): riesgo relativo (intervalo de confianza).
En un análisis de una base de datos de sujetos con ERC en estadios 3-4, el estudio comparativo, tras el ajuste adecuado de variables, entre los que recibían espironolactona (n = 693) y los que no la recibían (n= 1386) mostró que aquellos tenían menos progresión a ERC que requería diálisis (hazard ratio [HR] 0,66; IC del 95%, 0,51-0,84; p<0,001) y mayor riesgo de hospitalización por hipercaliemia (HR 3,17; IC del 95%, 2,41–4,17; p <0,001)80.
Recientemente, se ha observado un probable efecto nefroprotector del inhibidor del cotransportador sodio-glucosa tipo 2 (iSGLT2) dapagliflozina en la ERC no diabética. El ensayo clínico DAPA-CKD (The effect of dapagliflozin on renal outcomes and cardiovascular mortality in patients with chronic kidney disease)81 incluyó a 4.245 sujetos con ERC en estadios 2-4 y un aumento de excreción urinaria de albúmina, con dosis máxima tolerada de iECA o ARA2. Los pacientes se aleatorizaron a dapagliflozina 10mg/día o placebo. El objetivo primario fue el compuesto por un descenso del FG≥50%, ERC avanzada (FG<15ml/min, diálisis o trasplante renal) y muerte CV o renal. El 30 de marzo del 2020 se comunicó la interrupción del ensayo al observarse, antes de lo previsto, probables beneficios en la rama de la dapagliflozina. Aunque los resultados no están publicados, parece presumible atribuir la suspensión precoz del ensayo a la superioridad de dapagliflozina en la reducción de eventos.
Uno de los mecanismos implicados en el efecto nefroprotector de los iSGLT2 es la disminución de la presión intraglomerular secundaria a la vasoconstricción de la arteriola aferente inducida por el aumento de aporte de Na+ a la MD82. La coadministración con iECA o ARA2, al disminuir la vasoconstricción de la arteriola eferente, potenciaría el descenso de la presión intraglomerular. Teóricamente, la toma de diuréticos de asa, al inhibir la reabsorción de Na+ en MD, podría aminorar el efecto hemodinámico renal de los iSGLT2. Sin embargo, la coadministración de antialdosterónicos, al disminuir la reabsorción distal de Na+, inhibe el feedback túbulo conector-glomérulo, induciendo vasoconstricción de la arteriola aferente y potenciando el efecto de los iSGLT2 sobre la hemodinámica glomerular36,37,83. Así, la toma conjunta de iECA o ARA2, iSGLT2 y antagonistas del RM podría potenciar el efecto nefroprotector. Es necesario realizar estudios que exploren esta hipótesis.
El efecto de los bloqueantes del RM sobre eventos CV y mortalidad en la ERC se analiza en el ensayo clínico BARACK D84(Benefits of aldosterone receptor antagonism in chronic kidney disease), actualmente en realización, y con seguimiento de 3 años (tabla 4).
Ensayos clínicos fase iii, actualmente en realización, de bloqueantes de receptor mineralcorticoide en ERC
| Identificador/acrónimo/fecha consulta | Población estudiada | Fármacos comparados | Objetivo 1.° |
|---|---|---|---|
| Eudract: 2012-002672-13/BARACK D/12-.04-202084 | ERC estadio 3b (FGe 30-44 ml/min/1,73 m2) | Terapia convencional + espironolactona 25 mg/día vs. terapia convencional | Mortalidad y eventos CV |
| NCT01848639/ALCHEMIST/12-.04-2020118 | ERC avanzada en hemodiálisis + DM2 o ↓ FE o historia evento CV o HVI | Espironolactona 25 mg/día vs. placebo | IM no fatal/ictus no fatal/síndrome coronario agudo/hospitalización por IC/muerte CV |
| NCT03020303/ACHIEVE/12-04-2020119 | ERC avanzada en diálisis | Espironolactona 25 mg/día vs. placebo | Muerte CV/hospitalización por insuficiencia cardiaca |
| Eudract:2015-002168-17/FINESSE HF 12-04-2020125 | ICC con reducida FE + DM o ERC | iECA o ARA2 + finerenona 10-20 mg/día vs. iECA o ARA2 + eplerenona 25-50 mg/día | Muerte CV/hospitalización por insuficiencia cardiaca |
| NCT02540993/FIDELIO-DKD /12-04-2020149 | DM2 con enfermedad renal diabética y dosis máxima tolerada de iECA o ARA2 | Finerenona 10-20 mg/día vs. placebo | Desarrollo de ERC avanzada/↓ sostenida de FGe ≥ 40%/muerte renal |
| NCT02545049 /FIGARO-DKD /12-04-2020150 | DM2 con enfermedad renal diabética y dosis máxima tolerada d iECA o ARA2 | Finerenona 10-20 mg/día vs. placebo | Muerte CV/eventos CV no fatales |
ARA2: antagonistas del receptor de angiotensina II; CV: cardiovascular; DM: diabetes mellitus; DM2: diabetes mellitus tipo 2; ERC: enfermedad renal crónica; FE: fracción de eyección; FGe: filtrado glomerular estimado; HVI: hipertrofia ventricular izquierda; ICC: insuficiencia cardiaca congestiva; iECA:inhibidores de enzima de conversión de angiotensina; IM:infarto de miocardio.
La mayoría de los estudios referidos incluyeron subgrupos de enfermos con DM2. Hay, sin embargo, otros que han analizado específicamente el efecto del bloqueo de RM en la nefropatía diabética.
Se ha examinado el efecto de iECA, ARA2, fármacos antirrenina o combinación de ellos sobre las diferentes fases de desarrollo de la nefropatía diabética85-94. Comparados con terapia antihipertensiva convencional, los ARA2 reducen el riesgo de progresión de la enfermedad renal y de mortalidad. Sin embargo, persiste un elevado riesgo residual para estos eventos93,94.
La combinación iECA-espironolactona, comparada con la combinación iECA-ARA2, produce mayor descenso de la proteinuria, similares efectos sobre la PA y el FG, y valores más elevados de K+ sérico95.
En la DM2 es frecuente la presencia de valores séricos reducidos de renina y aldosterona96,97 por lo que, en esta situación, parecería razonable predecir una atenuada respuesta a los antagonistas de aldosterona. Sin embargo, tanto en animales con diabetes experimental como en sujetos con DM2, la administración de espironolactona reduce las alteraciones podocitarias y la proteinuria98,99. En modelo experimental de ratas diabéticas con hipoaldosteronismo, la administración de espironolactona previene el estrés oxidativo, la apoptosis podocitaria y la proteinuria. In vitro, la glucosa, a través del RM, aumenta la actividad NADPH oxidasa, la generación de ROS y la expresión de SGK1, y produce daño podocitario, todo ello inhibido por espironolactona100. El aumento de la actividad de AS podocitaria y de Rac1 podrían mediar la activación del RM por la glucosa, independiente de la aldosterona sistémica28,29,101,102. Por tanto, aún en situaciones de valores reducidos de aldosterona plasmática, la administración de antagonistas de RM puede ser útil para protección renal.
Varios metaanálisis evidenciaron que la coadministración de antagonista de aldosterona con iECA o ARA2, frente monoterapia con iECA o ARA2, en sujetos con nefropatía diabética, reducía la albuminuria y la PA, además de un aumento del riesgo de hipercaliemia que era menor con finerenona, antagonista de la aldosterona de 3.ª generación103,104 (tabla 3).
Aunque los estudios citados tienen algunas limitaciones, se puede concluir que en la ERC diabética y no diabética leve-moderada (estadios 2-3) con proteinuria, la adición de antagonistas de aldosterona a iECA o ARA2, comparado con monoterapia con iECA o ARA2, reduce la proteinuria y la PA, y aumenta el riesgo de hipercaliemia.
En los pacientes con DM2, es muy importante la prevención del desarrollo de nefropatía. Un adecuado control metabólico, de los valores de PA, del peso, los iECA o ARA2 y los iSGLT2 son eficaces para reducir la aparición de albuminuria en pacientes con DM2105-107. En el ensayo clínico PRIORITY (Proteomic prediction and renin angiotensin aldosterone system inhibition prevention of early diabetic nephropathy in type 2 diabetic patients with normoalbuminuria)108, 1.175 sujetos con DM2 y normoalbuminuria fueron clasificados, mediante un panel de biomarcadores proteómicos de orina (CKD273), en alto y bajo riesgo de desarrollo de albuminuria. Los 216 sujetos clasificados como riesgo elevado fueron aleatorizados a terapia convencional más espironolactona 25mg/día y a terapia convencional más placebo. El seguimiento fue de 2,57 años y el objetivo primario fue el desarrollo de albuminuria. Los resultados se presentaron en la 55.ª reunión de la European Association for the Study of Diabetes (EASD), celebrada en Barcelona, en septiembre del 2019. No se observó una reducción significativa de la aparición de albuminuria, aunque había alguna sugerencia de beneficio de espironolactona a partir del último año. La tasa de K+ sérico >5,5 mEq/l fue más elevada en el grupo con espironolactona.
Hay abundante evidencia del beneficio renoprotector de los iSGLT2 en la DM2109-111. Dados juntamente con iECA o ARA2, disminuyen el desarrollo y la progresión de nefropatía en la DM2. Hay consideraciones fisiopatológicas, incluso con más fuerza argumental que la comentada en la ERC, que suscitan la posibilidad de que la triple combinación antagonistas de aldosterona, IECA o ARA2 e iSGLT2 ofrezca mayor protección en la nefropatía diabética33,34,82,83.
Bloqueo del RM en pacientes con ERC en terapia con diálisisUn aspecto notable en los sujetos con ERC tratados con HD son las frecuentes calcificaciones vasculares. En un pequeño estudio de 5 sujetos con ERC tratados con HD, la toma de 50mg/día de espironolactona durante 3 años produjo un descenso significativo de las calcificaciones aórticas112.
Mediante estudios de biopsia peritoneal se ha demostrado que la administración de 25mg/día de espironolactona en sujetos con ERC tratados con diálisis peritoneal (DP) se asociaba, en comparación con placebo, a una menor cantidad de colágeno tipo iv y de linfocitos CD20 en el peritoneo113. Un menor grado de fibrosis puede mejorar la funcionalidad peritoneal en estos enfermos.
Al margen de estos hechos, el uso de antagonistas de aldosterona en enfermos con ERC tratados con diálisis es relevante, ya que en ellos se ha demostrado una asociación entre valores plasmáticos de aldosterona y mortalidad, incluyendo la muerte súbita114.
Uno de los estudios más amplios es el DOHAS (Dialysis outcomes heart failure aldactone study)115, en el que 309 sujetos en HD se aleatorizaron a 25mg/día de espironolactona o a terapia convencional. Tras 3 años, se observó una reducción muy importante de mortalidad o ingreso por eventos CV (HR 0,40; IC del 95%, 0,20-0,80; p=0,017) en el grupo de espironolactona. Un 1,9% de los sujetos tratados con espironolactona presentó hipercaliemia severa y un 10,2%, ginecomastia o mastodinia.
Resultados similares se obtuvieron en 2metaanálisis que incluyeron a pacientes en HD y en DP en los que se comparó el efecto de antagonistas de aldosterona frente a placebo o terapia convencional116,117 (tabla 3).
Es llamativa la gran reducción de eventos CV y de mortalidad total conseguidos por los antagonistas de la aldosterona en pacientes con ERC en diálisis si los comparamos con los observados en sujetos con ERC que no están en diálisis. Sin embargo, hay que tener en cuenta las limitaciones de los estudios incluidos (un diseño abierto de algunos, escaso número de pacientes, un seguimiento corto, pocos eventos de mortalidad CV, así como mucha variabilidad del riesgo relativo demostrada por análisis de sensibilidad). Todo ello permite afirmar que, actualmente, no hay una evidencia definitiva del beneficio de los antagonistas del RM en pacientes en diálisis. Pueden aportar más certidumbre 2ensayos aleatorizados, actualmente en marcha: uno de ellos, ALCHEMIST (Aldosterone antagonist chronic hemodyalisis interventional survival trial), incluye a 825 sujetos de alto riesgo vascular, con insuficiencia renal en tratamiento con HD. Su duración será de 2 años y el objetivo primario es analizar el efecto de espironolactona 25mg/día frente a placebo sobre eventos y muerte CV118. El otro ensayo, ACHIEVE (Aldosterone blockade for health improvement evaluation in end-stage renal disease), trata de determinar si la espironolactona 25mg/día, en comparación con placebo, reduce la mortalidad y la hospitalización por IC en 2.750 enfermos con ERC en tratamiento con diálisis119 (tabla 4).
Antagonistas del RM en IC con ERCLos beneficios de los antagonistas del RM en sujetos con insuficiencia cardiaca con reducción de la FE están bien establecidos7-9. Incluso en la IC con FE preservada pueden reducir los ingresos por insuficiencia cardiaca120. Más del 50% de pacientes con insuficiencia cardiaca tienen ERC y su mortalidad aumenta con la intensidad de descenso del FG121. Un gran porcentaje de pacientes con insuficiencia cardiaca y ERC no reciben terapia con bloqueantes del RM por temor a la hipercaliemia122. En el ensayo RALES el riesgo relativo de mortalidad total y hospitalización por insuficiencia cardiaca en sujetos tratados con espironolactona y con disminución del FG fue similar al de los que tenían un FG normal (0,68, IC del 95%, 056-0,84 y 0,64; IC del 95%, 0,52-0,72 frente a 0,71, IC del 95%, 0,57-0,90 y 0,67, IC del 95%, 0,56-0,81, respectivamente). La reducción del riesgo absoluto de mortalidad e ingreso por insuficiencia cardiaca fue mayor en presencia de insuficiencia renal. Como era de esperar, los antagonistas de aldosterona produjeron con más frecuencia hipercaliemia cuando el FG estaba reducido (el 25,6% frente al 15,4%)123.
Los bloqueadores no esteroideos del RM con mejor perfil de seguridad (menos hipercaliemia) y los nuevos ligadores intestinales de K+ pueden facilitar el uso de antagonistas de aldosterona en sujetos con insuficiencia cardiaca y ERC121,124.
El ensayo clínico FINESSE, actualmente en ejecución, compara el efecto de finerenona frente a eplerenona en la mortalidad CV y el ingreso por insuficiencia cardiaca en sujetos con insuficiencia cardiaca crónica con FE reducida y DM2 o ERC125 (tabla 4).
Antagonistas del RM e hipercaliemiaEn contraste a la consistente evidencia del beneficio CV y en mortalidad de los antagonistas de aldosterona en cardiología7-9, hay pocos estudios específicos del efecto de estos fármacos sobre estos eventos en nefrología. Es posible que uno de los efectos de estos fármacos, la hipercaliemia, especialmente en situación de insuficiencia renal, haya sido un freno para un uso frecuente de estos fármacos en la ERC.
La combinación de antagonistas de aldosterona con iECA o ARA2 aumenta el riesgo de hipercaliemia. como se ha observado en ensayos clínicos y en los estudios de vida real104,116,126.
Este hecho tiene importancia ya que, en las condiciones frecuentemente asociadas con discaliemia, como insuficiencia cardiaca, DM y ERC, existe una relación en U entre valores séricos de K+ y mortalidad127.
En sujetos con menos capacidad de excreción urinaria de K+ por disminución de diuresis los antagonistas de aldosterona también aumentan el K+ sérico. Comparados con sujetos con función renal normal, los pacientes con ERC severa tienen un aumento de la expresión de canales de K+(canales BK) en los enterocitos del colon que aumenta su capacidad para la eliminación intestinal de K+128. La aldosterona estimula la secreción colónica de K+ a través de los canales BK, secreción que es inhibida por espironolactona129,130.
La asociación de antagonistas de aldosterona con iECA o ARA2 contribuye a hipercaliemia, pero en estos enfermos también puede haber otras causas de la elevación del K+ sérico131.
Ante la aparición de hipercaliemia en sujetos que reciben bloqueadores del SRAA por procesos en los que estos han demostrado beneficio, con frecuencia se reduce la dosis de aquellos, incluso se suprimen. Este hecho puede condicionar un aumento de eventos CV y renales, y de mortalidad132. Es probable que con el uso de los nuevos ligadores orales de K+ como patirómero y ciclosilicato de zirconio mejore la tolerabilidad y se minimice la desprescripción de los bloqueantes del SRAA133-135. Por otra parte, los nuevos antagonistas no esteroideos de la aldosterona (ANEA) inducen menos hipercaliemia que los antagonistas clásicos136.
Antagonistas no esteroideos de la aldosteronaLa mayoría de los estudios con antagonistas de aldosterona han usado los antagonistas esteroideos clásicos: la espironolactona, que tiene poca especificidad de acción en el RM, y la eplerenona, que es más selectiva.
Los ANEA tienen una estructura química distinta de la de los esteroideos, lo que determina diferencias en las propiedades físico-químicas, las acciones farmacológicas, la distribución y la penetración tisular, el modo de acoplamiento al ligando y la capacidad de unirse a correguladores, entre otras137. Todo ello puede condicionar efectos especiales en la protección de órganos y atenuación de los efectos adversos.
Hasta la fecha se han probado 7 ANEA en ensayos clínicos en diferentes fases, siendo discontinuados por diversas razones algunos de ellos. Otros han completado ensayos fase 1 o están reclutando enfermos en fase 2138-141.
Los ANEA más avanzados son: apararenona (MT3995, Mitsubishi Tanabe Pharma Corporation, Osaka, Japón), exaserenona (CS3150, Exelisis, California, EE. UU., y Daiichi Sankio, Tokio, Japón) y finerenona.
La apararerona ha completado un ensayo clínico fase 2 en sujetos con nefropatía diabética142. La esaxerenona, cuya concentración inhibitoria máxima del 50% (IC50) de la activación transcripcional del RM es 9,4nM, es un inhibidor más potente, más selectivo y específico que espironolactona y epleronona. En un ensayo clínico aleatorizado ha demostrado ser efectiva y bien tolerada en pacientes con HTA143.
La finerenona tienen una IC50 de 18nM (mucho menor que la espironolactona y la eplerenona y, por tanto, más potente). Es mucho más selectiva para el RM que la espironolactona y la epleronona y, a diferencia de aquellos que se distribuyen predominantemente en el riñón, la finerenona lo hace por igual en el riñón y el corazón136.
Estudios experimentales demuestran que la finerenona produce protección renal y vascular, disminuyendo el estrés oxidativo y atenuando la disfunción endotelial, entre otros efectos144,145.
En el ensayo clínico ARTS (The mineralocorticoid receptor antagonist tolerability study), en el que se incluyeron 782 pacientes con insuficiencia cardiaca con reducción de la FE y ERC en estadios 2-3, fineronona en dosis de 5-10mg/día, comparada con espironolactona 25-50mg/día, produjo igual efecto sobre la reducción del NT-pro-BNP y de la albuminuria, menor deterioro de la función renal y menos elevación del K+ sérico con más baja incidencia de hipercaliemia (5% vs. 13%)146.
En una población similar, la finerenona en diferentes dosis, comparada con epleronona 25-50mg/día, produjo similar reducción de NT-pro-BNP y un menor aumento del K+ sérico y en dosis de 20mg/día, una mayor reducción de eventos CV y mortalidad si bien, al ser un estudio de corta duración, estas variables fueron consideradas como exploratorias147.
En el ensayo ARTS-DN (Mineralcorticoid receptor antagonist tolerability study-diabetic nephropathy), 823 pacientes con nefropatía diabética tratados con bloqueadores del SRA (iECA o ARA2) fueron aleatorizados a diferentes dosis de finerenona o a placebo. El objetivo principal fue la modificación de la proteinuria. La fineronona indujo una reducción significativa dependiente de la dosis de la proteinuria (reducción de 50% de proteinuria en el 40% de enfermos con 20mg/día), con un ligero descenso no significativo del FG, reversible tras suspender el fármaco, y disminución de la PA. Se observó una baja frecuencia de hipercaliemia (K+> 5,6 mEq/l) (1,6% del grupo tratado con 20mg/día de finerenona frente al 1,5% del grupo placebo)148.
Estos estudios a corto plazo analizan el efecto de los ANEA sobre variables intermedias. Los antagonistas clásicos del RM han conseguido, en los sujetos con insuficiencia cardiaca y FE reducida, beneficios relacionados con eventos CV y con la mortalidad pese a un aumento de hipercaliemia. La activación de RM produce, por diversos mecanismos ya comentados en esta revisión, efectos cardiorrenales nocivos. Es posible que con los ANEA, con una teórica mayor capacidad protectora cardiorrenal y con menos riesgo de hipercaliemia, se obtengan beneficios en variables CV y renales, clínicamente importantes.
La respuesta definitiva la aportarán 2 ensayos clínicos con finerenona, actualmente en realización. El ensayo FIDELIO-DKD (Finerenone in reducing kidney failure and disease progression in diabetic kidney disease) investiga la eficacia de la finerenona en comparación con placebo, para reducir eventos importantes renales y CV en sujetos con DM2 y ERC tratados con iECA o ARA2. El objetivo primario es el tiempo para la aparición de enfermedad renal avanzada, un descenso sostenido del FGe≥ 40% o muerte renal149. Se aleatorizó a 5.734 pacientes finalizando el seguimiento en 2020, año en el que se espera la publicación de los resultados.
En el FIGARO-DKD (Finerenone in reducing CV mortality and morbidity in diabetic kidney disease) se investigan, en sujetos con DM2 y ERC, la eficacia y la seguridad de finerenona comparada con placebo, para reducir eventos CV y renales clínicamente relevantes150. El objetivo primario es el compuesto por muerte CV, infarto de miocardio no fatal, ictus no fatal y hospitalización por insuficiencia cardiaca. Se reclutaron a 7.437 pacientes, actualmente en seguimiento, esperando resultados para el 2021.
Conceptos clave- 1.
Además de los sitios clásicos, como túbulo renal distal y conector, y colon, hay RM en otras localizaciones, como podocito, mesangio, mácula densa, endotelio, célula muscular lisa vascular, miocardiocito, adipocito, macrófago, entre otros. En determinadas situaciones, el RM puede ser activado por mecanismos independientes de la aldosterona.
- 2.
La activación del RM por la aldosterona aumenta la reabsorción tubular renal distal de Na+ y la secreción de K+. Además de efectos hemodinámicos sistémicos (aumento de la PA y de la rigidez arterial), la aldosterona modifica la hemodinámica intraglomerular por modulación de los feedbacks túbulo-glomerular y túbulo conector-glomérulo.
- 3.
La activación del RM vascular (endotelio, fibra muscular lisa) produce un aumento del estrés oxidativo, disfunción endotelial, fibrosis, remodelamiento vascular y aumento de la rigidez arterial.
- 4.
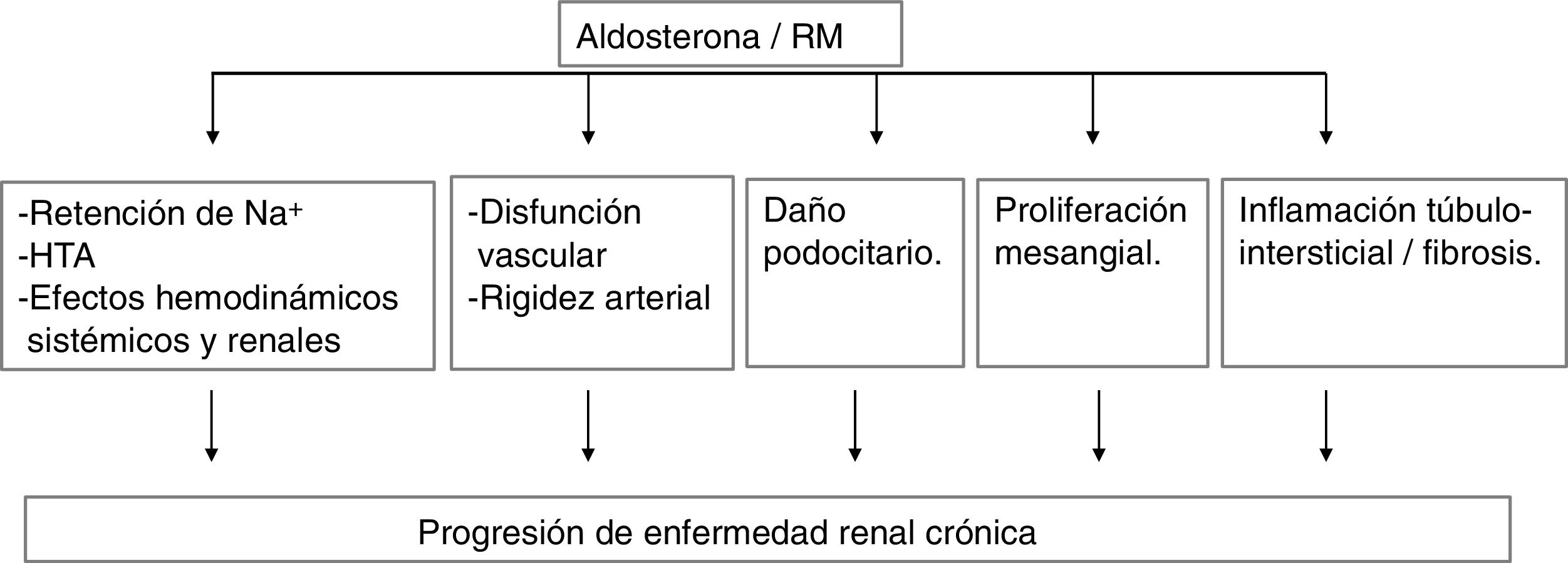
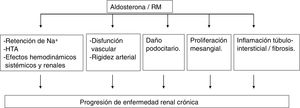
En modelos experimentales, la aldosterona y la activación del RM produce daño renal por diversos mecanismos (fig. 2)
- 5.
En la ERC con disminución del FG y proteinuria, hay un aumento de los valores plasmáticos de aldosterona y de la expresión renal de RM.
- 6.
Un porcentaje elevado de sujetos con ERC tratados con iECA o ARA2 presenta escape de aldosterona, lo que se asocia a reaparición o aumento de la proteinuria y mayor descenso del FG.
- 7.
Muchos estudios de corto seguimiento han demostrado que en la ERC diabética y no diabética, con proteinuria, los antagonistas clásicos de la aldosterona (espironolactona, eplerenona) reducen la proteinuria y aumentan el riesgo de hipercaliemia. Hay varios ensayos clínicos actualmente en realización que tratan de estudiar el efecto de la administración de espironolactona sobre mortalidad y eventos CV en sujetos con ERC estadios 3b y 5d.
- 8.
Los iECA y los ARA2, y los iSGLT2 asociados a aquellos, han demostrado mejorar la nefroprotección en nefropatía diabética y no diabética. Hay consideraciones fisiopatológicas que suscitan la posibilidad de que la combinación iECA o ARA2, iSGLT2 y bloqueadores del RM potencie la nefroprotección.
- 9.
Comparados con los bloqueadores esteroideos del RM, los nuevos bloqueadores no esteroideos del RM tienen mayor potencia y selectividad, y producen menor elevación del K+ sérico. Los ensayos clínicos actualmente en marcha (FIGARO-DCK y FIDELIO-DCK) determinarán si en sujetos con DM2 y nefropatía y con dosis máxima tolerada de iECA o ARA2, el bloqueador no esteroideo del RM, finerenona, 10-20mg/día, reduce la mortalidad, los eventos CV y la progresión de la enfermedad renal.
El Dr. Pablo Gómez-Fernández ha participado como investigador principal en los siguientes ensayos, patrocinados por Bayer.
- –
Mineralocorticoid receptor antagonist tolerability study-diabetic nephropathy (ARTS-DN; ClinicalTrials.gov identifier NCT01874431).
- –
Finerenone in reducing kidney failure and disease progression in diabetic kidney disease (FIDELIO-DKD, ClinicalTrials.gov identifier: NCT02540993).
- –
Finerenone in reducing CV mortality and morbidity in diabetic kidney disease (FIGARO-DKD; ClinicalTrials.gov identifier NCT02545049).