INTRODUCCIÓN
La insuficiencia renal aguda (IRA) es uno de los temas de mayor interés en el campo de la Nefrología, tanto por su incidencia, como por su elevada mortalidad y el elevado coste que genera. El año 2008 ha sido muy productivo en estudios y revisiones sistemáticas que han permitido profundizar en algunos aspectos muy relevantes de la IRA, como son la validación de las últimas clasificaciones propuestas, la utilidad de distintos biomarcadores en el diagnóstico precoz y en el pronóstico de la IRA, los interrogantes que todavía existen en cuestiones tan trascendentes sobre el tipo y la dosis de diálisis a administrar al paciente con IRA, así como la estrecha relación con la enfermedad renal crónica (ERC) que se está empezando a poner de manifiesto. En esta revisión, recogemos los estudios publicados en el año 2008 que, a nuestro criterio, son más relevantes en estos aspectos del fracaso renal agudo.
DEFINICIÓN Y CLASIFICACIÓN
Las guías de la Sociedad Española de Nefrología (S.E.N.) sobre la actuación en el fracaso renal agudo publicadas en 2007 constituyen una excelente revisión de la evidencia disponible hasta la fecha de su publicación en los aspectos más relevantes de la IRA. En estas guías se reconocía que hasta esa fecha no existía todavía una definición universalmente aceptada para la insuficiencia renal aguda1.
En el año 2004, el grupo de trabajo ADQI (Acute Dialysis Quality Initiative) publicó la clasificación RIFLE (Risk, Injury, Failure, Loss, ESRD) de la IRA. Posteriormente, en el año 2007 un nuevo grupo de trabajo, AKIN (Acute Kidney Injury Network), formado por la mayoría de los constituyentes del ADQI, publicó una definición y una nueva clasificación de la insuficiencia renal aguda en tres estadios, AKI 1, 2 y 32. La definición de IRA, según este grupo AKIN, sería el «súbito (en 48 horas) descenso en la función renal definida como:
- El incremento absoluto de la creatinina sérica (Crs) superior o igual a 0,3 mg/dl (basado en estudios recientes que avalan que pequeños incrementos en la Crs se asocian a una mayor mortalidad a corto y largo plazo).
- Un incremento porcentual de la Crs superior o igual al 50% (1,5 veces el basal).
- Oliguria documentada inferior a 0,5 ml/kg/h durante más de 6 horas».
Las diferencias entre las clasificaciones AKIN y RIFLE se recogen en la tabla 1.
El valor predictivo de la clasificación RIFLE se ha confirmado en una revisión sistemática publicada en el año 2008 que incluye 16 estudios con un total de 71.527 pacientes y en la que se refleja claramente que el riesgo relativo (RR) de mortalidad aumenta a medida que empeora la IRA (RR frente a no IRA de 2,4, 4,15 y 6,37 en los grados R, I y F de la clasificación RIFLE)3. En el momento actual, la controversia está en qué clasificación, AKIN o RIFLE, es mejor como predictora de mortalidad. En un trabajo reciente con 120.123 pacientes de unidades de cuidados intensivos de Australia y Nueva Zelanda no hubo diferencias en el valor pronóstico de las dos clasificaciones4, mientras que en otro trabajo con 22.303 adultos en unidades de cuidados intensivos del Reino Unido y Alemania el grado 3 de la clasificación AKIN fue superior como predictor de mortalidad que el grado F de la clasificación RIFLE5. En los próximos años la controversia estará resuelta y dispondremos de una clasificación que, al igual que ha ocurrido con la ERC, permitirá unificar criterios y comparar resultados.
BIOMARCADORES
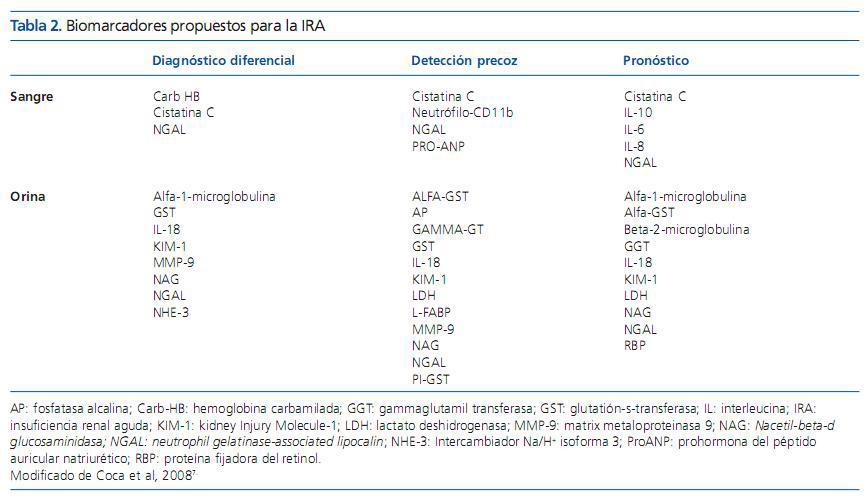
En la fisiopatología de la IRAhay inicialmente una situación de riesgo, seguida de un daño renal que, de poder detectarse precozmente, esto es antes de que se haga clínicamente evidente (por la elevación de la Crs o por la aparición de oliguria), podría beneficiarse de una intervención precoz. La búsqueda de este biomarcador o «troponina renal» ha sido objeto de múltiples revisiones en el año 2008. Se sabe que la Crs es un marcador que se eleva de forma tardía en el curso de la IRAy que está muy influenciada por muchos factores extrarrenales (peso, edad, raza, sexo, volumen corporal total, metabolismo proteico, entre otros), por lo que es un parámetro mediocre. El biomarcador ideal de la IRA sería aquel de alta sensibilidad y especificidad, fácil de cuantificar, reproducible, barato, específico para el riñón, que aparezca precozmente en el curso del fracaso renal, que permita determinar la gravedad de este fracaso y, por último, que sea capaz de predecir el riesgo en subgrupos determinados. Se han propuesto muchos biomarcadores, tanto en sangre como en orina (resumidos en la tabla 2), que en determinados contextos han demostrado su utilidad para el diagnóstico diferencial de situaciones prerrenales frente a la IRA establecida, para la detección precoz y para el pronóstico6. En una revisión sistemática reciente se analizaron más de 20 de estos marcadores, y los autores concluyeron que, hasta la fecha, no hay un biomarcador ideal que sirva para todas la poblaciones y que sea reproducible en la mayoría de las situaciones de riesgo para desarrollar una IRA. Y lo más importante, se desconoce si su introducción en la práctica clínica permitiría reducir la alta morbimortalidad asociada a la IRA7. La propuesta más prometedora podría ser la determinación de más de un biomarcador (p. ej., cistatina C o NGAL en sangre + KIM1 e IL18 en orina), en aquellas situaciones de mayor riesgo, como pueden ser determinadas cirugías mayores, el paciente séptico o el que ingresa en UCI, especialmente si existe ERC previa.
Si se confirma la utilidad de alguno de estos biomarcadores, solos o en asociación, en estudios clínicos amplios en diferentes contextos clínicos, es de esperar que puedan utilizarse como alternativa a la Crs para la definición de IRA, así como para el diagnóstico, el pronóstico y la toma de decisiones terapéuticas.
TIPOS Y DOSIS DE DIÁLISIS
El tratamiento de la IRAcon técnicas de sustitución de la función renal plantea todavía muchos interrogantes en aspectos tan fundamentales como la modalidad de diálisis, el momento en la que debe iniciarse y la dosis de diálisis que debe prescribirse en el tratamiento de la IRA. En los últimos años se han publicado muchos estudios que han abordado estos temas y que se resumen a continuación.
Diálisis precoz frente a diálisis tardía
El momento en el que deben iniciarse las técnicas de tratamiento renal sustitutivo (TRS) está por definir, sin que haya un consenso claro al respecto. Las indicaciones convencionales (diálisis «tardía») serían la sobrecarga de volumen, la hiperpotasemia, la acidosis metabólica y la uremia llamativa (NUS >100 mg/dl). Varios estudios avalan la idoneidad de iniciar diálisis precozmente en la IRA del paciente crítico, ya que permitiría controlar mejor el volumen extracelular, el equilibrio ácido-básico, y la situación metabólica del paciente, y contribuiría a eliminar mediadores que disminuirían la inflamación y el estrés oxidativo. Los estudios publicados sobre el momento de inicio de la diálisis dan resultados dispares, si bien la mayoría abogan por una diálisis precoz, y sin criterios comunes sobre la definición de «diálisis precoz», ya que algunos se basan en el NUS, otros en los días de ingreso en la unidad de cuidados intensivos (UCI) y otros en la clasificación RIFLE8. A pesar de la heterogeneidad de estos trabajos, en el año 2008 se publicó un metaanálisis que incluye 23 estudios: 18 de cohortes con 2.108 pacientes y 4 aleatorizados y controlados con 270 pacientes. En el metaanálisis de los estudios de cohortes se demuestra una reducción de la mortalidad del 28% (RR: 0,72 [0,64-0,82], p <0,001), a favor de la diálisis precoz, mientras que el metaanálisis de los estudios controlados no muestra diferencias (RR: 0,72 [0,40-1,05], p = 0,08). Los autores concluyen que los resultados obtenidos sugieren que la diálisis precoz podría tener un efecto beneficioso sobre la supervivencia, si bien se requiere la confirmación de los resultados observacionales en un amplio estudio controlado y aleatorizado que debería incluir no menos de 1.100 pacientes9.
Dosis de diálisis
Hasta ahora no existía evidencia concluyente sobre una menor morbimortalidad con dosis de diálisis más intensas en el tratamiento del fracaso renal agudo (hemodiálisis intermitente diaria o hemodiafiltración veno-venosa continua (CVVHDF) >35 ml/kg/h), aunque algunos trabajos así lo sugerían10. En julio del 2008 se publicaron los resultados del estudio ATN (Acute renal failure Trial Network study). Es un estudio multicéntrico, aleatorizado, controlado, que incluyó a 1.124 pacientes críticos con IRA y uno o más fallos en otros órganos, y a los que de forma aleatoria se les asignó a un esquema terapéutico de dosis de diálisis intensa (hemodiálisis intermitente 6 veces/semana para un KT/V diana de 1,2-1,4 por sesión, o CVVHDF, 35 ml/kg/h) o de dosis de diálisis convencional (hemodiálisis intermitente 3 veces/semana para un KT/V diana de 1,2-1,4 por sesión, o CVVHDF, 20 ml/kg/h). El objetivo primario fue la mortalidad a los 60 días, que fue idéntica en ambos grupos (53,6% en el grupo de diálisis intensa frente al 51,5% en el grupo de diálisis convencional). Además, hubo más hipotensiones, hipofosfatemias e hipopotasemias en el grupo de diálisis intensa11. Los resultados de este trabajo son concluyentes, si bien ha recibido numerosas críticas, fundamentalmente por los parámetros utilizados para comparar la dosis de diálisis administrada en las técnicas continuas e intermitentes, la exclusión de pacientes con ERC previa, el retraso en iniciar el TRS (6-7 días tras el ingreso en la UCI, de media), y el hecho de que se trataba de pacientes con una puntuación APACHE muy alta (28 puntos de media), lo que ha llevado a algunos autores a sugerir que en situaciones de fallo multiórganico grave el impacto de más dosis de diálisis sobre la supervivencia es pequeño, a diferencia de lo que ocurriría si se iniciase el TRS en fases más precoces con índices de gravedad menor12.
Actualmente hay otro estudio en marcha, el RENAL (Randomized Evaluation of Normal Versus Augmented Level of Renal Replacement Therapy in ICU) (N.º Clinical-Trials.gov: NCT00221013), que se publicará probablemente en el año 2009 y que, junto al estudio ATN, permitirá definir con claridad cuál es la mejor dosis de diálisis a administrar en el paciente con IRA grave.
Modalidad de diálisis
El intento de demostrar la superioridad de unas técnicas de TRS frente a otras en la IRA ha sido una constante en los últimos años y se han publicado innumerables trabajos que intentan resolver precisamente esta cuestión: si las técnicas continuas, habitualmente la CVVHDF, aportan ventajas en términos de supervivencia a la hemodiálisis intermitente. En el año 2008 se publicaron dos metaanálisis que tratan esta cuestión. El primero incluye 30 estudios aleatorizados, controlados, y 8 estudios prospectivos de cohortes. El segundo incluye 9 estudios controlados aleatorizados en un total de 1.403 pacientes. La conclusión es idéntica en ambos. No hay diferencias entre las dos modalidades de diálisis en lo que se refiere a supervivencia del paciente. Además, se reconoce que la evidencia disponible en los distintos ensayos es de escasa calidad, por lo que es necesario realizar estudios controlados más potentes para contestar definitivamente a esta pregunta13,14. Otros autores, sin embargo, consideran que esta cuestión (modalidad de diálisis) no es la que más urge, por lo que no deben seguir haciéndose esfuerzos económicos en este sentido, ya que finalmente la elección sobre qué tipo de TRS utilizar dependerá en gran parte de la experiencia y de la disponibilidad de las técnicas en cada centro. Sí sería adecuado invertir en ensayos que intenten responder a cuestiones más relevantes, como serían el momento en el que empezar el TRS, cómo medir su adecuación y, quizá, comparar las técnicas continuas con otras más innovadoras como la hemodiálisis diaria de baja eficiencia y larga duración15.
PREVENCIÓN DE LA IRA
En la fisiopatología de la IRA hay unos factores predisponentes y un daño renal que se produce en un momento muy concreto y que muchas veces es claramente identificable, como ocurre tras la administración de contrastes yodados o ante una cirugía mayor. Por ello es lógico que se hayan intentado en los últimos años diversas estrategias preventivas que pretenden reducir el riesgo de IRA asociado a estos procedimientos.
Prevención de la nefropatía por contrastes yodados
El riesgo de nefropatía por contrastes está determinado por factores relacionados con el paciente, fundamentalmente la ERC previa, la diabetes mellitus (DM) y cualquier circunstancia que implique un bajo gasto cardiaco o hipovolemia efectiva, y por factores relacionados con el contraste empleado, como son la osmolaridad, la viscosidad y el volumen administrado. La principal medida profiláctica es la expansión de volumen, preferentemente con soluciones salinas, y el tratamiento farmacológico más popular es la administración de N-acetilcisteína, dada la seguridad de este fármaco. Se han publicado más de 20 estudios16 con N-acetilcisteína en la prevención de la nefropatía por contrastes yodados, siendo más numerosos los que no observan efectos beneficiosos que los que sí los hallan, en una proporción 2:1. A raíz de los resultados del estudio REMEDIAL17, publicado en el 2007, en el que la administración conjunta de bicarbonato y N-acetilcisteína redujo el riesgo de IRA en pacientes con ERC previa (filtrado glomerular <40 ml/min), esta combinación se ha extendido en muchos centros. En el año 2008, se publicó un metaanálisis de 7 estudios aleatorizados que incluyen a 1.307 pacientes en el que se comparan estrategias basadas en hidratación con bicarbonato o con suero salino, concluyéndose que, si bien hay una gran heterogeneidad en los estudios y probablemente muchos sesgos de publicación, existe una menor incidencia de IRA en el grupo pretratado con bicarbonato (5,9 frente al 17,2 %, RR: 0,38), aunque sin efecto sobre la necesidad de hemodiálisis o sobre la mortalidad18. Por otra parte, en un estudio observacional retrospectivo de cohortes de la Clínica Mayo, publicado también en el año 2008, y en el que se compara la evolución de 7.988 pacientes de los cuales 268 recibieron bicarbonato sódico como prehidratación, esta estrategia se asoció a un mayor riesgo de IRA(OR: 3,1)19.
Por tanto, en el momento actual no hay una clara evidencia, aparte de la hidratación, sobre cuáles son las estrategias preventivas de la nefropatía por contrastes.
Prevención de la IRA tras cirugía mayor
El fracaso renal agudo es muy frecuente y varía según las series y el tipo de cirugía desde un 1 a un 30% de los procedimientos, con un 1-7% de los pacientes que requerirán técnicas de TRS, lo que implica un aumento en la mortalidad de más del 60%. Los factores predisponentes no relacionados con la cirugía incluyen la ERC previa, la DM, la edad superior a 65 años, la sepsis y la disfunción cardiaca, entre otros. La cirugía per se induce otros factores precipitantes de IRA, como son la hipovolemia, la isquemia renal, la toxicidad renal por determinados anestésicos y el aumento de la presión intraabdominal en algunas cirugías. Dada la elevada prevalencia de la IRA se han probado muchas estrategias preventivas, especialmente en cirugía cardiaca. Entre ellas, las más prometedoras, aparte de una adecuada hidratación, son el fenoldopam (agonista de la dopamina de acción corta que aumenta el flujo sanguíneo renal) y los péptidos natriuréticos como el BNP (péptido natriurético tipo B)20. La utilidad de la n-acetilcisteína es un tema controvertido. Un metaanálisis publicado en el año 2008, de 10 estudios aleatorizados con 1.193 pacientes, no pudo demostrar efecto beneficioso alguno de este abordaje profiláctico21. Da la impresión de que las estrategias que no han demostrado claramente su utilidad en la prevención de la nefropatía por contrastes tampoco lo hacen en la prevención de la IRA poscirugía. De hecho, en el mes de enero de 2009 se publicó un estudio controlado sobre la utilidad de la infusión perioperatoria de bicarbonato en 100 pacientes sometidos a cirugía cardiaca en los que hubo menos pacientes en el grupo tratado con bicarbonato que presentaron incrementos en la Crs >25% de la basal (8 frente al 13%; OR: 0,43 [0,19-0,98]; p = 0,043). Los propios autores afirman que se trata de un estudio piloto que precisa de validación en un estudio más amplio22.
INSUFICIENCIA RENAL AGUDA Y ENFERMEDAD RENAL CRÓNICA
La estrecha relación entre la IRA y la ERC ha sido objeto en los últimos meses de estudios epidemiológicos muy interesantes. Es bien sabido que la evolución natural de la IRA es variable: recuperación completa, evolución a la ERC, agravamiento de una ERC preexistente, o entrada en un programa de diálisis crónica, sin que se conozca, a priori, la evolución que seguirá cada paciente concreto23. La edad avanzada y la ERC preexistente se han implicado como factores de mal pronóstico. Este concepto de IRAsobreañadido a ERC, tan conocido por los nefrólogos, se ha analizado en un estudio observacional del registro permanente Kaiser de Carolina del Norte, y publicado en 2008. Se compararon 1.746 pacientes hospitalizados con el diagnóstico de «IRA que precisó diálisis» con 600.820 pacientes que estuvieron hospitalizados en el mismo periodo de tiempo y que no tuvieron ese diagnóstico, y se analiza el riesgo de IRAen función del grado de ERC previa según la clasificación KDOQI. Los resultados indican claramente que el riesgo de desarrollar IRAque precisa diálisis aumenta de forma muy llamativa con el estadio de ERC basal, y que ya está incrementado incluso con filtrados glomerulares entre 45-60 ml/min. Además de la ERC, la DM, la proteinuria, la hipertensión y la edad avanzada también se asociaron a un mayor riesgo de IRA24.
Por otra parte, en otro estudio muy reciente se analiza la otra cara de la moneda, la evolución en el tiempo de los pacientes que han presentado IRA. Se analizó una cohorte de 233.803 pacientes beneficiarios del Medicare estadounidense, todos con edad superior a 67 años y que habían tenido un ingreso hospitalario en el año 2000 y del que fueron dados de alta vivos. Se analizó el riesgo a los 2 años de evolucionar a ERC estadio 5 en tratamiento sustitutivo, y su relación con el diagnóstico de IRA durante el ingreso del año 2000 (3,1% de los pacientes), y con la existencia previa de ERC (34,3% de los pacientes). En los pacientes con IRA en el año 2000, el riesgo de desarrollar ERC-E5 a los 2 años fue del 6,9%; si presentaban ERC previa a la IRA, el riesgo fue del 14,3%, y si tenían previamente una función renal normal el riesgo fue del 3,7%. Por otra parte, en ausencia de IRA, el riesgo fue del 0,25% si no existía ERC previa al ingreso del año 2000, y del 2,54% si existía25. Estos datos confirman el enorme impacto de la IRAsobre el riesgo de desarrollar ERC avanzada, y desmitifican la idea de que es una entidad de buen pronóstico tras el alta hospitalaria. Se confirma, igualmente, que los pacientes en mayor riesgo de evolucionar a ERC-E-5 tras un episodio de IRAson aquellos que presentaban alteración de la función renal antes del episodio.
Estos dos estudios epidemiológicos permiten profundizar más en la estrecha interrelación existente entre estas dos entidades, IRA y ERC, y tiene claras implicaciones terapéuticas, en forma de estrategias más cautas en el paciente con ERC a la hora de indicar técnicas diagnósticas (exploraciones con contrastes) o tratamientos farmacológicos (antiinflamatorios no esteroideos), que puedan favorecer la aparición de un fracaso renal agudo.
Tabla 1. Criterios diagnósticos de la IRA según las clasificaciones RIFLE
Tabla 2. Biomarcadores propuestos para la IRA