Oedema is a common clinical manifestation of nephrotic syndrome. However, the pathophysiological mechanism of sodium retention in nephrotic syndrome has been intensely debated for decades. Several clinical and experimental observations argue against the classic or "underfill" hypothesis of oedema formation in nephrotic syndrome. In many patients, oedema formation in nephrotic syndrome is due to the kidney being intrinsically unable to excrete salt and is unrelated to systemic factors (i.e. hypoalbuminaemia, decreased “effective” arterial blood volume, and secondary hyperaldosteronism). The cortical collecting duct is the nephron site of sodium retention in nephrotic syndrome. Activation of the epithelial sodium channel in the cortical collecting duct is responsible for sodium retention in nephrotic syndrome. In nephrotic syndrome, a defective glomerular filtration barrier allows the passage of proteolytic enzymes or their precursors, which have the ability to activate the epithelial sodium channel, thereby causing the the subsequent sodium retention and oedema.
El edema es una manifestación clínica frecuente del síndrome nefrótico (SN); sin embargo, el mecanismo fisiopatológico responsable de la retención de sodio ha sido un tema de intenso debate durante décadas. Muchas observaciones clínicas y experimentales no apoyan a la hipótesis clásica o del underfill en la formación del edema nefrótico. En numerosos pacientes, el edema propio del SN se produce por un defecto renal intrínseco en la excreción de sodio y es independiente de factores sistémicos (p. ej., hipoalbuminemia, disminución del volumen arterial efectivo o hiperaldosteronismo secundario). El punto de la nefrona donde se produce la retención de sodio en el SN es el túbulo colector cortical. La activación del canal de sodio epitelial a ese nivel es responsable de la retención de sodio en la patología que nos ocupa. Una barrera glomerular defectuosa propia del SN permitiría el paso de enzimas proteolíticas o sus precursores que a su vez activarían el canal de sodio epitelial causando de esa manera su retención y consiguiente edema.
INTRODUCCIÓN
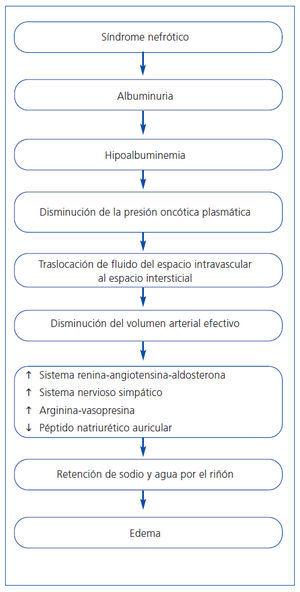
El edema se define como la acumulación de fluido en el espacio intersticial y es una manifestación clínica frecuente del síndrome nefrótico (SN). Sin embargo, su fisiopatología ha sido un área de intenso debate durante décadas. La hipótesis clásica o también llamada hipótesis del underfill postula que la retención de sodio en el SN es un fenómeno secundario a la disminución del volumen arterial efectivo (por ende el término underfill) y seguiría la siguiente secuencia de eventos (figura 1): la pérdida urinaria de proteínas propia del SN, especialmente de albúmina, produciría hipoalbuminemia, que a su vez causaría una disminución de la presión oncótica plasmática. Esta disminución en la presión oncótica plasmática ocasionaría un «imbalance» en las fuerzas de Starling, produciendo la translocación de fluido del espacio intravascular hacia el espacio intersticial, causando una disminución en el volumen arterial efectivo y, por consiguiente, hipovolemia relativa. Esta última produciría la activación del sistema renina-angiotensina-aldosterona y del sistema nervioso simpático, el incremento de la liberación de hormona antidiurética y la inhibición de la liberación del péptido natriurético auricular. La activación de todos estos sistemas produciría la retención de sodio y agua por parte del riñón con la consiguiente aparición del edema. Sin embargo, diversas observaciones experimentales y clínicas realizadas durante el transcurso de los años no apoyarían esta hipótesis.
OBSERVACIONES CLÍNICAS Y EXPERIMENTALES EN CONTRA DE LA HIPÓTESIS DEL UNDERFILL1,2 (tabla 1)
Pacientes y ratas con niveles bajos de albúmina sérica no desarrollan edema ni retención de sodio
Joles et al.3 realizaron mediciones de la presión oncótica plasmática e intersticial en ratas Nagase, ratas mutantes que se caracterizan por presentar analbuminemia. Los investigadores no observaron signos de retención de sodio en estos animales. Lecomte et al.4 realizaron, a su vez, observaciones en pacientes con analbuminemia congénita y observaron que en su mayoría no presentaban edema. Muchas otras series publicadas de pacientes con analbuminemia congénita no comunican la aparición de edema como manifestación clínica principal5. Steyl et al. estudiaron a 50 pacientes hospitalizados en una sala de medicina general en Sudáfrica6. Observaron que 24 pacientes tenían una albúmina sérica menor de 3,5 g/dl, en su mayoría asociada con inflamación crónica (tuberculosis). De estos 24 pacientes, sólo seis presentaron edema. Estos 6 pacientes con edema tuvieron otro diagnóstico alternativo que explicaba la presencia de edema de forma clara (cor pulmonale). En el estudio, los investigadores encontraron algunos pacientes con albúminas séricas menores a 1,5 g/dl, pero ninguno de ellos presentó edema.
La natriuresis en la fase de de recuperación del síndrome nefrótico comienza cuando la proteinuria desaparece, pero antes que la albúmina sérica vuelva a la normalidad7
La disminución absoluta en la presión oncótica plasmática no afecta el volumen del espacio intravascular en el síndrome nefrótico
Estudios realizados en perros sugieren que la disminución absoluta en la presión oncótica plasmática no afectaría al volumen plasmático y sanguíneo8. Pacientes con SN producido por glomerulonefritis fueron estudiados mediante la medición de la presión oncótica plasmática e intersticial: 12 pacientes en fase activa, 3 pacientes en fase de remisión completa y 3 pacientes en fase de remisión parcial9. Los investigadores encontraron que la presión oncótica plasmática y la intersticial estaban disminuidas en la fase activa de del SN, pero regresaron lentamente a valores normales durante la fase de remisión. Durante todo este tiempo el gradiente de presión oncótica entre el plasma y el intersticio fue constante9. Estos estudios demuestran que en realidad es el cambio en el gradiente de presión oncótica entre el plasma y el intersticio, y no solamente la disminución absoluta de la presión oncótica plasmática, el responsable de la translocación de fluido del espacio intravascular al espacio intersticial.
Los volúmenes plasmático y sanguíneo son normales o se encuentran incrementados en el síndrome nefrótico
Geers et al. realizaron medidas del volumen plasmático en 88 pacientes con SN y 51 pacientes control10. El volumen plasmático fue medido a través de la administración de albúmina radiactiva 131I y el volumen sanguíneo se calculó basándose en el volumen plasmático y en el hematocrito. En los pacientes con SN, el volumen plasmático y sanguíneo se encontraba elevado en el 14%, era normal en el 84% y era bajo en sólo el 2% de los casos.
La expansión del espacio intravascular con albúmina no aumenta la natriuresis en pacientes con síndrome nefrótico
El efecto de una infusión intravenosa de albúmina hiperoncótica (75 g) se observó en pacientes con SN11. Después de la infusión de albúmina el volumen sanguíneo se incrementó hasta un 120% del valor basal. La actividad de renina plasmática y la concentración de aldosterona sérica disminuyeron hasta quedar suprimidas. La excreción urinaria de sodio no cambió de manera significativa.
La activación del sistema renina-angiotensina-aldosterona no está implicada en la generación del edema en el síndrome nefrótico
Brown et al. administraron captopril a un grupo de pacientes con SN y no observaron ningún cambio en la excreción de sodio a pesar de suprimir la concentración de aldosterona sérica12. En otro estudio, Usberti et al. observaron hallazgos similares al usar espironolactona13.
La adrenalectomía no previene la retención de sodio y el desarrollo de ascitis en el síndrome nefrótico experimental en ratas
De Seigneux et al. estudiaron a un grupo de ratas a las que extrajeron la glándula adrenal de manera bilateral y que fueron suplementadas con dexametasona para evitar la insuficiencia adrenal14. Los investigadores indujeron el SN mediante la administración de puromicina. Los animales desarrollaron edema y retención de sodio a pesar de haber sido adrenalectomizados; estos hallazgos sugieren que la aldosterona no desempeña un papel fundamental en la retención de sodio propia del SN.
HIPÓTESIS ALTERNA O HIPÓTESIS DEL OVERFILL DE LA FORMACIÓN DEL EDEMA EN EL SÍNDROME NEFRÓTICO
Contraria a la hipótesis clásica, la hipótesis alterna, o también llamada hipótesis del overfill, postula que en muchos pacientes con SN la retención de sodio es un fenómeno renal primario y se produciría por un defecto renal intrínseco en la excreción de sodio, lo que a su vez produciría la expansión del volumen plasmático (por ende el término overfill). Aunque el mecanismo molecular de la retención de sodio en el riñón no ha sido dilucidado con claridad, existen varios estudios al respecto que describiremos a continuación.
Mecanismos moleculares de la retención de sodio en el síndrome nefrótico
Las primeras evidencias que apoyaron la hipótesis del overfill fueron las observaciones realizadas por Chandra15 e Ichikawa16. La mayor parte del conocimiento adquirido acerca de los mecanismos moleculares de la retención de sodio en el SN ha derivado del uso del modelo animal de SN inducido por la acción del aminonucleósido puromicina (PAN), el cual, al ser administrado a ratas, produce proteinuria masiva y retención de sodio. La histopatología renal del SN inducido por PAN se asemeja a la enfermedad de cambios mínimos17-19. Usando la técnica de la perfusión unilateral selectiva de la arteria renal izquierda con PAN descrita inicialmente por Bricker en perros20 y luego por Hoyer en ratas21, Chandra15 e Ichikawa16 demostraron que la proteinuria y la retención de sodio estaban confinadas al riñón perfundido con PAN (el modelo unilateral de SN permite el estudio de un riñón proteinúrico y un riñón control en el mismo animal). Es importante recalcar que la retención de sodio por parte del riñón perfundido con PAN ocurrió en la ausencia de una reducción en la concentración plasmática de proteínas, lo que sugiere que la retención de sodio observada en el SN se debe a un defecto renal intrínseco en la excreción de sodio y no a factores extrínsecos o sistémicos como la hipoalbuminemia.
El túbulo colector cortical es el punto de reabsorción de sodio en el síndrome nefrótico
Ichikawa, además, realizó estudios de micropunción de segmentos tubulares de nefronas superficiales en el modelo unilateral de SN en ratas y demostró que la cantidad de sodio al final del túbulo contorneado distal es igual en el riñón proteinúrico y en el riñón normal, pero la orina final del riñón nefrótico contenía tres veces menos sodio que la orina proveniente del riñón normal, lo que sugiere que la estimulación de la reabsorción de sodio en el SN ocurre en el túbulo colector cortical16.
El papel de NHE3 en la retención de sodio en el SN
A pesar de los hallazgos realizados por Ichikawa et al., otros estudios han postulado que la retención de sodio en el SN podría ocurrir en otros segmentos de la nefrona. El 66% del sodio filtrado por el glomérulo es reabsorbido en el túbulo proximal gracias a la acción del cotransportador Na+-H+ (NHE3); entonces sería razonable pensar que este segmento contribuiría, al menos en parte, a la retención de sodio observada en el SN. Besse-Eschmann et al. encontraron que la actividad de NHE3 (normalizada para la cantidad de proteína) estaba aumentada en un 88% en ratas tratadas con PAN comparadas con ratas control22. NHE3 está presente formando oligómeros en dos localizaciones del borde «en cepillo» del túbulo proximal: 1) en la región intervellosa, donde está asociado al receptor megalina (proteína responsable de la reabsorción de albúmina y otras sustancias filtradas por el glomérulo), representando la forma inactiva de NHE3, y 2) en la región microvellosa, donde se encuentra libre y representa la forma activa del transportador23. Los investigadores también observaron que en ratas tratadas con PAN existía movimiento de NHE3 de la región intervellosa a la región microvellosa22 y sugirieron que la albúmina filtrada por la barrera glomerular defectuosa propia del SN podría disociar a NHE3 de la megalina e incrementar el movimiento de NHE3 a las microvellosidades para que pueda ejercer desde ahí su función de retención de sodio22.
El papel de la bomba Na+/K+-ATPasa en la retención de sodio en el síndrome nefrótico
Otro transportador de sodio que ha sido implicado en la retención de sodio en el SN es la bomba Na+/K+-ATPasa. Deschenes et al. observaron que la actividad de esta bomba estaba aumentada en ratas tratadas con PAN comparado con ratas control24. Estos autores también observaron que el incremento en la actividad de la bomba se encontraba confinado al túbulo colector cortical24. Sin embargo, muchos estudios posteriores han demostrado que la actividad de esta bomba, así como la de otros transportadores de sodio (como NHE3), en ratas tratadas con PAN, están disminuidas si se comparan con las de ratas control25.
El papel de ENaC en la retención de sodio en el síndrome nefrótico
Otro de los transportadores de sodio que ha sido implicado con bastante fuerza en la retención de sodio en el SN es el canal de sodio epitelial o canal de sodio sensible a amilorida (ENaC). ENaC está compuesto de tres subunidades: α, β, y γ. Los primeros estudios llevados a cabo sobre el papel de ENaC en la retención de sodio en el SN demostraron que no se producía un incremento de la expresión de las proteínas (y del ARN mensajero) de ninguna de las tres subunidades de ENaC en ratas tratadas con PAN si se comparaban con ratas control26. Sin embargo, estudios posteriores han demostrado un incremento en la expresión de las proteínas de las tres subunidades de ENaC14,25, así como un aumento en el tráfico de estas subunidades del citosol hacia la membrana plasmática apical25.
ENaC es regulado por diversos factores; uno de ellos es la enzima 11-β-hidroxiesteroide deshidrogenasa tipo 2 (11βHSD2). La activación del receptor mineralocorticoide produce un incremento en la actividad de ENaC mediante el aumento en la expresión del gen que codifica la subunidad α ENaC y una disminución en su reciclado intracelular mediado por la ligasa de ubiquitina Nedd4-227. El cortisol tiene la misma afinidad que la aldosterona por el receptor mineralocorticoide; sin embargo, la aldosterona actúa como el único agonista de este receptor a pesar de que la concentración de cortisol en el plasma es 100 veces la concentración de aldosterona. La enzima 11βHSD2 suele proteger al receptor mineralocorticoide de la activación por cortisol al transformarlo localmente en cortisona, la cual es inactiva sobre este receptor. No obstante, en estados patológicos, como en el síndrome de exceso aparente de mineralocorticoides, la actividad de la enzima 11βHSD2 se encuentra disminuida, lo que permite que el cortisol sea capaz de activar el receptor mineralocorticoide y producir retención de sodio28. Kim et al. mostraron en un estudio que la actividad de la enzima 11βHSD2 estaría disminuida en ratas con SN producido por nefropatía membranosa inducida por cloruro de mercurio comparadas con ratas control, lo cual podría explicar la retención de sodio en estos animales29. Sin embargo, otros estudios no han confirmado estos hallazgos14,30.
Otro factor importante en la regulación de ENaC son las serina proteasas. Éstas son un grupo de enzimas proteolíticas que van a escindir las subunidades α y γ de ENaC en sitios específicos y, de esta manera, aumentarán la conductancia al sodio a través del canal31,32. En condiciones experimentales, la conductancia al sodio en ENaC que no ha sido expuesto a proteólisis por las serina proteasas es baja. El primer paso en la activación de ENaC por serina proteasas ocurre en el complejo de Golgi, donde una proteasa llamada furina escindirá a la subunidad α en los sitios R205 y R231 (liberando así un péptido inhibidor de 26 aminoácidos) y a la subunidad γ en el sitio R14333. Si en condiciones experimentales se midiera la conductancia de este ENaC ésta sería intermedia. Después de este paso enzimático, el canal es ensamblado en la membrana plasmática apical. Para que ENaC esté totalmente activo y con una conductancia de sodio alta, éste deberá ser activado por una segunda proteasa (como prostasina, elastasa de neutrófilo o elastasa pancreática)34.
Las primeras observaciones acerca de la activación de ENaC por serina proteasas en estados proteinúricos fueron realizadas por Kastner et al.35. Passero et al.36 encontraron que las corrientes de ENaC aumentaban cuando ENaC se exponía a plasmina, lo que sugeriría que la plasmina actuaría como una segunda proteasa y sería capaz de activar ENaC. Passero también descubrió que la plasmina activa ENaC escindiendo la subunidad γ en el sitio K19436.
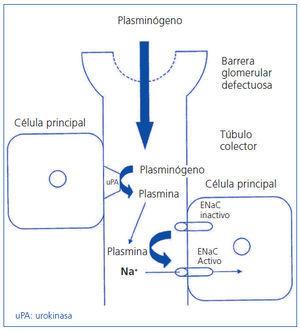
La evidencia quizás más convincente hasta la actualidad acerca del papel de las serina proteasas en la activación de ENaC en el SN es la recientemente publicada por Svenningsen et al.37. Estos investigadores observaron que la orina de ratas nefróticas (tratadas con PAN) incrementaba las corrientes de ENaC y que la amilorida las abolía. Svenningsen et al. investigaron la razón por la cual la orina de estas ratas nefróticas activaba ENaC y encontraron que las corrientes de ENaC eran abolidas cuando ENaC era expuesto a aprotinina, un inhibidor conocido de serina proteasas. Otra observación importante fue que la orina de ratas nefróticas no incrementaba las corrientes de ENaC cuando era sometida a calor. Cuando se midió la actividad de serina proteasas en esta orina, la actividad resultó elevada. Todos estos hallazgos sugerían que la orina de ratas nefróticas contenía una serina proteasa capaz de activar ENaC37. Varios estudios anteriores realizados en pacientes con SN han documentado la presencia de plasminógeno en la orina de dichos pacientes38,39. Después de varios pasos de purificación y espectrofotometría de masa (MALDI-TOF), Svenningsen et al. encontraron que las serina proteasas responsables de la activación de ENaC en la orina de estas ratas nefróticas eran plasminógeno y/o plasmina37. La orina de ratas nefróticas contenía ambas sustancias, pero el plasma de estos animales sólo contenía plasminógeno, lo que sugeriría que la plasmina era formada en la orina in situ y no era filtrada del plasma37. Se sabe que la plasmina proviene de la activación de plasminógeno a través de la acción enzimática de la urokinasa que se encuentra normalmente presente en el túbulo colector40. Svenningsen et al. observaron que las células del túbulo colector cortical de las ratas nefróticas tenían actividad de urokinasa37. Estos investigadores, además, observaron que mientras que la combinación de plasminógeno con urokinasa incrementaba las corrientes de ENaC en oocitos, el plasminógeno y la urokinasa eran incapaces de hacerlo de manera aislada37. Otro hallazgo importante de este grupo de investigadores es que la amilorida no sólo bloquea ENaC sino que también bloquea la enzima urokinasa responsable de la conversión de plasminógeno a plasmina37. Cabe resaltar que Svenningsen et al. fueron capaces de reproducir todos los hallazgos descritos anteriormente con orina proveniente de pacientes con SN37. En resumen, el plasminógeno presente en el plasma probablemente se filtra a través de la barrera glomerular defectuosa propia del SN y es luego convertido en plasmina por la acción de la urokinasa presente en el túbulo colector. La plasmina posteriormente activaría ENaC y se produciría retención de sodio con la consiguiente aparición de edema (figura 2).
Uso de amilorida en el tratamiento del edema nefrótico
El tratamiento del edema en el SN se basa tradicionalmente en una dieta hiposódica (2,3 g de sodio al día o 6 g de cloruro de sodio al día) y el uso de diuréticos de asa. La amilorida es un diurético ahorrador de potasio y su uso clásicamente ha sido restringido para la prevención de la hipopotasemia asociada con el uso de diuréticos de asa. Sin embargo, de acuerdo con los hallazgos descritos anteriormente, el uso de amilorida podría desempeñar un papel importante en el tratamiento del edema en el SN. En nuestra experiencia clínica, el empleo de amilorida potencia la diuresis producida por los diuréticos de asa. Esto ha sido reproducido de manera experimental41 y también ha sido comunicado en otros estudios clínicos42. Usualmente comenzamos el tratamiento del edema nefrótico con bumetanida a dosis de 1 mg por vía oral dos veces al día y amilorida a dosis de 5 mg por vía oral una vez al día. La amilorida no debe usarse de manera aislada sino más bien en combinación con los diuréticos de asa, puesto que aunque el papel del túbulo colector es clave en la retención de sodio en el SN, en términos absolutos éste sólo contribuye al 4% de la reabsorción del sodio filtrado total.
Conceptos clave
1. En un gran número de pacientes con SN, la fisiopatología del edema no estaría relacionada con la presencia de hipoalbuminemia, disminución del volumen del espacio intravascular o hiperaldosteronismo secundario.
2. El edema propio del SN se produciría por un defecto renal intrínseco en la excreción de sodio.
3. La retención de sodio en el SN ocurriría en el túbulo colector cortical.
4. ENaC, uno de los transportadores de sodio presentes en el túbulo colector cortical, estaría implicado en la retención de sodio en el SN.
5. La barrera glomerular defectuosa propia del SN permitiría el paso de muchas proteínas, entre ellas el plasminógeno.
6. La urokinasa, enzima presente de manera natural en el epitelio del túbulo colector cortical, sería la responsable de la conversión de plasminógeno a plasmina
7. La plasmina, formada in situ en el túbulo colector cortical, activaría ENaC causando, por ende, retención de sodio y formación de edema.
8. La amilorida potenciaría la diuresis producida por los diuréticos de asa en el SN.
Tabla 1. Argumentos en contra de la hipótesis del underfill de la formación del edema en el síndrome nefrótico
Figura 1. Hipótesis clásica o del underfill de la formación del edema en el síndrome nefrótico.
Figura 2. Plasmina en el túbulo colector cortical activa ENaC.