FUNDAMENTOS DE LA BIOIMPEDANCIA VECTORIAL
El conocimiento de la composición corporal (CC), por su implicación biológica, es de capital importancia tanto en la salud como en la enfermedad, y en las últimas décadas ha progresado permitiendo la cuantificación de los compartimentos corporales desde el modelo simple de dos compartimentos (magro frente a grasa), a los más sofisticados multicompartimentales (molecular, cuantificación como nitrógeno corporal, potasio, calcio, fósforo, etc.).
El análisis de la CC se ve limitado al contenido de agua corporal, masa magra, masa grasa y masa ósea mediante bioimpedancia eléctrica (BIA) y dual energy X-ray absorptiometry (DEXA), fundamentalmente porque otras tecnologías son todavía o bien demasiado complejas y caras o bien inexactas1.
La bioimpedancia vectorial (BIA), en sus distintas técnicas, Multifrecuencia (BIA-MF), espectroscópica (BIS) y vectorial (BIVA), tiene una enorme difusión en la comunidad científica como herramienta diagnóstica de los cambios de la CC. Descrita y validada por Kushner en 19862, sus grandes ventajas radican en que es una técnica no invasiva, económicamente rentable, validada y de fácil uso rutinario, comparada con las técnicas de referencia como densitometría ósea (DEXA) o utilización de isótopos3 como el deuterio o 40K.
El fundamento de la BIVA se publicó en esta Revista en el año 2002, y establece la CC a través vectores gráficos derivados de la resistencia-reactancia (R/Xc) sin ecuaciones4-7. Detecta cambios en la hidratación tisular menores de 500 ml y su error estándar es del 2%. Se considera adecuada cuando el vector se sitúa entre los percentiles 50 y 75%5 (figura 1).
La Agencia Estatal de Evaluación Tecnológica (avalia-t) evaluó la BIVA, y se consideró como emergente, consolidada, sin impacto ético y una herramienta útil en la evaluación de la CC de los pacientes con enfermedad renal crónica8.
Los tres parámetros de importancia clínica derivados de la BIVA son el ángulo de fase (AF), el intercambio celular Na-K y la masa celular (MC).
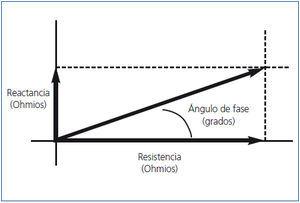
El AF (figura 2) evalúa la integridad de las membranas celulares y la relación entre el espacio extracelular e intracelular. Por definición, el AF tiene una relación positiva con la reactancia (AI) y negativa con la resistencia (AE)9. Su valor es pronóstico de supervivencia en diferentes patologías como enfermedad renal crónica (ERC), cardíaca y cáncer10-13. En este número, Caravaca, et al. y Abad, et al. aportan una experiencia importante en enfermedad renal crónica avanzada (ERCA) y en pacientes en diálisis poniendo de manifiesto la importancia del AF como parámetro de supervivencia14,15.
El intercambio celular Na-K constituye un parámetro emergente y de gran relevancia clínica en la monitorización de los estados inflamatorios. Se correlaciona con parámetros de inflamación, de malnutrición y de riesgo cardiovascular16,17.
Basado en las propiedades bioeléctricas celulares en las que éstas se comportan como verdaderos condensadores almacenando la electricidad a ambos lados de sus membranas, el intercambio Na-K determina el grado de lesión de la membrana celular.
La MC evalúa los componentes celulares implicados en los procesos bioquímicos y metabolismo energético. El estado nutricional, el nivel de actividad y los procesos patológicos alteran la MC constituyendo un biomarcador útil. De ella deriva el potasio corporal total (PCT) (mmol) = masas celular x 108,6) que corresponde al contenido total de K, de importancia en la evaluación nutricional, especialmente en la sarcopenia de los ancianos18-20.
BIOIMPEDANCIA VECTORIAL EN LA ENFERMEDAD RENAL CRÓNICA
En 2010 se produjeron novedades importantes en el manejo de la ERC para retrasar la progresión de la enfermedad renal y disminuir el riesgo cardiovascular asociado21.
Caravaca, et al.14 evidencian claramente la utilidad de la BIS en las variaciones del estado de hidratación en pacientes con ERCA y establecen que el AF de 5,3º tiene valor pronóstico de supervivencia junto con la relación entre la sobrecarga de volumen y la elevación de la tensión arterial y factores de riesgo cardiovascular. Aportan un dato relevante en cuanto al papel del hiperaldosteronismo relacionando el aumento del AE con el índice de excreción Na/K urinario bajo. Establecen la relación entre hidratación, nutrición e inflamación, y nos ayudan a tomar decisiones sobre el uso de fármacos y medidas no farmacológicas.
Los efectos cardiovasculares y los cambios en la CC se manifiestan en los estadios iniciales de la ERC, aumentando el AT a expensas del AE con descenso del AF, asociado a una remodelación cardíaca e hipertrofia del ventrículo izquierdo22. El AF disminuye en un 22% respecto a los controles y, especialmente, sufren estos cambios los pacientes diabéticos, evidenciando un cierto grado de exceso de volumen manifestado por el aumento del AT, AE y disminución de la MC23.
Las diferencias de la CC entre ambos sexos, independientemente de las funciones fisiológicas y culturales, se deben a la diferente alimentación, con nutrientes con actividad estrogénica, que aportan una perspectiva diferente a los riesgos cardiovasculares24.
Mantener la masa muscular es clave en la prevención de la malnutrición25. Junto con antropometría, la BIVA valora la masa muscular una vez que el estado de hidratación se haya normalizado. Asociada a la dinamometría permite una estimación de la fuerza muscular y de la masa muscular. Por cada 0,5 kg de fuerza aumenta 1 Ohm/m la reactancia/altura (m) y cada descenso de 1 Ohm/m de la resistencia/altura (m) disminuye 0,063 kg de fuerza26. En nuestra unidad estudiamos a 519 pacientes en estadios 2-5 seguidos con BIVA y dinamometría observando que tanto la fuerza del brazo dominante como del no dominante presenta una correlación significativa negativa con edad (p <0,001), Na-K intercambiable (p <0,001), proteína C reactiva (p <0,040), y positiva con porcentaje magro (p <0,001), porcentaje de músculo (p <0,001), AF (p <0,001), albúmina sérica (p <0,001), prealbúmina (p <0,001), nPNA (p <0,001), albúmina/creatinina urinaria (p <0,021) y testosterona (p <0,001)27. En nuestra población por cada kg de fuerza varía el músculo en 0,659 kg o un 4,4%. Además, los parámetros de la BIVA se correlacionan con los marcadores séricos de nutrición e inflamación.
La estimación del filtrado glomerular con MDRD y CKD-EPI no tiene en cuenta la CC. Sin embargo, tanto la masa muscular como la MC influyen en el filtrado glomerular. Basándonos en los estudios de validación realizados por Donadio utilizando la MC, evaluamos a 353 pacientes con ERC estadios 1-5 y encontramos una significativa correlación con los métodos actuales; se abre una metodología nueva en la evaluación del filtrado glomerular, aunque hacen falta más estudios28,29.
El sobrepeso y la obesidad constituyen un importante problema de salud, y se asocia tanto al desarrollo de ERC como a la progresión de la enfermedad, al desarrollo de diabetes y a los eventos cardiovasculares30.
El uso del índice de masa corporal (IMC) como indicador de sobrepeso/obesidad está cuestionado por su fuente de error e inexactitud y la BIVA tiene un papel relevante por su fiabilidad. Ha demostrado una especificidad del 86%, un valor predictivo positivo del 98% y un valor predictivo negativo del 20%. El error de la técnica con adiposidad elevada es del 9%31.
La CC varía con la edad y el género a lo largo de la vida. Se ha observado mediante BIVA que, superando los 50 años, en ambos sexos se producen cambios de la CC consistentes en aumento del porcentaje de grasa, disminución de la masa muscular, aumento del AT, AE y disminución del AF, MC, AI y metabolismo basal, probablemente en relación con los hábitos de vida, entre los que el sedentarismo y la alimentación tienen un papel relevante32.
Esto es importante a la hora de valorar los cambios producidos por el envejecimiento en nuestros pacientes en los que su CC no puede ser comparada con la de poblaciones más jóvenes y que supone un importante reto en su manejo, debido a que la sarcopenia constituye el principal cambio corporal de la población anciana sana, que en la actualidad es objeto de estudio33.
La sarcopenia en ancianos se traduce en cambios de la CC detectados mediante BIVA con MC, PCT y AF disminuidos. El AF ha resultado ser también un marcador de mortalidad en pacientes ancianos hospitalizados; pacientes con AF de 4,3 ± 1,1º presentan una mayor supervivencia34.
BIOIMPEDANCIA VECTORIAL BIVA EN DIÁLISIS
La diálisis per se produce cambios importantes en la CC, en poco tiempo, y donde la BIVA más se ha utilizado para establecer la CC adecuada y controlar los factores de morbimortalidad, como son la malnutrición, la inflamación y el riesgo cardiovascular. Se ha consolidado en los últimos años como herramienta de ayuda en la toma de decisiones tanto en pacientes en hemodiálisis (HD) como diálisis peritoneal (DP)35. La BIVA ha hecho evolucionar el concepto de «peso seco» hacia una situación más fisiológica y menos arbitraria como peso adecuado o «CC adecuada».
Evaluando el volumen extracelular, la BIVA permite prevenir los eventos cardiovasculares y la pérdida de la función renal residual. En cualquiera de sus modalidades, la diálisis controla el volumen a expensas del AE, y mantener los pacientes en un estado euvolémico es un reto para los nefrólogos36,37.
La individualización de la ultrafiltración dentro del concepto de individualización de la prescripción de diálisis y el uso del AT como parámetro que debe incluirse en la adecuación de la diálisis hace que las prescripciones sean más eficientes y efectivas38.
El Vurea forma parte del Kt/V. Comparada con diferentes férmulas antropométricas (Watson, Hume, Randall, Tzamaloucas y Chertow) y con el modelo cinético de la urea, el AT estimada mediante BIVA resultó ser más exacto39,40.
La evaluación de la CC de las dos técnicas dialíticas demuestra que los pacientes en DP presentan significativamente un mayor porcentaje de AT en comparación con los pacientes en HD. La proporción de hipertensos volumen-dependientes es mayor en los pacientes en DP, pero no significativamente41. Usando el índice AE/AT, recientemente se sugirió que la CC era similar en los pacientes en DP y en HD prediálisis. Los niveles de péptido natriurético auricular (PNA) fueron similares en DP y en HD posdiálisis, a pesar de haber mejorado su índice AE/AT, lo que sugiere que la compartimentalización del volumen era diferente en las distintas técnicas42. Con la introducción de la icodextrina y la expansión de la diálisis peritoneal ambulatoria (DPA), especialmente en los altos transportadores, se encontró que el estado de hidratación no es diferente entre ambas modalidades, estimando que un 25% de los pacientes en DP y en HD presentan un exceso de volumen. La BIVA ha demostrado ser útil en el establecimiento del estado de hidratación adecuado en DPCA y en HD. Los vectores de los pacientes con edema son cortos y se desplazan por debajo del percentil 75%43,44.
La malnutrición es altamente prevalente tanto en DP como HD, con cifras similares en ambas técnicas, aunque algún estudio se ha reseñado una mayor prevalencia en DP, que se estima en un 34%, y las anomalías del estado nutricional han sido referenciadas con diferentes métodos45.
Los pacientes que inician diálisis muestran una mejoría del estado nutricional en los primeros seis meses y, aun así, el 40% presentan malnutrición. El nivel sérico de albúmina es considerado como indicador de mortalidad, y los pacientes con niveles <3,5 g/l tienen el doble de mortalidad si se comparan con los de >4 g/l46. La hipoalbuminemia se ha asociado con estados de hidratación, tanto en pacientes en HD como en DP, y con factores comórbidos, medidos con BIVA47. La prealbúmina tiene valor predictivo similar al de la albúmina y no se ve afectada por el estado de hidratación48.
La BIVA posee una excelente correlación con albúmina, nPNA y Kt/V en HD y en DP, siendo el AF y la MC los marcadores pronósticos de supervivencia49,50. Abad, et al.15 aportan una nueva e interesante experiencia con resultados controvertidos respecto a los de otros autores9,10 con BIA-MF; han hallado un AF de 8º como pronóstico de la supervivencia tanto en HD como en DP, evidenciando estos últimos pacientes un mejor estado nutricional. Los autores encuentran una relación significativa positiva entre el AF con la ganancia de peso interdiálisis, AE y AI, lo que sugiere que la CC de los pacientes se corresponde con vectores largos por encima del percentil 75%.
La inflamación modifica la CC, disminuye la masa muscular, y aumenta el AE y el intercambio Na-K, cambios que se observan en ambas técnicas determinados mediante BIVA, comparadas con voluntarios sanos51,52.
El concepto de malnutrición puede redefinirse incluyendo parámetros de la BIVA como el AF, PCT o MC, junto con los marcadores bioquímicos, lo que permite discriminar malnutrición-inflamación del estado de sobrecarga de volumen por otra causa53.
La obesidad confiere un riesgo de mortalidad en la población en general; los estudios observacionales en pacientes en diálisis demostraron lo contrario54. El tejido adiposo es un órgano complejo con funciones más allá del depósito energético. Los investigadores han demostrado que el efecto protector del alto IMC lo confiere la cantidad de músculo, no el tejido adiposo55. Recientemente, los mismos autores refieren la importancia en distinguir entre los dos componentes; mediante BIVA los que tienen mayor proporción de músculo evidencian mayor MC, AF, AI y metabolismo basal que en los que el tejido graso es superior al 35%. Estas variaciones van unidas a un aumento de la ingesta energética y a una disminución de la ingesta proteica y, con ello, a un mayor riesgo de eventos cardiovasculares56,57.
El propio procedimiento dialítico tiene efectos metabólicos importantes. La HD lo hace mediante el aumento del catabolismo proteico que incluye la pérdida de aminoácidos en el líquido de diálisis y por la proteólisis inducida por las citoquinas activadas por las membranas y líquidos de diálisis no ultrapuros. Esto tiene como resultado el aumento del gasto energético en un 10% y en un 133% de la proteólisis de las proteínas musculares. El sustrato de oxidación se ve alterado con disminución de los hidratos de crbono y aceleración de la oxidación de los lípidos y de los aminoácidos58,59.
La DP ejerce sus efectos catabólicos proteicos debido a las pérdidas de proteínas y aminoácidos a través del efluente peritoneal.
Los pacientes en HD tienen un nPNA mayor los días que son sometidos a diálisis. Al ser el músculo la fuente energética del organismo, su integridad debe ser un objetivo y, por tanto, su evaluación sistemática, así como el metabolismo basal, permitirán prevenir al desgaste proteico-calórico60.
Medidas preventivas, como la administración de suplementos orales nutricionales y/o nutrición parenteral intradiálisis, están siendo utilizadas con diferentes resultados61.
Finalmente, el tiempo y la frecuencia de la HD influyen en la CC. Los pacientes con sesiones de ocho horas evidencian un aumento de la reactancia y de AF, que se atribuye a los cambios en los fluidos corporales que con índices de ultrafiltración horaria más baja son menos intensos y más progresivos, lo que permite un relleno vascular más eficiente62.
BIOIMPEDANCIA VECTORIAL EN TRASPLANTE RENAL
El trasplante renal constituye el tratamiento de elección en los pacientes con ERC subsidiarios de recibirlo, y son escasas las publicaciones que analicen la CC63,64. La mayoría de los pacientes no alcanzan la función de los dos riñones nativos y en un alto porcentaje la función renal va declinando lenta y progresivamente hacia la ERCA. Es reciente la guía de manejo nutricional de los pacientes trasplantados65.
La obesidad también afecta a los pacientes sometidos a trasplante (previamente obesos y no obesos), es frecuente y multifactorial (ausencia de actividad física, predisposición genética, corrección de la uremia, edad, género y raza) y se asocia con importantes complicaciones como hipertensión, diabetes tipo 2, enfermedad coronaria y dislipemia, que incrementan la morbimortalidad postrasplante66. Contrariamente a lo descrito en los pacientes en diálisis, un alto IMC se asocia directamente con hospitalizaciones y alta mortalidad, lo que parece indicar que la recuperación o la pérdida de la función renal tienen una influencia diferente sobre cómo el tejido adiposo ejerce sus efectos metabólicos67.
El análisis de la CC mediante BIVA está despertando un interés creciente por la importancia en la selección de los candidatos, evolución y manejo de fármacos68.
La malnutrición-inflamación se asocia con la progresiva pérdida de función del injerto, la respuesta inmune frente al injerto y los episodios de rechazo. Este síndrome ha sido recientemente protocolizado con un sistema de evaluación validado de forma similar al de los pacientes con ERC y diálisis, ya que produce cambios en la CC, especialmente pérdida de masa muscular69.
Comparada la CC de los pacientes sometidos a trasplante mediante BIVA con la de la población sana de referencia, los pacientes sin deterioro inicial de la función renal (un mes después del trasplante) muestran una composición similar a la de la población de referencia, mientras que los que se encuentran en estadios iniciales de ERC (<75 ml/min/1,73 m2) evidenciaron cambios de la CC con aumento del AE, disminución del AI, menor AF e incremento del Na-K intercambiable, hallazgos similares a los observados en pacientes con ERC70,71.
El género presenta diferencias, especialmente en el pretrasplante, e influye en la evolución en los tres primeros meses posteriores al mismo. La CC pretrasplante de los hombres sometidos a trasplante, en comparación con la de controles sanos, presentó resistencia, reactancia, MC más elevados y menor AE, lo que concuerda con una situación de depleción. Sin embargo, a los tres meses del trasplante su única diferencia es un mayor AE y AT respecto a los controles. No hay diferencia en el grupo de las mujeres sometidas a trasplante72 .
Con los datos disponibles, el análisis de la CC en los pacientes trasplantados, la estratificación de los riesgos y la potenciación de la salud son retos en los datos de la BIVA pueden ser útiles.
BIOIMPEDANCIA VECTORIAL EN INSUFICIENCIA CARDÍACA Y SÍNDROME CARDIORRENAL
La prevalencia de insuficiencia cardíaca (IC) crónica (ICC) sintomática afecta a un 2% de las personas mayores de 45 años, es la causa más importante de hospitalización en las personas mayores de 65 años y constituye un problema de salud pública. La presencia de enfermedad renal en pacientes con fracción de eyección normal o baja es común, así como en pacientes con o sin sintomatología. La alteración renal desempeña un importante papel en la progresión de la enfermedad cardíaca y constituye un factor de riesgo independiente de morbimortalidad73. La relación entre el corazón y riñón ha sido recientemente redefinida como síndrome cardiorrenal (SCR)74. Aunque su mecanismo no es bien conocido, se sabe que el deterioro de la función cardíaca causa un descenso de la perfusión tisular renal, lo que explica algunos de los aspectos implicados en el SCR75.
La ICC se caracteriza por una sobrecarga de volumen de forma cíclica (pulmonar y periférica) y su eliminación (diuréticos, ultrafiltración). A pesar de la buena respuesta, la alta tasa de reingresos indica que probablemente los criterios de alta se correlacionan pobremente con la estabilización clínica. El uso de la BIVA para evaluar el fallo cardíaco ha sido examinado en el contexto de la medición del estrés miocárdico76. Combinando BIVA y BNP, en 292 pacientes disneicos, el 58,2% presentaban descompensación cardíaca aguda, mostrando valores significativamente más altos de BNP y vectores cortos en BIVA con valores predictores aislados o asociados a BNP, respecto a los que no manifestaban fallo cardíaco agudo, con lo que la combinación de BIVA y BNP resultó útil en el manejo de estos pacientes. La combinación de BIVA y Pro-BNP discrimina la disnea de origen cardíaco de la que no lo es, y mejora la rapidez y la exactitud del diagnóstico77.
El seguimiento ambulatorio de pacientes cardiópatas puede beneficiarse del uso de la BIVA con el objetivo de monitorizar el tratamiento farmacológico, consiguiéndose una reducción del 35% de los reingresos y de los costes de tratamiento14,78.
Las alternativas terapéuticas con DP o HD en el SCR, con el objetivo de mantener la estabilidad hemodinámica y un buen control del volumen y del estado nutricional, abren una puerta al uso de la BIVA para evaluar la CC junto con los marcadores de riesgo cardiovascular79.
BIOIMPEDANCIA VECTORIAL EN EL ENFERMO CRÍTICO
Cuantificar exactamente los fluidos corporales en el enfermo crítico ni es práctico ni es posible. La presión venosa central se utiliza para monitorizar la infusión de soluciones.
La BIVA demostró ser útil comparada con la presión venosa central. Ambos componentes del vector se correlacionaron inversamente con los valores de la presión venosa central. El aumento de la presión venosa central correspondió con vector corto y desplazado hacia la parte baja de la elipse, por debajo del percentil 75%. Las situaciones de depleción se asociaron con vectores largos, por encima del percentil 75%. Combinando los parámetros de hidratación tisular y la BIVA, el aporte de fluidos en los pacientes críticos es más exacto, en especial con presión venosa central baja80. En los pacientes quirúrgicos permite la monitorización durante la anestesia, facilitando la fluidoterapia y el soporte nutricional81.
En el fallo multiorgánico, con terapia sustitutiva continua, la monitorización del estado nutricional y de hidratación, especialmente del espacio extracelular, la BIVA en combinación con los marcadores séricos permite un manejo adecuado de la CC82. En el cuadro séptico tratado con drotrecogin alfa (Xigris®), el intercambio Na-K y el AF constituyen los parámetros predictores de evolución en las primeras 24 horas. En varias series, en las que incluyeron más de 30 pacientes con sepsis, el AF >4º al ingreso se correlacionó significativamente con la supervivencia83. Esta patología, además, se asocia con una pérdida del 15-20% de proteínas y potasio provenientes del músculo, disminuyendo el AI, PCT, y aumentando el AT y el AE. La BIVA permite detectar de forma precoz estos cambios y facilitar el soporte nutricional necesario al objeto de preservar el músculo84. La masa magra, compartimento de la actividad metabólica, funciona como un reservorio de aminoácidos durante la respuesta al estrés. La pérdida de MC se correlaciona con alteraciones de las funciones fisiológicas y con la supervivencia85. La monitorización de la MC es más precisa que la masa magra, debido a que esta última incluye el AE, que es fluctuante, especialmente en los sometidos a terapias continuas, mientras que la primera incluye sólo el AI. En consecuencia, la evaluación sistemática de la CC es de importancia clínica en el enfermo crítico.
BIOIMPEDANCIA VECTORIAL EN EMBARAZO DE RIESGO
Un reto importante es el análisis de los cambios de la CC en situaciones fisiológicas como es el ciclo menstrual. Las fluctuaciones importantes del peso y de la CC durante el ciclo menstrual han sido objeto de dos estudios con BIVA en mujeres que no tomaban anticonceptivos orales. Se evidenciaron variaciones en la CC en el período premenstrual de hasta dos litros en el AT86. Existe la sincronía menstrual entre aquellas mujeres que conviven en lugares de trabajo o en colegios, consistente en la normalización de los ciclos y su aparición simultanea87.
Durante el embarazo, la CC sufre cambios de adaptación y el aumento del peso es el más evidente. La CC resultante del aumento de peso no ha sido del todo aclarada, lo que justifica su estudio mediante la BIVA.
El embarazo produce un incremento del AT a expensas del AE, especialmente en los dos últimos trimestres. El AI aumenta alcanzando el máximo porcentaje al final del tercer trimestre. Tales alteraciones pueden ser explicadas por la retención de agua en algunos tejidos como mama y pelvis, con el objetivo de facilitar el trabajo del parto y el puerperio.
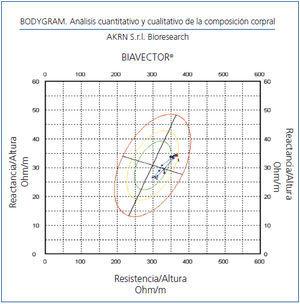
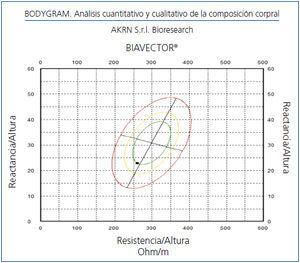
La monitorización de la CC durante el embarazo aporta información relevante sobre la calidad de la adaptación maternal a la situación fisiológica. El agua corporal se relaciona con el volumen plasmático y la BIVA nos aporta de forma directa las variaciones de la CC en sucesivas etapas (figura 3).
Además, permite detectar el aumento del AT y su distribución antes de que se evidencie clínicamente. El aumento tanto del AI como del AE se evidencia en mujeres que desarrollan hipertensión gestacional, aunque no es concluyente88.
Existen pocos estudios en los que se haya empleado la BIVA en la preeclampsia, una causa importante de mortalidad materna. Hemos seguido a 10 embarazadas con riesgo de preeclampsia, bien porque la hayan desarrollado en embarazos anteriores o bien por presentar hipertensión antes del embarazo, observando que una vez controlada la tensión arterial se producen cambios en la CC similares a los descritos por otros autores, disminuyendo la resistencia y reactancia. A partir del sexto mes de gestación la CC se acerca a la CC basal con tensión arterial y el cociente albúmina/creatinina urinaria normales (Cigarrán, datos no publicados, figura 3).
El grupo de Sao Paulo, analizado la evolución de la CC mediante BIVA en 23 embarazos con preeclampsia frente a 22 embarazos sin patología, observó un aumento del volumen del AT, del AI y un incremento del índice de resistencia (talla2 (cm)/resistencia Ohm) en el grupo de pacientes con preeclampsia. Los autores atribuyen estos cambios a la retención hidrosalina debida a la vasoconstricción generalizada, al incremento de la permeabilidad capilar y a la disminución de la excreción de sodio89.
La BIVA evalúa variaciones de la CC en el ciclo menstrual, embarazo normal y de riesgo.
CONCLUSIONES
1. La BIVA constituye una herramienta de gran valor clínico por su inocuidad, fácil uso, bajo coste y exactitud.
2. La monitorización de la composición corporal en ERC, diálisis y trasplante permite evaluar cambios en el estado de nutrición, inflamación y riesgo cardiovascular.
3. Los parámetros derivados de la BIVA han demostrado su validez en la predicción de mortalidad; el más relevante es el AF.
4. El concepto «peso seco» cambia a composición corporal adecuada o euvolémica.
5. Se abren líneas futuras de aplicación de la BIVA en situaciones poco conocidas como la insuficiencia cardíaca, el síndrome cardiorrenal, el enfermo crítico y el embarazo de riesgo.
Figura 2. Relación entre resistencia (R), reactancia (Xc) y ángulo de fase (0).
Figura 3. Monitorización de la composición corporal en embarazo de riesgo.
Figura 1. Nomograma de composición corporal normal entre percentiles 50 y 75%.