Existen diversos cuadros clínicos que pueden causar la pérdida de visión en un paciente con insuficiencia renal. Casi siempre existe daño directo sobre el nervio óptico, favorecido por la uremia y los factores de riesgo cardiovascular que suelen asociarse a ella. Es importante que el nefrólogo tenga conciencia de las posibilidades diagnósticas, dada la necesidad de tratamiento urgente y la dramática evolución de muchas de ellas a ceguera total.
INTRODUCCIÓN
La pérdida aguda de visión en pacientes urémicos es una situación clínica poco frecuente y en el contexto de patologías renales muy diversas. La bibliografía al respecto es escasa y se limita a descripciones de casos aislados, muchas de ellas en el ámbito de la neurooftalmología. Muchos ejemplos se describen en pacientes con fracaso renal agudo sin enfermedad renal previa conocida. La entidad más conocida es la neuritis óptica isquémica (NOI), pero existen otras causas como infecciones oportunistas, toxicidad farmacológica, hipertensión o leucoencefalopatía posterior. La neuritis óptica urémica es una entidad clínica vagamente definida desde el punto de vista conceptual y terapéutico, al constatarse que determinados pacientes que desarrollan ceguera súbita presentan simultáneamente una importante afectación renal. A pesar de carecer de características clínicas específicas, el diagnóstico precoz podría tener importantes implicaciones pronósticas.
Es necesaria una implicación multidisciplinar por parte de nefrólogos, oftalmólogos y neurólogos, aunque no existe evidencia científica fuerte que respalde el tratamiento. La recuperación del déficit visual dependerá en muchos casos de la corrección de factores como hipotensión relativa y anemia, del inicio temprano de hemodiálisis y de la terapia con corticoides.
Aunque la presentación clínica puede ser idéntica, el pronóstico es claramente distinto. En las formas isquémicas rara vez se recupera el déficit visual, mientras que en las formas urémicas el tratamiento con hemodiálisis y corticoides puede conseguir una franca mejoría en el plazo de unas pocas semanas o meses. En las formas secundarias a infecciones o fármacos, la evolución dependerá de un apropiado tratamiento antimicrobiano o de la retirada del medicamento, respectivamente.
Siguiendo el esquema de clasificación propuesto por Winkelmayer et al1, y como revisión de la bibliografía disponible, se analizarán las diversas etiologías que pueden conllevar a una pérdida aguda de visión en dichos enfermos.
CASOS CLÍNICOS (tabla 1)
Caso 1
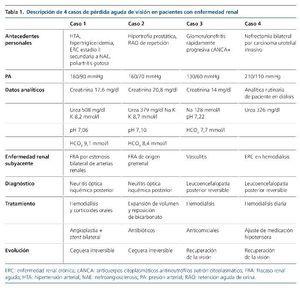
Varón de 52 años, con antecedentes de hipertrigliceridemia, hipertensión arterial (HTA), enfermedad renal crónica (ERC) II secundaria a nefroangioesclerosis y gota; fumador; refería cuadro de poliartralgias de varias semanas, tratado con corticoides y antiinflamatorios no esteroideos; acudió a urgencias por visión borrosa de 24 h de evolución, náuseas y vómitos. Fue empeorando hasta la amaurosis bilateral. Al examen físico presentaba tofos gotosos en pies y codos. Presión arterial (PA), 160/90 mmHg.
Exploración oftalmológica: papila nítida y dudoso defecto pupilar aferente.
Analítica: urea, 508 mg/dl; creatinina, 17,6 mg/dl; K, 8,2 mmol/l; pH, 7,06; HCO3, 9,1 mmol/l.
Ecografía: riñón izquierdo pequeño con cortical adelgazada y riñón derecho de tamaño normal con cortical conservada.
Resonancia magnética (RM) cerebral: lesiones crónicas por leucoencefaolopatía de pequeño vaso.
Se realizó angio-TC diagnosticándose de estenosis crítica de ambas arterias renales. Se inició hemodiálisis urgente, tratamiento con corticoides sistémicos y se realizó angioplastia de ambas arterias renales, con recuperación de la función renal previa. Fue diagnosticado de NOI. El paciente no recuperó la visión.
Caso 2
Varón de 60 años, fumador que acude a urgencias por dolor lumbar, disuria y diarrea importante. Había tomado ibuprofeno cada 3 h. En la exploración destacaban pupilas midriáticas arreactivas y signos de deshidratación. PA, 160/70 mmHg.
Analítica: creatinina, 20,8 mg/dl; urea, 379 mg/dl; Na, 128 mmol/l; K, 8,7 mmol/l; pH, 7,10; HCO3, 8,4 mmol/l.
Ecografía: riñones de tamaño normal con vía excretora izquierda dilatada y vejiga muy distendida.
A las pocas horas de su llegada presentó ceguera súbita bilateral y signos de sepsis. El paciente recuperó su función renal tras sondaje vesical, expansión de volumen y antibioterapia, pero no recuperó visión. Tomografía computarizada (TC) craneal y RM cerebral sin alteraciones relevantes. Fue diagnosticado de neuropatía óptica posterior de origen isquémico.
Caso 3
Mujer de 56 años, con diagnóstico de glomerulonefritis rápidamente progresiva cANCA (anticuerpos citoplasmáticos antineutrófilos patrón citoplasmático) en tratamiento con ciclofosfamida, que acude a urgencias por malestar general, astenia y diarrea. PA, 130/60 mmHg.
Analítica: hemoglobina, 4 g/dl; leucocitos, 3.000/µl; plaquetas, 26.000/µl; creatinina, 14 mg/dl; urea, 326 mg/dl; pH, 7,22; HCO3, 7,7 mmol/l.
Ingresó con diagnóstico de sospecha de posible infección en paciente inmunodeprimida e hipoplasia medular. Durante el ingreso, la paciente presentó 3 episodios de crisis tonicoclónica y posterior ceguera bilateral súbita. La TC craneal no reveló lesiones.
RM cerebral: lesiones sugestivas de leucoencefalopatía posterior reversible. Recibió tratamiento anticomicial y hemodiálisis, con progresiva mejoría de la clínica neurológica y recuperación completa de visión.
Caso 4
Mujer de 63 años, con entrada reciente en programa de hemodiálisis crónica tras nefrectomía bilateral por carcinoma urotelial invasivo. Presenta un episodio de pérdida de conciencia en su domicilio, con alteración de la conducta. A su llegada al hospital se objetiva una crisis comicial con movimientos tonicoclónicos. PA, 210/110 mmHg. Refería cefalea intensa desde hacía 2 semanas, coincidiendo con cifras altas de PA de reciente inicio. Ingresa con sospecha de encefalopatía hipertensiva. A las 48 h del ingreso presenta ceguera súbita. Se descartó patología infecciosa o diseminación tumoral por punción lumbar.
TC craneal: 2 lesiones hipodensas en área occipital.
RM cerebral (secuencias T2 y DW): áreas bilaterales de señal hiperintensa, corticosubcorticales, afectando ambos lóbulos occipitales y parietales.
Fondo de ojo: signos de retinopatía hipertensiva.
Se ajustó tratamiento antihipertensivo y se realizó hemodiálisis diaria durante el ingreso, con mejoría de la clínica neurológica y recuperación del déficit visual.
DISCUSIÓN
Entidades responsables de la pérdida aguda de visión (tabla 2)
Las causas más frecuentes de pérdida de visión en los pacientes con enfermedad renal son la retinopatía diabética y la hipertensiva, que pueden producir amaurosis por edema macular o por atrofia del nervio óptico. También puede haber déficits visuales secundarios a patologías benignas (cataratas, hemovítreo), enfermedades sistémicas autoinmunes (vasculitis, esclerosis múltiple), infecciones con tropismo ocular, o al efecto tóxico de fármacos. En estos casos, la pérdida de visión puede ser rápida, asociar dolor y síntomas acompañantes que orientan el diagnóstico.
La primera referencia en la literatura de amaurosis y enfermedad renal data del año 1881, en la que Dobrowolsky2 describe un caso de ceguera total en una niña de 10 años con glomerulonefritis postestreptocócica, que recuperó la visión cuando se restableció su función renal. Ha de pasar casi medio siglo antes de que se vuelvan a publicar nuevos casos de pérdida visual en relación con patología renal, apareciendo la mayoría en literatura oftalmológica.
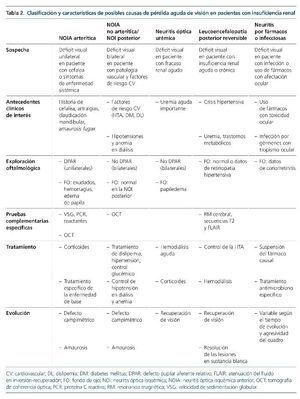
Neuritis óptica isquémica. Es una de las etiologías más frecuentes entre los nuevos casos de ceguera súbita asociada a enfermedad renal, dada la elevada prevalencia de factores de riesgo cardiovascular en la población actual. La NOI3 representa un evento isquémico a nivel de la vasculatura ocular que afecta principalmente a las arterias ciliares posteriores cortas causando un defecto de perfusión del nervio óptico, que es especialmente sensible a la isquemia. Esta susceptibilidad, además, está incrementada en el paciente urémico, por cambios en la viscosidad sanguínea y la agregación plaquetaria.
Debe diferenciarse entre NOI anterior (NOIA) o posterior4. La forma anterior se caracteriza por la existencia de un defecto pupilar aferente, alteraciones campimétricas y presencia de lesiones (edema, exudados, hemorragia) alrededor del nervio óptico. Suele ser de presentación monocular, pero con riesgo de extensión bilateral. La forma posterior, o retrobulbar, se caracteriza por la ausencia de lesiones en el fondo de ojo y se diagnostica siempre por exclusión. Se dice que “el paciente no ve nada, y el oftalmólogo tampoco”. La presentación es casi siempre bilateral de inicio.
En la NOIA es importante diferenciar entre formas arteríticas y las no arteríticas. Las NOIA arteríticas5 son secundarias a los fenómenos inflamatorios de la arteritis de células gigantes o de las vasculitis, y precisan tratamiento urgente porque con frecuencia se hacen bilaterales. Se diagnostican por el contexto clínico (cefalea, síntomas de enfermedad sistémica, velocidad de sedimentación globular elevada). Las formas no arteríticas son neuritis por hipoperfusión o infartos del nervio óptico.
La etiología de la NOIA no arterítica es multifactorial y está asociada al riesgo cardiovascular: dislipemia, hipertensión crónica y arteriosclerosis avanzada. En los pacientes con ERC habría que tener en consideración el hiperparatiroidismo secundario y la hiperfosforemia. Las hipotensiones intradiálisis y los cambios bruscos en las cifras de hemoglobina podrían desencadenarla6-9.
Neuropatía óptica asociada a fármacos. La rica vascularización ocular hace que este órgano sea especialmente sensible al efecto tóxico de diversos fármacos10,11. En ocasiones, estos efectos son leves y transitorios tras la retirada del medicamento, pero otras veces pueden ser graves. Debido a la difusión sistémica del fármaco, la afectación es bilateral. La evolución del cuadro puede ser lenta (a lo largo de años) o rápida. La enfermedad renal es un factor potenciador de toxicidad, especialmente si no se hace ajuste de dosis del fármaco en cuestión. Existe una amplia lista de fármacos con toxicidad a nivel del nervio óptico, que incluye linezolid, etambutol, isoniazida, amiodarona, metotrexato, infliximab, vincristina, cisplatino, carboplatino, paclitaxel, cloroquina e hidroxicloroquina10,22.
Los inmunosupresores empleados en el trasplante excepcionalmente producen afectación ocular, aunque hay descritos casos aislados de neuropatía óptica. Los inhibidores de la calcineurina además pueden producir alteraciones neurológicas a través de mecanismos vasculares por toxicidad sobre el endotelio12. Estas alteraciones en general son dependientes de los valores plasmáticos del fármaco, aunque no necesariamente.
Neuropatía óptica por infecciones. Los pacientes con uremia grave y los trasplantados renales presentan una situación de inmunosupresión que los hace susceptibles a infecciones que pueden cursar con afectación ocular grave1,13. Las más frecuentes son coriorretinitis por citomegalovirus, herpes y toxoplasma. También existen casos descritos de coriorretinitis en la tuberculosis, la sífilis y la enfermedad de Lyme, así como secundarias a ciertos parásitos. Las meningitis criptocócicas también pueden causar ceguera cortical.
Leucoencefalopatía posterior reversible. Síndrome descrito por primera vez en 1996 por Hinchey et al14. Su nomenclatura hace referencia a una afectación predominante de la sustancia blanca encefálica occipital (fig. 1), que se caracteriza por la reversibilidad de los síntomas y los hallazgos de neuroimagen una vez corregido el proceso primario que la desencadena. Es una forma de encefalopatía toxicometabólica que aparece como complicación de enfermedades médicas que pueden cursar con hipertensión y fracaso renal agudo. Es de presentación aguda o subaguda, con síntomas como cefalea, confusión, náuseas, vómitos, crisis comiciales, visión borrosa o ceguera completa. El principal desencadenante es la HTA acelerada, como forma de encefalopatía hipertensiva. Algunos pacientes pueden desarrollarlo con elevaciones moderadas de la PA, especialmente si asocian fracaso renal agudo y trastornos hidroelectrolíticos.
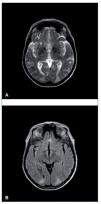
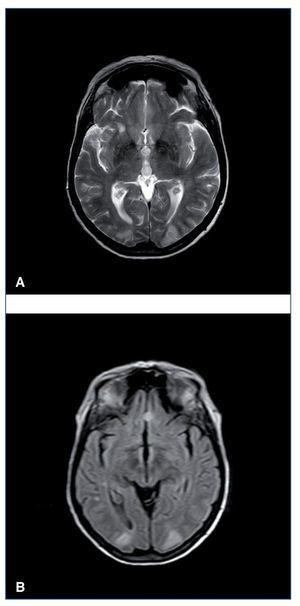
Figura 1. Resonancia magnética cerebral en secuencias T2 (A) y FLAIR (B). Imágenes hiperintensas en la región corticosubcortical de ambos lóbulos occipitales.
Se ha propuesto como mecanismo fisiopatológico la pérdida de la autorregulación vascular cerebral por cifras muy altas de PA, que provocaría vasodilatación arteriolar, disfunción endotelial con disrupción de la barrera hematoencefálica y finalmente edema vasogénico, que es reversible12. Se propone que la afectación predominante en sustancia blanca podría deberse a una menor inervación simpática perivascular a ese nivel, por lo que se perdería antes la capacidad de vasoconstricción autorreguladora en esas zonas.
La mayor parte de casos se asocian con la encefalopatía hipertensiva, la eclampsia15 y con enfermedades que cursan con insuficiencia renal aguda o subaguda: glomerulonefritis agudas16, vasculitis, crisis esclerodérmicas, nefritis lúpica, síndrome hemolítico urémico, púrpura trombocitopénica trombótica. La hipertensión secundaria sería el principal responsable, aunque las toxinas urémicas y la sobrecarga de volumen podrían intervenir alterando la integridad vascular.
Neuritis óptica urémica. El término inicialmente propuesto por Knox et al13 trataba de definir un daño óptico en el seno de un fallo renal agudo y grave. Se alude al efecto neurotóxico de las toxinas urémicas acumuladas, entre ellas, el fósforo. Podría añadirse un efecto osmótico brusco que favorecería el edema. Aun así, se desconoce por qué se afectan exclusivamente los nervios ópticos; podría deberse a la rica vascularización ocular que ofrecería mayor aporte de toxinas.
El diagnóstico es de exclusión tras descartar las patologías previas, y no suele ser oftalmológico de inicio, puesto que el abordaje médico está determinado por el fracaso renal. Puede sospecharse cuando el paciente presenta ceguera bilateral con papiledema. Las pruebas de neuroimagen no muestran alteraciones, a diferencia de la leucoencefalopatía posterior. Solo la evolución clínica y visual del paciente orientará hacia un trastorno isquémico o metabólico.
Los pocos casos disponibles en la bibliografía con este diagnóstico8,13,17 fueron los que mejoraron tras iniciar tratamiento con corticosteroides y hemodiálisis. No hay evidencia de que ninguno de estos tratamientos sea claramente responsable de la mejoría ocular, pero el aclaramiento de sustancias neurotóxicas debe tener cierta relevancia. El uso de corticoides en esta situación es totalmente empírico.
Este tipo de neuropatía se relaciona más con situaciones de uremia aguda, puesto que no existen casos descritos en pacientes con ERC avanzada. El motivo no está aclarado, aunque es conocido el papel neuroprotector de la uremia crónica.
Clínica y diagnóstico
Todo paciente con enfermedad renal y pérdida aguda de visión mono- o binocular exige comprobar las cifras de PA y descartar un fracaso renal agudo o sobreañadido a un deterioro renal previo silente. La importancia de un abordaje precoz y multidisciplinar reside en el solapamiento clínico de estos cuadros y la potencial reversibilidad de algunos de ellos.
La clínica consiste en pérdida de agudeza visual súbita o progresiva a lo largo de horas o días. Puede existir una alteración campimétrica progresiva con escotomas de diversas localizaciones o cursar con ceguera total.
Examen oftalmológico. En la NOIA unilateral existe un defecto pupilar aferente o eferente (fallo de los reflejos fotomotores), que es excepcional en las formas bilaterales. La cámara anterior es normal. En el fondo de ojo se observa un disco óptico hiperémico, edematoso y se puede encontrar infarto de la capa de fibras nerviosas, con exudados superficiales y hemorragias en astilla. Todos estos hallazgos pueden estar presentes también en las neuritis urémicas. La tomografía de coherencia óptica (OCT)18,19 permite obtener imágenes tomográficas de la capa de fibras nerviosas de la retina y nervio óptico a gran resolución. La angiografía fluoresceínica se utiliza mucho menos. El diagnóstico de las NOIA arteríticas viene dado por el cuadro clínico acompañante (claudicación mandibular, cefalea de perfil temporal, episodios de amauroxis fugax) con reactantes de fase elevados.
Cuando se sospecha encefalopatía (deterioro cognitivo, crisis convulsivas, estupor, coma) es fundamental la realización de una prueba de imagen cerebral, TC o RM para descartar una leucoencefalopatía posterior reversible. Aunque en la TC se pueden ver imágenes hipodensas en los sectores afectados por el edema y serviría para el diagnóstico, la RM es la técnica de elección (secuencias T2 y FLAIR, que mostrarían señales hiperintensas en la sustancia blanca subcortical a nivel parietooccipital). En contexto infeccioso deberá realizarse punción lumbar con estudio microbiológico del líquido cefalorraquídeo.
Tratamiento y pronóstico
No es posible revertir el deterioro visual ocasionado por la isquemia del nervio óptico, aunque se puede actuar sobre los factores de riesgo que lo precipitan. Debe asegurarse un buen control de la PA, lipídico y del hiperparatiroidismo secundario. Hay que prestar atención a las hipotensiones intradiálisis y los cambios bruscos de hematocrito. Una vez instaurado el cuadro clínico, generalmente es irreversible. El uso de antiagregantes solo estaría indicado en casos donde se demuestre una etiología tromboembólica4.
La neuritis óptica urémica desaparece cuando el paciente es sometido a hemodiálisis aguda, aunque se desconoce si un inicio más temprano de la depuración renal se asocia a una evolución más favorable. El tratamiento con corticoides es totalmente empírico y podría tener teóricos beneficios disminuyendo el edema del nervio óptico. En las neuritis ópticas de la esclerosis múltiple no parece haber diferencias en el pronóstico a largo plazo entre diversas pautas de corticoides orales o intravenosos20, siendo la recuperación de visión más rápida al iniciar el tratamiento con metilprednisolona intravenosa21, por lo que se podría optar por seguir una pauta similar.
En la leucoencefalopatía posterior reversible, las lesiones se resuelven completamente tras corregir la hipertensión y los factores metabólicos predisponentes. Es importante haber descartado previamente patología isquémica, donde la normalización de las cifras de PA podría ser contraproducente. El cuadro suele revertir tras el inicio de diálisis, aunque en algunos casos el edema vasogénico puede progresar a edema citotóxico y hacerse irreversible12.
El manejo del resto de cuadros clínicos se basa en la retirada de fármacos neurotóxicos o el tratamiento antimicrobiano específico.
Análisis de los casos clínicos
Los casos clínicos expuestos son representativos de las entidades referidas previamente. Los pacientes con enfermedad renal suelen asociar factores de riesgo cardiovascular que les predisponen a padecer neuritis isquémicas, como sucede en el primer caso clínico, en el que tanto la patología ocular como la renal se asentaban sobre fenómenos arterioscleróticos. El segundo caso fue diagnosticado de neuritis isquémica posterior ante la ausencia de alteraciones en el fondo de ojo y en las pruebas de imagen, aunque también podría haberse tratado de una neuritis urémica evolucionada, puesto que el paciente no fue dializado. Finalmente, el tercer y cuarto casos representan cuadros típicos de leucoencefalopatía posterior reversible, donde las manifestaciones neurológicas desaparecieron al corregir las cifras de PA e iniciar hemodiálisis.
Agradecimientos
Los autores reconocen la cooperación de personas que ayudaron a la recopilación de datos y redacción del manuscrito, así como la supervisión de la información clínica aquí presente.
Agradecimientos a la Dra. Concepción Álvarez Sanz, del Servicio de Radiodiagnóstico del Hospital Universitario Príncipe de Asturias, por su ayuda a la hora de interpretar las pruebas de imagen cerebral.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Correspondencia:
Vanessa Lopes Martín
Sección de Nefrología. Hospital Universitario Príncipe de Asturias.
Carretera Alcalá-Meco, s/n.
28805 Alcalá de Henares, Madrid.
vanloma82@gmail.com