INTRODUCCIÓN: IMPORTANCIA EPIDEMIOLÓGICA DE LA NEFROPATÍA CRÓNICA EN TRASPLANTE NO RENAL (NCT NO RENAL)
El lento y progresivo deterioro de la función renal que se produce en los pacientes trasplantados no renales se conoce desde hace décadas1, aunque va adquiriendo dimensiones significativas como consecuencia de la generalización de este tipo de trasplantes. Según datos de Ojo2, en el año 2005 más de 250.000 pacientes habían recibido un trasplante no renal en el mundo. Actualmente3, se calcula que se practican cada año unos 100.000 trasplantes no renales con el siguiente orden de frecuencia: hígado (50%), corazón, pulmón, corazón-pulmón e intestino. La longevidad de los pacientes trasplantados ha aumentado progresivamente y, solamente en los Estados Unidos de América, 70.000 personas viven en estos momentos con un órgano no renal trasplantado, acercándose a 100.000 las personas que viven con un riñón trasplantado. Las consecuencias de esta pérdida de la función renal no serán sólo las derivadas del incremento de la morbimortalidad de los pacientes, sino que incluirán importantes pérdidas de tipo económico. Por otro lado, la pluripatología de estos trasplantados y el uso generalizado de fármacos anticalcineurínicos hará que la mayoría de aquéllos requieran revisiones periódicas realizadas por nefrólogos expertos en trasplantes y disfunción renal.
La afectación renal que se puede producir en los pacientes con este tipo de trasplantes puede ser aguda y crónica. La aguda suele definirse como una pérdida del 25% de la función renal previa, como un incremento de 0,5 mg/dl de creatinina plasmática o como unos niveles de creatinina superiores a 2 mg/dl en los pacientes que tenían previamente una buena función renal4-8. El fracaso renal agudo en el perioperatorio inmediato se cifra entre un 46-61% en trasplantados hepáticos; entre un 20-30% en trasplantados cardiacos y entre un 5-60% en trasplantados pulmonares. Asimismo, la necesidad de diálisis en el perioperatorio (10-25%) tiene un impacto negativo en la supervivencia de los enfermos frente a los que no desarrollan esta complicación (92 vs. 50%)9-12.
La incidencia de enfermedad renal crónica (ERC) en pacientes trasplantados no renales oscila entre el 10-83%, aunque es muy importante el criterio que se adopte para definirla. Algunos autores consideran que a los tres años del trasplante, entre el 80-100% de los trasplantados no renales tendrá algún grado de afectación renal1,13. Un intento de definición3 considera la ERC grave como un aclaramiento de creatinina inferior a 30 ml/min por 1,73 m2 de superficie corporal. La tabla 1 muestra la frecuencia de los estadios IV-V en 70.000 trasplantados no renales según las guías KDOQI14. Los casos más graves requerirán tratamiento sustitutivo con diálisis (2,6-25%), siendo los pacientes más afectados los de trasplante cardiaco (0-23%), seguidos de los de trasplante hepático (1,4-10%) y pulmonar (1,6-5%)6-8;15-18. En España, existen dos estudios cooperativos no publicados (estudios ICEBERG y CAPRI) en los que podemos observar como la prevalencia de la ERC a los 7,7 años del trasplante cardiaco es del 32% si consideramos como disfunción renal significativa unos valores de creatinina superiores a 2 mg/dl, y del 46% si consideramos una TFG (tasa de filtrado glomerular) inferior a 50 ml/min/1,73 m2.
En resumen, las consecuencias de la insuficiencia renal serán múltiples, destacando tanto la disminución de la supervivencia del paciente (hasta cuatro veces) como la del injerto; el aumento de la estancia hospitalaria, del número de reingresos y de los costes económicos, y la dificultad de uso de los fármacos inmunosupresores y de otras drogas requeridas en el tratamiento de los pacientes trasplantados8;19-22.
MECANISMOS FISIOPATOLÓGICOS GENERALES DE LA NCT NO RENAL
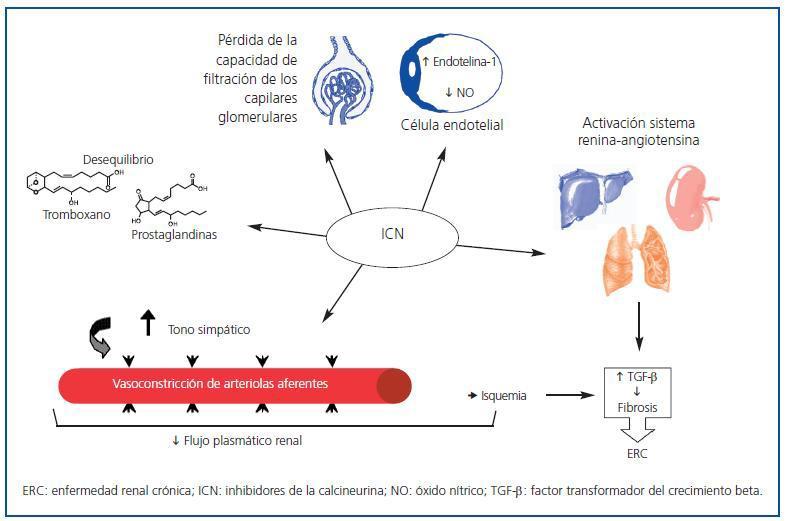
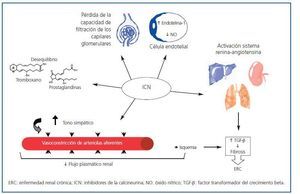
Numerosos factores contribuyen a la aparición y el desarrollo de la NCT no renal. Entre los más importantes, cabe destacar el uso generalizado de fármacos inhibidores de la calcineurina (ICN) (ciclosporina y tacrolimus)18. Desde su introducción en los protocolos de inmunosupresión, la supervivencia de los injertos a un año ha aumentado un 60-90%. Sin embargo, los ICN presentan un importante efecto secundario: su nefrotoxicidad23. Se han descrito distintos mecanismos que la producen, como la disminución del flujo plasmático renal24, la pérdida de la capacidad de filtración de los capilares glomerulares, la vasoconstricción de arteriolas aferentes por aumento del tono simpático, la activación del sistema renina-angiotensina, el desequilibrio entre tromboxano y prostaglandinas, el aumento de la producción de endotelina-1 y la disminución de la producción de óxido nítrico por las células endoteliales3. También se ha descrito la existencia de toxicidad directa sobre células endoteliales y tubulares, y es bien conocido que la vasoconstricción (dosis-dependiente) causa isquemia, aumento de la síntesis del factor transformador del crecimiento beta (TGF-β), fibrosis y, finalmente, insuficiencia renal crónica25,26 (figura 1). Asimismo, existe una predisposición individual a la nefrotoxicidad por ICN.
Otro aspecto muy importante es que existen claras diferencias entre la nefrotoxicidad por ICN sobre riñón propio (NCT no renal) o sobre riñón trasplantado. Esto se debe a que el riñón trasplantado es menos susceptible a la vasoconstricción producida por vía simpática debido a que se trata de un riñón desnervado, mientras que el riñón propio no lo está. Ello hace que en las biopsias de riñón propio se vean más lesiones isquémicas que en las de riñón trasplantado27. Sin embargo, el riñón trasplantado está sujeto a fenómenos inmunológicos que no afectan al riñón propio18,28-30.
FACTORES DE RIESGO DE LA NCT NO RENAL
Existen varios factores que predisponen a la aparición de NCT no renal. La mayoría de ellos son comunes a todos los tipos de trasplante no renal, aunque algunos son más específicos de determinados tipos de trasplante2,3. En general, se dividen atendiendo a si preceden, coinciden o son posteriores al momento del trasplante.
Factores predisponentes pretrasplante
- Insuficiencia renal crónica previa.
- Edad avanzada.
- Sexo masculino.
- Diabetes mellitus.
- Hipertensión arterial.
- Dislipemia.
- Hipoperfusión renal mantenida (insuficiencia cardiaca, síndrome hepatorrenal, etc).
- Patología glomerular concomitante (especialmente en trasplante hepático).
- Pacientes con anticuerpos para el virus de la hepatitis C (VHC).
- Cardiopatía isquémica.
- Trasplantados pulmonares por fibrosis quística.
- Polimorfismo genético frente al TGF-β.
- Hiperuricemia.
Factores predisponentes peritrasplante
- Hemorragia quirúrgica.
- Hipotensión e inestabilidad hemodinámica intraoperatoria.
- Hemólisis por circulación extracorpórea.
- Uso de fármacos presores.
- Insuficiencia renal aguda.
- Antibióticos y otros agentes nefrotóxicos.
- Rechazo agudo postrasplante del órgano no renal.
- Administración intravenosa de ICN.
- Infecciones oportunistas (citomegalovirus, etc.).
- Sepsis.
Factores predisponentes postrasplante a medio y largo plazo
- Función renal a un año del trasplante.
- Hipertensión arterial.
- Diabetes de novo postrasplante.
- Dislipemia.
- Proteinuria importante.
- Grado de exposición a los ICN.
- Infección crónica por poliomavirus.
En el trasplante cardiaco (TC), la comprobación de que la afectación renal en estos pacientes puede tener varios orígenes y factores predisponentes la sugirieron Greenberg A et al.1,31 en su estudio anatomopatológico renal de 24 pacientes trasplantados de corazón. Observaron que el 60% de estas biopsias renales mostraban toxicidad por ICN, el 30% nefropatía hipertensiva, el 16% glomeruloesclerosis segmentaria-focal y el 6% nefropatía diabética. La afectación por ICN es especialmente trascendente, ya que estos fármacos (ciclosporina y tacrolimus) forman parte del régimen inmunosupresor habitual en el mantenimiento de los pacientes trasplantados cardiacos. De hecho, en el último Registro Español de Trasplante Cardiaco publicado se puede observar que a prácticamente la totalidad de los pacientes trasplantados en España se les administran estos fármacos como parte del tratamiento de mantenimiento32.
El estudio español CAPRI mostró que, aunque tanto la exposición a ciclosporina como a tacrolimus se asociaban a nefrotoxicidad, este último ofrecía un perfil de mayor protección renal con menos toxicidad que la ciclosporina de forma estadísticamente significativa, con una reducción del riesgo del 35% (Delgado J. ISHLT 2009, enviado para publicación). No obstante, en un reciente metaanálisis tan sólo se demostró una mayor tendencia a la entrada en diálisis en pacientes trasplantados cardiacos que llevaban ciclosporina frente a tacrolimus33.
Aunque se acepta que la exposición a ICN es nefrotóxica, existen todavía puntos por aclarar, ya que no siempre se relacionan con la disfunción renal en los análisis multivariantes. Así, a veces, dosis bajas son muy nefrotóxicas, lo que sugiere que existe susceptibilidad individual. Por otro lado, también se ha observado que una reducción de las dosis no siempre se acompaña de mejoría de la función renal, lo que se ha relacionado con el tiempo desde el TC y con los factores asociados.
En los trasplantes pulmonares, aparte de los factores comunes anteriormente mencionados, se ha demostrado una especial predisposición a la NCT no renal en los pacientes cuya enfermedad pulmonar de base era una fibrosis quística, posiblemente relacionado con la colonización pulmonar crónica por Pseudomonas, el uso frecuente de aminoglucósidos para su tratamiento34, el riesgo de amiloidosis y la presencia de alteraciones renales en relación con su enfermedad (oxalosis, urolitiasis y calcinosis medular)35. Se han encontrado más fenómenos renales de glomeruloesclerosis relacionados con la hipoxia crónica del paciente con insuficiencia respiratoria de larga evolución. El uso de anfotericina B también se ha relacionado claramente con el desarrollo de insuficiencia renal crónica postrasplante pulmonar.
En el caso del trasplante hepático, se añade a los factores comunes la coexistencia de infecciones víricas que pueden afectar al riñón nativo a partir del depósito de inmunocomplejos. Asimismo, es frecuente encontrar depósitos de inmunoglobulina A (IgA) en el riñón propio de pacientes afectados de hepatopatía crónica o crioglobulinemia ligada al VHC36.
PREVENCIÓN
Hay que tener en cuenta los siguientes puntos para la prevención de la ERC en trasplantados no renales:
- Identificación del paciente de riesgo. Será un punto clave en la prevención de la NCT no renal. Aunque muchos de los factores de riesgo existentes pretrasplante no pueden evitarse (edad avanzada, sexo masculino, hipoperfusión renal mantenida, insuficiencia cardiaca, síndrome hepatorrenal y patología asociada como hipertensión arterial (HTA), diabetes, ERC, cardiopatía isquémica, VHC, etc.). La objetivación por parte del médico de trasplante de que el paciente tiene alto riesgo de sufrir insuficiencia renal ayudará a que todos los cuidados perioperatorios sean los adecuados para este tipo de pacientes. En general, se evita el uso de fármacos nefrotóxicos y las situaciones de compromiso hemodinámico que agravarían la función renal de estos pacientes. También se aconseja evitar el uso de ICN de forma endovenosa (ev.) para impedir los picos sanguíneos tan nefrotóxicos de estos fármacos en pacientes de riesgo3. Al mismo tiempo, se evitarán o corregirán todos los factores de riesgo pretrasplante mencionados.
- Cuidados perioperatorios. La técnica quirúrgica debe ser muy cuidadosa y obviar, en la medida de lo posible, los sangrados importantes, hipotensiones, uso de fármacos presores por la vasoconstricción renal asociada, episodios de rechazo agudo, sepsis, etc. El manejo de los fluidos también debe ser cuidadoso y la profilaxis antibiótica, suficiente y apropiada.
- Manejo inicial del tratamiento inmunosupresor. Como ya se describió anteriormente, los ICN son los inmunosupresores más utilizados en la actualidad en el mundo del trasplante. Cuando el paciente es de riesgo para el desarrollo de insuficiencia renal aguda, es recomendable evitar su uso inicial, especialmente de forma ev. Si consideramos que necesitamos mayor cobertura inmunológica frente al rechazo agudo, podemos administrar anticuerpos policlonales o monoclonales37,38, y no introducir los ICN hasta que el paciente se haya recuperado hemodinámicamente o hasta que mejore la insuficiencia renal aguda (en general, Cr <3 mg/dl) que haya podido tener por un trastorno hemodinámico. Tampoco debe olvidarse la monitorización de los niveles de ICN. En el trasplante cardiaco, un reciente trabajo ha demostrado una eficacia similar a corto-medio plazo de un protocolo inmunosupresor inicial combinado de ciclosporina-everolimus frente a otro basado en everolimus-ácido micofenólico39.
- En caso de insuficiencia renal aguda, la hemodiálisis y las técnicas de ultrafiltración deberán ser cuidadosas, para evitar hipotensiones e inestabilidad hemodinámica que pudieran agravar o retardar la recuperación de dicha insuficiencia renal.
- Evitar la toxicidad renal farmacológica. Esto incluye sustancias nefrotóxicas, como antibióticos aminoglucósidos (caso de ser necesarios, la monitorización de los niveles de éstos y de la función renal es imprescindible)40, anfotericina B41, ICN en altas dosis42, antiinflamatorios no esteroideos43, contrastes yodados44, etc.
- Uso de fármacos nefroprotectores. Los más recomendados serían los bloqueantes de los canales del calcio dihidropiridínicos, los inhibidores de la enzima de conversión de la angiotensina (IECA) y los antagonistas de los receptores de angiotensina II (ARA II)45-47. La combinación de éstos daría protección teórica contra los componentes hemodinámicos de la NCT no renal y contribuiría a contrarrestar los efectos vasculares y túbulo-intersticiales de la angiotensina II, el TGF-β y otros mediadores crónicos de inflamación y fibrosis3.
- Tratamiento inicial sin inhibidores de la calcineurina. Se basa en la asociación de fármacos no nefrotóxicos, como los inhibidores del mammalian target of rapamycin (im-TOR) y los derivados del ácido micofenólico. Su uso inicial generalmente se acompaña de inducción con sueros policlonales o monoclonales25,48-50, al objeto de evitar episodios de rechazo agudo. Presenta como inconveniente el potencial peligro de los im-TOR sobre los fenómenos de cicatrización50 y el retraso en la resolución de la necrosis tubular aguda. Sin embargo y, muy recientemente, el Estudio Callisto51 no objetivó que el tratamiento inicial con everolimus prolongara los episodios de necrosis tubular aguda y causara más complicaciones derivadas de alteraciones de la cicatrización osquirúrgica.
- Reducción de las dosis iniciales de ICN. Encaminada, lógicamente, a disminuir la nefrotoxicidad asociada a éstos. En el caso de órganos vitales y al objeto de evitar el rechazo agudo, suele apoyarse en una inducción más potente (especialmente anticuerpos antilinfocitarios de tipo policlonal) junto con fármacos antiproliferativos (derivados del ácido micofenólico o inhibidores de la m-TOR) y corticosteroides52. Existen, por otro lado, varios estudios realizados en amplias series de pacientes que demuestran la eficacia y la seguridad de las combinaciones de everolimus o sirolimus en dosis plenas, combinados con dosis reducidas de inhibidores de la calcineurina en trasplante renal de novo. Pascual et al.53 demostraron que everolimus en dosis plenas permitía una reducción del 57% de las dosis de ICN sin afectar a la eficacia inmunosupresora del tratamiento. En el caso de utilizar ICN junto con un im-TOR, es bien sabido que tacrolimus sería menos nefrotóxico que ciclosporina en el marco de esta asociación54.
- Conversión precoz a inhibidores de la im-TOR (everolimus, sirolimus). En general, hablamos de conversión precoz de ICN a im-TOR cuando ésta se realiza entre los 2-6 meses postrasplante. El objetivo sería evitar que los ICN con los que se ha hecho la inducción y el tratamiento inicial del trasplante pudieran contribuir de forma importante al desarrollo de NCT. Sabemos por numerosos estudios55-57 que la conversión a im-TOR es mucho más efectiva cuando se realiza de forma precoz que cuando es más tardía, posiblemente porque las lesiones renales están ya más establecidas. Una posibilidad que cabe considerar, pues, especialmente en pacientes con factores de riesgo de NCT, es la sustitución de los ICN por los inhibidores de la m-TOR. El paciente quedaría con una pauta inicial de mantenimiento con inhibidores de la im-TOR como fármaco base acompañados de derivados del ácido micofenólico y prednisona58,59. Groetzner et al. han descrito muy buenos resultados de función renal con la conversión a im-TOR en pacientes trasplantados cardiacos60. Existe, sin embargo, otra pauta de conversión precoz a inhibidores de la im-TOR que contempla su introducción igualmente precoz, pero acompañada de una reducción de las dosis de ICN (aproximadamente a la mitad), y la eliminación del ácido micofenólico. Dicha pauta presenta como ventajas la disminución clara de la nefrotoxicidad por ICN sin la eliminación de éstos para aquellos grupos que se sienten más seguros con su utilización en fases iniciales del trasplante. A ello se añade el potencial antifibrótico61, antivírico48,62,63 y antineoplásico de los im-TOR64. El estudio Callisto51 ha demostrado que el inicio del tratamiento con everolimus al segundo mes postrasplante, junto con la reducción del ICN, es muy adecuado para equilibrar la eficacia inmunosupresora y la toxicidad por ICN. Otra opción que cabe considerar es la introducción precoz del im-TOR y la eliminación del CNI, quedando el paciente con una inmunosupresión de mantenimiento mediante inhibidores de la im-TOR y ácido micofenólico. La ventaja de este régimen es la franca mejoría de la nefrotoxicidad por ICN56.
DIAGNÓSTICO PRECOZ. ¿CUÁNDO REMITIR AL NEFRÓLOGO?
Tras la identificación del paciente de riesgo, el siguiente paso será el diagnóstico precoz de la disfunción renal, ya sea aguda o crónica. En el caso de los pacientes trasplantados renales, las recomendaciones de las guías KDIGO y KDOQI sugieren que todos ellos deben considerarse como afectados de distintos grados de ERC y requieren una estricta y correcta monitorización de su función renal14. Posiblemente, esta recomendación deba mantenerse en el trasplante no renal para poder diagnosticar precozmente la NCT y realizar las intervenciones terapéuticas, especialmente del tratamiento inmunosupresor, que consideremos oportunas. Para ello disponemos de varios elementos:
Detección bioquímica
- Creatinina plasmática. Es un parámetro que tiene muchas limitaciones para el diagnóstico precoz de la NCT, ya que cuando se eleva traduce una pérdida de la función renal que puede llegar al 50%65,66. No sirve, pues, para el diagnóstico precoz de la NCT. Sin embargo, tiene varias ventajas: se puede realizar fácilmente en todos los centros, tiene un bajo coste y la mayoría de los facultativos están acostumbrados a trabajar con ella.
- Aclaramiento de creatinina. Es un mejor predictor de la función renal que la creatinina plasmática aislada. Para su cálculo, requiere una correcta recogida de orina de 24 horas (lo contrario altera enormemente el resultado). Utiliza las concentraciones plasmáticas y urinarias de creatinina. Debe corregirse según la superficie corporal del paciente65,66.
- Ecuaciones para el cálculo del filtrado glomerular. Existen varias, siendo las más utilizadas la de Cockcroft-Gault67, el MDRD (Modification of Diet in Renal Disease)66 y la fórmula de Nankivell68. A pesar de que todas ellas tienen sus limitaciones, pueden detectar de forma mucho más temprana que la creatinina plasmática una situación de disfunción renal aguda o crónica. La National Kidney Foundation propone, en las guías K/DOQI (Kidney Disease Outcomes Quality Iniative), el uso del MDRD-4, ya que asume que una gran parte de los trasplantados de órgano sólido estarán afectados de ERC. Es importante remarcar, no obstante, que ninguna de las ecuaciones anteriormente descritas ha sido validada en trasplante renal o no renal.
- Cistatina C. Se trata de una molécula proteica endógena que puede ser utilizada como marcador de la función renal. Se cree que no se ve afectada por la edad, el sexo o la raza, y que está producida por casi todas las células. La cistatina C se filtra totalmente por el glomérulo y no reabsorbe ni secreta en los túbulos renales. Su uso en el trasplante renal debe ser todavía validado, aunque existen varios estudios que sugieren su utilidad69-71.
- Inulina. El cálculo del aclaramiento renal mediante inulina es el método de referencia para la medición del filtrado glomerular. Presenta como inconvenientes su coste, laboriosidad y que requiere varias extracciones sanguíneas, lo que dificulta su uso en la práctica clínica habitual72,73.
- Cálculo del aclaramiento renal mediante radioisótopos. Es bastante exacto y aporta información de la función renal, de la perfusión vascular y de la via urinaria. El filtrado mediante isótopos ha demostrado tener una relación directa con las lesiones de fibrosis observadas en la biopsia renal y clasificadas mediante Banff74. Los isótopos más utilizados han sido el tecnecio 99, el cromo EDTA 51 y el yodo 12573,75.
- Agentes de contraste no radiactivos. Introducidos recientemente, los más utilizados son el iohexol y el iothalamato no radiactivo. Se han propuesto como sustitutos del aclaramiento de inulina76,77. No presentan problemas de radiactividad y deben determinarse en sangre unas 4-6 horas después de su administración.
Remisión al nefrólogo
Tras la sospecha clínica y analítica de disfunción crónica del injerto, es muy aconsejable la remisión del paciente trasplantado no renal al nefrólogo de trasplante. Entre los principales criterios de derivación cabe citar los siguientes:
- Paciente que tenía una función renal deteriorada previamente al trasplante (MDRD <60 ml/min).
- Paciente con varios factores de riesgo de insuficiencia renal con anterioridad al trasplante.
- Deterioro progresivo de la función renal tras el trasplante. Conviene tener presente que debe objetivarse con la medida directa o por fórmula del filtrado glomerular estimado. La creatinina plasmática no es una forma correcta de seguimiento.
- Aparición de una proteinuria superior a 0,5 g/24 h, especialmente si se asocia a HTA de reciente instauración o agravación de una hipertensión previamente estable.
Biopsia renal
Facilita información diagnóstica, pronóstica y terapéutica. Tras el seguimiento por parte del nefrólogo, éste y el equipo médico habitual decidirán si el paciente presenta criterios de biopsia renal. La decisión de realizarla debe ser individualizada tras la valoración del riesgo-beneficio en cada caso. Estará especialmente indicada en los siguientes casos:
- Deterioro de la función renal y/o proteinuria y/o hematuria asociadas o no a HTA.
- Sospecha de una patología de base distinta de la disfunción renal crónica en el contexto de un trasplante no renal (glomerulonefritis, nefroangioesclerosis, etc.).
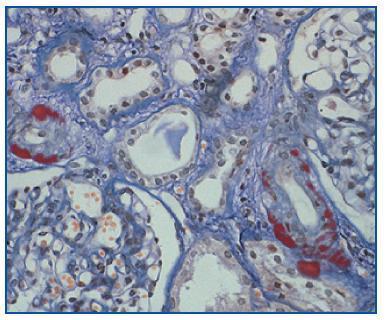
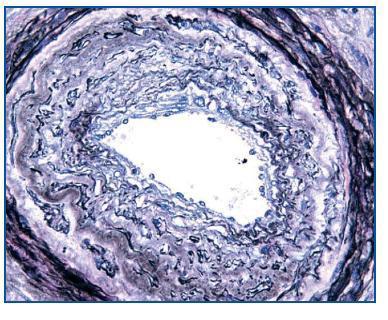
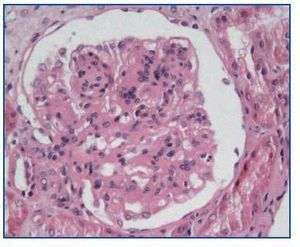
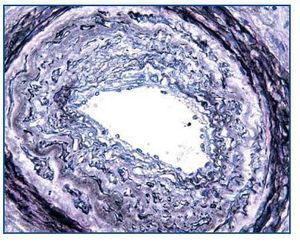
- Como confirmación de la sospecha de nefrotoxicidad por anticalcineurínicos (figura 2). Cabe recordar que esta causa es responsable de, aproximadamente, la mitad de los deterioros de la función renal tras un trasplante no renal2.
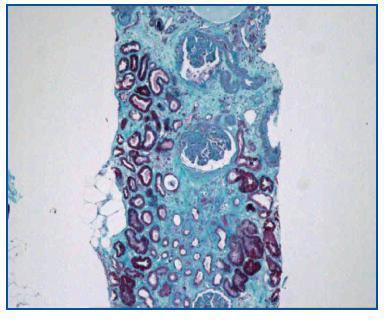
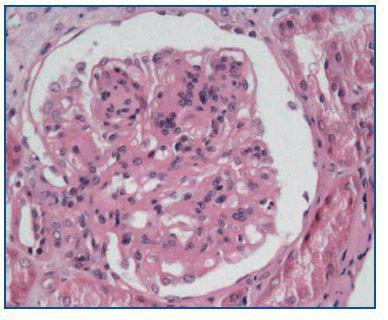
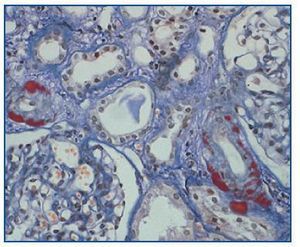
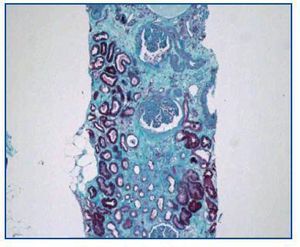
- Como paso previo a un cambio a im-TOR, puede confirmar la mayor o menor evolución a la cronicidad de la disfunción (figura 3). Asimismo, puede descubrir lesiones que desaconsejen el inicio de tratamiento con el im-TOR (lesiones diabéticas evolucionadas (figura 4); lesiones vasculares o glomerulares graves (figura 5), etc., que no siempre se asocian con proteinuria importante).
TRATAMIENTO
Algunas de estas medidas pueden ser de utilidad en el manejo de la disfunción renal en pacientes con trasplante no renal:
1- Aprendizaje del trasplante renal. Una de las enseñanzas más importantes aprendida de pacientes trasplantados renales es la de que las pautas de conversión a im-TOR de los pacientes trasplantados con nefrotoxicidad por ICN deben realizarse de la forma más precoz posible55-57. Cuando la nefropatía está instaurada, el paciente ya no se beneficiará del cambio a im-TOR. Por ello, algunos especialistas prefieren la realización de una biopsia renal previa a la conversión a im-TOR. Una vez decidida la conversión, las pautas de mantenimiento serán las mismas que se han descrito en la conversión precoz (asociadas a dosis bajas de ICN, con ácido micofenólico y sin anticalcineurínicos, etc.).
2- ¿Cómo hacer la conversión a inhibidores de la im-TOR? En general, los pacientes pueden ser sometidos a conversión de dos maneras:
- Conversión rápida. El día anterior a la conversión, el paciente toma la medicación inmunosupresora habitual. El día de la conversión, inicia por la mañana el im-TOR en dosis de impregnación rápida (p. ej., 4 mg/día en caso de sirolimus y 1,5 mg/12 h en caso de everolimus) y la dosis habitual de ICN. Por la noche, se toma la mitad del ICN. Al día siguiente, se toma el im-TOR en dosis estándar, se suspende el ICN y se mantiene en todo momento el ácido micofenólico. A los tres días de la conversión, deben determinarse los niveles plasmáticos del im-TOR.
- Conversión lenta o solapada. El día de la conversión, se reduce el ICN a la mitad y se empieza con el im-TOR en dosis estándar (sirolimus 2 mg/día o everolimus 0,75 mg/12 h). La dosis del ICN se irá reduciendo lentamente para suspenderla en una semana y mantener al paciente con im-TOR y ácido micofenólico. Al igual que en el caso anterior, deben determinarse los niveles plasmáticos del im-TOR a los 2-3 días de la conversión.
3- Tratamiento de los factores de riesgo concomitantes de disfunción crónica renal. Existen varios factores de riesgo que contribuyen de forma decisiva a la progresión de la nefropatía crónica. Por lo tanto, habrá que prevenir su aparición78-83.
- Hipertensión arterial.
- Hiperfiltración renal. Proteinuria.
- Dislipemia.
- Diabetes y otros trastornos del metabolismo hidrocarbonado.
- Anemia.
- Hiperuricemia.
- Trastornos del metabolismo fosfocálcico.
- Obesidad.
- Tabaquismo.
- Vida sedentaria.
4- Diálisis, lista de espera y trasplante renal posterior. Al igual que en cualquier paciente que desarrolle ERC, el trasplantado no renal debe prepararse para la diálisis de acuerdo con las guías KDOQI14. La franca mejoría de los resultados del trasplante renal en los últimos años en este tipo de pacientes hace que deba considerarse una opción terapéutica de primera línea. Según datos de Ojo et al.84, el 46% de los pacientes trasplantados no renales que desarrollan ERC terminal en Estados Unidos y que requieren tratamiento con diálisis son inscritos en una lista de espera de trasplante renal; de ellos, un 27,4% son trasplantados anualmente. La espera media es de 689 días. Aquellos que van a ser trasplantados presentan una mayor supervivencia a los cinco años que los que van a permanecer en lista de espera. No obstante, la mortalidad de estos pacientes en lista de espera para trasplante renal es similar a la de los enfermos con ERC primaria que esperan un trasplante renal aislado. Por los tanto, este aspecto debería tenerse en cuenta a la hora de priorizar el acceso a este tratamiento sustitutivo. Asimismo, y dada la comorbilidad y la inmunosupresión previa acumuladas de esta población, sería conveniente realizar un estudio cardiovascular y metabólico más exhaustivo (ecocardiografía, angio-TAC, ecografía carotídea, test de sobrecarga a la glucosa, etc.) a la hora de valorar el riesgo-beneficio en estos pacientes.
5- Trasplante renal simultáneo. Debe considerarse esta opción en aquellos pacientes que necesitan un trasplante de órgano sólido y, al mismo tiempo, tienen una ERC avanzada que haga prever un pronto inicio del tratamiento sustitutivo renal. Como es bien sabido, el trasplante de órgano sólido acelera dicha progresión. Según datos de la UNOS (United Network for Organ Sharing), en Estados Unidos se han practicado casi 3.000 trasplantes simultáneos de órgano sólido y riñón, siendo los más frecuentes los de hígado-riñón85, seguidos de los de corazónriñón86. Existen al respecto discrepancias entre los autores en el caso del trasplante simultáneo hepatorrenal, ya que algunos de ellos opinan que el trasplante hepático aislado mejora en muchas ocasiones la insuficiencia renal de los pacientes, posiblemente por la resolución de factores hemodinámicos que la perpetuaban87,88. El mismo argumento se emplea, en ocasiones, para el trasplante de corazón-riñón combinado, ya que el deterioro de la función renal puede ser debido a bajo gasto y, por tanto, mejorar con un trasplante cardiaco aislado.
CONCLUSIONES
La ERC tras el trasplante de órgano sólido es un fenómeno emergente que afecta de forma muy importante a los receptores de este tipo de trasplantes. Dada su enorme repercusión sobre la morbilidad y la mortalidad de dichos pacientes, es necesario extremar las medidas de identificación de los factores y de los pacientes de riesgo, hacer prevención de éstos y, en su defecto o ante la imposibilidad de hacerlo, realizar un diagnóstico y un tratamiento lo más precoces posibles. El trabajo en equipo de todos los profesionales será la clave para el éxito de nuestro propósito.
Tabla 1. Frecuencia de los estadios IV-V en 70.000 trasplantados no renales según las guías KDOQI
Figura 1.
Figura 2.
Figura 3.
Figura 4.
Figura 5.