Tenofovir es un inhibidor nucleótido de la transcriptasa inversa, de uso muy extendido como parte del tratamiento antirretroviral en pacientes con infección por el virus de inmunodeficiencia humana. Aunque en estudios controlados ha demostrado tener una gran eficacia y un buen perfil de seguridad, con preservación de la función renal similar a la del placebo, se han descrito en los últimos años casos de fracaso renal agudo por necrosis tubular y disfunción del túbulo proximal asociados con el uso de este fármaco. Los principales factores predisponentes descritos son el tratamiento concomitante con otros nefrotóxicos y la insuficiencia renal crónica previa. Describimos dos casos de deterioro severo de función renal tras el inicio de tratamiento con tenofovir.
INTRODUCCIÓN
El tenofovir es un fármaco antirretroviral inhibidor de la transcriptasa inversa, de gran efectividad y, por tanto, de empleo cada vez más frecuente en pacientes con infección por el virus de inmunodeficiencia humana (VIH). A pesar de haber sido considerado inicialmente seguro y relativamente libre de efectos adversos, se han descrito casos de tubulopatías y fracaso renal, de severidad variable, relacionados con su uso. El riesgo es mayor si existe insuficiencia renal previa o cuando se emplea en combinación con algunos antirretrovirales, como los inhibidores de la proteasa1.
Presentamos 2 casos de deterioro severo de la función renal y tubulopatía proximal tras iniciar tratamiento con tenofovir
CASOS CLÍNICOS
Caso 1
Hombre de 66 años, de raza blanca, diagnosticado de infección por VIH desde hace 12 años y de hipertensión arterial bien controlada con monoterapia.
Inicia tratamiento con emtricitabina, efavirenz y tenofovir; en aquel momento mantenía niveles estables de creatinina sérica (Crs) de 1,5 mg/dl, con filtrado glomerular (FG) estimado de 48,4 ml/min/1,73 m2. Tres meses después, se modificó el tratamiento antirretroviral por toxicodermia secundaria a efavirenz, de manera que se suspendió este fármaco y se asoció al tratamiento ritonavir, con buena respuesta inmunológica y virológica: niveles normales de CD4 y carga viral indetectable; entonces la creatinina era de 2 mg/dl.
Ocho meses después de la introducción de tenofovir, ingresa en nuestro centro por cuadro de náuseas y vómitos. El paciente se encontraba normotenso, afebril, sin signos de deshidratación y con volumen de diuresis conservado. En estudio analítico se detecta hemoglobina (Hb) 8,7 g/dl, creatinina 7,7 mg/dl, urea 260 mg/dl, ácido úrico 6,1 mg/dl, glucosa 113 mg/dl, fósforo 7,1 mg/dl, sodio 134 meq/l, potasio 2,6 meq/l, pH 7,27, pCO2 34,4 mmHg, HCO3 15,9 meq/l. Perfil hepático, lipídico, inmunoglobulinas y complementos normales. Autoanticuerpos y serología para virus de las hepatitid B y C (VHC y VHB) negativos. En orina se objetiva pH 5, sodio 58 meq/l, potasio 25 meq/l, proteinuria de 0,98 g/24 h, glucosuria 2+ y sedimento normal.
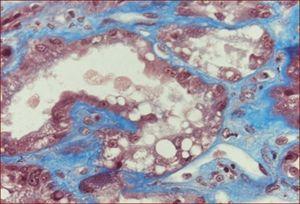
En el estudio ecográfico, los riñones eran de aspecto normal. La biopsia renal mostró daño tubular severo con necrosis y vacuolización de células tubulares, así como cambios regenerativos con agrandamiento nuclear (figura 1).
Con la sospecha de deterioro agudo de función renal asociado a tenofovir, se suspendió el tratamiento con este fármaco. Además, el paciente recibió aportes de potasio y bicarbonato con normalización de las alteraciones iónicas y del equilibrio ácido-base. Días después, la función renal comienza una lenta mejoría; a los 14 días de evolución, la creatinina era de 3,8 mg/dl y a los 7 meses de 1,8 mg/dl, con FG de 37,7 ml/min/1,73 m2, la proteinuria disminuyó a 600 mg/24 h y la glucosuria había desaparecido.
Caso 2
Hombre de 67 años, también de raza blanca, con infección por VIH de 15 años de evolución, que ingresa en nuestro centro tras detectarse insuficiencia renal severa. Tres meses antes se modificó su tratamiento antirretroviral, a la combinación lopinavir-ritonavir se asoció tenofovir-emtricitabina. Entonces mantenía Crs de 1,2 mg/dl, con FG de 69 ml/min/1,73 m2.
Consultó en nuestro hospital por deterioro del estado general, hipertensión (tensión arterial 215/118) y oliguria. En analítica sérica se objetiva Hb 10,7 g/dl, creatinina 14,3 mg/dl, urea 366 mg/dl, ácido úrico 4,6 mg/dl, glucosa 100 mg/dl, fósforo 3,8 mg/dl, sodio 136 meq/l, potasio 7,2 meq/l, pH 7,23, pCO2 23,2 mmHg y HCO3 11,2 meq/l. Perfil hepático, lipídico, inmunoglobulinas y complementos normales. Autoanticuerpos y serología para VHC y VHB negativos. En la orina pH 6, sodio 58 meq/l, potasio 33 meq/l, proteinuria de 0,9 g/24 h, glucosuria 2+ y sedimento normal. CD4 1100 y carga viral indetectable.
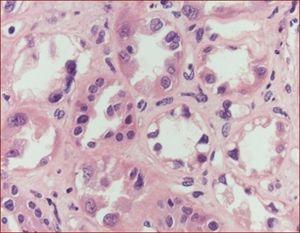
El estudio ecográfico no mostró alteraciones. Le fue practicada una biopsia renal que evidenció un daño tubular agudo severo, necrosis, vacuolización y cambios regenerativos de células tubulares con cariomegalia focal (figura 2).
Se suspendió el tratamiento con tenofovir. En los días siguientes, y tras requerir dos sesiones de hemodiálisis, comienza a aumentar progresivamente el volumen de diuresis y a descender lentamente la Crs alcanzando niveles de 5,2 mg/dl al mes de evolución y de 1,9 mg/dl con FG de 38 ml/min/1,73 m2 6 meses después del alta, con proteinuria y glucosuria negativas.
En ambos casos se consideró al tenofovir como el agente responsable del deterioro de función renal, apoyándonos en la relación cronológica existente entre la introducción del fármaco y la alteración renal, la ausencia de otras causas de fracaso renal y el hallazgo histológico de necrosis tubular aguda habitual en estos casos1.
DISCUSIÓN
El tenofovir es un análogo de nucleótido inhibidor de la transcriptasa inversa, que se viene empleando desde el año 2001 en combinación con otros antirretrovirales para tratar la infección por VIH. Inicialmente, y a diferencia de otros fármacos de estructura similar, como adefovir y cidofovir, parecía presentar una escasa toxicidad renal. Sin embargo, se han descrito, en los últimos años, unos 70 de casos de fracaso renal agudo por necrosis tubular y síndrome de Fanconi relacionados con el empleo de este fármaco2.
La prevalencia de nefrotoxicidad en los pacientes que reciben tenofovir es baja, en torno al 2,5%3, pero es necesario tenerla en cuenta dado el empleo cada vez más frecuente de este fármaco.
El tenofovir se excreta por vía renal, principalmente por FG y en menor medida por secreción tubular. En la membrana basolateral de las células tubulares proximales, el transportador de aniones orgánicos (OAT-1) capta el tenofovir desde la sangre y lo introduce en las células, para luego ser secretado a la luz tubular mediante los transportadores MRP-2 y MRP-4 (multidrug resistance protein), situados en la membrana apical4. Aunque no se ha establecido el mecanismo preciso de nefrotoxicidad, es probable que una expresión alterada de estos transportadores lleve a la acumulación intracelular de tenofovir en el túbulo proximal, capaz de afectar al mantenimiento de la integridad celular, además de producirse una reducción de la excreción renal de este fármaco5.
Es posible que existan factores genéticos que faciliten el desarrollo de la lesión. En este sentido, se ha demostrado recientemente que ciertos polimorfismos genéticos en las regiones que codifican MRP2 (ABCC2) y MRP4 (ABCC4) están asociados con diferencias en la excreción urinaria de tenofovir y con la probabilidad de presentar fracaso renal1,5.
Por otra parte, se ha descrito un aumento en el número de casos de insuficiencia renal cuando tenofovir se combina con algunos antirretrovirales, principalmente con inhibidores de la proteasa; se cree que como consecuencia de interacciones farmacocinéticas que incrementan su potencial nefrotóxico. El inhibidor de proteasa, ritonavir, es un potente inhibidor de MRP-2, de manera que impide la secreción tubular de tenofovir provocando una importante acumulación intracelular y elevación de sus niveles plasmáticos, de hasta el 30%, responsables de la mayor toxicidad1.
El desarrollo de enfermedad renal es más frecuente en hombres, ancianos, cuando existe insuficiencia renal previa y en casos de infección por VIH avanzada, con bajo recuento de CD4 y con carga viral detectable6. Nuestros pacientes acumulaban varios de los factores predisponentes descritos: eran hombres, mayores de 60 años, ambos tenían al comenzar el tratamiento un FG disminuido y recibían tratamiento antirretroviral combinado con ritonavir. En cambio, tenían un recuento de CD4 normal y la carga viral del VIH era indetectable.
La mayoría de los pacientes con nefrotoxicidad por tenofovir presentan deterioro progresivo de la función renal y en algunos casos se asocian datos de disfunción tubular proximal, principalmente glucosuria, acidosis tubular proximal, hipofosfatemia e hipopotasemia8. En los dos casos presentados se detectó glucosuria en ausencia de hiperglucemia y en uno de ellos hipopotasemia persistente. La biopsia renal suele evidenciar lesiones en las células tubulares proximales, con pérdida del borde en cepillo y vacuolización, además de necrosis tubular aguda.
Llama la atención el largo período de latencia observado entre la introducción del fármaco y el deterioro de la función renal. El tiempo medio de los casos publicados es de 7 meses, aunque con una gran variabilidad que oscila entre 3 y 104 semanas3,4.
En general, son lesiones reversibles siempre que se suspenda el tratamiento con tenofovir, aunque la recuperación suele ser lenta y en ocasiones incompleta, sobre todo en pacientes que ya presentaban insuficiencia renal antes del tratamiento2.
Es necesario monitorizar estrechamente la función renal en pacientes que reciban tenofovir, especialmente cuando existan factores predisponentes asociados. Incluso se recomienda evitar su uso en pacientes con función renal disminuida9 o al menos realizar ajuste de dosis.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Figura 1. Detalle con vacuolización y cambios regenerativos del epitelio tubular. Tinción con tricrómico de Masson.
Figura 2. Detalle de pérdida, descamación, vacuolización celular y signos regenerativos con núcleos agrandados. Tinción con hematoxilina-eosina.