La púrpura de Schönlein-Henoch (PSH) es una vasculitis sistémica de pequeño vaso que se caracteriza por depósitos vasculares y mesangiales de inmunoglobulina A. Es más frecuente en niños. Su incidencia en adultos es escasa y también la afectación pulmonar, que tiene una elevada morbimortalidad. Presentamos un caso de PSH en un hombre de 61 años que asoció hemorragia pulmonar bilateral, insuficiencia renal con requerimiento de tratamiento renal sustitutivo y polineuropatía en ambas extremidades inferiores.
INTRODUCCIÓN
La púrpura de Schönlein-Henoch (PSH) es una vasculitis sistémica de pequeño vaso (clasificación Chapel Hill Consensus Conference, 1994), caracterizada por depósitos vasculares y mesangiales de inmunoglobulina A (IgA)1. Es más frecuente en niños, pero puede ocurrir a cualquier edad. Sus manifestaciones clínicas constituyen la tétrada clásica: exantema, artralgias, dolor abdominal y afectación renal. Sin embargo, puede afectar a otros muchos órganos, como miocardio, pulmones, uréter y sistema nervioso central (SNC)2,3. La hemorragia pulmonar es una rara complicación y se asocia con una mayor morbimortalidad.
Describimos el caso clínico de un hombre de 61 años con insuficiencia renal progresiva por glomerulonefritis IgA y hemorragia pulmonar bilateral.
CASO CLÍNICO
Hombre de 61 años, sin antecedentes patológicos de interés, que acude a Urgencias por síndrome general (malestar general, anorexia, adelgazamiento no cuantificado), con fiebre, poliartralgias y lesiones purpúricas en ambas extremidades inferiores. Refería dos brotes de lesiones cutáneas similares, cuatro meses y un mes antes del ingreso. Presentó también poliartralgias con afectación de manos, muñecas, tobillos y rodillas, que habían remitido espontáneamente, así como mialgias y parestesias en las extremidades inferiores. No tenía antecedentes previos de infección de vías respiratorias ni de tratamientos farmacológicos. En la exploración destacaban una temperatura de 38,5 ºC y una presión arterial de 160/90 mmHg. Tenía hemorragia subconjuntival y lesiones purpúricas palpables en ambas ingles y piernas. En el momento del ingreso presentaba hemograma normal con velocidad de sedimentación globular (VSG) 60 mm/h; estudio de coagulación y función renal normal, con análisis de orina sin proteinuria, y sedimento 5-7 hematíes/campo. Proteína C reactiva 10,70 mg/dl (valores normales: 0,00-0,50 mg/dl). Hemocultivos negativos y radiografía de tórax sin alteraciones. El ecocardiograma y la ecografía abdominal tampoco presentaban alteraciones. Se realiza biopsia de las lesiones cutáneas (figura 1), con resultado de vasculitis leucocitoclástica neutrofílica-linfocítica.
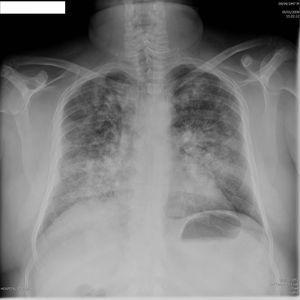
El día 3 después del ingreso el paciente presenta expectoración hemoptoica y anemización (descenso de la hemoglobina [Hb] 4 g). La gasometría arterial mostraba hipoxemia con pO2 50, pCO2 34, saturación de O2 88,5%, bicarbonato normal y radiografía de tórax con lesiones alveolares bilaterales compatibles con hemorragia pulmonar bilateral (figura 2). Se realizan broncoscopia y lavado broncoalveolar que confirman la existencia de una hemorragia pulmonar bilateral. El paciente es tratado con tres bolos intravenosos (i.v.) de 1 g de 6-metilprednisolona (seguidos de prednisona oral a dosis de 1 mg/kg/día) y 1 g i.v. de ciclofosfamida mensual. Se mantiene estable desde el punto de vista respiratorio y no precisa intubación orotraqueal.
La analítica realizada mostraba: Hb 10,7 g/dl, hematocrito 30,4%, leucocitos 6.700/µl (79% polimorfonucleares y 3% cayados), plaquetas 109.000 y VSG 60 mm/h. Estudio de coagulación normal. Hemocultivos negativos. Función renal normal (MDRD > 60 ml/min/m²), transaminasas (GOT, GPT, GGT), bilirrubina total y fracciones CPK y LDH dentro de la normalidad, colesterol, triglicéridos, Na, K, Cl, Ca, P, proteinograma, IgG, IgA e IgM dentro de la normalidad. Hipocomplementemia C3 y C4 (56 y 8,3 mg/dl, respectivamente). La determinación de anticuerpos antinucleares (ANA), anti-ADN, antígenos nucleares extractables, antifosfolípido, antimembrana basal glomerular, anticuerpos anticitoplasma de neutrófilo (ANCA), antimieloperoxidasa y antiproteinasa 3 fueron negativos. Factor reumatoideo negativo. Crioglobulinas negativas. Serología para virus de las hepatitis B y C y para virus de la inmunodeficiencia humana también negativa. Los anticuerpos antiestreptolisina fueron negativos. Los marcadores tumorales (antígeno prostático específico, antígeno carcinoembriónico, alfafetoproteína, beta-2-microglobulina, CA 19:9) eran normales. En la exploración neurofisiológica de las extremidades inferiores se detectaron datos de polineuropatía sensitivo-motora mixta (axonal y desmielinizante), de intensidad moderada-grave.
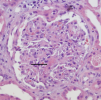
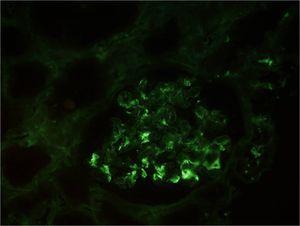
El día 10 se constatan leucocituria, hematuria macroscópica, proteinuria moderada (600 mg/día en orina de 24 horas) y deterioro progresivo y rápido de la función renal, por lo que el paciente requiere hemodiálisis (HD) desde el día 13 del ingreso. El día 14 se realiza biopsia renal (figura 3, figura 4 y figura 5). En la microscopia óptica (figura 3 y figura 4) se observaban un total de 14 glomérulos con lesiones en distinto estadio de evolución; cuatro de ellos totalmente esclerosados. Los demás glomérulos presentaban engrosamiento de la membrana basal, mínimas áreas indicativas de necrosis fibrinoide y discreto aumento de proliferación mesangial con esclerosis, alguna zona focalmente exudativa y una mínima reacción tipo semiluna. El intersticio tenía un intenso infiltrado inflamatorio de predominio linfoplasmocitario, acompañado de algunos eosinófilos y neutrófilos. También había daño tubular con rotura de la pared de los túbulos e intenso infiltrado hemático en la luz de estos. En inmunofluorescencia directa (figura 5) se aprecian depósitos mesangiales de IgA y, en menor medida, C3, que se corresponden con áreas de ensanchamiento mesangial de la figura 3 y de la figura 4. Se informa como nefropatía IgA.
En la tomografía computarizada torácica realizada el día 20 se informa de patrón intersticial reticular de predominio en campos pulmonares superiores y medio, sin observarse nódulos ni imágenes de cavitación.
Posteriormente, el paciente tuvo una recuperación lenta de la función renal sin necesidad de HD un mes después del comienzo.
El tratamiento realizado fue con tres bolos de 1 g de 6-metilprednisolona i.v. en tres días consecutivos, seguidos de prednisona oral a dosis de 60 mg/día. Se asoció ciclofosfamida en pauta i.v. mensual (dosis habituales corregidas según edad y función renal), tres bolos y a partir del cuarto mes se asoció azatioprina oral (dosis 1 mg/kg/día) con pauta descendente de prednisona. Desde el mes 18 se suspenden corticoides y azatioprina. También se utilizaron dosis moderadas de antagonistas de los receptores de la angiotensina II (candesartán a dosis de 16 mg/día).
Dos años después del diagnóstico el paciente está asintomático, con analítica urinaria normal, microalbuminuria de 8 mg/g de creatinina y enfermedad renal crónica en estadio 3 (según las Guías K/DOQI, 2002), estable desde hace más de un año con creatinina sérica de 1,5 mg/dl y filtrado glomerular estimado de 50 ml/min/1,73 m² (MDRD abreviada o modificada).
DISCUSIÓN
La PSH es una entidad rara en adultos. Se describe una incidencia 20 veces mayor en niños que en adultos (22,1 frente a 1,3 por 100.000 habitantes, respectivamente)4. Algunos estudios han comparado las diferencias de presentación de la enfermedad (en niños, curso clínico más corto y autolimitado; en adultos, más severo) y pronóstico (peor en adultos), y han sugerido mecanismos patogénicos diferentes3. También se ha relacionado la PSH en adultos con tumores1,3.
Clásicamente, el diagnóstico de esta entidad se apoya en los criterios PSH del American College of Rheumatology (1990), que restringe el diagnóstico a pacientes menores de 20 años4. La clásica tétrada de vasculitis cutánea, artralgias, vasculitis gastrointestinal y nefritis, tres de ellas suficientes para el diagnóstico, actualmente es aceptada solo cuando se demuestra depósito de IgA en un órgano afectado.
La afectación pulmonar en PSH es rara y está limitada a la descripción en la literatura médica de casos clínicos y algunas series cortas1,2,5. Es más frecuente en adultos. En una serie de 124 pacientes con PSH5, solo se identifican tres (2,4%) con afectación pulmonar atribuible a esta enfermedad, todos adultos (el menor de 20 años). La afectación pulmonar en PSH suele manifestarse como hemorragia alveolar difusa, si bien hay algún caso descrito con neumonía intersticial que responde a tratamiento esteroideo5. Los datos histopatológicos (estudio histopatológico pulmonar disponible en muy pocos casos), las manifestaciones clínicas y la respuesta a terapia esteroidea sugieren vasculitis pulmonar activa como mecanismo predominante de afectación pulmonar en PSH5. No se ha establecido un tratamiento con probada efectividad cuando se asocia afectación pulmonar2; se han realizado terapias con combinaciones de corticoides, ciclofosfamida y azatioprina5-7.
La incidencia de afectación renal en PSH es variable dependiendo de las series y de la definición de afectación renal utilizada1,4. En la mayoría de las poblaciones es más frecuente en adultos que en niños4; en adultos, la incidencia de afectación renal es del 45-85%1. Suele cursar con grados variables de proteinuria, hematuria microscópica o macroscópica, hipertensión arterial (HTA) e insuficiencia renal. Los hallazgos histopatológicos son los de la nefropatía IgA (Consenso de Óxford, 2009)8, que requiere un mínimo de ocho glomérulos en la muestra y que evalúa cuatro parámetros: hipercelularidad mesangial, hipercelularidad extracapilar, glomeruloesclerosis segmentaria y atrofia tubular/fibrosis intersticial.
La gravedad de la afectación renal en el momento de realizar el diagnóstico, así como los hallazgos histopatológicos en la biopsia renal, se consideran factores pronósticos1,3,4. Se describen diversos factores de riesgo para el desarrollo de insuficiencia renal crónica en estadio 5. La proteinuria superior a 1 g/24 horas durante el seguimiento es un factor predictivo significativo para el desarrollo de insuficiencia renal; la cifra de proteinuria al inicio no tiene tanta influencia4. También es importante la HTA al inicio y durante el seguimiento y el comienzo con insuficiencia renal. La hematuria no parece tener efecto sobre la supervivencia renal. Las lesiones histológicas asociadas con un pronóstico adverso son el grado de fibrosis intersticial y atrofia tubular, la presencia de semilunas4, necrosis fibrinoide y porcentaje de glomérulos esclerosados1.
La afectación del SNC clínicamente relevante (en ausencia de HTA grave) es poco común y casi siempre se asocia con enfermedad renal en estadios avanzados o con otras afectaciones poco frecuentes9, pero es todavía más rara la afectación del sistema nervioso periférico (SNP). Las vasculitis pueden causar inflamación de los vasa nervorum e inducir isquemia en estos nervios, aunque otro mecanismo de lesión sería por compresión por hematoma o edema localizado. Las vasculitis que más afectan al SNP son el síndrome de Churg-Strauss, la granulomatosis de Wegener y la poliangeítis microscópica. En la PSH la afectación del SNC o del SNP obliga a descartar otras vasculitis en las que dicha afectación es más frecuente. En nuestro paciente, los ANA, anti-ADN, ANCA y anticuerpos antifosfolípido fueron negativos. La existencia de afectación del SNP en PSH no requiere tratamiento corticoideo o inmunosupresor (tiende a la recuperación espontánea completa), excepto en presencia de síndrome de Guillain-Barré.
El paciente que presentamos asociaba una hemorragia pulmonar bilateral con insuficiencia renal progresiva, con datos histológicos de mal pronóstico (cuatro glomérulos esclerosados de 14 totales, mínimas áreas de necrosis fibrinoide, intenso infiltrado inflamatorio intersticial y daño tubular). Por ello realizamos tratamiento con esteroides y pauta corta de ciclofosfamida i.v. (similar a la empleada en otras vasculitis con afectación renal), con una buena evolución clínica. Actualmente tiene una insuficiencia renal crónica en 3 (MDRD 50 ml/min/m2), PA normal y ausencia de alteraciones en la analítica urinaria.
En nuestro caso, destacamos las afectaciones pulmonar y renal graves en ausencia de sintomatología gastrointestinal. Se han sugerido factores genéticos en esta enfermedad. Así, el polimorfismo en el codón 469 del locus de la molécula de adhesión intercelular-1 (ICAM-1) se ha asociado con protección para complicaciones gastrointestinales graves en PSH. El polimorfismo R/G en el codón el 241 podría reducir el riesgo de secuelas renales en la PSH de presentación en adultos3.
El tratamiento de PSH en adultos es controvertido2,4,5; se han utilizado distintas combinaciones de corticoides e inmunosupresores, pero no existían estudios aleatorizados que evaluasen la eficacia de los mismos. Un reciente estudio prospectivo y aleatorizado10 compara el tratamiento corticoideo con la asociación de corticoides y ciclofosfamida en pacientes adultos con PSH grave, sin observar beneficio adicional al añadir ciclofosfamida al tratamiento.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Figura 2. Radiografía de tórax.
Figura 5. Biopsia renal. Inmunofluorescencia directa.
Figura 3. Biopsia renal, microscopia óptica.
10805_18107_14977_es_10805_18559_14977_es_biopsia_piel_figura_1.ppt
Figura 1. Biopsia cutánea, lesión purpúrica.
10805_18107_15088_es_10805_18559_15088_es_presentacin1_figura_4.ppt
Figura 4. Biopsia renal, microscopia óptica.