La proteinuria es el principal predictor de progresión de la enfermedad renal crónica. Los fármacos que bloquean el eje renina-angiotensina-aldosterona (RAA) reducen la proteinuria y retrasan la progresión de la enfermedad. Sin embargo, su efecto es subóptimo, y la proteinuria residual persiste como predictor relevante de deterioro renal. La vitamina D tiene efectos pleiotrópicos que podrían impactar en estos parámetros. En este trabajo revisamos críticamente las bases moleculares y experimentales que sugieren un efecto antiproteinúrico de la activación del receptor de vitamina D (VDR), así como la evidencia disponible sobre su efecto antiproteinúrico en la práctica clínica. En modelos animales se ha observado un efecto antiproteinúrico de la activación del VDR, que podría deberse a una acción protectora directa sobre el podocito u otros efectos pleiotrópicos que frenen la activación del sistema RAA, la inflamación y la fibrosis. Los ensayos clínicos se han realizado en general en pacientes con déficit o insuficiencia de vitamina D y el mayor de ellos (VITAL) no demostró que el paricalcitol mejorara el objetivo primario del estudio (descenso del cociente albúmina creatinina urinario). En este sentido, la información disponible es insuficiente para aconsejar el empleo de la vitamina D nativa o de activadores del VDR como fármacos antiproteinúricos renoprotectores más allá del ámbito experimental. Dos ensayos clínicos españoles y uno italiano intentan aclarar cuál es el efecto del paricalcitol y la vitamina D sobre la proteinuria residual en diversas circunstancias clínicas (PALIFE, NEFROVID y PROCEED).
Proteinuria is the main predictor of chronic kidney disease progression. Drugs that block the renin-angiotensin-aldosterone system (ARBs) reduce proteinuria and slow down the progression of the disease. However, their effect is suboptimal, and residual proteinuria persists as an important predictor of renal impairment. Vitamin D has pleiotropic effects that could have an impact on these parameters. In this study, we critically review the molecular and experimental bases that suggest an antiproteinuric effect of vitamin D receptor (VDR) activation and the available evidence on its antiproteinuric effect in clinical practice. In animal models, we have observed the antiproteinuric effect of VDR activation, which could be due to direct protective action on the podocyte or other pleiotropic effects that slow down RAA system activation, inflammation and fibrosis. Clinical trials have generally been conducted in patients with a vitamin D deficiency or insufficiency and the main trial (VITAL) did not demonstrate that paricalcitol improved the study’s primary endpoint (decrease in the urine albumin to creatinine ratio). In this sense, the information available is insufficient to advise the use of native vitamin D or VDR activators as renoprotective antiproteinuric drugs beyond the experimental level. Two Spanish clinical trials and one Italian trial attempted to determine the effect of paricalcitol and vitamin D on residual proteinuria in various clinical circumstances (PALIFE, NEFROVID and PROCEED).
La proteinuria es el principal predictor de progresión de la enfermedad renal crónica (ERC) y, aunque es un parámetro bioquímico subrogado, se reconoce actualmente como la primera diana terapéutica en el manejo de la ERC1-5.
Los fármacos que bloquean el eje renina-angiotensina-aldosterona (BRAA) han demostrado ser efectivos en reducir la proteinuria y en retrasar la progresión de la enfermedad. Asumidas las recomendaciones higiénico-dietéticas iniciales, los BRAA constituyen el primer escalón en el tratamiento renoprotector antiproteinúrico, siendo clasificados en el primer nivel de evidencia3,4,6-11. Sin embargo, su efecto antiproteinúrico suele ser subóptimo, por lo que la proteinuria residual persiste como diana terapéutica, al ofrecer efectos renoprotectores adicionales10,11. Aunque la asociación de BRAA puede disminuir la proteinuria residual, el bloqueo dual presenta potenciales efectos adversos, no disminuye la mortalidad y no se ha podido demostrar que mejore la evolución de la función renal en nefropatías prevalentes como la diabetes12-14. Por lo tanto, ni las recientes recomendaciones de la American Diabetes Association 2013 sobre nefropatía diabética15 ni las guías KDIGO (Kidney Disease: Improving Global Outcomes)1 recomiendan su uso.
En el terreno clínico, se han ensayado numerosos fármacos para reducir la proteinuria residual y otros están en fase de experimentación. En este sentido, la vitamina D y sus derivados han mostrado un amplio rango de efectos pleiotrópicos o multisistémicos, que afectan al riñón, al árbol cardiovascular y a la respuesta inmune. El efecto antiproteinúrico es uno de ellos y numerosos datos experimentales avalan esta afirmación, aunque clínicamente no se ha podido demostrar16-19.
El objetivo de esta revisión es analizar las bases biológicas y el grado de evidencia en el ámbito clínico del uso de la vitamina D y de agonistas de receptores de la vitamina D (VDR) como potenciales fármacos antiproteinúricos.
BASES MOLECULARES Y LECCIONES DE LA EXPERIMENTACIÓN BÁSICA
Patogenia de la proteinuria
La barrera de filtración glomerular está formada por tres capas: el endotelio capilar fenestrado, la membrana basal glomerular y los podocitos en la capa más externa. El podocito desempeña el principal papel para el mantenimiento de la barrera de filtración glomerular y la integridad de la estructura glomerular. Los podocitos son células terminalmente diferenciadas que han agotado su capacidad proliferativa. Por ello, la lesión o pérdida de podocitos puede generar una lesión glomerular irreversible, con evolución a glomeruloesclerosis focal y segmentaria, manifestada clínicamente como proteinuria y eventual pérdida de función renal20.
En condiciones normales el plasma se filtra al espacio de Bowman entre los pedicelos de los podocitos, atravesando el diafragma de hendidura, que retiene las proteínas. El componente central del diafragma de hendidura es la nefrina, proteína identificada en 1998, a partir de la clonación del gen mutado en el síndrome nefrótico congénito de tipo finlandés, una enfermedad caracterizada por proteinuria masiva21. La nefrina ejerce funciones estructurales y de señalización, y junto con los otros componentes del diafragma de hendidura forman un tamiz molecular poroso que es el principal responsable de la impermeabilidad a las proteínas22,23.
Además, el podocito expresa numerosos receptores y responde a la presencia de factores de crecimiento y productos metabólicos implicados en la ERC. Entre otros receptores, presenta receptores para angiotensina 2, factor de crecimiento transformante beta-1 (TGFβ1) y VDR20,24.
Vitamina D
La vitamina D natural o nativa procede de la dieta o de la síntesis en la piel. La dieta provee dos formas de vitamina D: ergocalciferol (D2) y colecalciferol (D3). En la piel se sintetiza D3 en respuesta a la estimulación ultravioleta procedente del sol. Las formas D2 y D3 son modificadas hasta convertirse en la forma activa de la vitamina D. En el hígado la enzima 25-hidroxilasa las transforma en calcidiol o 25-hidroxi-vitamina D (25OHD). La enzima 1 alfa hidroxilasa renal y extrarrenal transforma el calcidiol en calcitriol o 1,25-dihidroxivitamina D (1,25OHD). El calcitriol es un activador del receptor intracelular VDR (AVDR). Además de estos productos naturales, existen fármacos que son AVDR selectivos (AsVDR), como el paricalcitol.
De forma práctica, las acciones de la vitamina D se pueden subdividir en calciotrópicas y no calciotrópicas25. Las acciones calciotrópicas son las relacionadas con la activación del VDR por el calcitriol endocrino originado en el túbulo renal proximal. Estas acciones regulan el metabolismo mineral, actuando sobre las paratiroides, los huesos y el intestino para modular la secreción de PTH, resorción ósea y absorción intestinal de calcio y fósforo.
Las acciones no calciotrópicas o pleiotrópicas están relacionadas con la activación autocrina o paracrina del VDR por calcitriol de origen extrarrenal, actuando en el sistema inmunológico, el páncreas, el corazón y otros. También existen acciones autocrinas y paracrinas del calcitriol en el mismo riñón, que no están relacionadas con el metabolismo mineral. Así, por ejemplo, además de la gran producción endocrina de calcitriol en el túbulo proximal, los podocitos también tienen capacidad de sintetizar calcitriol para uso propio y expresan tanto 1-alfahidroxilasa como VDR26.
Las acciones de la vitamina D requieren la activación del VDR. El complejo ligando-VDR se comporta como un factor de transcripción que puede promover o reprimir la transcripción de genes, favoreciendo o impidiendo la producción de ARN mensajero y la consecuente traducción y formación de proteínas27. El patrón concreto de genes activados o suprimidos depende de la dosis de vitamina D, de la célula diana, del microambiente celular y del ligando concreto.
La importancia relativa de estos factores ha sido estudiada en células musculares lisas cultivadas mediante un abordaje transcriptómico, que permite tener una visión global de la respuesta celular. Científicos compararon el efecto del calcitriol con el del paricalcitol y estudiaron también el efecto de la concentración extracelular de fosfato28,29. En este sistema experimental y a las concentraciones (0,1 microM) y tiempos estudiados (30 horas), no se observaron diferencias significativas entre la expresión global de genes en respuesta a calcitriol o paricalcitol. Ambos fármacos inhibieron la proliferación celular de una manera dependiente de la dosis28. Por el contrario, el ambiente, representado por la concentración extracelular de fosfato, tuvo un impacto mayor. El aumento de la concentración de fosfato ejerció un efecto generalizado sobre la expresión génica mediada por VDR, afectando el número de genes modulados29.
Es posible que el efecto de la concentración de fósforo pueda tener más importancia in vivo que el ligando concreto del VDR que se esté usando. Así, el paricalcitol parece asociarse a menor riesgo de hipercalcemia e hiperfosforemia que el calcitriol30. En este sentido, se está acumulando evidencia sobre el papel de la concentración extracelular de fósforo sobre el podocito y la proteinuria. En 331 pacientes con nefropatías proteinúricas, tratados con el inhibidor de la enzima convertidora de angiotensina ramipril, la ERC progresó más rápido en los pacientes con niveles basales de fosfato sérico más altos, sugiriendo que los niveles altos de fosfato atenúan el efecto renoprotector del ramipril31. Asimismo, la sobreexpresión de un transportador de fósforo en ratas induce lesión de podocitos fosfato-dependiente, que favorece la progresión de la esclerosis glomerular en el riñón32.
Un eventual empleo terapéutico de los agonistas del VDR en el tratamiento de la proteinuria requiere un conocimiento preciso de la dosis necesaria para obtener efectos antiproteinúricos evitando la hipercalcemia y la calcificación vascular. La estrategia de administrar agonistas del VDR por vía sistémica, remedando la acción endocrina reguladora del metabolismo calcio-fósforo, para conseguir efectos auto o paracrinos (pleiotrópicos), tiene el peligro potencial de desencadenar efectos adversos relacionados con las acciones calciotrópicas del sistema.
En este sentido, la existencia de acciones calciotrópicas depende de la dosis usada tanto para calcitriol como para paricalcitol. El efecto de la dosis ha sido bien caracterizado en animales de experimentación, donde las dosis más altas de ambos compuestos causan hipercalcemia, hiperfosforemia y calcificación vascular30. Es preciso buscar un equilibrio entre beneficios y efectos adversos de la vitamina D, optimizando la dosis para obtener los máximos beneficios con los mínimos efectos adversos. El tratamiento con vitamina D es aceptado en pacientes con enfermedad renal, fundamentalmente por los beneficios ampliamente reconocidos relacionados con la regulación del metabolismo calcio-fósforo, a los que se añaden los potenciales beneficios pleiotrópicos antes mencionados. Sin embargo, todavía no existe suficiente experiencia a largo plazo como para definir el riesgo de calcificación vascular con las dosis más elevadas de los fármacos más nuevos.
En un estudio en el que se evaluó el efecto del tratamiento con calcitriol y paricalcitol sobre células de músculo liso vascular tanto in vivo como in vitro en ratas con ERC avanzada, las células cultivadas con calcitriol desarrollaron calcificación y este efecto no se observó en las células cultivadas con paricalcitol. Además, se observó aumento de presión de pulso solo en animales tratados con calcitriol que puede estar explicado por el aumento de la calcificación vascular, y este efecto fue independiente de los niveles de calcio y fósforo séricos, ya que con ambas drogas se obtenían niveles similares30. Sin embargo, los animales tratados con paricalcitol también desarrollaron hipercalcemia y un aumento de cinco veces en la magnitud de calcificación vascular con respecto a los controles sin vitamina D. En otro estudio en ratas con ERC, dosis bajas tanto de calcitriol como de paricalcitol protegieron de la calcificación aórtica, pero en dosis altas ambas drogas estimularon la calcificación vascular33.
Vitamina D y podocitos
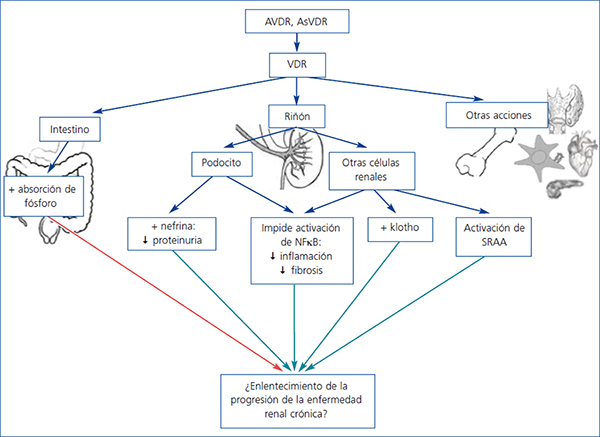
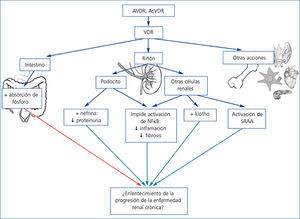
La activación del VDR podría tener efectos antiproteinúricos y nefroprotectores actuando a varios niveles, incluidos efectos directos sobre los podocitos (figura 1).
Los podocitos expresan tanto 1-α-hidroxilasa como VDR en cultivo e in vivo26, lo que les confiere capacidad tanto para producir calcitriol como para responder al calcitriol autocrino o endocrino.
En podocitos cultivados, el calcitriol activó la transcripción del gen de la nefrina de una forma dependiente de la dosis34. Esto podría favorecer la conservación de la impermeabilidad a proteínas. El sistema experimental (cultivo celular) excluye la posible influencia de modificaciones hormonales (angiotensina) o metabólicas (calcio, fósforo) en la observación. En células renales cultivadas, tanto el calcitriol como el paricalcitol reducen la expresión de mediadores inflamatorios en respuesta a altas concentraciones de glucosa, como interleucina (IL)-6, proteína quimiotáctica de monocitos-1 (MCP-1) e IL-8 en podocitos y células tubulares35.
Efecto antiproteinúrico de los activadores del receptor de vitamina D en nefropatías experimentales
Los ratones diabéticos knock-out para VDR desarrollan mayor albuminuria y esclerosis glomerular y tienen niveles de nefrina más bajos que los ratones control36. Esta observación indica un efecto nefroprotector de la vitamina D endógena, sin requerimientos exógenos adicionales, y podría justificar que la deficiencia o insuficiencia de vitamina D tuviera un impacto negativo sobre la proteinuria. Desde los años noventa diversos estudios han abordado el posible efecto antiproteinúrico de los AVDR en nefropatías experimentales. La activación del VDR puede tener un efecto antiproteinúrico en nefropatías glomerulares de origen inmune, en la ERC de la nefrectomía subtotal, en la nefropatía diabética y en el síndrome nefrótico por puromicina.
En 1993 se abordó el efecto de la vitamina D sobre la modulación del sistema inmunológico, como aproximación terapéutica en glomerulonefritis de origen inmune. En ratas con nefritis de Heymann, un modelo de nefropatía membranosa, el calcitriol en dosis de 250-500 ng/kg/48 horas redujo significativamente la proteinuria a las 7-9 semanas, sin cambios en los títulos de anticuerpos. Sin embargo, el calcitriol produjo hipercalcemia y aumento de la calciuria37.
En ratas con síndrome nefrótico inducido por una toxina para podocitos (aminonucleósido de puromicina), se observó un aumento de expresión de la 24-hidroxilasa y disminución de la 1-α-hidroxilasa que precedió a la aparición de la insuficiencia renal. Este patrón de expresión génica origina una disminución del calcitriol. Asimismo, la administración diaria de calcitriol o su análogo 22-oxacalcitriol previno la lesión de los podocitos y en dosis altas se suprimió significativamente la proteinuria, sugiriendo que el deterioro en la regulación de la vitamina D juega un papel importante en la aparición de proteinuria26.
Los ratones db/db, un modelo murino de diabetes de causa genética similar a la diabetes tipo 2 con manifestaciones renales menos graves, sobreexpresaban 23 genes relacionados con la vitamina D y existió un aumento de la 1-α-hidroxilasa y del VDR glomerular comparados con ratones db/+ no diabéticos. Los autores plantearon la hipótesis de que la menor gravedad de las manifestaciones renales podría estar relacionada con la expresión de estos genes protectores, que además se encontraban aún más aumentados en situación de hiperglucemia. El aumento de expresión de 1-α-hidroxilasa previno el aumento de producción de fibronectina y colágeno IV inducido por altas concentraciones de glucosa en podocitos, lo que podría explicar la resistencia de estos ratones a la nefropatía diabética progresiva38. En ese sentido, la activación del VDR mediante calcitriol o paricalcitol previno la respuesta profibrótica y proinflamatoria de los podocitos a la presencia en el microambiente de otro producto metabólico cuya acumulación produce nefropatía proteinúrica, la globotriaosilesfingosina acumulada en la enfermedad de Fabry39.
En ratas con nefrectomía subtotal, dos dosis diferentes de paricalcitol (100 y 300 ng/kg/3 veces x semana) durante ocho semanas disminuyeron la proteinuria y conservaron la función renal de forma no dependiente de la dosis40. En este mismo modelo, el enalapril mejora de forma significativa la proteinuria, y en el grupo con la combinación de paricalcitol 800 ng/kg tres veces por semana asociado a enalapril la proteinuria tendió a disminuir aún más y disminuyó la glomeruloesclerosis y el TGFβ141. En el mismo modelo, el calcitriol 3 ng/kg/día redujo la albuminuria sin cambios significativos en la creatinina ni en la calcemia42. En resumen, un rango de dosis muy amplio, 21-2400 ng/kg/semana, tuvo efectos beneficiosos, lo que sugiere que se debería optar por dosis más bajas, que presumiblemente tendrán menos efectos adversos. El equivalente humano de estas dosis bajas es mal conocido.
Otro beneficio del tratamiento con análogos de la vitamina D en animales es la supresión de la renina, ya que el aumento compensador de la renina es una respuesta fisiológica al uso de BRAA como antiproteinúricos. En ratones con diabetes inducida con estreptozotocina, la combinación de bloqueadores del receptor de angiotensina 1 y análogos de vitamina D previno completamente la albuminuria, restauró la estructura de la barrera de filtración glomerular y redujo notablemente la glomeruloesclerosis. El paricalcitol previno la disminución de mRNA de nefrina y el aumento de mRNA de renina43.
La vitamina D tiene también efectos antiinflamatorios. La inflamación local contribuye a la progresión de la nefropatía diabética35,44. En ratas con nefropatía diabética, una dosis de calcitriol o paricalcitol que no redujo la proteinuria tuvo, no obstante, efectos antiinflamatorios, reduciendo la expresión renal de mRNA de IL-6, MCP-1 e IL-8 en podocitos y células tubulares, así como el infiltrado glomerular por macrófagos35.
En resumen, en modelos animales diferentes AVDR tienen un efecto antiproteinúrico (figura 1). Además, existe una plausibilidad biológica que explica los efectos antiproteinúricos de la activación del VDR, ya sea a través de la supresión de renina, de regulación de la inflamación/fibrosis o de efectos directos en el podocito como acciones antiapoptóticas, preservación del diafragma de hendidura, efectos antiinflamatorios y antifibróticos, que indican que la activación del VDR puede ser una alternativa para el tratamiento de la proteinuria. Sin embargo, desde el punto de vista clínico resulta fundamental confirmar estos potenciales beneficios en ensayos clínicos en pacientes, a fin de contestar a la pregunta propuesta por el profesor Cosío durante el congreso de la Sociedad Española de Nefrología 2012: ¿nos miente la rata?
EFECTO ANTIPROTEINÚRICO DE LA VITAMINA D. EVIDENCIAS EN INVESTIGACIÓN CLÍNICA
En la práctica clínica conviene diferenciar entre indicaciones aprobadas de un fármaco y potenciales beneficios sugeridos por datos experimentales pero pendientes de validación en el ser humano.
Indicaciones de la vitamina D y los activadores selectivos del receptor de la vitamina D según ficha técnica
Inicialmente vamos a revisar las indicaciones que tienen aprobadas en ficha técnica estos productos. La vitamina D natural o nativa, colecalciferol o vitamina D3 y ergocalciferol o vitamina D2, tiene indicaciones terapéuticas fuera del ámbito renal, en la prevención y el tratamiento del déficit vitamínico.
El calcifediol o calcidiol es el 25(OH)D3 y está indicado en el tratamiento de algunas formas de osteopenia, raquitismo u osteomalacia, hipofosforemia y, de forma muy genérica, en la osteodistrofia renal. Los AVDR tienen indicaciones (algo anacrónicas) para el manejo de las alteraciones fosfocálcicas y el hiperparatiroidismo renal. El más empleado en España es el calcitriol. Los AsVDR, concretamente el paricalcitol, tienen la indicación del tratamiento del hiperparatiroidismo secundario en el enfermo renal. Los potenciales efectos pleiotrópicos beneficiosos de los derivados de la vitamina D aún no están incluidos en ficha técnica, ni en las guías de práctica clínica, como es el caso de las KDIGO1,45.
Escala de evidencia científica
Las escalas de evidencia son el referente para proporcionar el nivel de calidad de los estudios y establecer la fuerza de la recomendación. La más empleada actualmente es la desarrollada por el Grade Working Group y que emplean con ligeras modificaciones las guías KDIGO46,47. Según estas categorías, el patrón de oro para alcanzar el primer nivel de evidencia son los ensayos clínicos aleatorizados (ECA) con suficiente potencia estadística y adecuado tamaño muestral o las revisiones sistemáticas, con sus correspondientes metaanálisis, que incluyan ECA y estén bien diseñadas.
Sin embargo, la jerarquía de la evidencia puede aumentar o reducir su nivel en función de varias consideraciones: a) importancia del outcome o resultado; b) diseño controlado (placebo o estándar de referencia); c) enmascaramiento; d) análisis del tamaño de la muestra y tiempo de seguimiento; e) adecuación estadística y valoración de las contundentes, etc. Por lo tanto, el análisis global conlleva cierto margen de subjetividad, ya que no hay reglas fijas para evaluar estos parámetros. Un ejemplo es el número de pacientes que se ha de incluir: estudios con pocos pacientes pueden aumentar la magnitud del efecto artificialmente e inducir un sesgo en la calidad de evidencia.
Estas consideraciones previas serán nuestro soporte para evaluar el nivel de evidencia y la fuerza de la recomendación del efecto antiproteinúrico de la vitamina D y de sus derivados en el terreno clínico.
Efecto antiproteinúrico: información clínica disponible
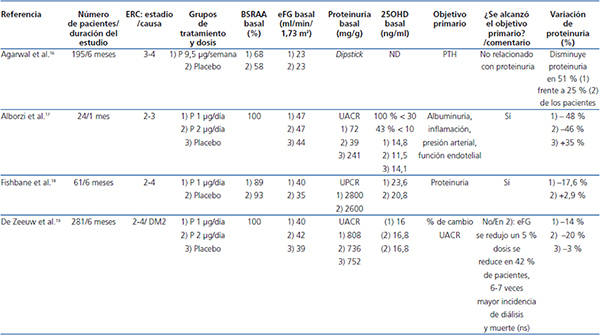
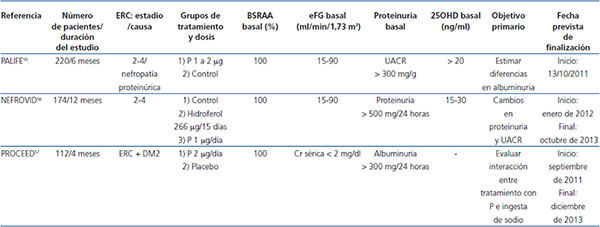
La tabla 1 recoge los principales ECA que han explorado el efecto de la vitamina D y los AVDR sobre la proteinuria, y la tabla 2 los estudios en marcha.
- Vitamina D nativa. La determinación sérica de 25(OH)D3 es el test habitual para evaluar los niveles de vitamina D. En un amplio corte poblacional (NHANES III) constataron una relación inversa entre los niveles de 25(OH)D3 y una mayor prevalencia de albuminuria48. Sin embargo, no hemos encontrado estudios de intervención que exploren el efecto antiproteinúrico de la vitamina D nativa.
- Calcitriol.Liu et al.49 demostraron en un ECA de 50 pacientes con nefropatía IgA y proteinuria residual > 0,8 g/día que los pacientes que recibieron calcitriol 0,5 μg bisemanal presentaron un descenso medio de la proteinuria del 19 % (valores medios de 1,6 a 1,3 g/24 horas) frente a placebo, tras 48 semanas de seguimiento.
Análisis: tamaño muestral pequeño, no enmascarado, sin aportar datos clínicamente importantes, como la tensión arterial. El descenso de la proteinuria, aunque significativo, fue escaso (1,6 a 1,3 g/24 horas) y no hubo cambios en el filtrado glomerular. Aunque es un estudio sugerente del efecto antiproteinúrico del calcitriol, la calidad de la evidencia y la fuerza de la recomendación son bajas. Asimismo, se trata de un único ensayo (por lo que requiere verificación), con resultados no extrapolables a otras enfermedades renales.
- Paricalcitol. Cuatro estudios y un metaanálisis han evaluado el efecto antiproteinúrico del paricalcitol oral en pacientes con ERC estadios 2 a 4 (E2-4). Los cuatro trabajos analizaron la proteinuria residual en pacientes previamente tratados con BRAA (tabla 1).
Agarwal et al.16 observaron en un ECA realizado en pacientes con proteinuria residual y ERC E2-4 un descenso de la proteinuria (dipstick) en el 51 % de los pacientes tratados con paricalcitol frente a un 25 % en el grupo control (p = 0,025) tras 24 semanas de tratamiento.
Los autores concluyeron que el efecto antiproteinúrico del paricalcitol es una potencial acción farmacológica que requiere ulterior investigación.
Análisis: este estudio fue diseñado para valorar la supresión de la hormona paratiroidea, siendo el efecto antiproteinúrico un análisis post hoc. Por tanto, el nivel de calidad de la evidencia es bajo. Además, la muestra fue relativamente pequeña y la valoración de la proteinuria fue semicuantitativa, no disponiendo de valores de proteinuria. No se encontraron cambios en la función renal.
Alborzi et al.17 realizaron un ensayo diseñado para tres grupos de pacientes con ERC E2-4: sin tratamiento, paricalcitol 1 μg y paricalcitol 2 μg. Incluyeron 8 pacientes en cada grupo y el tiempo de seguimiento fue de un mes. Las variables del estudio fueron albuminuria, inflamación, tensión arterial y función endotelial.
Análisis: podría considerarse un estudio piloto, dado el reducido tamaño muestral y el breve período de seguimiento. El descenso de la albuminuria se analizó solo en términos porcentuales y, aunque fue próximo al 50 % en el grupo con paricalcitol, el reducido tamaño muestral impide extraer información cualificada para establecer la calidad de la evidencia. Además, la albuminuria basal fue cuatro veces superior en el grupo control que en el grupo paricalcitol.
Fishbane et al.18 también publicaron un ECA comparando paricalcitol (n = 27) con placebo (n = 27) en pacientes con ERC 2-3, en un período de seguimiento de seis meses. El descenso del cociente proteína-creatinina urinario fue 2,8 frente a 2,3 g/día (17,6 %), p = 0,04; el 57 % alcanzó un descenso superior al 10 % (frente al 30 % en el grupo placebo).
Análisis: ECA realizado en una serie muy pequeña de enfermos, con una estimación del tamaño de la muestra poco clara, baja potencia estadística y heterogeneidad en los resultados. La modesta reducción de la proteinuria y la ausencia de datos en la progresión de la ERC limitan el valor del efecto antiproteinúrico del fármaco.
Podemos concluir que estos tres estudios son un soporte importante para recomendar el estudio del efecto antiproteinúrico del paricalcitol, pero la calidad de la evidencia y la fuerza de la recomendación son insuficientes para sostener cambios en la práctica clínica. Además, la inclusión de pacientes deficitarios en vitamina D impide distinguir entre efectos terapéuticos intrínsecos del paricalcitol y efectos de la corrección del defecto de vitamina D.
De Zeeuw et al.19 publicaron un ECA específicamente diseñado para evaluar en pacientes diabéticos tipo 2 con un filtrado glomerular entre 15 y 90 ml/min y albuminuria residual el efecto antiproteinúrico del paricalcitol en dosis de 1 y 2 μg. El primer objetivo era el porcentaje de cambio del cociente albúmina-creatinina urinario (CAC), que no alcanzó significación estadística. En los grupos con paricalcitol, la albuminuria descendió un 14 % y un 20 %, respectivamente. El descenso medio de la albuminuria de 24 horas fue 254 mg (desde 717 mg a 463 mg, 34 %) en el grupo de paricalcitol 2 μg. El porcentaje de pacientes con descenso del CAC > 15 % solo alcanzó mínima significación (p = 0,038) en aquellos que recibían 2 μg de paricalcitol. Es destacable que tras seis meses de tratamiento se constató un descenso del 5 % del filtrado glomerular estimado en el grupo tratado con 2 μg de paricalcitol. Un análisis post hoc identificó a los pacientes tratados con 2 μg/día y alta ingesta de sal como los únicos que podrían beneficiarse del tratamiento. Sin embargo, en el 42 % de estos pacientes fue preciso reducir la dosis de paricalcitol y la incidencia de diálisis o muerte fue 6-7 veces mayor en el grupo paricalcitol 2 μg que en el placebo (p = 0,064-0,118, no hay datos publicados suficientes para ser más precisos).
Análisis: es un ECA bien diseñado, enmascarado, controlado, con tamaño muestral estimado adecuadamente. Ni el CAC (parámetro subrogado) ni la función renal mostraron un claro beneficio con la intervención. El primer outcome, que fue el cambio del CAC con paricalcitol frente a placebo, no fue significativo. No se consideró la variabilidad del CAC, lo que disminuye aún más la potencia estadística. El descenso medio de la albuminuria fue sutil, inferior a 250 mg/24 horas, y siempre partiendo de valores basales medios relativamente bajos (< 0,8 g/24 horas). El porcentaje de pacientes con descenso del CAC mayor del 15 % fue significativamente superior en los pacientes que recibieron paricalcitol (p = 0,038). Asimismo, los pacientes que recibieron paricalcitol experimentaron un ligero y transitorio descenso del filtrado glomerular estimado. Estos resultados no aclaran de forma contundente los potenciales beneficios antiproteinúricos del paricalcitol. Además, no se consideró la repleción previa con vitamina D (en una población altamente deficitaria) ni se planteó la comparación con otras formas activas de vitamina D más económicas. De nuevo, la inclusión de pacientes deficitarios en vitamina D (25-OHD media 16,6 ng/ml)50 impide distinguir entre efectos terapéuticos intrínsecos del paricalcitol y efectos de la corrección del defecto de vitamina D51.
Cheng et al.52 publicaron un metaanálisis donde se evaluó el efecto del paricalcitol sobre el hiperparatiroidismo y la proteinuria residual (post-BRAA) en pacientes con ERC E2-5. Se seleccionaron los cuatro estudios previamente mencionados. Ante la falta de datos para evaluar la proteinuria final, se aplicó como end-point o resultado el descenso de la proteinuria > 10 %. Debemos consignar que el método de determinación de esta variable no fue homogéneo en los cuatro estudios (dipstick, albuminuria, cociente proteína-creatinina urinario y CAC, respectivamente). A partir de los cuatro ECA evaluados, se reclutaron un total 469 pacientes: 285 tratados con paricalcitol y 184 con placebo. El análisis global mostró un beneficio significativo en la reducción de la proteinuria > 10 % (riesgo relativo [intervalo de confianza al 95 %]: 1,68 [1,25-2,25]). Este metaanálisis tiene limitaciones importantes; la mayor potencia estadística la proporcionan los ECA con series más pequeñas y diseño más cuestionable. De hecho, ensayos con series pequeñas suelen mostrar mayores efectos terapéuticos, por acentuar las diferencias en la selección de casos. Asimismo, cuando se consideraron solamente los pacientes tratados con paricalcitol 2 μg, no se observaron beneficios significativos del tratamiento.
CONCLUSIONES
Existen evidencias experimentales de que la activación del VDR ejerce una acción protectora sobre el podocito, limita la activación del sistema renina-angiotensina-aldosterona frenando la producción de renina y tiene efecto antiproteinúrico. Sin embargo, este último efecto se ha observado con dosis muy variables de AVDR, lo que deja abierta la cuestión de cuál es la dosis óptima y de si la mera sustitución de un déficit vitamínico puede ser útil. Los ensayos clínicos se han realizado en general en pacientes con déficit o insuficiencia de vitamina D, lo que no ayuda a aclarar esta cuestión. Es más, estos ensayos mostraron una mala tolerancia a las dosis más altas de paricalcitol (2 µg/día). Hay datos que sugieren que los animales de experimentación y el ser humano pueden responder de forma diferente a la activación de VDR. Así, el paricalcitol no disminuyó la actividad renina plasmática en el estudio VITAL19 ni evitó una llamativa hiperplasia del aparato yuxtaglomerular productor de renina en un paciente con biopsia renal postratamiento de proteinuria53.
En resumen, la información disponible es insuficiente para aconsejar el empleo de la vitamina D nativa, de los AVDR o del AsVDR como fármacos antiproteinúricos renoprotectores más allá del ámbito experimental. Más aún, con estos datos no es posible aclarar si la magnitud de descenso de la proteinuria alcanzada en los estudios (> 10 % en este metaanálisis) tiene impacto sobre la progresión de la ERC. Nuevos estudios deberían establecer dentro de qué rangos de proteinuria se obtiene una eficacia real. Asimismo, estudios de coste-eficacia contribuirían a defender la indicación. Con cierta aproximación podemos afirmar que el tratamiento dialítico puede incrementar el coste anual del paciente en unos 40 000 euros54. Cualquier medida terapéutica que demuestre retrasar el inicio de la diálisis durante una media de seis meses, por ejemplo, podría ser eficaz si su coste semestral fuera inferior a esta cifra. En este sentido, todos los AVDR, incluido el paricalcitol, tienen un coste sensiblemente inferior.
CONCEPTOS CLAVE
- La proteinuria es el principal predictor de progresión de la ERC. La proteinuria residual tras el empleo de BRAA persiste como diana terapéutica prioritaria.
- Varios modelos experimentales sugieren un efecto antiproteinúrico de la activación del VDR por varios mecanismos: supresión de renina, regulación de la inflamación, efectos directos en el podocito y efectos antifibróticos.
- Desde el punto de vista clínico la información disponible es insuficiente para aconsejar el empleo de la vitamina D nativa o de AVDR como fármacos antiproteinúricos renoprotectores adicionales, más allá del ámbito experimental.
Agradecimientos
Instituto de Salud Carlos III (ISCIIIRETIC REDINREN RD12/0021, PS09/00447), Comunidad de Madrid (CIFRA S2010/BMD-2378), Programa Intensificación Actividad Investigadora (ISCIII/Agencia Laín-Entralgo/CM) to AO.
Conflictos de interés
VLS es investigador principal del estudio NEFROVID y AOA pertenece al comité de dirección del estudio PALIFE.
Tabla 1. Principales ensayos clínicos aleatorizados publicados que exploran el efecto del paricalcitol sobre la proteinuria
Tabla 2. Ensayos clínicos en marcha que exploran el efecto del paricalcitol sobre la proteinuria
Figura 1. Mecanismos potencialmente implicados en el efecto antiproteinúrico y nefroprotector de la activación del receptor de vitamina D