La hemodiálisis (HD) con líquido de diálisis (LD) con bicarbonato requiere la presencia de un ácido para prevenir la precipitación del carbonato de calcio y magnesio. El más usado es el ácido acético, y con él se han descrito diversas complicaciones. En un trabajo previo describimos los cambios agudos, durante una sesión, en los pacientes en HD con un LD con citrato en lugar de acetato, y en este referimos los resultados a medio plazo: 16 semanas.
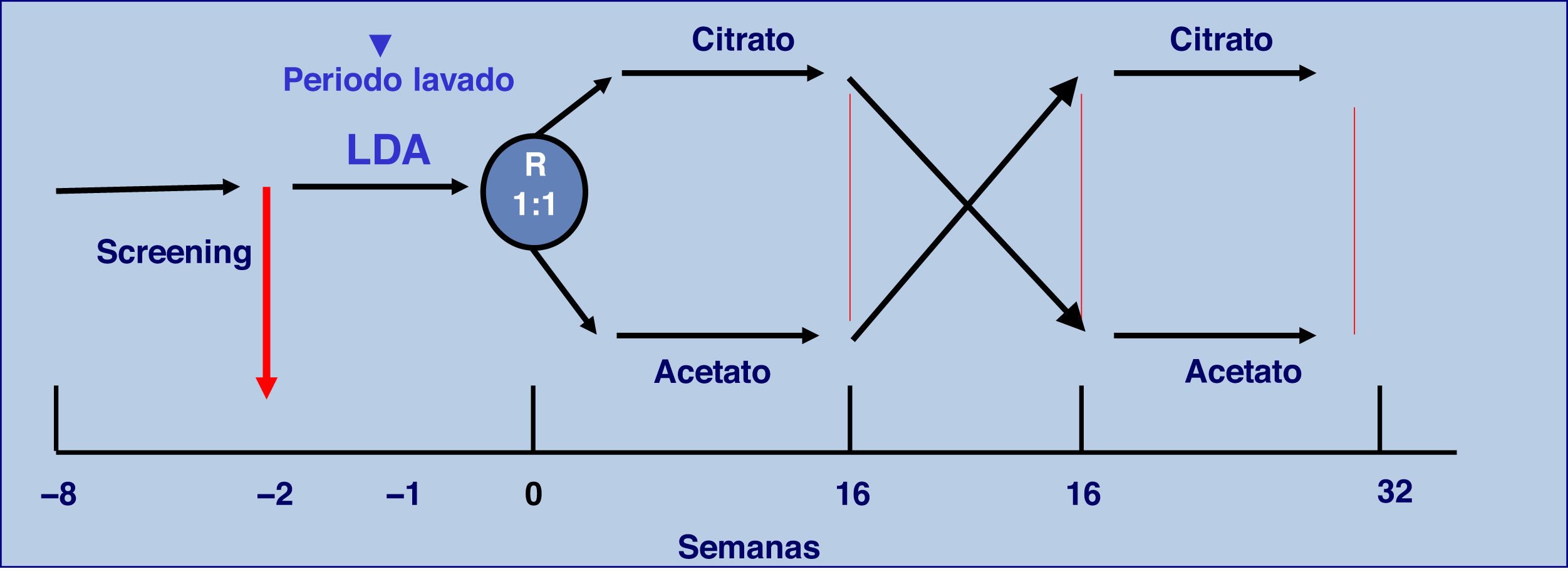
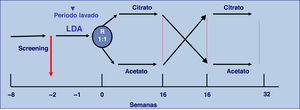
Es un estudio prospectivo, multicéntrico, cruzado y aleatorizado, donde 56 pacientes en HD con bicarbonato 3 veces a la semana se dializaron 16 semanas con 3mmol/l acetato y 16 semanas con 1mmol/l de citrato. Se incluyeron pacientes mayores de 18 años con una estancia en HD previa superior a 3 meses y con fístula arteriovenosa normofuncionante. Se recogieron mensualmente datos epidemiológicos, de diálisis, bioimpedancia, bioquímica pre y postHD, así como los episodios de hipotensión.
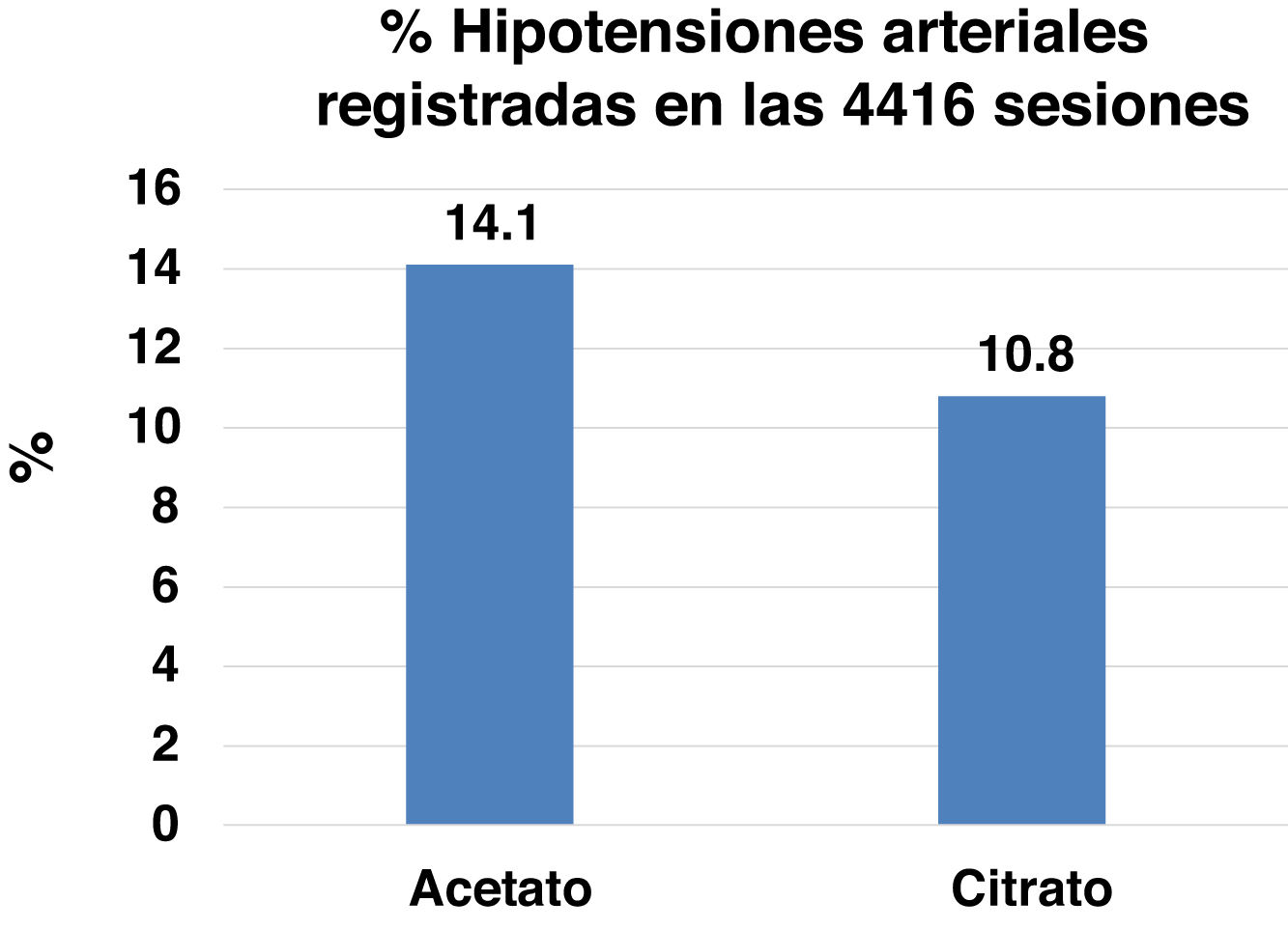
Después de 16 semanas de tratamiento con citrato el calcio iónico y el magnesio preHD eran significativamente inferiores y la hormona paratiroidea (PTH) más alta que en el periodo con acetato. No se observaron diferencias en la eficacia de la diálisis. Los episodios de hipotensión fueron significativamente más frecuentes con acetato que con citrato: 311 (14,1%) vs. 238 (10,8%) sesiones. El índice de masa magra se incrementó en 0,96±2,33kg/m2 cuando los pacientes pasaron de LD con acetato a citrato.
La HD con citrato modifica varios parámetros del metabolismo óseo-mineral, no solo de forma aguda como se había descrito, sino también a medio plazo. La sustitución del acetato por el citrato mejora la estabilidad hemodinámica, produciendo menos hipotensiones y puede mejorar el estado nutricional.
ClinicalTrials.gov NCT03319680.
Hemodialysis (HD) with bicarbonate dialysis fluid (DF) requires the presence of an acid to prevent the precipitation of calcium and magnesium carbonate. The most used acid is acetic acid, with it several complications have been described. In a previous work, we described the acute changes during an HD session with a DF with citrate instead of acetate. Now, we report the results in the medium term, 16 weeks. It is a prospective, multicenter, crossover and randomized study, where 56 HD patients with bicarbonate three times a week were dialysed for 16 weeks with 3mmol/L acetate and 16 weeks with 1mmol/L citrate. Patients older than 18 years with a previous stay on HD of more than 3 months and with a normal functioning arteriovenous fistula were included. Epidemiological data, dialysis, bioimpedance, biochemistry before and after HD, as well as hypotensive episodes, were collected monthly. After 16 weeks of citrate treatment, pre-HD ionic calcium and magnesium were significantly lower and paratiroid hormone (PTH) higher than in the acetate period. No differences were observed in the effectiveness of dialysis. Hypotensive episodes were significantly more frequent with acetate than with citrate: 311 (14.1%) vs 238 (10.8%) sessions. The lean mass index increased by 0.96±2.33kg/m2 when patients switched from DF with acetate to citrate.
HD with citrate modifies several parameters of bone mineral metabolism, not only acutely as previously described, but also in the long-term. The substitution of acetate for citrate improves hemodynamic stability, producing less hypotension and can improve nutritional status.
En la hemodiálisis (HD) la composición del líquido de diálisis (LD) es clave para optimizar el balance de fluidos, electrolitos y acido-base1. El LD se produce en las máquinas de HD mediante la mezcla de sus 3 componentes: el agua purificada, el concentrado ácido y el bicarbonato. El concentrado ácido recibe este nombre porque debe contener un ácido que, al mezclarse con el bicarbonato en el circuito hidráulico de la máquina prevenga la precipitación del carbonato cálcico y magnésico. El ácido usado más comúnmente es el ácido acético, en concentraciones que van desde 3 a 10mmol/l, generalmente 3-4mmol/l. Estas concentraciones son cerca de 30 veces las fisiológicas en el plasma, 0,1mmol/l, lo que produce una transferencia neta de acetato desde el LD al plasma durante la sesión de HD, incrementándose la concentración plasmática de acetato2. Estas concentraciones de acetato durante y después de la HD son mayores en pacientes con una menor capacidad de metabolizar el acetato, generalmente con una masa muscular disminuida, y van a producir efectos adversos.
El LD con citrato se desarrolló para mejorar la biocompatibilidad de la diálisis de bicarbonato más acetato, reemplazando este por el ácido cítrico3. El citrato es un quelante del calcio que tiene propiedades anticoagulantes al reducir el calcio iónico. Los beneficios que se han descrito con el LD con citrato incluyen: menor trombogenicidad4 e inflamación y un aumento del aclaramiento de moléculas de bajo y medio peso molecular5,6, mejoría tanto en la nutrición7 como en la tolerancia8 y el control ácido-base, con menor acidosis prediálisis9 y sin complicaciones severas, incluso en la hemodiafiltración10.
Las evidencias clínicas sobre sus ventajas en estudios aleatorizados son escasas. El uso del LD con citrato se ha incrementado lentamente en la práctica clínica cotidiana.
En 2019 publicamos la primera parte del estudio ABC-treat11 (NCT03319680), que demostraba que el uso del citrato en lugar del acetato tiene un efecto agudo en los electrolitos, reduciendo posdiálisis el bicarbonato, el calcio y el magnesio e incrementando la hormona paratiroidea (PTH). También se objetivó una menor frecuencia de hipotensiones, del 10,8% con el citrato respecto al acetato, 14,1%.
Esta segunda parte del estudio ABC-treat investiga el efecto crónico de la HD con citrato, sin acetato, comparada con el LD estándar respecto a los cambios en el estado ácido-base, parámetros del metabolismo mineral-óseo, eficacia de diálisis, tolerancia, nutrición e inflamación.
Material y métodosDiseño del estudioSe ha realizado un estudio abierto, aleatorizado, prospectivo, multicéntrico y cruzado de 32 semanas de duración, en pacientes en HD 3 veces a la semana. Los pacientes recibieron HD durante 16 semanas con LD con acetato y otras 16 semanas con LD con citrato. El LD inicial fue determinado por aleatorización con una relación 1:1 y estratificado por centros (fig. 1).
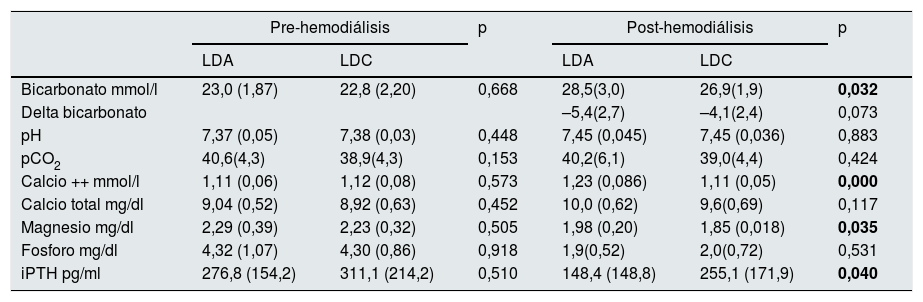
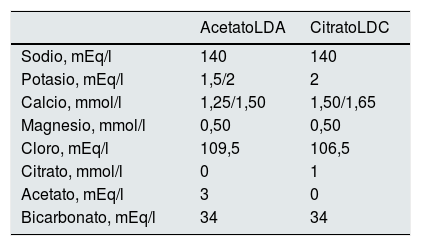
El efecto agudo de la sesión de HD, valores pre y postHD, del LDC versus el LDA se han descrito previamente con detalle11. En resumen, al final de una sesión de HD el bicarbonato sérico, el calcio iónico y el magnesio son inferiores con LDC que con LDA y la PTH más alta (tabla 1). Estos resultados del efecto agudo se han querido corroborar en el estudio a largo plazo (32 semanas).
Datos de laboratorio basales, pre y poshemodiálisis (HD) (n=56)
| Pre-hemodiálisis | p | Post-hemodiálisis | p | |||
|---|---|---|---|---|---|---|
| LDA | LDC | LDA | LDC | |||
| Bicarbonato mmol/l | 23,0 (1,87) | 22,8 (2,20) | 0,668 | 28,5(3,0) | 26,9(1,9) | 0,032 |
| Delta bicarbonato | –5,4(2,7) | –4,1(2,4) | 0,073 | |||
| pH | 7,37 (0,05) | 7,38 (0,03) | 0,448 | 7,45 (0,045) | 7,45 (0,036) | 0,883 |
| pCO2 | 40,6(4,3) | 38,9(4,3) | 0,153 | 40,2(6,1) | 39,0(4,4) | 0,424 |
| Calcio ++ mmol/l | 1,11 (0,06) | 1,12 (0,08) | 0,573 | 1,23 (0,086) | 1,11 (0,05) | 0,000 |
| Calcio total mg/dl | 9,04 (0,52) | 8,92 (0,63) | 0,452 | 10,0 (0,62) | 9,6(0,69) | 0,117 |
| Magnesio mg/dl | 2,29 (0,39) | 2,23 (0,32) | 0,505 | 1,98 (0,20) | 1,85 (0,018) | 0,035 |
| Fosforo mg/dl | 4,32 (1,07) | 4,30 (0,86) | 0,918 | 1,9(0,52) | 2,0(0,72) | 0,531 |
| iPTH pg/ml | 276,8 (154,2) | 311,1 (214,2) | 0,510 | 148,4 (148,8) | 255,1 (171,9) | 0,040 |
iPTH: hormona paratiroidea intacta; LDA: líquido de diálisis con acetato; LDC: líquido de diálisis con citrato; pCO2: presión parcial de dióxido de carbono;
*Se destaca en negrita las p significativas.
Los datos se expresan como la media (desviación típica).
Explicación adicional: todas las muestras sanguíneas se extrajeron de la línea arterial en la sesión de mitad de semana. La sangre preHD fue extraída justo antes de comenzar la sesión y las postHD 60 segundos después de haber reducido el flujo sanguíneo a 50ml/min al final de la sesión.
Estos resultados corresponden a la primera sesión de HD después de la aleatorización. Previamente todos los pacientes se habían dializado 2 semanas con LDA, por lo que los valores preHD corresponden a 2 semanas con acetato y los postHD al LD asignado, acetato o citrato.
Los pacientes se dializaron en monitores AK 200 Ultra S o Artis, usando 3mmol/l SoftPac® acetato o 1mmol/l SelectBag Citrato® (Baxter Healthcare, Deerfield, EE. UU.). Se aportan más detalles en Sequera et al. 201911.
El Comité de Ética aprobó el estudio, que fue realizado de acuerdo con la declaración de Helsinki (ClinicalTrials.gov: NCT03319680).
La composición del LD con acetato (LDA) y con citrato (LDC) aparece en la tabla 2. Se utilizaron 2 concentraciones diferentes de calcio en el LD; esa concentración se correspondía a la que cada paciente utilizaba antes de entrar en el estudio, 1,25 o 1,50mmol/l. Con LDA se mantenía la concentración de calcio. Si el calcio previo en LDA era 1,25 o 1,50mmol/l la concentración en LDC se aumentaba a 1,50 y 1,65mmol/l, respectivamente. El grado de aumento en el calcio no fue el mismo para ambos grupos, de 1,25 a 1,50 (0,25) y de 1,5 a 1,65 (0,15) debido a que se adaptó el aumento de la concentración de calcio a las disponibles en el mercado.
Antes de la aleatorización todos los pacientes se dializaron 2 semanas con LDA. Cada paciente mantuvo el mismo esquema de diálisis durante todo el estudio y servía como control de sí mismo. El único cambio realizado en la HD fue la utilización de LDC. El diseño del estudio se representa en la figura 1.
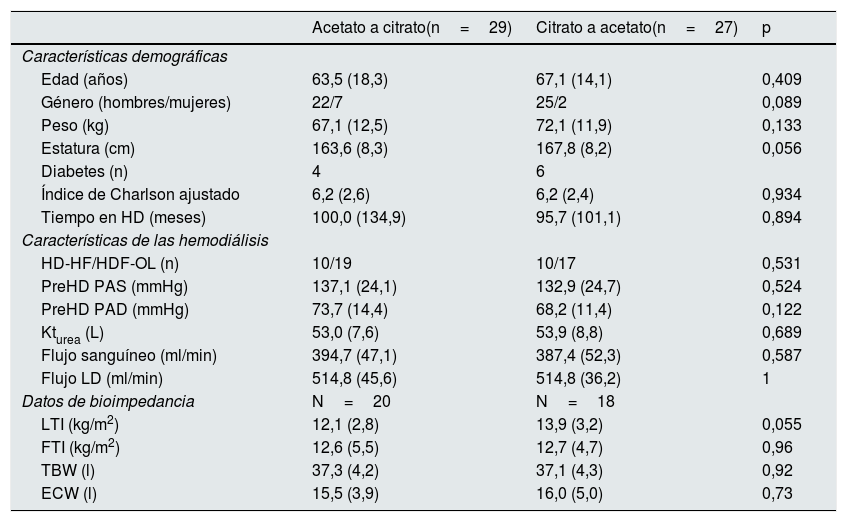
Población estudiadaSe incluyeron pacientes prevalentes con enfermedad renal crónica (ERC) en HD mayores de 18 años y que llevasen en HD un mínimo de 3 meses y utilizando como acceso vascular un fistula arteriovenosa (FAV) (tabla 3). Todos los pacientes firmaron un consentimiento informado.
Características basales de los pacientes de acuerdo al grupo aleatorizado
| Acetato a citrato(n=29) | Citrato a acetato(n=27) | p | |
|---|---|---|---|
| Características demográficas | |||
| Edad (años) | 63,5 (18,3) | 67,1 (14,1) | 0,409 |
| Género (hombres/mujeres) | 22/7 | 25/2 | 0,089 |
| Peso (kg) | 67,1 (12,5) | 72,1 (11,9) | 0,133 |
| Estatura (cm) | 163,6 (8,3) | 167,8 (8,2) | 0,056 |
| Diabetes (n) | 4 | 6 | |
| Índice de Charlson ajustado | 6,2 (2,6) | 6,2 (2,4) | 0,934 |
| Tiempo en HD (meses) | 100,0 (134,9) | 95,7 (101,1) | 0,894 |
| Características de las hemodiálisis | |||
| HD-HF/HDF-OL (n) | 10/19 | 10/17 | 0,531 |
| PreHD PAS (mmHg) | 137,1 (24,1) | 132,9 (24,7) | 0,524 |
| PreHD PAD (mmHg) | 73,7 (14,4) | 68,2 (11,4) | 0,122 |
| Kturea (L) | 53,0 (7,6) | 53,9 (8,8) | 0,689 |
| Flujo sanguíneo (ml/min) | 394,7 (47,1) | 387,4 (52,3) | 0,587 |
| Flujo LD (ml/min) | 514,8 (45,6) | 514,8 (36,2) | 1 |
| Datos de bioimpedancia | N=20 | N=18 | |
| LTI (kg/m2) | 12,1 (2,8) | 13,9 (3,2) | 0,055 |
| FTI (kg/m2) | 12,6 (5,5) | 12,7 (4,7) | 0,96 |
| TBW (l) | 37,3 (4,2) | 37,1 (4,3) | 0,92 |
| ECW (l) | 15,5 (3,9) | 16,0 (5,0) | 0,73 |
ECW: agua extracelular; FTI: índice de masa grasa; HD-HF: hemodiálisis de alto flujo; HDF-OL: hemodiafiltración en línea; LTI: índice de masa magra; PreHD PAD: presión arterial diastólica preHD; PreHD PAS: presión arterial sistólica preHD; TBW: agua total corporal.
Los datos se expresan como la media (desviación típica) o según se especifica.
Los criterios de exclusión fueron: alergia o intolerancia al citrato, enfermedad inflamatoria intercurrente, HD mediante un catéter y deterioro cognitivo.
Protocolo de estudioLos objetivos del estudio fueron: evaluar el impacto del LDC en el metabolismo óseo-mineral, estado ácido-base, eficacia de la HD, inflamación, estado nutricional, coagulación, estabilidad hemodinámica y tolerancia, en comparación con el LDA.
Se recogieron los datos epidemiológicos, de diálisis, analíticos, de composición corporal, parámetros de coagulación y episodios de hipotensión mensualmente durante los 8 meses del estudio, como se han descrito previamente11. Las muestras de sangre se obtuvieron pre y postHD, midiéndose: pH, bicarbonato, pCO2, calcio iónico y total, fósforo, magnesio, albúmina, proteína C reactiva (PCR) y PTH. Los métodos de determinación fueron los estándares y similares en todos los centros. No se permitieron modificaciones de la metodología durante el estudio.
El Kt fue medido automáticamente por el biosensor de dialisancia iónica Diascan®.
Para evaluar el estado nutricional, además de los datos de laboratorio, se midió la composición corporal por bioimpedancia eléctrica multifrecuencia (BIA), usando el Body Composition Monitor ([BCM®] Fresenius Medical Care, Bad Homburg vor der Höhe, Alemania) en 29 pacientes, algunos centros no contaban con bioimpedancia eléctrica multifrecuencia. Las medidas se realizaron en el lado dominante o donde no estaba la FAV, antes de comenzar la sesión de HD de mitad de semana, usando la configuración de los electrodos estándar y después de haber estado 5minutos en decúbito en reposo. Se recogieron los datos de hidratación (OH) y composición corporal: índice de masa grasa (FTI) y el índice de masa magra (LTI) ajustados a la superficie corporal (kg/m2). El estado de inflamación se valoró mediante la PCR.
Análisis estadísticoLas variables continuas normales se expresan como la media y la desviación típica. La única variable con una distribución no normal ha sido la PCR, Z de Kolmogorov-Smirnov y mediante Log ha sido posible transformarla en normal y así se expresa. Para comparar las variables normales se utilizó la «t» de Student, pareada o no, según convenía. Para comparar más de 2 variables normales se recurrió a una prueba MANOVA. Dado el diseño del estudio no se recurrió a un análisis de ajuste multivariante12,13. Se ha considerado como significativo una p<0,05. El análisis estadístico se realizó usando el programa SPSS 15.0 (SPSS INC., Chicago IL, EE. UU.).
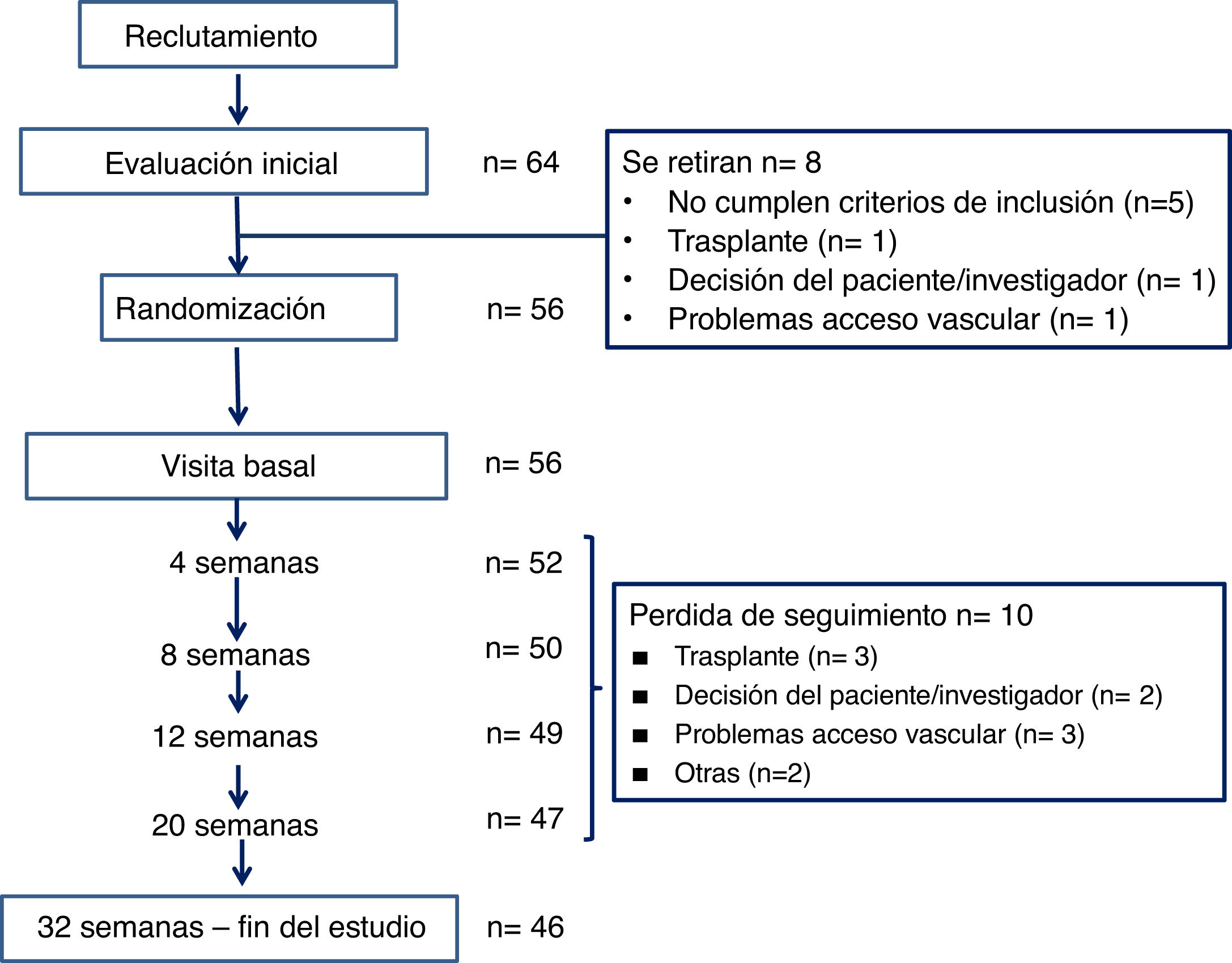
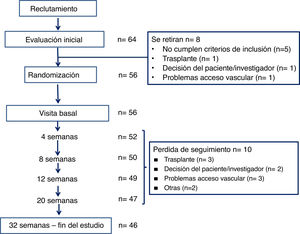
ResultadosPoblación estudiadaEn la figura 2 se ilustra el flujo de pacientes. De los 64 pacientes reclutados inicialmente en 8 unidades de hemodiálisis españolas, 8 salieron del estudio y en 10 se perdió el seguimiento. La muestra final incluye 56 pacientes iniciales y 46 que completaron el estudio.
La edad media fue de 65,34,14 (rango 23-93) años, 47 hombres y 9 mujeres, con un índice de Charlson ajustado de 6,2 (2,5). La etiología de la ERC fue: en 16 glomerulonefritis, 10 diabetes, 9 enfermedad vascular, 4 hereditarias, 4 nefritis intersticial, 9 otras causas y en 4 de causa desconocida.
36 pacientes se dializaban mediante hemodiafiltración en línea (HDF-OL) y 20 en HD de alto flujo (HD-HF).
La aleatorización asigno a 29 pacientes para comenzar con LDA y a 27 con LDC, a las 16 semanas los pacientes cambiaron al otro tipo de LD durante otras 16 semanas. En la tabla 1 se describen las características basales de los pacientes de acuerdo al grupo asignado, no existiendo diferencias significativas entre los 2 grupos. En la población estudiada predominaban los hombres, siendo esta proporción más acentuada en el grupo que inició LDC, pero no de forma significativa.
Parámetros ácido-base y del metabolismo óseo-mineralEl efecto agudo de la sesión de HD, valores pre y postHD, del LDC versus el LDA se ha descrito previamente con detalle11. En resumen, al final de una sesión de HD el bicarbonato sérico, el calcio iónico y el magnesio son inferiores con LDC que con LDA y la PTH más alta (tabla 3).
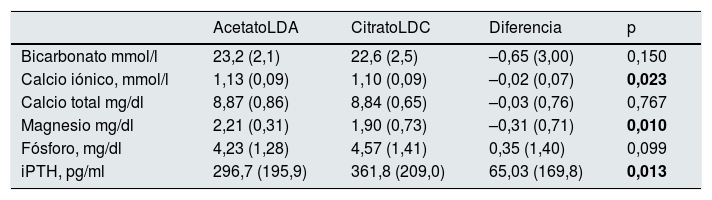
La tabla 4 muestra el efecto crónico sobre el estado ácido-base y parámetros del metabolismo óseo-mineral preHD, con la utilización del LD con acetato o citrato durante 16 semanas en 46 pacientes. No se encontraron diferencias significativas en el bicarbonato y sí en el calcio iónico y magnesio, que eran significativamente inferiores después del periodo con citrato. Después de las 16 semanas con citrato la iPTH aumentaba significativamente. Se buscó si el Cai, el P y el Mg influían en el aumento final de la iPTH. El Cai, p=0,011 y el P, p=0,013 se correlacionaban con la iPTH. Con el Mg la relación no era significativa. En el análisis mediante regresión lineal múltiple, usando como variables predictivas: fósforo (mg/dl), calcio iónico (mg/dl), magnesio (mg/dl) y como variable dependiente la PTH (pg/ml), el modelo es significativo, F=4,257 y p=0,012. El aumento de la PTH es atribuible fundamentalmente al cambio de calcio iónico. El Mg bajo no sería capaz de estimular la PTH en presencia de un calcio bajo15.
Efecto crónico de la utilización de LDA o LDC durante 16 semanas en los parámetros del estado ácido-base y óseo-mineral en los 46 pacientes que completaron el estudio
| AcetatoLDA | CitratoLDC | Diferencia | p | |
|---|---|---|---|---|
| Bicarbonato mmol/l | 23,2 (2,1) | 22,6 (2,5) | –0,65 (3,00) | 0,150 |
| Calcio iónico, mmol/l | 1,13 (0,09) | 1,10 (0,09) | –0,02 (0,07) | 0,023 |
| Calcio total mg/dl | 8,87 (0,86) | 8,84 (0,65) | –0,03 (0,76) | 0,767 |
| Magnesio mg/dl | 2,21 (0,31) | 1,90 (0,73) | –0,31 (0,71) | 0,010 |
| Fósforo, mg/dl | 4,23 (1,28) | 4,57 (1,41) | 0,35 (1,40) | 0,099 |
| iPTH, pg/ml | 296,7 (195,9) | 361,8 (209,0) | 65,03 (169,8) | 0,013 |
LDA: líquido de diálisis con acetato; LDC: líquido de diálisis con citrato; iPTH: hormona paratiroidea intacta.
*Se destaca en negrita las p significativas.
Usando como rango de PTH: 100-500pg/ml. La PTH se situó por debajo de rango en el 13% con LDA y en el 8,7% con LDC, y por encima de 500pg/ml ocurrió a la inversa, el 8,7% con LDA y el 13% con LDC.
Eficacia de la hemodiálisisNo se encontraron diferencias significativas en el Kt entre el periodo con LDA respecto a LDC (53,06 [7,56] L versus 53,97 [8,93] L), ni en el Kt/V (1,41 [0,19] versus 1,39 [0,29]). A las 16 semanas no se encontraron diferencias significativas en el fósforo, ni en la creatinina, ni beta-2-microglobulina séricos entre los 2 grupos (tablas 4 y 5).
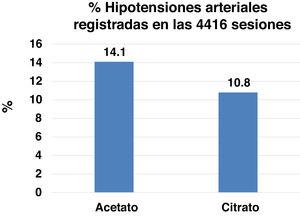
ToleranciaSe realizaron 4.416 sesiones de HD en los 46 pacientes que completaron el estudio, un 50% con LDA y otro 50% con LDC. El número de episodios de hipotensión fue significativamente mayor en el periodo con acetato que en el de citrato: (311 [14,1%] versus 238 [10,8%] sesiones, p<0,01) (fig. 3). No se encontraron diferencias en cuanto a los calambres.
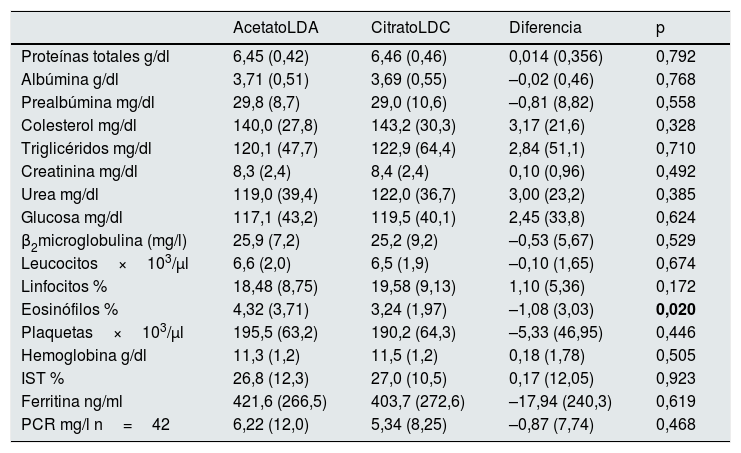
Nutrición e inflamaciónNo se encontraron diferencias en la albúmina ni en la PCR después de 16 semanas con LDA o LDC (tabla 5). Sin embargo, cuando analizamos los resultados separando a los pacientes con una albúmina sérica basal mayor o menor de 3,8g/dl, sí se encuentran diferencias significativas. Después de 16 semanas con LDC, los pacientes con una albúmina inferior a 3,8g/dl experimentaron un incremento significativo en la albúmina, de 3,37 a 3,49g/dl (p<0,000).
Datos de laboratorio preHD en los 46 pacientes después de 16 semanas con LDA y LDC
| AcetatoLDA | CitratoLDC | Diferencia | p | |
|---|---|---|---|---|
| Proteínas totales g/dl | 6,45 (0,42) | 6,46 (0,46) | 0,014 (0,356) | 0,792 |
| Albúmina g/dl | 3,71 (0,51) | 3,69 (0,55) | –0,02 (0,46) | 0,768 |
| Prealbúmina mg/dl | 29,8 (8,7) | 29,0 (10,6) | –0,81 (8,82) | 0,558 |
| Colesterol mg/dl | 140,0 (27,8) | 143,2 (30,3) | 3,17 (21,6) | 0,328 |
| Triglicéridos mg/dl | 120,1 (47,7) | 122,9 (64,4) | 2,84 (51,1) | 0,710 |
| Creatinina mg/dl | 8,3 (2,4) | 8,4 (2,4) | 0,10 (0,96) | 0,492 |
| Urea mg/dl | 119,0 (39,4) | 122,0 (36,7) | 3,00 (23,2) | 0,385 |
| Glucosa mg/dl | 117,1 (43,2) | 119,5 (40,1) | 2,45 (33,8) | 0,624 |
| β2microglobulina (mg/l) | 25,9 (7,2) | 25,2 (9,2) | –0,53 (5,67) | 0,529 |
| Leucocitos×103/μl | 6,6 (2,0) | 6,5 (1,9) | –0,10 (1,65) | 0,674 |
| Linfocitos % | 18,48 (8,75) | 19,58 (9,13) | 1,10 (5,36) | 0,172 |
| Eosinófilos % | 4,32 (3,71) | 3,24 (1,97) | –1,08 (3,03) | 0,020 |
| Plaquetas×103/μl | 195,5 (63,2) | 190,2 (64,3) | –5,33 (46,95) | 0,446 |
| Hemoglobina g/dl | 11,3 (1,2) | 11,5 (1,2) | 0,18 (1,78) | 0,505 |
| IST % | 26,8 (12,3) | 27,0 (10,5) | 0,17 (12,05) | 0,923 |
| Ferritina ng/ml | 421,6 (266,5) | 403,7 (272,6) | –17,94 (240,3) | 0,619 |
| PCR mg/l n=42 | 6,22 (12,0) | 5,34 (8,25) | –0,87 (7,74) | 0,468 |
IST: Índice de saturación de la transferrina; iPTH: hormona paratiroidea intacta; LDA: líquido de diálisis con acetato; LDC: líquido de diálisis con citrato; PCR: proteína C reactiva.
*Se destaca en negrita la p significativa.
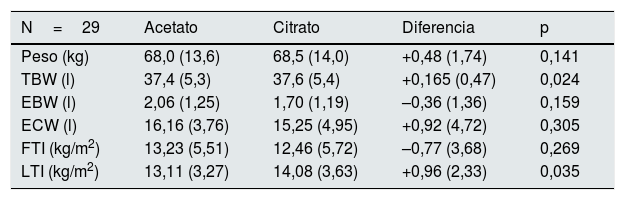
Los resultados de la bioimpedancia en un subgrupo de 29 pacientes se describen en la tabla 6. El LTI y el agua corporal total se incrementaban durante el periodo con citrato, siendo al final significativamente superior al del periodo con acetato.
Composición corporal por bioimpedancia a las 16 semanas de cambiar de tipo de líquido de diálisis (LD). Las variables se comparan en cada paciente al final del periodo con LD con acetato y LD con citrato
| N=29 | Acetato | Citrato | Diferencia | p |
|---|---|---|---|---|
| Peso (kg) | 68,0 (13,6) | 68,5 (14,0) | +0,48 (1,74) | 0,141 |
| TBW (l) | 37,4 (5,3) | 37,6 (5,4) | +0,165 (0,47) | 0,024 |
| EBW (l) | 2,06 (1,25) | 1,70 (1,19) | –0,36 (1,36) | 0,159 |
| ECW (l) | 16,16 (3,76) | 15,25 (4,95) | +0,92 (4,72) | 0,305 |
| FTI (kg/m2) | 13,23 (5,51) | 12,46 (5,72) | –0,77 (3,68) | 0,269 |
| LTI (kg/m2) | 13,11 (3,27) | 14,08 (3,63) | +0,96 (2,33) | 0,035 |
EBW: exceso de agua corporal; ECW: agua extracelular; FTI: índice de masa grasa; LTI: índice de masa magra; TBW: agua corporal total.
Ninguno de los otros parámetros analizados fue significativamente diferente entre los grupos, excepto el porcentaje de eosinófilos, significativamente más alto con acetato (tabla 5), probablemente en relación con la peor biocompatibilidad.
DiscusiónAunque se han publicado beneficios del líquido de diálisis con citrato respecto al de acetato, la información proveniente de estudios aleatorizados es escasa. Este estudio se diseñó para comparar el efecto del citrato de forma controlada y aleatorizada. La diálisis con citrato respecto a la de acetato provoca cambios en los parámetros del metabolismo óseo-mineral y ácido-base, de forma aguda y crónica, y también mejora la tolerancia hemodinámica y probablemente el estado nutricional.
Como se ha descrito previamente11,16 el citrato mejora el control ácido-base respecto al acetato. Disminuye el pico de alcalemia postHD manteniendo el mismo balance ácido-base, como se demuestra al no haber cambios en el bicarbonato preHD a las 16 semanas. Una alcalosis severa postHD se ha relacionado con inestabilidad hemodinámica14 y arritmias17. La HD con una elevada e inadecuada concentración de bicarbonato puede incrementar la mortalidad18. El metabolismo del citrato19 es probablemente más lento que el del acetato10. Cerca del 25% de los tampones transferidos al paciente en una HD dependen de la metabolización del acetato o citrato.
En este estudio el LDC, respecto al LDA, modifica algunos parámetros del metabolismo calcio-fósforo tanto de forma aguda, como se ha descrito previamente4,5,9, como crónicamente. El citrato se asocia con un calcio iónico y un magnesio inferiores, pre y postHD y con un aumento de la PTH. Todo ello, a pesar de la mayor concentración de calcio empleado en el LDC que en el de LDA. El citrato tiene una gran afinidad por el calcio y el magnesio, lo que modifica la transferencia de masas en el dializador de estos 2 elementos. Las concentraciones bajas de calcio en el LD pueden inducir hipocalcemia, que estimula la PTH, el recambio óseo, la aparición de calambres, arritmias e incrementa el riesgo de episodios de hipotensión. Por todo lo anterior, como también han hecho otros autores6,20, cuando los pacientes se dializan con citrato se incrementa la concentración de calcio en el LD. Tal como se ha observado previamente6 ese aumento de 0,15mmol/l no impide la disminución del calcio iónico. Tal como describen Gabutti et al.20 el LDC, a pesar de utilizar una concentración mayor de calcio, previene el incremento del calcio iónico postHD que aparece con LDA, que inhibe la secreción de PTH. En este trabajo observamos que los valores postHD de calcio iónico y magnesio son ligeramente más bajos (∼0,1 mmol/l) con LDC que con LDA, como previamente se ha descrito10. En este contexto la PTH preHD se incrementa significativamente después de 16 semanas con citrato.
En estudios observacionales el riesgo de muerte es mayor en pacientes en HD con valores de iPTH<2 o>9 veces el límite superior normal del ensayo21. El espectro de los pacientes con ERC en estadio 5ha cambiado a lo largo de los 20 últimos años, de una forma de enfermedad ósea de alto remodelado a una de bajo remodelado, que actualmente representan entre el 40% y 70% de los pacientes, y que se caracteriza por niveles de iPTH relativamente bajos. Este cambio se debe al envejecimiento de la población en HD, el incremento de la prevalencia de diabéticos y de enfermedad ósea adinámica, lo que se asocia a un incremento del riesgo de fracturas y calcificaciones vasculares22–24, que junto a la edad y la diabetes son factores de riesgo de muerte25,26. En este contexto clínico, la menor alcalosis y niveles de calcio y el aumento de la PTH producido por el LDC podría ser una ventaja para reducir las calcificaciones vasculares y la enfermedad ósea adinámica. Por otro lado, el citrato disminuiría la propensión a las calcificaciones medida por la prueba T50 en un estudio preliminar a 3 meses27, en un estudio de corta duración, multicéntrico, aleatorizado y cruzado28 y en otro realizado en ratas con anillos de aorta cultivados exvivo29.
En nuestro estudio la concentración sérica de magnesio disminuye al utilizar el LDC. Para una misma concentración de magnesio en el LD, 0,5mmol/l, el LDC produce una disminución del magnesio sérico respecto al LDA, lo que se ha descrito también en otros trabajos10; este resultado no es una sorpresa ya que el citrato quela también el magnesio. Niveles séricos elevados de magnesio se asocian a una disminución de las calcificaciones vasculares30,31. Sin embargo, un magnesio sérico bajo en la diálisis con citrato no afecta negativamente a la propensión a las calcificaciones27. Aunque los niveles séricos óptimos en los pacientes en HD continúan siendo controvertidos32, los pacientes con niveles bajos tienen peor pronóstico que los que los tienen algo elevados, como recientemente hemos publicado33. En trabajos anteriores se ha observado un resultado similar34–40. El tipo de LD podría influir en la concentración de magnesio y en el riesgo de muerte33. Jefferies et al.41, en un estudio basado en LD con acetato, compara la concentración habitual de magnesio, 0,5mmol/l con un alta, 1,0mmol/l, sin observar efectos adversos con el LD con concentraciones altas de magnesio. Se ha sugerido que el magnesio en el LDC se debería aumentar, idea que compartimos. El aumento de la concentración de magnesio en el líquido de diálisis se ha asociado a una mejoría de las calcificaciones vasculares42, a una reducción de la mortalidad total y cardiovascular43, así como a una reducción de marcadores de inflamación (TNFalfa e IL6)44.
Aunque algunos autores han publicado una mejoría de la eficacia de la diálisis con el LDC, valorada por el Kt/V o el Kt, nosotros no hemos confirmado este hallazgo. Esta mejoría se ha explicado por el efecto anticoagulante del citrato. En este estudio, como describimos previamente11, no observamos diferencias en el grado de coagulación de las cámaras o dializadores, el grado de coagulación tanto con LDC como con LDA era 0, ausente, o 1, mínimo, en el 80% de las sesiones. Nuestra explicación es que las diferencias en la coagulación del dializador, y por tanto en la eficacia de diálisis, solo llega a ser aparente cuando las dosis de heparina están muy ajustadas a la baja.
Los efectos más relevantes del acetato en la HD son la inestabilidad hemodinámica secundaria a la vasodilatación que provoca, mediada por el óxido nítrico45 y la activación de citoquinas proinflamatorias46,47. En este sentido el acetato plasmático se incrementa por encima de 1mmol/l después de una HD con un LD con 4 y 8mmol/l de acetato48. En los pacientes con menor velocidad de metabolización del acetato, con una masa muscular menor, estas concentraciones serían mayores y más prolongadas. Estudios previos encuentran una frecuencia menor de hipotensiones en 44 pacientes en HD, especialmente respecto a los episodios sintomáticos y más severos8. Con el LDA se produciría una mayor caída de las resistencias vasculares periféricas y de la presión arterial sistólica20. En la línea de esas observaciones encontramos que los episodios de hipotensión son más frecuentes con el LDA que con el LDC, nuestro estudio sería el mayor para evaluar ese aspecto al incluir información de 4.416 sesiones de HD.
En este trabajo no hay cambios significativos en la PCR. El efecto beneficioso del citrato y de la retirada del acetato sobre la inflamación49 se podría ver contrarrestado, en algunos pacientes, por la aparición de hipomagnesemia50.
Uno de los resultados más interesantes de nuestro estudio es el aumento significativo del LTI durante las 16 semanas con citrato, lo que sugiere que el LDC podría mejorar el estado nutricional. En este sentido hay evidencias previas en la literatura. Se ha observado un aumento del ángulo de fase y de la masa celular corporal medida por bioimpedancia monofrecuencia después de 12 semanas con citrato51. La albúmina sérica aumentaría después de 12 semanas con citrato51, algunas veces este efecto se limitaría a los pacientes con hipoalbuminemia52, como es el caso de nuestros pacientes con una albúmina por debajo de 3,8g/dl. Esos estudios atribuyen la mejoría del estado nutricional a un efecto positivo sobre la inflamación de la ausencia de acetato y/o a la presencia del citrato en el LDC6. El impacto anabólico que sugieren el incremento del LTI se podría relacionar por las calorías aportadas por el citrato53 y su incorporación al ciclo de Krebs54. El acetato para metabolizarse de esa forma precisa de la coenzima A, la piruvato deshidrogenasa y NAD+. El citrato para incorporarse a las células no requiere de insulina55. Las mitocondrias desempeñan un papel clave en el funcionamiento de los músculos esqueléticos56 y el citrato se puede incorporar directamente si escasean otros sustratos57. Estos datos se han recogido en pacientes con citrato como anticoagulante, en los que el citrato se utiliza en concentraciones más altas que en nuestro estudio. Sin embargo, la infusión del LDC en la HDF-OL aporta una cantidad mucho mayor de citrato a los pacientes que la HD convencional. La masa muscular y su función se ven afectadas negativamente por varios factores en los pacientes con ERC en la HD58, el uso de citrato en lugar de acetato podría mejorar alguno de ellos.
Limitaciones del estudioLas limitaciones de este estudio incluyen el tamaño muestral pequeño y el criterio de selección, que solo abarca a los pacientes con una FAV. Debido a que uno de los objetivos en el diseño del estudio era evaluar la eficacia de la diálisis y la duración del estudio era de 32 semanas, se decidió excluir a los pacientes con un catéter para evitar la posibilidad de su disfunción e influencia en la dialisancia. Por este motivo, la etiología de la ERC de los pacientes incluidos en el estudio no es representativa de toda la población en diálisis, ya que la primera causa fue la glomerulonefritis, seguida de la diabetes, mientras que tanto en la población española como en la mayoría de los países la principal causa de ERC en pacientes en diálisis es la diabetes. El aspecto a destacar del estudio fue el uso de un diseño cruzado: por lo tanto, eliminamos la variación del paciente en el tiempo, por lo que sirvieron como su propio control. Aunque no analizamos el impacto del uso a largo plazo del LD con citrato en objetivos claves, como la mortalidad59–61, en nuestro conocimiento este es el ensayo aleatorizado más largo con citrato, permitiendo la evaluación y exploración de las consecuencias a largo plazo.
ConclusionesEn conclusión, el LD con citrato modifica la mayoría de los parámetros del metabolismo mineral óseo no solo agudamente, sino también a largo plazo. Hasta donde sabemos esta es la primera vez que esto se aborda en un ensayo controlado aleatorizado. Esta observación puede tener 2 implicaciones prácticas importantes; por un lado, que la concentración de magnesio se debería aumentar en el LD con citrato en la mayoría de los casos, y por otro lado que el citrato es el tratamiento de elección en pacientes con una enfermedad ósea dinámica o bajos niveles de PTH. En comparación con el acetato, el citrato ofrece una mayor estabilidad hemodinámica produciendo menos hipotensión, y puede mejorar el estado nutricional. Se necesitan ensayos controlados aleatorizados a largo plazo para corroborar los beneficios nutricionales potenciales y su repercusión en la morbimortalidad.
FinanciaciónEl patrocinador de este estudio ha sido la Fundación de la Sociedad Española de Nefrología (SEN) y ha recibido una beca de investigación independiente de Baxter.
Conflicto de interesesP. de S., R.P.G., R.E.C. y M.M. han recibido honorarios por la participación como ponentes en reuniones de Fresenius y Baxter y ayudas de viaje de Nipro, Fresenius y Baxter para congresos científicos. P. de S. ha recibido pagos por participar en advisory board de Baxter y Nipro. El resto de autores declara no tener ningún conflicto de intereses.
Al personal de enfermería de las unidades de diálisis de los hospitales que participan en el estudio por su valiosa colaboración.
P. de Sequera Ortiz y R. Pérez García. Hospital Universitario Infanta Leonor, Madrid.
M. Molina Núñez y G. Álvarez Fernández. Hospital General Universitario Santa Lucía, Cartagena.
R.I. Muñoz González e I. Gallardo. Hospital Galdakao, Galdácano.
E. Mérida Herrero y E. Hernández Martínez. Hospital Universitario Doce de Octubre, Madrid.
M.J. Camba Caride y A. Otero González. Complexo Hospitalario Universitario de Ourense, Orense.
L.A. Blázquez Collado, M. Sánchez Heras y G. de Arriba de la Fuente. Hospital Universitario de Guadalajara, Guadalajara.
M.P. Alcaide Lara y L. Gil Sacaluga. Hospital Universitario Virgen del Rocío, Sevilla.
R. Echarri Carrillo, Cirugeda García y A. V. Barrio Lucía. Hospital Universitario Infanta Sofía, Madrid.