La aparición de los nuevos agentes antirretrovirales de acción directa (AAD) para el tratamiento del virus de la hepatitis C (VHC) han supuesto una revolución en el control de esta infección, alcanzándose tasas de respuesta viral sostenida (RVS) cercanas al 99%1–4. Algunas manifestaciones extrahepáticas (EH) asociadas a dicha infección pueden persistir o recurrir tras alcanzar la RVS con AAD4. Son pocos los casos descritos de desarrollo de nuevas manifestaciones EH tras obtener una RVS. A continuación, presentamos un caso de una vasculitis crioglobulinémica mixta (VCM) y glomerulonefritis membranoproliferativa, acompañadas de síndrome seco (SS), que se manifestaron 28 meses después de alcanzar RVS con AAD.
Mujer de 70 años con infección por VHC sin afectación hepática ni EH, tratada con elbasvir/grazoprevir en diciembre de 2017 con RVS. Seis meses después de obtener viremia indetectable, comenzó con xeroftalmia, xerostomía y parotiditis, por lo que inició seguimiento por reumatología. En la analítica presentaba: hipergammaglobulinemia (IgG policlonal), ANA positivos (título 1/640), anticuerpos antiRO (anti-Ro) y anticuerpos antiLA (anti-LA) negativos, factor reumatoide (FR) 55 mg/dL (0-40); creatinina sérica (Crs) 0,87 mg/dL; básico de orina con proteínas y hematíes negativas. A la vista de estas alteraciones fue diagnosticada de un SS, dado que no cumplía criterios de síndrome de Sjögren primario por anti-Ro, anti-La negativos e infección VHC previa.
En enero de 2020 comenzó con lesiones cutáneas purpúricas en miembros inferiores asociadas a crioglobulinas tipo III o mixtas positivas (IgG policlonal e IgM policlonal), sin haber realizado determinaciones previas; el FR se había elevado (130 UI/mL) y la función renal persistía conservada (Crs 0,87 mg/dL), junto con un básico de orina sin alteraciones. La biopsia cutánea no fue concluyente, sin embargo, por el resto de los resultados se trató como una VCM tipo III o mixta con afectación cutánea y se inició prednisona oral (0,5 mg/kg/día).
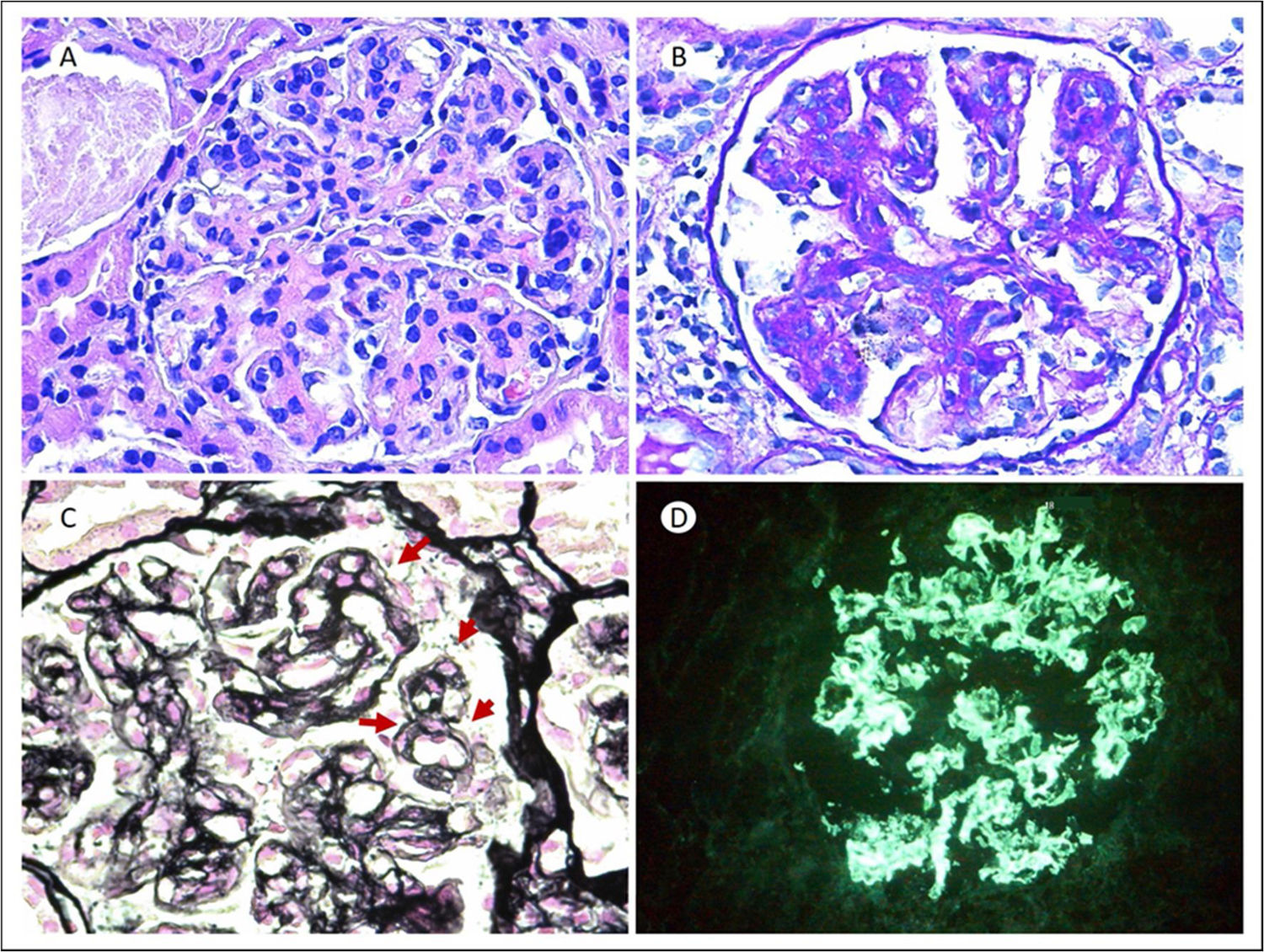
En mayo de ese mismo año, ingresó por una infección respiratoria documentándose, simultáneamente un síndrome nefrótico clínico y bioquímico (Crs 1,35 mg/dL; urea 55 mg/dL; albúmina 3,2 g/dL; colesterol 275 mg/dL; proteinuria en 24 h 5.900 mg/24 h; sedimento urinario con 5-10 hem/campo, dismórficos e hipocomplementemia con C3 de 47,80 mg/dL y C4 de 2,20 mg/dL). El resto del estudio de autoinmunidad fue negativo (antiPLA2R, ANCA y proteinograma negativos). Se realizó biopsia renal que mostró 18 glomérulos, todos ellos hipertróficos con morfología lobulada y oclusión de luces vasculares por células inflamatorias, expansión mesangial con hipercelularidad mesangial (fig. 1, A y B). Mediante la técnica de plata, imágenes de doble contorno en las asas capilares (fig. 1, C). La inmunofluorescencia mostró positividad capilar para IgG (+++) en patrón granular grueso y de localización subendotelial y mesangial (fig. 1, D). Todo esto compatible con un patrón de glomerulonefritis membranoproliferativa (GNMP) mediada por inmunocomplejos.
A. H&E: 20x. Glomérulo con morfología lobulada, aumento del mesangio a expensas de matriz y proliferación mesangial y endocapilar. B. PAS 20x: expansión del mesangio PAS positiva, con incremento de la celularidad. C. Plata metenamina 64x. Imágenes de dobles contornos en las asas capilares glomerulares (flechas rojas). D. IFD IgG 20x. Depósito intenso (3+) en patrón granular grueso y de localización subendotelial y mesangial para IgG.
A pesar de que no hubo muestra para microscopía electrónica y que no se observaron trombos ni necrosis fibrinoide, el resto correspondía una VCM tipo III con afectación cutánea y renal en forma de GNMP, en probable relación con infección VHC pasada. Se descartó un síndrome linfoproliferativo mediante tomografía computarizada, y la carga viral de VHC siempre fue negativa. Recibió rituximab (500 mg x 2 dosis separadas de 15 días) y tratamiento esteroideo en pauta descendente. A los tres meses presentaba remisión completa: Crs 0,8 mg/dL; albúmina 4,2 g/dL; C3 66,90 mg/dL (normal); C4 5,40 mg/dL (normal); crioglobulinas negativas. Análisis de orina con proteinuria en 24 h de 294 mg/g y sedimento normal. Se ha mantenido estable durante los siguientes 18 meses de seguimiento, recibiendo dosis de mantenimiento de rituximab (500 mg) cada seis meses desde entonces.
La aparición de los nuevos AAD contra el VHC ha supuesto un cambio de paradigma en el tratamiento de esta infección1. Son claramente efectivos en la erradicación del virus, con tasa de RVS cercanas al 99%. A pesar de ello, la efectividad sobre el control de algunas manifestaciones EH no es tan evidente1.
La VCM es la manifestación EH más frecuente2. Habitualmente, las que se asocian a la infección por virus C son la crioglobulinemia tipo II y/o tipo III, también conocidas como crioglobulinemias mixtas3. Entre un 70-90% se asocian a infección por VHC2. En nuestro caso, se trataba de una crioglobulinemia mixta tipo III porque estaba formada por IgG e IgM policlonal, con actividad reumatoidea.
La afectación renal habitualmente asociada a la VCM por virus C es una GNMP3. Los AAD presentan tasas de respuesta clínica e inmunológica muy variables sobre la VCM (64 al 96% y 48 al 89%, respectivamente)4. Más aún, algunos autores han sugerido que el uso de AAD solo podría ser insuficiente en el control de las manifestaciones renales y la vasculitis crioglobulinémica4. Publicaciones recientes han reflejado persistencia de VCM con o sin afectación renal a pesar de una RVS con AAD5–8. En estos pacientes, el uso de tratamiento inmunosupresor como rituximab puede resultar efectivo en el control de la enfermedad9. En nuestro caso, lo que lo hace especial es que las manifestaciones aparecieron tras la RVS. Previo al tratamiento con AAD, no se había documentado ninguna afectación EH. Hasta donde hemos podido comprobar, son escasos los casos publicados similares al nuestro.
El mecanismo por el que los pacientes con infección erradicada por VHC pueden desarrollar manifestaciones EH tras el tratamiento con AAD, no ha sido del todo aclarado. La infección por VHC provoca distintas alteraciones de la regulación del sistema inmune. Una teoría conocida es que el VHC se «instala» en el interior de la célula que infecta, evitando así el ataque del sistema inmune10. El VHC tiene acción sobre los mecanismos habituales de reparación celular del ADN, produciendo un aumento de las alteraciones no reparadas en el ADN que se asocian a una mayor inestabilidad genómica, favoreciendo la aparición de neoplasias y la disfunción del sistema inmune10,11. Este hecho, entre otros, provocaría la activación anómala de linfocitos B y su expansión monoclonal que daría lugar a la formación de crioglobulinas responsables de la VCM11. Algunos estudios han observado que pacientes que alcanzaban una remisión clínica de la VCM tras el uso de AAD han presentado disminución de los linfocitos B activados y el aumento de los linfocitos T reguladores12. Por otro lado, otros autores como Hegazy et al. han comprobado que los pacientes con infección por VHC, tratados con AAD presentarían mayor concentración de factores de activación de los linfocitos B (BAFF y APRIL) durante los 12 primeros meses tras recibir el tratamiento13. Este hecho podría suponer una hiperactividad de los linfocitos B tras el uso de AAD que podría explicar aparición de manifestaciones autoinmunes tras el tratamiento.
Por último, al contrario de lo que podía suceder con el efecto inmunomodulador del interferón, los regímenes libres de este fármaco podrían perder este efecto antiinflamatorio, y no ser suficiente en todos los casos para el control de las manifestaciones EH13.
En conclusión, los AAD mejoran la morbimortalidad hepática en la casi totalidad de los casos. Se desconoce cuál es la evolución exacta de aquellas manifestaciones autoinmunes que aparecen una vez obtenida una RVS estos fármacos. Por ello, durante los primeros meses tras el tratamiento con AAD es importante la monitorización estrecha de manifestaciones autoinmunes, que en caso de aparecer podrían requerir tratamiento inmunosupresor adicional.
FinanciaciónLos autores declaran no haber recibido financiación para la publicación de este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.