Las enfermedades renales hereditarias (ERH) son un grupo heterogéneo de nefropatías que constituyen entre el 10 y el 15% de los pacientes que inician tratamiento renal sustitutivo (TRS), e incluso podría ser mayor en la población pediátrica1. Las ERH precisan un enfoque diagnóstico diferente al resto de las nefropatías, ya que su patogenia se debe a una mutación. No solo estudiamos a pacientes aislados, sino a la familia como una entidad, por lo que es necesario realizar un árbol genealógico detallando todos los familiares, tanto enfermos como sanos.
La poliquistosis renal autosómica dominante (PQRAD), debida a mutación en los genes PKD1 o PKD22 es la nefropatía hereditaria más frecuente y causa del 6 al 10% de los pacientes en TRS. Se caracteriza por el crecimiento de quistes renales que conduce a un deterioro de la función renal hasta precisar TRS3. Además se asocia con otras manifestaciones: hipertensión arterial (HTA)4, poliquistosis hepática, aneurismas cerebrales o valvulopatías5. El síndrome de Alport (SA) se clasifica según el patrón de herencia: 85% ligado al cromosoma X por mutación en COL4A56 y 15% autosómico recesivo por mutación en COL4A3 o COL4A47. En SA la alteración de la membrana basal glomerular provoca microhematuria, proteinuria y ERC progresiva, que puede asociarse con alteraciones oculares e hipoacusia8. La microhematuria familiar benigna (MFB), que puede afectar hasta al 1% de la población, tiene una patogenia común al SA recesivo9. Las tubulopatías son otro grupo de ERH, en el que la mutación de una proteína implicada en la reabsorción tubular favorece que determinados iones se excreten por la orina10. Además, existen otros síndromes hereditarios con nefropatía en un contexto de importante afectación multiorgánica como esclerosis tuberosa11 o síndrome de Bardet-Bieldt12.
Nuestro objetivo fue crear una consulta monográfica para el seguimiento de pacientes con ERH. Estas enfermedades suelen ser poco prevalentes, por lo que se precisa agruparlas en una consulta seguida por el mismo facultativo para aumentar su experiencia clínica. A continuación, presentamos los pasos que hemos seguido, lasdificultades que se han planteando y nuestros resultados tras 3 años de seguimiento.
Diseño del estudio y selección de pacientesEn febrero de 2012 se creó una consulta monográfica para el seguimiento de pacientes con ERH en nuestro servicio, que abarca una población de casi 300.000 habitantes y con aproximadamente 1.500 visitas al año en consultas externas. Nuestro hospital es de tercer nivel. Se incluyó a pacientes con nefropatía y antecedentes familiares con alta probabilidad clínica de ERH o con un estudio genético positivo. Fueron excluidos con un filtrado glomerular inferior a 25ml/min.
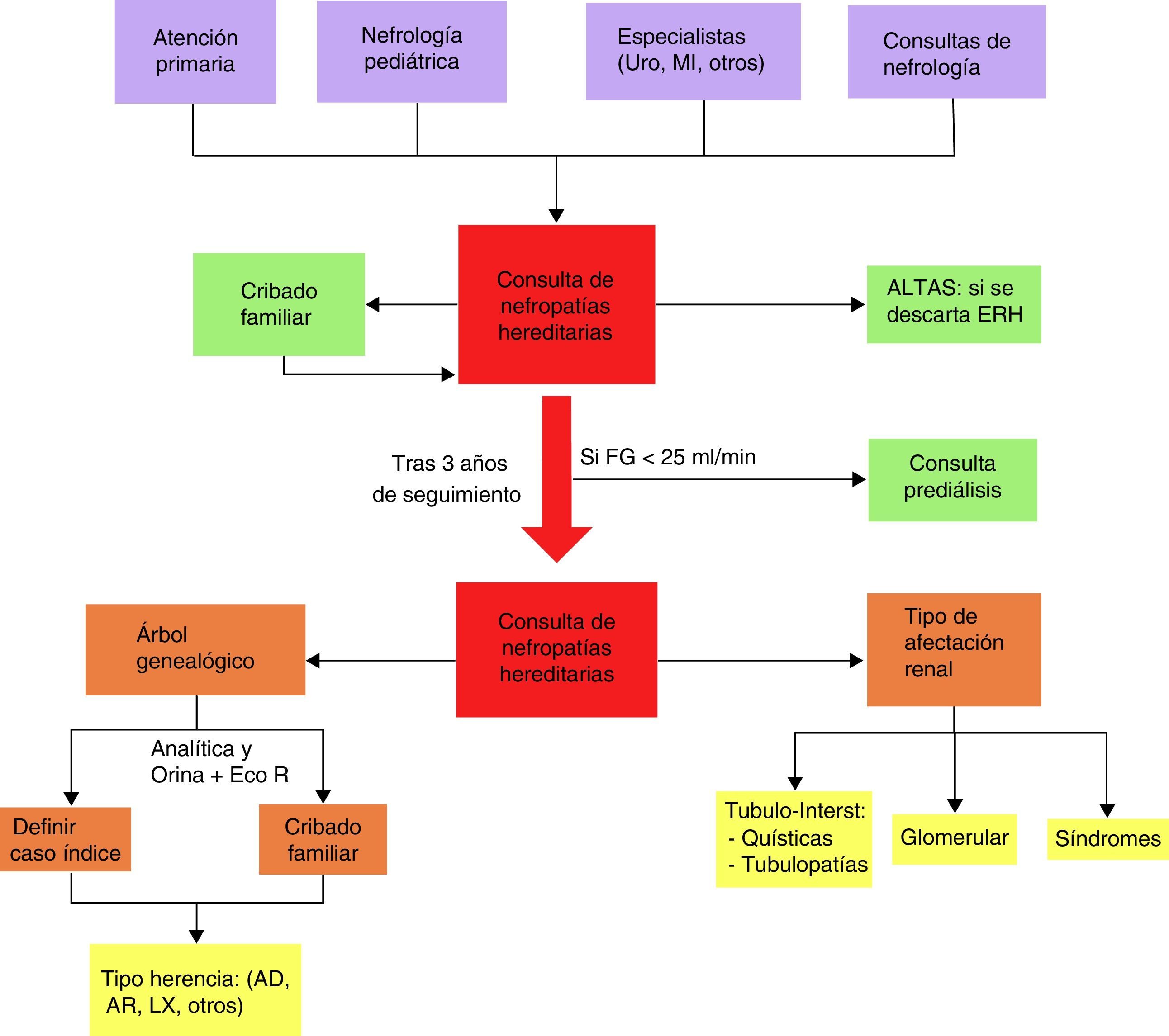
Los pacientes se remitieron desde Atención Primaria, Nefropediatría, otras consultas de Nefrología y por otros especialistas a una consulta específica de ERH seguida por el mismo nefrólogo. Desde esta consulta se dieron altas si se descartaba ERH y se incluyó a los familiares con nefropatía tras la realización de un cuidadoso cribado. El seguimiento se realizó durante 3 años. Finalizó el estudio en enero de 2015 (fig. 1).
Planificación de la Consulta de Enfermedades Renales Hereditarias.
AD: autosómica dominante; AR: autosómico recesivo; Eco R: ecografía renal; ERH: enfermedades renales hereditarias; FG: filtrado glomerular; LX: ligado al cromosoma X; ME: Medicina Interna; Tubulo-Interst: tubulointersticial; Uro: urología.
A todos los pacientes se les realizó analítica de sangre y orina, ecografía renal, medición de tensión arterial y árbol genealógico, en el que se recogió parentesco con caso índice, familiares sanos o con nefropatía (microhematuria, proteinuria, quistes renales, enfermedad renal crónica o si precisaron TRS). Con estos datos se establecieron 3 patrones clínicos básicos: tubulointersticial, subdividido en quístico (enfermedades quísticas por diagnóstico ecográfico) o tubulopatías (alteraciones iónicas por aumento de excreción urinaria), glomerular (proteinuria o microhematuria) o síndromes (nefropatía en un contexto de importante alteración multiorgánica). Los patrones clínicos junto con el patrón de herencia (autosómica dominante [AD], autosómica recesiva [AR] y ligada al cromosoma X [LX]), orientaron hacia un diagnóstico clínico de sospecha inicial en cada paciente (fig. 1).
Al final del estudio, se recogieron los siguientes datos: edad, sexo, realización de biopsia renal o estudio genético, servicios que derivaron al paciente a la consulta de ERH, existencia de diagnóstico previo, seguimiento por otros especialistas a causa de su ERH, realización de un cribado familiar completo, HTA, tratamiento con inhibidores del sistema renina angiotensina, diabetes mellitus, dislipidemia y si era fumador.
En la PQRAD, no hubo ningún radiólogo asignado específicamente para analizar los datos ecográficos: tamaño renal medido en centímetros, descripción de riñones normales o grandes y presencia de quistes hepáticos. La microhematuria familiar (MF) se definió como microhematuria en el paciente y en, al menos, otro familiar, habiendo descartado otras causas con estudio inmunológico, serológico y litiásico. Dentro de la MF se incluyeron: SA por diagnóstico genético o histológico compatible y nefropatía IgA familiar por biopsia renal con antecedentes familiares positivos. En este grupo, las audiometrías realizadas fueron valoradas por el otorrino como normales o con hipoacusia.
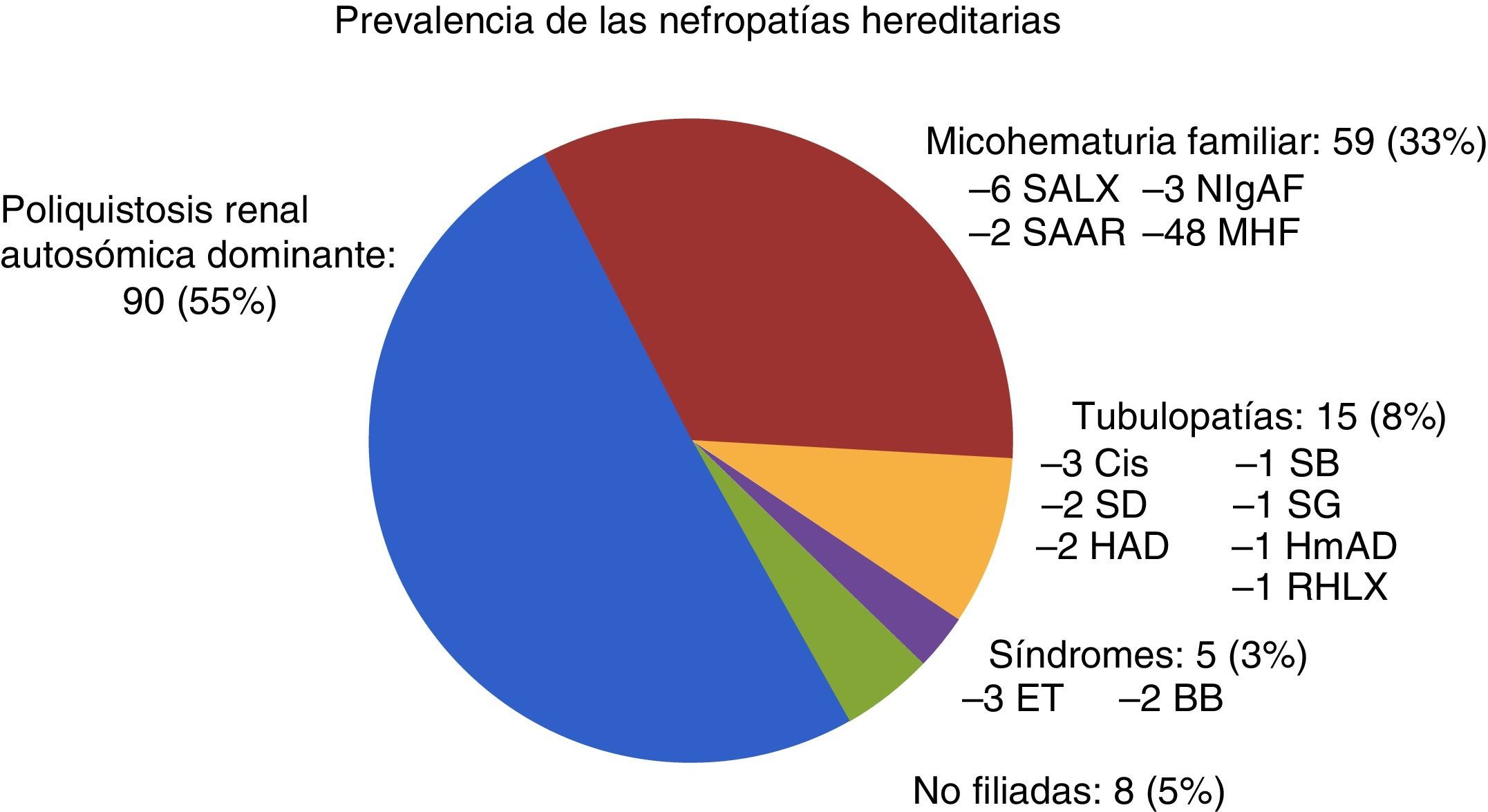
De los 177 pacientes seguidos en la consulta de ERH, 73 eran hombres (41,2%) y 104 mujeres (58,8%). La edad media fue: 43,13 ± 15,20 (14-84) años. Se realizó árbol genealógico a todos los pacientes; el cribado familiar fue completo en 81 pacientes (45,8%) e incompleto en 96 (54,2%) debido a fallecimiento o negativa de los familiares. Un total de 117 pacientes (66,1%) tenían algún familiar en TRS. Respecto a los patrones de herencia: AD en 143 (80,1%), AR en 16 (9%), LX en 11 (6,2%) y no filiado en 7 (4%). El estudio genético se solicitó en 34 casos; fue positivo en 21 (61,8%). De las 8 biopsias renales realizadas, solo 3 fueron diagnósticas por nefropatía IgA y en el resto, normales. En la figura 2 se recoge la prevalencia de ERH de nuestra consulta.
Prevalencia de las nefropatías hereditarias al final del estudio (número de pacientes y porcentaje).
BB: síndrome de Bardel-Bieldt; Cis: cistinuria; ET: esclerosis tuberosa; HAD: hipocalcemia autosómica dominante; HmAD: hipomagnesemia autosómica dominante; MHF: microhematuria familiar; NIgAF: nefropatía IgA familiar; RHLX: raquitismo hipofosfatémico ligado a X; SAAR: síndrome de Alport autosómico recesivo; SALX: síndrome de Alport ligado a X; SB: síndrome de Bartter; SD: síndrome de Dent; SG: síndrome de Gitelman.
La procedencia de los pacientes seguidos en consultas de ERH fue: 61 (34,5%) de Atención Primaria, 14 (7,9%) de Nefropediatría, 51 (28,8%) de otras consultas de Nefrología, 17 (9,6%) por otros especialistas, principalmente Urología y Medicina Interna, y 34 (19,2%) por el cribado familiar realizado desde la consulta de ERH. Solo 73 pacientes (41,2%) estaban diagnosticados antes de ser derivados a nuestra consulta.
Un total de 49 pacientes (27,7%) eran seguidos por otros especialistas debido a alteraciones derivadas de su ERH: 19 por Urología, debido a litiasis, infecciones urinarias de repetición o quistes complicados; 11 pacientes por Otorrino debido a hipoacusia; 5 por Cardiología por cardiopatía isquémica e insuficiencia mitral; 4 pacientes por Digestivo por poliquistosis hepática masiva o diverticulosis.
Al analizar los factores de riesgo cardiovascular, 94 pacientes (53,1%) eran hipertensos, 15 (8,5%) diabéticos, 58 (32,8%) dislipémicos y 42 (23,7%) fumadores. Además, 104 pacientes (58,8%) estaban tratados con inhibidores del sistema renina angiotensina.
Los datos ecográficos en el grupo con PQRAD fueron: 49 pacientes (54,44%) tenían quistes hepáticos y solo en 45 (50%) se midió el tamaño renal, aunque en todos se definió si los riñones eran normales o grandes. Las audiometrías se realizaron en el grupo con MF en 45 pacientes (75%), de ellos tuvieron hipoacusia 26 y solo 13 fueron informadas por el otorrino.
La mayoría de los pacientes fueron derivados a nuestra consulta por sospecha de ERH, al presentar nefropatía y tener algún familiar en TRS, aunque casi el 60% no tenían un diagnóstico inicial hecho. Para establecer un diagnóstico clínico, nuestra principal herramienta no fue el estudio genético, sino el árbol genealógico. Además de estudiar al paciente, es fundamental realizar un exhaustivo cribado familiar, con analítica y ecografía renal, diferenciando entre sanos o con nefropatía para identificar el tipo de herencia y el patrón clínico. Sin embargo, en la mitad de los casos el cribado familiar fue incompleto debido a negativa o fallecimiento de algunos miembros de la familia.
Es importante un correcto diagnóstico de ERH para controlar los factores de progresión, establecer un enfoque multidisciplinar, registrar adecuadamente, ofrecer consejo genético y, en algunos casos, iniciar el tratamiento correspondiente, como el reemplazamiento enzimático en la enfermedad de Fabry13 o everolimus en la esclerosis tuberosa14. Sin embargo, hay nefropatías familiares no filiadas o con presentación clínica muy atípica, objeto de proyectos de investigación, donde se necesita la colaboración interhospitalaria para crear una red nacional que aumente el número de pacientes con estas enfermedades poco prevalentes. Las nuevas técnicas de genómica de secuenciación masiva (next generation sequencing) están contribuyendo a la evolución y la optimización del diagnóstico de ERH15.
Coincidiendo con nuestros datos, PQRAD es la nefropatía hereditaria más frecuente. La ecografía es la técnica de elección para el diagnóstico, seguimiento y el despistaje de PQRAD en los familiares de primer grado16. El volumen renal es el mejor predictor de progresión de la enfermedad17, sin embargo, en nuestro estudio radiológico, en la mitad de los casos, no se valoró el tamaño renal de forma precisa. Además, la ecografía es necesaria para diagnosticar quistes hepáticos, la manifestación extrarrenal más frecuente de PQRAD2. Es fundamental la concienciación y realizar las pruebas de imagen por un mismo facultativo entrenado en estas enfermedades.
Clínicamente es díficil diferenciar entre MFB, portadoras del SA e IgA familiar, ya que pueden cursar con el mismo patrón glomerular18. Aunque en nuestro estudio se agruparon conjuntamente como MF, debemos realizar un diagnóstico definitivo. El primer paso para el diagnóstico diferencial es el patrón de herencia: AD en la MFB, AR o LX en SA y una herencia poligénica en IgA familiar (aunque están investigándose los genes implicados)19. El diagnóstico definitivo del SA se realiza por el hallazgo de una membrana basal glomerular desestructurada en la microscopia electrónica o de una mutación patogénica en COL4A5 en Alport LX, o 2 mutaciones patogénicas en COL4A3 o COL4A4 en Alport AR; mientras que en MFB solo existiría una mutación en COL4A3/COL4A49.
Existen alteraciones multiorgánicas características asociadas a determinadas ERH que pueden ayudar a identificarlas, siendo fundamental un enfoque multidisciplinar. El nefrólogo, muchas veces, se convierte en el coordinador del resto de las especialidades. Los pacientes deben ser seguidos por un mismo facultativo con experiencia, para que estas enfermedades poco prevalentes no pasen desapercibidas. Ante la sospecha de SA, es necesario realizar una audiometría para descartar hipoacusia bilateral para altas frecuencias (2.000-8.000Hz)8. Al revisar las audiometrías, observamos que la hipoacusia solo se diagnosticó en la mitad de los casos, al considerarse normal cuando el defecto era leve: este es un factor de confusión. Otro problema añadido es la transición desde Pediatría a Nefrología de adultos, en una etapa tan conflictiva como la adolescencia, cuando el paciente puede llegar a negar su enfermedad y rechazar el tratamiento crónico20.
Existen una serie de factores que aceleran el deterioro de la función renal y debemos controlarlos para frenar su progresión21. Los factores de progresión de PQRAD son: genéticos (la mutación PKD1 tiene un peor pronóstico que la PKD2), volumen renal, HTA5, proteinuria, incapacidad de concentración urinaria o hiperuricemia22. Los factores de progresión del SA son: tipo de mutación (son más graves las de tipo truncante), proteinuria, hipoacusia y episodios de macrohematuria23. Los inhibidores del sistema de renina angiotensina son un tratamiento de primera elección al controlar HTA y disminuir la proteinuria, y retrasar el deterioro de la función renal tanto en PQRAD 24 como en SA25.
En conclusión, es necesaria la creación de una consulta de ERH en la que este tipo de nefropatías sean seguidas por un mismo facultativo para un adecuado enfoque diagnóstico y multidisciplinar, el control de los factores de progresión y la colaboración interhospitalaria que contribuya al avance diagnóstico y terapéutico de este campo en continua evolución. Hay que destacar la importancia de elaborar un completo árbol genealógico para clasificar el patrón de herencia (AD, AR o LX) y el tipo de lesión renal (quística, tubular, glomerular o sindrómica), que, a diferencia del diagnóstico genético, está disponible en todos los hospitales.