El carcinoma tiroideo es una neoplasia que tiene una incidencia más alta en pacientes con enfermedad renal crónica. Durante los últimos años se ha avanzado en las pruebas diagnósticas y terapéuticas. Los pacientes de diálisis son un grupo particular, al ser detectado el cáncer de forma indirecta en el estudio del hiperparatiroidismo secundario y durante el estudio previo al trasplante renal. La tiroidectomía es el tratamiento definitivo, pero en pacientes con riesgo de recidiva es necesaria la terapia ablativa con yodo radioactivo I-131, que es predominantemente excretado por vía renal, por lo que su uso en pacientes en diálisis supone un problema de dosificación. Se presentan dos casos de pacientes en hemodiálisis sometidos a radioablación con yodo radiactivo I-131, que con un manejo multidisplinar produjo los resultados esperados en los pacientes.
Thyroid carcinoma is a neoplasia with a higher incidence in patients with chronic kidney disease. In recent years advances have been made in diagnostic and therapeutic trials. Dialysis patients are a particular group, their cancer being detected indirectly in the study of secondary hyperparathyroidism and during the study prior to renal transplantation. Thyroidectomy is the definitive treatment, but in patients with risk of recurrence, ablative therapy is required using radioactive iodine I-131, which is predominantly eliminated by renal excretion, therefore its use in patients on dialysis poses a problem in terms of dosage. Two cases are presented of patients on haemodialysis undergoing radioablation with radioactive iodine I-131, which with multidisciplinary treatment had the expected results in the patients.
INTRODUCCIÓN
La incidencia de cáncer de tiroides ha tenido un mayor crecimiento en los últimos años, al menos en Estados Unidos1, aunque ese fenómeno puede deberse a un mero aumento en su detección2,3. El tipo de cáncer de tiroides más frecuente es el tipo papilar (cerca del 80 %).
El estudio diagnóstico actual incluye los niveles de la tiroglobulina sérica, la ecografía cervical y la hormona estimulante de la tiroides recombinante humana (TSH rh). Esta aproximación es menos traumática para el paciente que enfoques previos, como recogen las guías europeas de 2006 (European Thyroid Association)4 y la postura de la Sociedad Española de Endocrinología5.
Por su parte, los pacientes con insuficiencia renal crónica en diálisis tienen un mayor riesgo de padecer cáncer6,7. La detección del cáncer de tiroides es muchas veces un hallazgo casual en el estudio del hiperparatiroidismo secundario o en el de inclusión en lista de espera del trasplante renal.
Una vez realizada la tiroidectomía total, el tratamiento de elección es la terapia ablativa con yodo radiactivo I-131, pero como el yodo es predominantemente excretado por vía renal (90 %)8 su eliminación se ve reducida en pacientes con enfermedad renal crónica, especialmente en estadio de diálisis. La alta dosis de radiactividad resultante constituye un riesgo elevado de exposición al paciente y al personal de diálisis, así como de contaminación de las máquinas de diálisis.
Los servicios de radiofísica disponen de instalaciones y procedimientos rigurosos para monitorizar y controlar este riesgo de exposición a radiación. Sin embargo, en pacientes sometidos a hemodiálisis se necesita un sistema controlado de eliminación de líquidos y una monitorización más frecuente de la radiactividad por la falta de eliminación renal normal del radiofármaco.
A continuación se describe el manejo de dos casos de pacientes en hemodiálisis con cáncer de tiroides tratados con el radiofármaco.
CASO CLÍNICO 1
Paciente varón de 51 años, con enfermedad renal crónica secundaria a poliquistosis renal y hepática, en hemodiálisis desde septiembre de 2010. Tras el hallazgo de un nódulo tiroideo con citología sospechosa de malignidad en el estudio pretrasplante renal, se le practicó una tiroidectomía.
El informe anatomopatológico mostraba un carcinoma papilar de tiroides, localizado en istmo, de 1,5 cm de diámetro, con márgenes quirúrgicos libres y con extensión extratiroidea en el tejido peritiroideo y ausencia de invasión linfovascular o perineural (pT3Nx).
Se preparó una habitación especial en la unidad de terapia metabólica, que depende del servicio de medicina nuclear y está aislada según la normativa vigente. Para poder realizar la hemodiálisis, se instaló un equipo portátil de tratamiento de agua de diálisis (HemoRO 3000 de DWA GmbH & Co. KG). Con una manguera se conectó el desagüe del monitor de diálisis al contenedor de residuos radioactivos localizado en el inodoro del paciente. Posteriormente, el paciente ingresó para tratamiento ablativo con yodo radiactivo I-131 en septiembre de 2012, según el siguiente protocolo:
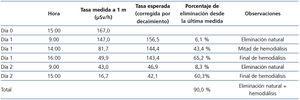
- Administración de TSH rh (Thyrogen® de Sanofi) los días -2 y -1 (con el objetivo de conseguir TSH > 30 µIU/ml); el día 0 se le administró una dosis oral de 100 mCi (3700 MBq) de yodo radiactivo I-131, inmediatamente después de una sesión ordinaria de hemodiálisis en la unidad de hemodiálisis de nuestro hospital. Antes de la preablación tenía una TSH 611 µIU/ml y un T4 libre de 1,83 ng/dl.
- Tras administrar el radiofármaco, se efectuaron dos sesiones de hemodiálisis diaria en la habitación adaptada de la unidad de terapia metabólica, a las 20 y a las 44 horas después de la toma del yodo radioactivo I-131. Las sesiones tuvieron una duración de 4 horas, con la máquina de diálisis Integra® (Hospal), con dializadores HF80s® (Fresenius) de alto flujo, un baño de Ca 2,5/K 1,5 mEq/l y un flujo de sangre de 380 ml/min. Se obtuvo una ultrafiltración de entre 1,5 y 2,3 litros y la presión arterial se mantuvo estable, en 110/80 mmHg.
- Cada día se midió la dosis de radiación emitida en diferentes puntos del entorno del paciente. Se recurrió a un detector de área Rotem Ram Gene 1. La dosis recibida por el enfermero se midió con un detector personal de lectura directa Atomtex AT2503A. En todo caso, se siguieron las normas de protección radiológica exigibles por la legislación española vigente, el manual de protección radiológica de nuestro hospital y el reglamento de funcionamiento de la instalación radiactiva de medicina nuclear, así como las instrucciones de manejo del paciente dictadas por el servicio de radiofísica9.
- La tasa de dosis en el entorno del paciente se consideró adecuada para proceder al alta hospitalaria (16,7 µSv)9. Los niveles de radiactividad en el enfermero al final del tratamiento ablativo fueron de 21,55 µSv.
- El paciente fue dado de alta al tercer día tras la administración de yodo radiactivo I-131, después de explicarle las medidas de radioprotección. Tenía una tiroglobulina de 6,98 ng/ml, anticuerpos antitiroglobulina < 15 U/ml y captación en el lecho del tiroides.
- No se observó ningún efecto adverso atribuible a la TSH rh ni al yodo radiactivo I-131, ni se registró contaminación de los dispositivos no desechables del equipo de hemodiálisis.
- Se presentan las mediciones de radiactividad del paciente en la tabla 1 y las del enfermero en la tabla 2.
CASO CLÍNICO 2
Paciente mujer de 52 años, procedente de otro hospital, con enfermedad renal crónica secundaria a reflujo vesicoureteral, en hemodiálisis de 1993 a 1998, trasplante renal en 1998, y paratiroidectomizada en julio de 2011. Reinició hemodiálisis en mayo de 2012 y posteriormente sufrió amputación supracondílea izquierda debido a calcifilaxis.
En septiembre de 2011 se le detectó un nódulo tiroideo y se realizó tiroidectomía total en mayo de 2012. En el informe de anatomía patológica se diagnosticó de carcinoma papilar. Se remitió a nuestro centro para tratamiento ablativo con yodo radiactivo I-131. Dos días antes de su ingreso se le administró TSH rh (Thyrogen®).
En el momento del ingreso, la paciente presentaba una pauta de hemodiálisis diaria por mala tolerancia hemodinámica.
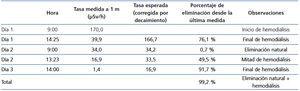
- El día del tratamiento se realizó una sesión de hemodiálisis en la unidad de hemodiálisis de nuestro hospital y posteriormente se le administró oralmente 100 mCi (3700 MBq) de yodo radiactivo I-131. Previamente a la ablación tenía una TSH de 51,5 µIU/ml, un T4 libre de 0,94 ng/dl y un T3 libre de 1,27 pg/ml.
- Con posterioridad a la administración del radiofármaco se realizaron tres sesiones de hemodiálisis diaria, dos en la unidad de terapia metabólica con la máquina de diálisis Integra® (Hospal) y una en la unidad de hemodiálisis. Las sesiones tuvieron una duración de 4 horas, alto flujo con dializadores Diapes BLS® (Bellco), un baño con Ca 2,5/K 1,5 mEq/l y un flujo de sangre de 300 ml/min. La ultrafiltración fue de entre 1 y 1,5 litros por sesión.
- Cada día se midió la tasa de dosis de radiación emitida (tabla 3).
- Tres días después de administrarle yodo radiactivo I-131, la paciente tenía una tiroglobulina de 4,32 ng/ml y unos anticuerpos antitiroglobulina < 15 U/ml, y la captación en el lecho del tiroides era adecuada.
- La tasa de dosis en el entorno de la paciente se consideró adecuada para proceder al alta hospitalaria (1,4 µSv). Fue dada de alta después de explicarle las medidas de radioprotección.
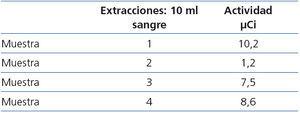
- A las 48 horas de la administración de yodo radioactivo I-131, la paciente presentó fiebre de 40 ºC, secundaria a bacteriemia por estafilococo aureus sensible a la meticilina. Se interpretó como una bacteriemia debida a una infección del catéter de hemodiálisis con hipotensión arterial, con buena respuesta a tratamiento antibiótico. No se observó ningún efecto adverso atribuible a la TSH rh ni al yodo radiactivo I-131, ni se registró contaminación de los dispositivos no desechables del equipo de hemodiálisis.
- En la tabla 4 y la tabla 5 se muestra la radiactividad recibida del enfermero de hemodiálisis y de las muestras de sangre extraídas para el diagnóstico de la bacteriemia.
DISCUSIÓN
El tratamiento con yodo radiactivo I-131 en los pacientes sometidos a hemodiálisis resulta potencialmente problemático, ya que la principal vía de eliminación es la renal. Para llevarlo a cabo, se trabajó en forma coordinada entre los servicios de nefrología, endocrinología, medicina nuclear y radiofísica para organizar las sesiones de hemodiálisis, las dosis de yodo radiactivo I-131 y la medida de radiactividad.
El primer problema que hubo que resolver fue el de acondicionar una habitación adaptada para pacientes de hemodiálisis en la unidad de terapia metabólica. El objeto del acondicionamiento fue doble: por un lado, recoger el líquido eliminado en cada sesión de diálisis, a través de un sistema de drenaje de excretas de la unidad de terapia metabólica; por otro, instalar un equipo portátil de tratamiento de agua, en el baño de la habitación, para su mezcla con los concentrados ácido y de bicarbonato.
La dosis fija de 3700 MBq (100 mCi) para la ablación tiroidea fue aprobada en Europa en 2005 por la European Medicines Agency previa preparación con TSH rh4. En estos dos casos, se administró dicha dosis oral de yodo radiactivo I-131, la misma que se utiliza en pacientes con función renal normal, y antes de darles el alta radiológica fueron necesarias dos sesiones de hemodiálisis diaria para lograr una eliminación adecuada del radiofármaco medida por la tasa a un metro de distancia.
En la literatura médica, hay otras descripciones de la administración de yodo radiactivo I-131 para el tratamiento del cáncer de tiroides en pacientes en hemodiálisis. Jiménez et al.10, en sus tres pacientes, administraron la misma dosis que a pacientes con función renal normal de radiofármaco y tras hemodiálisis diaria durante cinco días lograron una eliminación mayor del 89 % de la dosis inicial. Hols et al., con tres sesiones, lograron una eliminación superior al 90 %11.
Otros autores administraron una dosis menor a la habitual12-14 y con pautas de hemodiálisis variables.
La guía de la Asociación Americana de Tiroides solo menciona unas líneas para pacientes con insuficiencia renal, donde se deben usar los métodos dosimétricos para administrar el I-131, que son difíciles de realizar en la práctica clínica y no superiores en resultados al método de dosis fija15.
El Comité de Terapia de la Asociación Europea de Medicina Nuclear sí recomienda una sesión de hemodiálisis después de la administración de yodo radiactivo I-131, pero no queda reflejada una dosis estandarizada del radiofármaco ni la forma de medir la radiactividad16.
Hay pocas publicaciones sobre el tratamiento ablativo en diálisis peritoneal (DP) y se centran más en el ajuste de dosis que en los aspectos de seguridad. Como referencia, un paciente en DP continua ambulatoria con diuresis residual de 600 ml precisó una dosis de I-131 de 814 MBq (22 mCi), con una vida media de eliminación de 2,9 días y una medición de radiactividad inferior a 25 µSv/h a las 24 horas después del tratamiento17.
En los dos casos que presentamos hay una diferencia importante en la dosis de radiactividad recibida del enfermero de hemodiálisis (21,55 µSv/h en el caso 1 y 145,55 µSv/h en el caso 2), debido a tres razones. En primer lugar, en el caso 1 el proceso de montaje del monitor y la preparación del material se hizo con el paciente sentado en un sillón tras una mampara de plomo y a mayor separación, mientras que en el caso 2 la paciente se encontraba en la cama debido a sus problemas de movilidad. En segundo lugar, en el caso 1 el acceso vascular era una fístula arteriovenosa, mientras que el caso 2 se trataba de un catéter, lo que implica mayor tiempo en la manipulación. Y, en tercer lugar, la sesión del caso 2 fue mal tolerada y necesitó de más intervenciones durante la técnica de hemodiálisis que en el caso 1, debido a la bacteriemia.
Con respecto a la tasa de dosis a un metro de distancia al alta, en el caso 1 fue de 16,7 µSv/h (con dos sesiones de hemodiálisis) y en el caso 2 de 1,4 µSv/h (con tres sesiones). Estas cifras son similares a lo encontrado por otros autores, como Murcutt et al.18, que también realizó dos sesiones de hemodiálisis, con menos de 20 µSv, y Andrés et al.14, con 18 µSv tras dos sesiones. Solo Gutiérrez et al.19 obtuvieron al alta cifras de 1,4 µSv, tras dos sesiones, igual que el caso 2 descrito, aunque este necesitó de tres sesiones.
En ninguno de los dos casos la utilización de TSH rh ocasionó síntomas relacionados con el hipotiroidismo de los pacientes al no suspenderse la levotiroxina.
Debemos mencionar que el protocolo de monitorización de la radiactividad es propio, desarrollado por el servicio de radiofísica de nuestro hospital, basado en el documento del Foro sobre Protección Radiológica en el Medio Sanitario9, y siguiendo las directrices de los organismos internacionales.
Según este protocolo, el límite de radiación para el personal no profesionalmente expuesto, así como para el público en general, es de 1 mSv/año. El límite para los profesionales expuestos a radiaciones es de 20 mSv/año (personal de la unidad de tratamientos metabólicos).
En nuestra experiencia con el uso de I-131 en hemodiálisis, podemos sugerir que es necesaria una implicación de todos los servicios para aplicar pequeñas modificaciones en la habitación de terapia metabólica, como son el equipo portátil de tratamiento de agua (como el usado para pacientes en unidad de cuidados intensivos) y la adecuación del sistema de desagüe, asequibles en cuestión de costes. Además, es muy importante la labor del personal de enfermería que realiza la diálisis, por lo que si se realizan varios tratamientos sería recomendable realizar rotaciones de dicho personal para evitar la acumulación de radiación en un solo trabajador. Proponemos utilizar la dosis fija de 3700 MBq (100 mCi) para los pacientes en hemodiálisis, sin olvidar que la monitorización durante todas las sesiones de diálisis es la base para lograr tanto la efectividad del tratamiento como la seguridad para el paciente y para el personal sanitario. La implicación del servicio de radiofísica es fundamental en estos aspectos de seguridad. Estas recomendaciones no se pueden extender a los pacientes en DP que precisen recibir tratamiento con I-131, que han de ser objeto de estudios específicos17.
En conclusión, el enfoque multidisciplinar permite un manejo terapéutico seguro y efectivo para los pacientes de hemodiálisis. La dosis de yodo radiactivo I-131 aplicada es la recomendada para pacientes con función renal normal, con necesidad de dos sesiones diarias posteriores para lograr las condiciones de radiactividad adecuadas para el alta hospitalaria. El enfermero recibió una dosis de radiación que no supera los límites de seguridad.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 1. Medidas de radiactividad del paciente.
Tabla 2. Medidas de radiactividad del enfermero.
Tabla 3. Medidas de radiactividad del paciente.
Tabla 4. Medidas de radiactividad del enfermero.
Tabla 5. Medidas de radiactividad de las muestras de sangre.