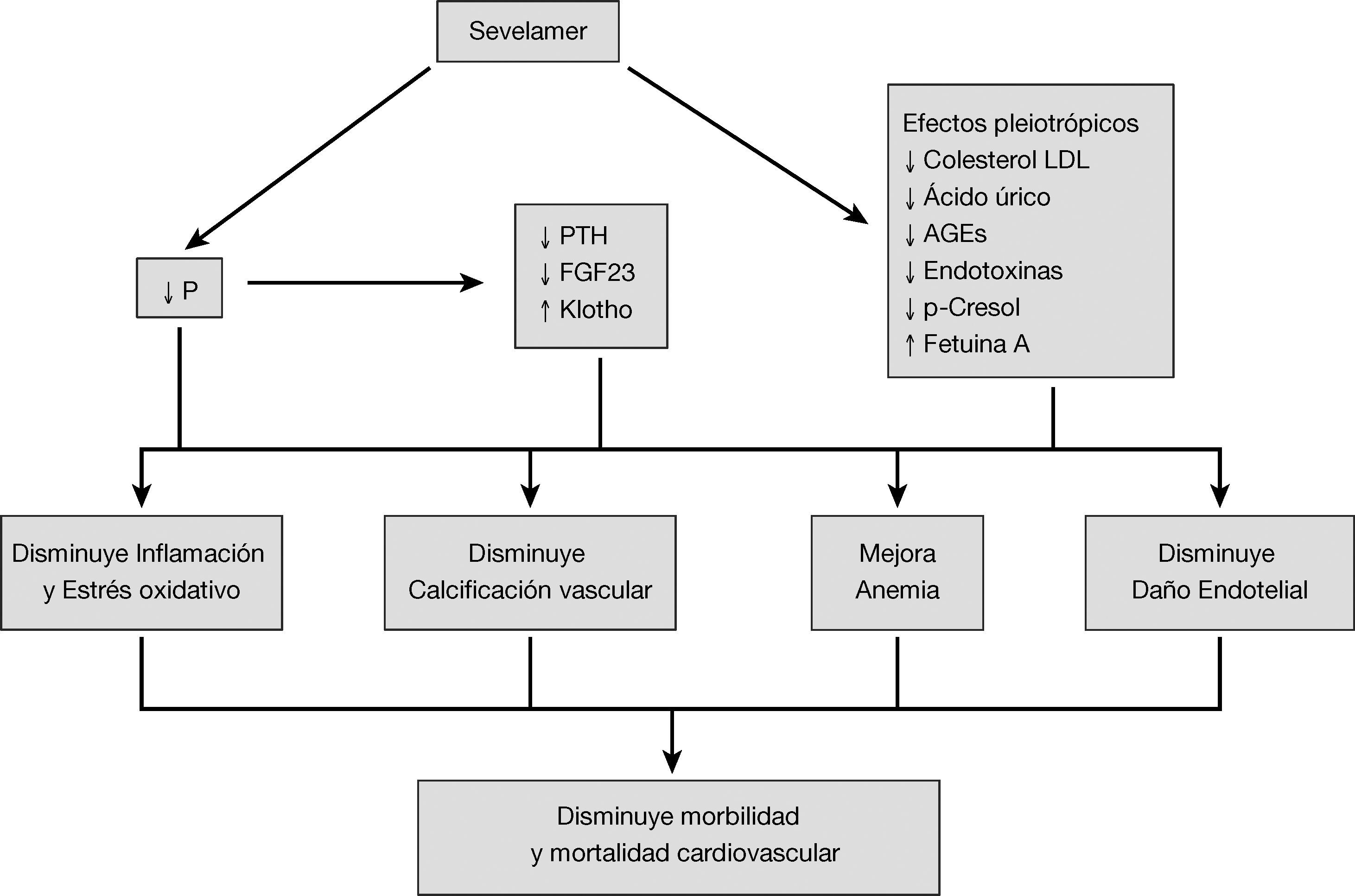
El sevelamer es un captor no cálcico de fósforo que se utiliza en la ERC avanzada y en diálisis para el control de la hiperfosforemia. Varios estudios experimentales, observacionales y ensayos clínicos han mostrado que el sevelamer tiene efectos pleiotrópicos, más allá del control de la hiperfosforemia, incluyendo acciones sobre la inflamación, el estrés oxidativo, el perfil lipídico y la aterogénesis, la calcificación vascular, la disfunción endotelial y la disminución de diversas toxinas urémicas, todo lo cual sería la base biológica de su efecto global sobre la morbilidad y la mortalidad cardiovascular en pacientes con enfermedad renal crónica. En esta revisión, se hace énfasis en estas acciones pleiotrópicas del sevelamer y su impacto en la salud cardiovascular, con la experiencia publicada después de más de 10 años de experiencia clínica.
Sevelamer is a calcium-free phosphate binder used in advanced chronic kidney disease (CKD) and in dialysis to control hyperphosphatemia. Several experimental and observational studies and clinical trials have shown that sevelamer has pleiotropic effects that go beyond controlling hyperphosphatemia; these pleiotropic effects include acting on inflammation, oxidative stress, lipid profile and atherogenesis, vascular calcification, endothelial dysfunction and decreasing various uremic toxins. All of these represent the biological basis for the global effect of sevelamer on cardiovascular morbidity and mortality in patients with CKD. In this review, we emphasis these pleiotropic actions of sevelamer and their impact on cardiovascular health, with the experience published after more than 10 years of clinical experience.
Los pacientes con enfermedad renal crónica (ERC) presentan un aumento importante de la morbimortalidad cardiovascular en relación a la población general1. Entre el 40%-75% de los pacientes que comienzan diálisis tiene enfermedad cardiovascular (ECV), siendo esta responsable del 44% de las muertes de estos pacientes y constituye, ajustado para edad y sexo, la causa más importante de morbilidad cardiovascular y de mortalidad total2,3. Uno de los factores de riesgo cardiovascular no clásicos en estos pacientes son las alteraciones del metabolismo mineral4.
El fósforo está considerado en la actualidad como un elemento importante que ocasiona daño vascular, en personas con función renal normal, y de manera especial en pacientes con insuficiencia renal5. El control de su absorción para evitar su sobrecarga es una práctica habitual en el enfermo renal, pero se comienza a plantear su utilidad en otros pacientes. La dieta y el uso de captores de fósforo constituyen las formas con las que se consigue este control6.
Existen diferentes captores de fósforo, pero cada uno presenta unas peculiaridades que les hacen diferentes, y que pueden aportar ventajas añadidas a la ya demostrada reducción de la absorción de fósforo. Recientemente se ha puesto de manifiesto la menor mortalidad de los captores no cálcicos frente a los cálcicos, de manera que son los no cálcicos los que presentan unos mejores resultados de supervivencia7. Estos trabajos han conseguido que se despierte el interés nuevamente por estos captores, fundamentalmente el sevelamer y lantano. En esta revisión nos detenemos en el análisis de uno de ellos, el sevelamer. Esta molécula ha sido usada en la práctica clínica durante más de 10 años, y son una gran cantidad de estudios los que han puesto de manifiesto sus efectos sobre el paciente con enfermedad renal. El sevelamer en sus dos formulaciones, carbonato e hidrocloruro, es un captor o quelante de fósforo no absorbible, libre de metal y calcio, que se emplea para el control de la hiperfosfatemia en la enfermedad renal crónica8 (ERC). Su administración simultáneamente con los alimentos reduce la absorción de este ión. En su composición, contiene múltiples aminas, separadas por un carbono del esqueleto del polímero, que se ionizan parcialmente en el intestino e interaccionan con moléculas de fosfato mediante enlaces iónicos y de hidrógeno. De esta forma se une fósforo de la dieta en el tracto gastrointestinal, lo captura y lo elimina por vía intestinal, disminuyendo su concentración en suero9.
Además de reducir la absorción de fósforo por su capacidad de captarlo en el intestino, sin aportar calcio, es capaz de modificar los mecanismos adaptativos como reducir el factor de crecimiento del fibroblasto 23 (FGF23) o la parathormona (PTH). También, desde su comercialización, se han ido confirmando otros efectos de esta molécula, conocidos como efectos pleiotrópicos. De esta forma se ha descrito el descenso de los lípidos10 cambios en la estructura ósea11, la inflamación12, el estrés oxidativo13, la anemia14 así como de la fetuina-A15 entre otros. Todos estos efectos del sevelamer se han relacionado con una reducción de la calcificación vascular, una mejoría en las lesiones cardiovasculares y por lo tanto una reducción de la mortalidad16.
Los efectos pleiotrópicos del sevelamer, teniendo en cuenta que no se absorbe, se deben al efecto intestinal de esta molécula. Su unión a sales biliares, y su capacidad captora de otras moléculas en el intestino parecen tener otros efectos beneficiosos. Este efecto no hace más que remarcar la importancia que tiene el intestino en el paciente urémico y deja abierta la posibilidad de nuevos tratamientos que tengan el intestino como lugar de acción en el paciente con ERC y sus complicaciones17. En esta revisión, analizamos los diferentes efectos publicados con sevelamer, evitando el análisis detallado de su efecto captor del fósforo en el intestino (fig. 1).
a) FGF23
El factor de crecimiento del fibroblasto 23 (FGF23) es un miembro de la superfamilia del factor de crecimiento de fibroblastos que posee acción fosfatúrica, de inhibición de la 1a-hidroxilasa en los túbulos proximales, y activación de la 24-hidroxilasa18,19 por lo que reduce la actividad de la vitamina D. El FGF23 juega un papel importante en el metabolismo de la vitamina D y del fósforo20–22. En la uremia ambos metabolismos están alterados.
Tanto en los individuos sanos como en los pacientes con ERC, el FGF23 es secretado por los osteocitos y osteoblastos como respuesta a la sobrecarga oral de fosfatos19,23,24. Se sabe además que los niveles de FGF23 en suero aumentan en las etapas precoces de la enfermedad renal crónica en un intento inicial de evitar la retención de fósforo, incrementando la fosfaturia. Con la progresión de la ERC, ya en estadios muy avanzados, la hiperfosfatemia aparece a pesar de niveles elevados de FGF23 y PTH. Aunque es un aspecto aún en fase de estudio parece ser que el receptor de FGF23 y su co-receptor Klotho se expresan en muchos tipos celulares, incluyendo cardiomiocitos, pared vascular, los riñones y glándulas paratiroideas25,26. Además el FGF23 elevado se asocia con desarrollo de disfunción endotelial e hipertrofia cardiaca en pacientes con ERC27.
Varios estudios recientes han demostrado la capacidad de sevelamer para disminuir FGF23 gracias a su capacidad de reducir la absorción de fósforo en intestino. Koiwa y cols. demostraron que el empleo de hidrocloruro de sevelamer reduce los niveles de FGF23 en suero en pacientes de diálisis presumiblemente a través de la inhibición de la carga de fósforo en el intestino. Los niveles de FGF23 séricos disminuyeron significativamente después de 4 semanas de tratamiento con clorhidrato de sevelamer + CaCO3 a partir de los niveles previos al tratamiento (p < 0,05), mientras que no se encontraron cambios en los pacientes tratados solo con CaCO3 28.
Oliveira y cols. confirmaron este efecto del sevelamer sobre el FGF23 en pacientes con ERC. En un estudio randomizado de 6 semanas estudiaron el efecto de dos quelantes del fósforo (acetato cálcico y sevelamer) sobre la PTH y FGF23 en pacientes con ERC estadios 3 y 4. Durante el tratamiento con ambos quelantes hubo una disminución progresiva de la PTH sérica y del fósforo urinario, pero no hubo cambios en el calcio sérico o fósforo sérico. Solo se observaron cambios significativos para FGF23 en los pacientes tratados con sevelamer29.
El descenso del FGF23 aumenta el calcitriol al reducir la actividad de la 24-hidroxilasa y aumentar la de la 1a-hidroxilasa. Sin embargo también se ha descrito un leve descenso de la absorción intestinal de grasas y vitaminas liposolubles, incluida la vitamina D, derivada de su unión a ácidos biliares30.
La reducción de los niveles séricos de FGF23 con sevelamer tiene un efecto beneficioso sobre la función endotelial vascular en el enfermo renal, mejorando la vasodilatación mediada por el flujo vascular, que es un marcador de daño endotelial. Además el FGF23 se correlaciona con la dimetil-arginina asimétrica (ADMA) y es un inhibidor endógeno de la enzima óxido nítrico sintetasa, vía que podría ocasionar disfunción vascular en el paciente renal31.
b) Klotho
El descenso de FGF23 se acompaña de un aumento del Klotho sérico. Estos cambios se observan ya 48 horas después del tratamiento. El FG23 y el fósforo séricos descienden mientras se usa el sevelamer y el incremento de klotho es proporcional al descenso de fósforo32.
c) Efecto del sevelamer sobre la vía WNT-Betacatenina
Olivera y cols. examinaron los efectos de quelantes de fósforo, hidrocloruro de sevelamer y acetato cálcico, en las hormonas reguladoras de la energía y vía WNT-Betacatenina en ERC estadio 3-4. En el estudio se vio que en la ERC hay una importante alteración de la vía WNT, reflejado por la elevada esclerostina y una disregulación de las hormonas reguladoras de la energía. Muchas de estas alteraciones pueden ser atenuadas por el tratamiento con quelantes de fósforo, más con hidrocloruro de sevelamer que con acetato cálcico, ya que este disminuye de forma significativa el FGF23 sérico, la esclerostina y la leptina, e incremente también de forma significativa los niveles de fosfatasa alcalina33.
Sevelamer y absorción de moléculas de origen intestinala) Sevelamer y su efecto sobre las endotoxinas
Los pacientes en hemodiálisis se caracterizan por tener una elevada tasa de inflamación crónica, que ocasiona una alta comorbilidad que se ve incrementada además por un pobre estado nutricional. La endotoxina (ET) es un componente glucolipídico de la pared celular de bacterias Gram-negativas que supone un potente estímulo para la activación y liberación de citoquinas pro-inflamatorias (por ejemplo, IL-1, IL-6, y TNF) que afectan de forma negativa al metabolismo proteico y al estado nutricional34. Estas citoquinas pro-inflamatorias están elevadas en pacientes en hemodiálisis y se han asociado con mayor riesgo de enfermedad cardiovascular, hospitalización y muerte35–37. Además niveles bajos de albúmina están asociados con marcadores de inflamación elevados como IL6, PCR, TNFa38–40.
Estudios observacionales transversales en pacientes en hemodiálisis han encontrado niveles séricos elevados de ET. Estos se asocian a una menor albúmina sérica, aumento de citoquinas pro-inflamatorias y proteína C reactiva, que se relacionan con un importante daño cardiovascular, y en casos extremos pueden incluso ocasionar un shock séptico41. La albúmina se ha demostrado además, que presenta propiedades anti-inflamatorias uniéndose a la endotoxina y reduciendo la expresión de marcadores pro-inflamatorios42,43.
Como posibles fuentes de ET está la translocación bacteriana en el tracto gastrointestinal34. En la ERC estadio 5 la función de la barrera gastrointestinal está comprometida por el estrés oxidativo, compromiso circulatorio, hipoxia de la pared intestinal, motilidad reducida y sobrecrecimiento bacteriano44. La hipoperfusión y el edema intestinal inducen cambios de permeabilidad, facilitando que las bacterias se transloquen a través del lumen gastrointestinal al torrente sanguíneo45. La administración de suplementos de hierro, que son tratamientos comunes para la anemia en pacientes con ERCT, puede favorecer también la proliferación bacteriana intestinal35,46. El hierro, además, es un requisito esencial para la mayoría de microorganismos, y se ha demostrado que la sobrecarga de hierro puede mejorar el crecimiento bacteriano y la virulencia47,48.
En algunos estudios observacionales se ha visto que pacientes de hemodiálisis en tratamiento con sevelamer, presentan niveles más bajos de ET, con la consecuente disminución de citoquinas pro-inflamatorias y PCR, y un aumento simultáneo de la albúmina sérica43.
El sevelamer puede unirse de forma no específica a biomoléculas cargadas negativamente, como puede ser la porción A del lípido cargado negativamente de la ET, reduciendo así las concentraciones de esta en suero in vitro e in vivo. Experimentos in vitro demuestran que la unión del sevelamer a ET es dependiente de la dosis49.
Varios estudios pequeños y a corto plazo han mostrado una asociación entre el tratamiento con sevelamer y disminuciones en ET, CD14 soluble y marcadores pro-inflamatorios, como la PCR y la IL-6 34. Un estudio reciente de 8 semanas, aleatorizado y cruzado en pacientes con ERC estadios 2-4 demostró que el tratamiento con carbonato de sevelamer reduce los productos avanzados de glicosilación (AGE), la hemoglobina A1C, y biomarcadores de inflamación50. Estos datos preliminares sugieren posibles beneficios de sevelamer en la reducción de citoquinas pro-inflamatorias.
b) Sevelamer y colesterol
El sevelamer se une a los ácidos biliares cargados negativamente, actuando así como un secuestrador de ácidos biliares que pueden reducir las concentraciones de lipoproteínas de baja densidad9. Los efectos beneficiosos atribuidos al sevelamer sobre la mortalidad cardiovascular, se deben en parte a la acción hipolipemiante de la molécula51. Es bien conocida la capacidad de reducir la absorción de colesterol intestinal con el sevelamer con varios estudios que sustentan este efecto10,52. Este efecto hipolipemiante ha sido descrito en nuestro medio ampliamente. En diálisis peritoneal el sevelamer ha demostrado reducir el fósforo y el colesterol en un ensayo cruzado multicéntrico realizado en España53. Este efecto ha conseguido también en nuestro medio reducir las necesidad del uso de estatinas en pacientes con insuficiencia renal crónica54.
c) Sevelamer y p-Cresol
Dentro de las toxinas urémicas se encuentran aquellas moléculas producidas por la flora intestinal alterada en el paciente renal. Las más estudiadas son aquellas derivadas del metabolismo de los aminoácidos aromáticos por esta flora intestinal anómala y que originan moléculas como los fenoles e indoles. Estos son absorbidos al torrente sanguíneo constituyendo unas toxinas urémicas con gran implicación clínica. Uno de estos fenoles es el p-Cresol, molécula que ha demostrado tener importancia en el deterioro de la función renal, como en el daño vascular del paciente renal55. El poder captor en el intestino del sevelamer no solo parece ser exclusivo del fósforo de la dieta. El sevelamer ha sido descrito como un potencial absorbente de estas moléculas de origen intestinal como el p-Cresol56. Este poder captor ha sido cuantificado en un 10-15% de los indoles y un 40-50% del p-Cresol dependiendo del pH intestinal57. Sin embargo, en otros estudios el sevelamer no ha demostrado reducir la absorción de estas moléculas en modelos de ERC en roedores58.
Recientemente se ha descrito en 57 pacientes en diálisis peritoneal, como los pacientes que estaban siendo tratados con el sevelamer tienen valores más bajos de p-Cresol, y aunque es un estudio observacional y transversal en el que tal efecto no puede ser atribuido a este fármaco, si apoyaría las evidencias de otros autores59.
d) Sevelamer y productos de glicosilación
Los productos finales de la glucosilación avanzada (AGEs), son moléculas altamente inflamatorias, oxidantes y aterogénicas formadas por la oxidación de carbohidratos, lípidos y aminoácidos60. Estas moléculas se acumulan en mayor medida en el paciente renal, a medida que se pierde función renal. Se conoce que la absorción intestinal de AGEs determina las concentraciones plasmáticas de AGE61. El sevelamer reduce los valores séricos e intracelulares de AGEs en pacientes con ERC estadio 3-4 con nefropatía diabética50 y en diabéticos en diálisis62. Una de estas moléculas, la pentosidina, se reduce con el sevelamer, pero aumenta con captores cálcicos63. Un estudio reciente de 8 semanas, aleatorizado y cruzado, en pacientes con ERC estadios 2-4 demostró que el tratamiento con carbonato de sevelamer reduce los AGEs, la hemoglobina A1C y diversos biomarcadores de inflamación50. Estos datos preliminares sugieren posibles beneficios de sevelamer en la reducción de citoquinas pro-inflamatorias50.
e) Sevelamer y ácido úrico
El ácido úrico es una molécula que induce estrés oxidativo y daño endotelial en pacientes con ERC64. Existe controversia sobre si el sevelamer es capaz de reducir los niveles séricos de ácido úrico. Diversos estudios han observado una reducción del ácido úrico sérico en pacientes en hemodiálisis65 y en diálisis peritoneal66. Sin embargo, otros autores no han encontrado este efecto67.
f) Sevelamer y fetuina A
La fetuina-A es una glicoproteína que esta disminuida en situaciones de inflamación sistémica68. Los niveles séricos de fetuina-A están más bajos en los pacientes con ERC que en controles sanos, posiblemente por la presencia inflamación, como sugiere la correlación negativa entre fetuina A y la proteína C reactiva69.
Caglar y cols. vieron que sevelamer tiene efectos a corto plazo sobre los niveles de fetuina A y consecuentemente sobre la disfunción endotelial. En un estudio durante 8 semanas, prospectivo y aleatorizado en 50 pacientes con ERC estadio 4, se comparó el efecto del sevelamer versus el acetato cálcico sobre los niveles de fetuina A y la disfunción endotelial. Los niveles de fetuina A y la dilatación mediada por el flujo se determinaron tanto al inicio como después del tratamiento. Los pacientes con ERC tenían niveles significativamente más bajos de fetuina-A. El uso de sevelamer condujo a un aumento significativo en la concentración de fetuina-A con la mejora de la dilatación mientras que no se observó ninguna diferencia significativa en el grupo de acetato de calcio. En un análisis de regresión múltiple, la dilatación mediada por flujo se relacionó de forma independiente a fetuina-A70.
3. Sevelamer, endotelio e inflamaciónExisten evidencias de que el sevelamer reduce el estado inflamatorio del paciente renal. Chennasamudram y cols., compararon los efectos de carbonato de sevelamer y carbonato de calcio sobre la función endotelial (FE) y la inflamación en pacientes en diálisis peritoneal (DP) con diabetes mellitus tipo 2 (DM2). Al principio y al final de cada tratamiento se midieron los biomarcadores de FE, las citoquinas pro-inflamatorias, albúmina, calcio, fosfato y lípidos. Se vio que el tratamiento con carbonato de sevelamer tiene efectos beneficiosos en comparación con carbonato de calcio en la disminución de la inflamación, ya que disminuyó en suero los niveles de endotelina-1, el inhibidor-1 del activador del plasminógeno, la proteína C reactiva y la interleucina-6, y mejoró significativamente el perfil lipídico en comparación con carbonato de calcio71. Navarro y cols. han demostrado igualmente, como el sevelamer reduce en los pacientes en hemodiálisis la proteína C reactiva, la IL-6, niveles de endotoxinas y las concentraciones de CD14, mientras que los captores cálcicos no lo hacen72.
Todos los efectos vistos anteriormente estarían implicados de una manera directa o indirecta en la reducción del estado inflamatorio. El fósforo ha demostrado ser una potente molécula inflamatoria, que ocasiona daño vascular73 por lo que su sola reducción implicaría un descenso de la misma. El FGF23 y la PTH igualmente constituyen moléculas pro-inflamatorias que han demostrado implicación en daño vascular74.
La inflamación vascular y endotelial es responsable de daño cardiovascular en el paciente urémico75. Pero como ya se ha descrito previamente cada una de las moléculas implicadas cuyo bloqueo se relaciona con los efectos pleiotrópicos del sevelamer, presentan de forma individual relación con la inflamación. No se ha determinado que importancia presentan por separado o de forma conjunta en la inflamación. El LDL colesterol oxidado, las endotoxinas bacterianas, los AGEs y toxinas bacterianas como el p-Cresol aumentarían la actividad inflamatoria celular y la oxidación76.
Sevelamer y anemiaLa información actual sobre los efectos de los quelantes de fósforo en la anemia de pacientes con ERC es bastante limitada. La anemia es otra complicación importante en los pacientes en HD y se asocia con una reducción de la calidad de vida, mayor morbilidad cardiovascular y el aumento de la mortalidad77–79.
Aasebø y cols. observaron que los pacientes que recibían una dosis más alta de sevelamer mostraban niveles de hemoglobina más altos que aquellos tratados con una dosis más baja, aunque esta asociación no fue significativa en el análisis multivariante80.
Ikee y cols. estudiaron si el empleo de los análogos de la vitamina D, sevelamer y cinacalcet afecta a la capacidad de respuesta a los agentes estimulantes de la eritropoyesis (ESA) en pacientes en hemodiálisis tratados con ellos. Los datos preliminares mostraron una asociación independiente entre la dosis de sevelamer y la capacidad de respuesta a los ESA en pacientes en hemodiálisis. El análisis univariante mostró asociación significativa del índice de resistencia a la ESA con la tasa de saturación de transferrina (TSAT), la dosis del análogo de vitamina D y la dosis de sevelamer. En el análisis multivariado, la dosis de sevelamer y la TSAT resultaron ser determinantes independientes del índice de resistencia a la ESA81.
Repercusión clínica: calcificación y supervivencia cardiovascularTodos los efectos descritos hasta ahora tienen un efecto directo sobre la situación clínica del paciente y se traducen en una reducción de mortalidad cardiovascular.
La enfermedad cardiovascular es una causa importante de mortalidad en los pacientes con ERC y la hiperfosfatemia parece ser uno de los factores implicados más importantes. El fósforo se ha asociado a desarrollo de inflamación y ateroesclerosis en pacientes con ERC, así como en la población general con función renal normal, ya que favorece la disfunción endotelial, incrementa el grosor de la íntima media, y da lugar a una mayor mortalidad cardiovascular82.
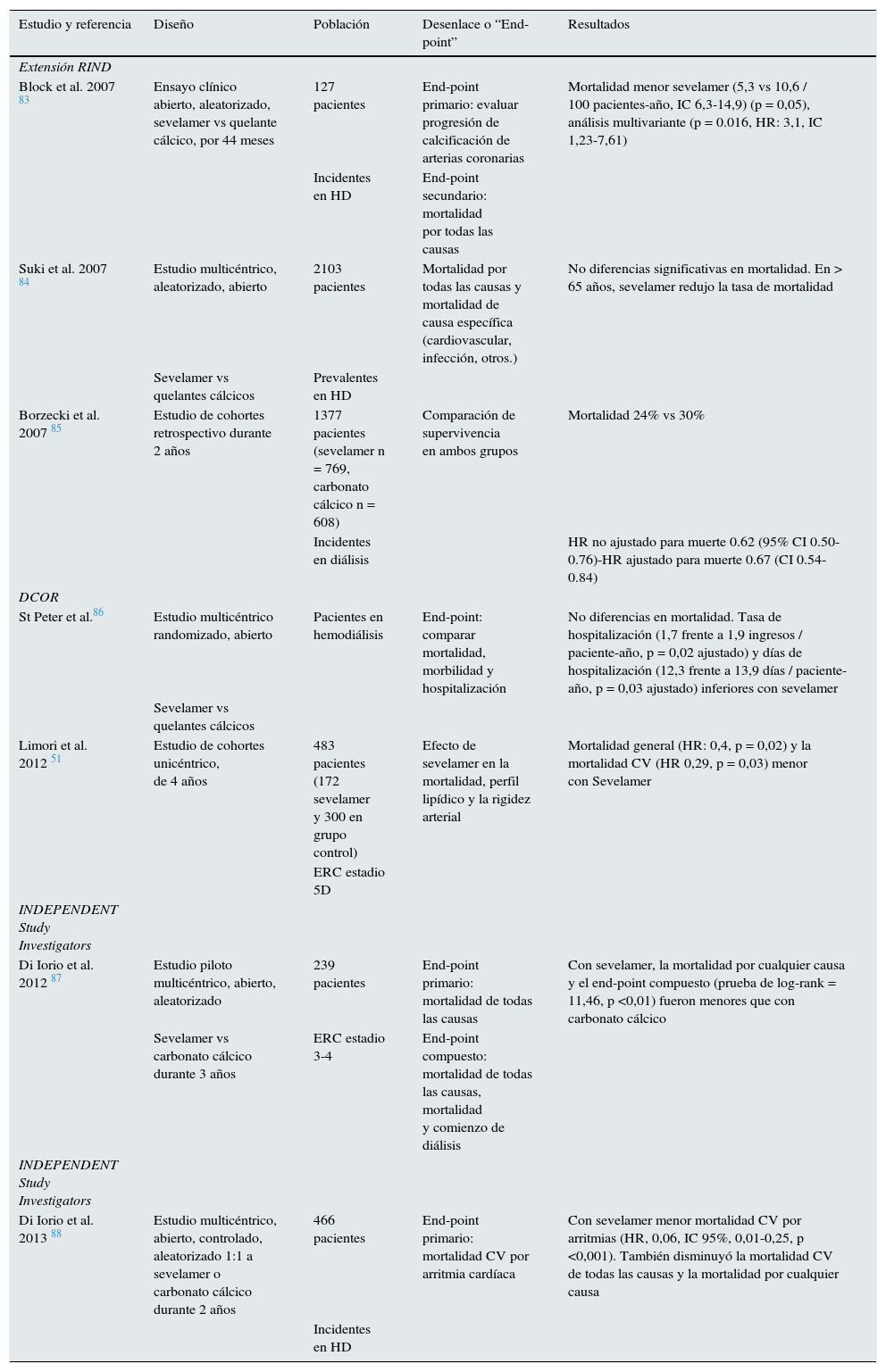
En la tabla 1 se muestran los principales estudios en los que se ha visto asociación entre el tratamiento con sevelamer y disminución de la tasa de mortalidad.
– Principales estudios en lo que se ha asociado Sevelamer con mejoría de la mortalidad
| Estudio y referencia | Diseño | Población | Desenlace o “End-point” | Resultados |
|---|---|---|---|---|
| Extensión RIND | ||||
| Block et al. 2007 83 | Ensayo clínico abierto, aleatorizado, sevelamer vs quelante cálcico, por 44 meses | 127 pacientes | End-point primario: evaluar progresión de calcificación de arterias coronarias | Mortalidad menor sevelamer (5,3 vs 10,6 / 100 pacientes-año, IC 6,3-14,9) (p = 0,05), análisis multivariante (p = 0.016, HR: 3,1, IC 1,23-7,61) |
| Incidentes en HD | End-point secundario: mortalidad por todas las causas | |||
| Suki et al. 2007 84 | Estudio multicéntrico, aleatorizado, abierto | 2103 pacientes | Mortalidad por todas las causas y mortalidad de causa específica (cardiovascular, infección, otros.) | No diferencias significativas en mortalidad. En > 65 años, sevelamer redujo la tasa de mortalidad |
| Sevelamer vs quelantes cálcicos | Prevalentes en HD | |||
| Borzecki et al. 2007 85 | Estudio de cohortes retrospectivo durante 2 años | 1377 pacientes (sevelamer n = 769, carbonato cálcico n = 608) | Comparación de supervivencia en ambos grupos | Mortalidad 24% vs 30% |
| Incidentes en diálisis | HR no ajustado para muerte 0.62 (95% CI 0.50-0.76)-HR ajustado para muerte 0.67 (CI 0.54-0.84) | |||
| DCOR | ||||
| St Peter et al.86 | Estudio multicéntrico randomizado, abierto | Pacientes en hemodiálisis | End-point: comparar mortalidad, morbilidad y hospitalización | No diferencias en mortalidad. Tasa de hospitalización (1,7 frente a 1,9 ingresos / paciente-año, p = 0,02 ajustado) y días de hospitalización (12,3 frente a 13,9 días / paciente-año, p = 0,03 ajustado) inferiores con sevelamer |
| Sevelamer vs quelantes cálcicos | ||||
| Limori et al. 2012 51 | Estudio de cohortes unicéntrico, de 4 años | 483 pacientes (172 sevelamer y 300 en grupo control) | Efecto de sevelamer en la mortalidad, perfil lipídico y la rigidez arterial | Mortalidad general (HR: 0,4, p = 0,02) y la mortalidad CV (HR 0,29, p = 0,03) menor con Sevelamer |
| ERC estadio 5D | ||||
| INDEPENDENT Study Investigators | ||||
| Di Iorio et al. 2012 87 | Estudio piloto multicéntrico, abierto, aleatorizado | 239 pacientes | End-point primario: mortalidad de todas las causas | Con sevelamer, la mortalidad por cualquier causa y el end-point compuesto (prueba de log-rank = 11,46, p <0,01) fueron menores que con carbonato cálcico |
| Sevelamer vs carbonato cálcico durante 3 años | ERC estadio 3-4 | End-point compuesto: mortalidad de todas las causas, mortalidad y comienzo de diálisis | ||
| INDEPENDENT Study Investigators | ||||
| Di Iorio et al. 2013 88 | Estudio multicéntrico, abierto, controlado, aleatorizado 1:1 a sevelamer o carbonato cálcico durante 2 años | 466 pacientes | End-point primario: mortalidad CV por arritmia cardíaca | Con sevelamer menor mortalidad CV por arritmias (HR, 0,06, IC 95%, 0,01-0,25, p <0,001). También disminuyó la mortalidad CV de todas las causas y la mortalidad por cualquier causa |
| Incidentes en HD |
CV: cardiovascular, ERC: enfermedad renal crónica, HD: hemodiálisis, HR: hazard ratio.
La progresión de la calcificación vascular es uno de los marcadores tardíos de daño vascular, por lo que su enlentecimiento o desaparición contribuye a una mayor supervivencia. La calcificación de las arterias coronarias (CAC) es más lenta en los pacientes en hemodiálisis tratados con sevelamer que los tratados con quelantes de fósforo con base de calcio89,90. Este efecto es debido a varias de las acciones del sevelamer. El sevelamer disminuye el colesterol de las lipoproteínas de baja densidad (LDL-C). Ounibi y cols., en el estudio CARE-2, intentaron comprobar si la reducción intensiva de los niveles de LDL-C con atorvastatina para alcanzar los niveles séricos inferiores a 70 mg/dl en 203 pacientes prevalentes en hemodiálisis tratados con acetato de calcio podría resultar en tasas de progresión de CAC similares a las de los pacientes tratados con sevelamer. El cambio en la puntuación en CAC se evaluó por medio de la tomografía computarizada por haz de electrones. Los pacientes en hemodiálisis tratados con acetato de calcio o sevelamer durante 1 año, con un control intenso de LDL-C (< 70 mg/dl) experimentaron una progresión similar de CAC91.
Di Iorio y cols. examinaron si el empleo de sevelamer en lugar de un quelante cálcico de fosfato mejora la supervivencia cardiovascular (CV) en pacientes incidentes en hemodiálisis en un estudio abierto aleatorizado y controlado, con grupos paralelos, con un seguimiento de 36 meses. La muerte cardiovascular por arritmias cardíacas fue considerada como el objetivo primario. Después de un seguimiento medio de 28 ± 10 meses, se registraron 128 muertes (29 y 88 debido a arritmias cardíacas y todas las causas de muerte CV). Los pacientes tratados con sevelamer experimentaron una menor mortalidad cardiovascular por arritmias cardiacas en comparación con los pacientes tratados con carbonato de calcio (HR, 0,06, IC 95%, 0,01-0,25, p < 0,001). Se observaron resultados similares para todas las causas de mortalidad cardiovascular. Estos resultados muestran que sevelamer en comparación con un captor del fósforo cálcico, mejora la supervivencia en pacientes incidentes en hemodiálisis88.
Por otra parte, Maizel y cols. estudiaron los efectos terapéuticos de sevelamer en las alteraciones cardiovasculares inducidas por la ERC, para ello se utilizó un modelo de ratón desarrollado recientemente, con fallo renal crónico pero sin hipertensión arterial, sin hipercolesterolemia y sin calcificación de la aorta82. Este modelo de ratón se caracteriza porque después de 6 semanas de fallo renal crónico, desarrollan anomalías cardiovasculares, incluyendo hipertrofia ventricular izquierda (HVI), disfunción diastólica, rigidez aórtica y disfunción endotelial92. Los animales se iniciaron el sevelamer después de 6 semanas de inducción de CKD y fueron reevaluados 8 y 14 semanas después. Después de las primeras 8 semanas de tratamiento con sevelamer, en los ratones con fallo renal crónico había disminuido los niveles séricos de fosfato y tanto la expansión sistólica aórtica, la velocidad de la onda del pulso, como la función diastólica habían mejorado; la HVI se mantuvo sin cambios. Después de 6 semanas adicionales de sevelamer, la HVI no había progresado. Los niveles de FGF23 no se redujeron hasta 14 semanas después de tratamiento con sevelamer. En el análisis de regresión múltiple, el fosfato sérico, pero no FGF23, se correlacionó de forma independiente con la función diastólica del ventrículo izquierdo y la masa. Por lo tanto, sevelamer mejoró primariamente la rigidez aórtica y disfunción diastólica y secundariamente impidió el desarrollo de HVI en ratones con ERC82.
Chue y cols. plantearon la hipótesis de que si la disminución de la absorción gastrointestinal de fosfato mediante el uso de carbonato de sevelamer reduciría los niveles séricos de fosfatoninas tales como FGF-23, reduciendo así la masa de VI y la rigidez arterial, así como mejorar la función sistólica y la función diastólica del VI en pacientes con ERC en estadios tempranos. Para ello realizaron un estudio aleatorizado, doble ciego, controlado con placebo, con 120 pacientes con ERC no diabética estadio 3. Después de 40 semanas, no se encontraron diferencias estadísticamente significativas entre sevelamer y placebo con respecto a la masa del ventrículo izquierdo, la función sistólica y diastólica medida por resonancia magnética, o la velocidad de onda de pulso carótida-femoral. Este estudio no proporciona evidencia de que el carbonato de sevelamer mejora la masa del ventrículo izquierdo, la función del VI, o la rigidez arterial en estadio 3 de ERC no diabética93.
La protección cardiovascular del sevelamer parece deberse en parte a la reducción de la absorción de fósforo, sin aportar calcio, así como reducción de los lípidos. Los quelantes de fósforo con base de calcio se utilizan comúnmente para tratar la hiperfosfatemia, pero, sin embargo se ha observado que aumentan la carga de calcio, por lo que se recomienda que los quelantes del fósforo sean libres de calcio94,95. Sevelamer produce una disminución significativa en los niveles séricos de fósforo sin alterar los niveles séricos de calcio, con lo que causa las tasas más bajas de calcificación vascular. Además, el tratamiento con sevelamer disminuye los niveles de colesterol total y lipoproteínas de baja densidad, apolipoproteína B, b2-microglobulina y la proteína C-reactiva, al tiempo que aumenta el nivel de lipoproteína de alta densidad96. En este contexto, Iimori y cols. examinaron los efectos de sevelamer sobre la mortalidad, el perfil lipídico y la rigidez arterial en pacientes con enfermedad renal crónica estadio 5D. Concluyeron que una menor mortalidad en pacientes en tratamiento con sevelamer HCl se puede explicar, por una parte, por una mejora en la dislipidemia y la rigidez arterial97.
El efecto beneficioso de todos los captores salvo el aluminio en la supervivencia del paciente en hemodiálisis ha sido recientemente verificado por el estudio COSMOS. En él, se observa como también el sevelamer solo o en asociación, mejora la supervivencia de estos pacientes98. La eficacia en el control del fósforo sin aporte de calcio y aluminio ya ha sido planteada desde hace años por otros autores como una de las ventajas del sevelamer en el paciente con insuficiencia renal crónica99.
ConclusiónEl sevelamer es un captor del fósforo que actúa en el intestino, impidiendo su absorción, pero sin absorberse. Su uso se ha asociado una menor mortalidad cardiovascular. Este efecto es debido en gran medida a su capacidad captora del fósforo y una reducción de sus mecanismos adaptativos como el FGF23 y la PTH, y el que sea una molécula libre de calcio. Durante los más de 10 años de experiencia con sevelamer, se han demostrado varios efectos derivados de su capacidad de captar otras moléculas en el intestino, que tienen importancia en la reducción del riesgo cardiovascular. La reducción del colesterol LDL, los AGEs, fenoles, ácido úrico o endotoxinas, todos ellos de origen intestinal, parecen tener un efecto en la reducción en el estado de la inflamación y oxidación en estos pacientes. Todas estas acciones tendrían efectos importantes sobre aspectos clínicos concretos como son la anemia, la calcificación vascular, la aterogénesis y la disfunción endotelial; determinando por lo tanto, una mejoría en la supervivencia del paciente con ERC.
FinanciaciónInstituto de Salud Carlos III (PI10/00072), REDINREN (RD012/0021).
Conflicto de interesesLos autores declaran conflictos de interés potenciales:
- •
Honorarios por ponencias: EGP ha recibido honorarios por ponencias de Sanofi, Shire y Abbvie. JE ha recibido honorarios por ponencias de Sanofi y Abbvie.
- •
Honorarios como consultor: AO consultor Sanofi.
Instituto de Salud Carlos III (PI10/00072), REDINREN (RD012/0021).