Los anticalcineurínicos son fármacos inmunosupresores que inhiben el gen de la calcineurina y, por tanto, la producción de citoquinas. La más importante de éstas es la interleucina (IL)-2 que interviene en la activación del linfocito T. La eficacia de estos fármacos en el tratamiento del síndrome nefrótico se ha demostrado en múltiples estudios aleatorizados controlados. Los anticalcineurínicos son efectivos en el control de la proteinuria en los casos de cambios mínimos y glomerulosclerosis focal y segmentaria corticodependientes y corticorresistentes. La respuesta es menor y más tardía en los casos de glomerulosclerosis segmentaria y focal (GSFS). En el 70-80% de las glomerulonefritis (GN) membranosas se produce un control de la proteinuria tras el tratamiento con anticalcineurínicos. Éstos son fármacos bien tolerados, pero debido a su potencial nefrotoxicidad requieren una monitorización cuidadosa de sus niveles plasmáticos y de la función renal. El problema con estos fármacos es la alta tasa de recidiva al disminuir la dosis o suspender su administración. Debido a esto, se deben mantener durante largos períodos y la retirada debe ser lenta y paulatina.
Los anticalcineurínicos podrían ser un grupo farmacológico que tener en cuenta en pacientes con lupus y proteinuria persistente, a pesar del tratamiento inductor iniciado o intolerante a otros fármacos inmunosupresores. La posibilidad de tratamiento con triple terapia debe ser una vía a estudiar en futuros ensayos clínicos.
INTRODUCCIÓN
Los anticalcineurínicos son fármacos inmunosupresores usados ampliamente en el trasplante renal. Su mecanismo de acción se basa en la inhibición de la calcineurina y así impiden la expresión de genes de citoquinas que promueven la activación del linfocito T. Estas citoquinas son: IL-2, IL-4, interferón gamma y el factor de necrosis tumoral alfa. La más importante de éstas es la IL-2, que actúa como factor regulador de la célula T en múltiples procesos inmunitarios. Además, disminuye la activación de las células B y, por tanto, la producción de anticuerpos. Como consecuencia de la inhibición de la calcineurina, hay una limitación cuantitativa en la producción de citoquinas y se inhibe la proliferación linfocitaria1. Además de esta acción inmunológica, los anticalcineurínicos reducen la proteinuria al estabilizar el citoesqueleto de actina del podocito2.
Es imprescindible, para el manejo de estos fármacos, la monitorización de sus niveles plasmáticos. Existe una gran variabilidad en el metabolismo del fármaco entre pacientes y en un mismo paciente. Las interacciones de los inhibidores de la calcineurina con otros fármacos son frecuentes. Su metabolismo es hepático, a través del citocromo P450 (CYP 3A). Los fármacos inductores de la actividad del citocromo disminuyen la concentración de los anticalcineurínicos (rifampicina, fenitoína, carbamazepina). Y también existen fármacos que aumentan sus niveles por inhibición del citocromo o por competición con sus rutas (ketoconazol, fluconazol, eritromicina, etc.).
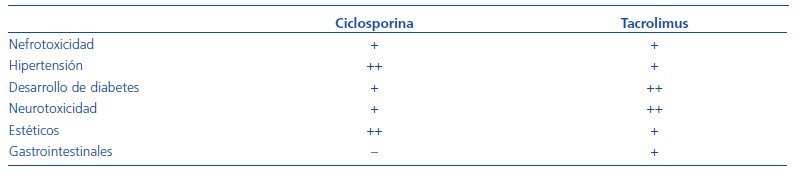
Los efectos secundarios más frecuentes son la nefrotoxicidad, la toxicidad intestinal, los efectos estéticos (hipertrofia gingival e hirsutismo con la ciclosporina [CsA]), la predisposición a la diabetes, así como la toxicidad neurológica (tabla 1). La nefrotoxicidad es producida por una vasoconstricción renal dosis-dependiente y reversible, y ésta favorece también la aparición de hipertensión. Este efecto puede producir, a largo plazo, fibrosis intersticial crónica y daño renal irreversible. Por este motivo, es primordial en el seguimiento la medición de los niveles del fármaco, así como de la función renal periódicamente. Si se produce un aumento de la creatinina sérica superior al 30%, es mandatorio disminuir la dosis del fármaco. A pesar de esto, algunos trabajos demuestran que este fármaco puede administrarse a pacientes con síndrome nefrótico durante años sin provocar insuficiencia renal3. La CsA y el tacrolimus comparten su mecanismo de acción. El tacrolimus es un fármaco con mayor potencia inmunosupresora, parece que menos nefrotóxico y presenta menos efectos adversos estéticos. Sin embargo, se asocia con mayor tasa de diabetes.
Estos fármacos se han usado en el tratamiento de diversas enfermedades glomerulares, sobre todo en las que presentan síndrome nefrótico (SN): enfermedad de cambios mínimos (ECM), glomerulosclerosis segmentaria y focal (GSFS) y en la membranosa (GM).
ANTICALCINEURÍNICOS EN LA ENFERMEDAD DE CAMBIOS MÍNIMOS
La ECM es la causa más frecuente de síndrome nefrótico en los niños. En los adultos representa un 20% de los SN. El riesgo de insuficiencia renal terminal es muy bajo. La primera línea de tratamiento en la ECM son los esteroides. El 95% de los niños alcanzan la RC a las 8 semanas del inicio del tratamiento esteroideo. Si el tiempo de tratamiento se alarga a 12 semanas, mejora la tasa de remisiones mantenidas. En los adultos se consigue la remisión en hasta el 80% de los casos con tratamientos de al menos 12-16 semanas. Sin embargo, esto tiene importantes efectos secundarios, sobre todo en los pacientes ancianos (intolerancia a la glucosa, osteonecrosis, infecciones).
La mitad de los pacientes que responden a los esteroides presentarán recidivas frecuentes, y en muchas ocasiones se convierten en corticodependientes. Éstos van a recibir tratamiento esteroideo durante largos períodos, con sus consecuentes efectos secundarios. Por este motivo, es preciso buscar tratamientos alternativos que produzcan una menor toxicidad. Los pacientes corticodependientes responderán a un ciclo de tratamiento con citotóxicos (ciclofosfamida o clorambucilo), pero no así los pacientes resistentes.
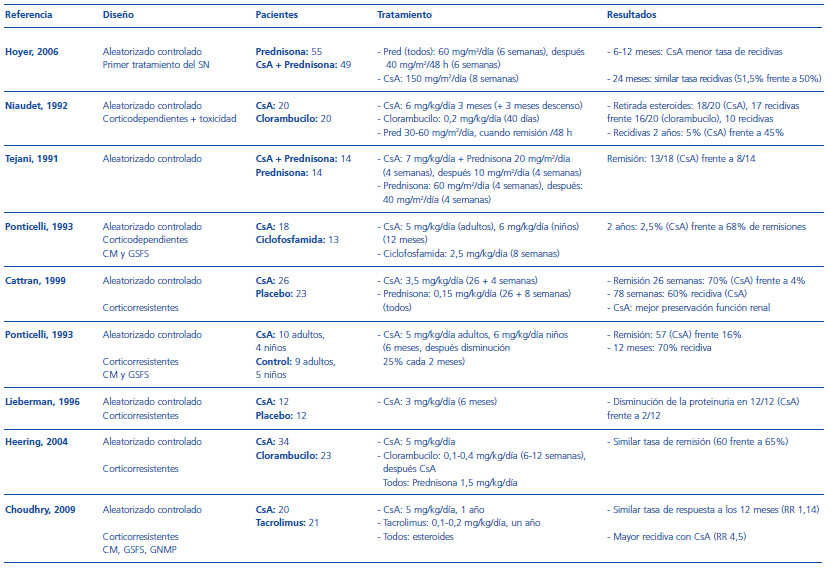
En 2006, Hoyer et al. compararon el tratamiento de inicio con esteroides en monoterapia (prednisona 60 mg/m2/día, 6 semanas, y después 40 mg/m2/48 h, 6 semanas) con el tratamiento con esteroides más CsA (igual pauta de prednisona y CsA 150 mg/m2/día, 8 semanas) en 104 niños con SN. A los 12 meses, los pacientes que recibieron monoterapia tuvieron más recidivas y más tempranas que los que recibieron la asociación (51 frente al 36,5%). Sin embargo, a los 24 meses esta tasa de recidiva se había igualado en ambos grupos (51 frente al 50%). No parece, por tanto, recomendable el tratamiento intensivo con CsA de inicio en todos los pacientes4.
Previamente, Tejani había descrito resultados más favorables en el grupo tratado con ciclosporina. En un estudio de 28 niños con síndrome nefrótico, 14 recibieron ci CsA en dosis bajas de prednisona y 14 prednisona en altas dosis. En el grupo de terapia combinada, 13 entraron en remisión frente a tan sólo ocho en el grupo de prednisona5.
El estudio de la Sociedad Francesa de Nefrología Pediátrica describe un estudio en el que 40 niños corticodependientes fueron distribuidos aleatoriamente a recibir tratamiento con CsA o clorambucilo. La dosis de CsA fue de 60 mg/kg/día, 12 semanas, y después fue retirada progresivamente en las siguientes 12 semanas. La dosis de clorambucilo fue de 0,2 mg/kg/día durante 40 días. La tasa de remisión fue similar en ambos grupos, sin embargo las recidivas fueron mayores en los niños que recibieron CsA. A los 2 años tan sólo el 5% de los niños tratados con CsA estaban en remisión frente al 45% del grupo tratado con clorambucilo6. Este trabajo apoya que los pacientes corticodependientes reciban tratamiento con fármacos citotóxicos. Los anticalcineurínicos quedarían reservados para los que mantengan la dependencia a pesar del tratamiento citotóxico.
Ponticelli et al. distribuyeron aleatoriamente a 73 pacientes (niños y adultos, con ECM y GSFS) con recidivas frecuentes o corticodependientes: 36 recibieron CsA (5 mg/kg/día, 9 meses) y 28 ciclofosfamida (2,5 mg/kg/día, 8 semanas), 7 pacientes se perdieron del estudio precozmente. A los 9 meses, 26/35 (74%) de los pacientes tratados con CsA y 18/28 (64%) de los tratados con clorambucilo estaban en remisión. Sin embargo, a los 2 años mantenían la remisión el 25% de los tratados con CsA frente al 63% de los que habían recibido ciclofosfamida7.
Recientemente ha sido publicado un estudio realizado en adultos con una primera recidiva de la ECM. Los pacientes fueron distribuidos aleatoriamente en dos grupos de tratamiento: 26 recibieron prednisona (1 mg/kg/día) y 26 CsA (C2: 600-800 ng/ml) + prednisona (0,8 mg/kg/día) durante 6 meses. En el grupo de CsA el tiempo hasta la remisión era más corto que en el otro grupo. La dosis de esteroides acumulada fue menor en el grupo de CsA. Sin embargo, en el trabajo no se describe la tasa de recidivas, que sabemos que es el problema que surge al retirar el tratamiento anticalcineurínico8.
El tratamiento con CsA ha demostrado una buena tasa de remisión en los pacientes con ECM, pero con una alta tasa de recidivas que, en muchos casos, se producen durante el período de disminución de la dosis. Existen experiencias de tratamiento con anticalcineurínicos durante largos períodos del tiempo. Husseini et al. describen la evolución de un grupo de 117 niños con SN (corticodependientes y corticorresistentes) que recibieron CsA durante más de 2 años. La dosis inicial fue de 5 mg/kg/día, para obtener niveles de 100-150 ng/ml los primeros 2 meses y después 50-100 ng/ml. Posteriormente hasta niveles de 30 ng/ml eran válidos si eran capaces de mantener la remisión. El 87% alcanzó remisión del SN (82% completa). En 102 pacientes se retiraron los esteroides, con recidiva del SN en 31 (30,4%). La CsA fue retirada a 29 pacientes y 22 de ellos (75%) presentaron recidiva de la enfermedad. De éstos, hubo 6 pacientes que no respondieron a un segundo ciclo de CsA. A pesar del largo período de tratamiento con un fármaco nefrotóxico, sólo el 6% desarrolló insuficiencia renal9.
Resultados parecidos se han descrito con el tratamiento con tacrolimus. Fueron tratados 19 pacientes con SN resistente a ciclofosfamida con la administración de prednisona y tacrolimus (niveles 5-10 ng/ml durante 24 semanas, y después niveles 3-6 ng/ml, 24 semanas). El 64,7% de los pacientes alcanzaron remisión completa (RC) y el 17,6% remisión parcial (RP). El 35% presentó recidiva con la disminución de la dosis o con la retirada del tacrolimus10.
Por tanto, los anticalcineurínicos son una buena alternativa a los casos de síndrome nefrótico por ECM corticodependiente. En el caso de dependencia, parece indicado intentar previamente un ciclo de esteroides más citostáticos, que ha demostrado ser superior a largo plazo a los anticalcineurínicos. Ambos (CsA y tacrolimus) son eficaces en este tratamiento, como se ha demostrado en múltiples estudios. Existe menor evidencia en el caso del tacrolimus, pero posiblemente su mayor potencia inmunosupresora, junto con su mejor perfil de tolerabilidad, lo conviertan en un fármaco indicado en el tratamiento de estas patologías.
La limitación de este tratamiento es la alta tasa de recidivas que se producen con la retirada del fármaco11. Varios autores han postulado que alargar el tratamiento, hasta incluso 2 años, mejora la tasa de recidiva, disminuyendo los casos de «ciclosporina-dependencia». La reducción progresiva de la dosis parece un factor añadido para alargar la duración de la remisión. Los niveles plasmáticos deben ser tan bajos como sea posible, cada paciente tendrá su nivel umbral de mantenimiento de la respuesta. En pacientes adultos, en los que la remisión depende de la CsA/tacrolimus, se puede controlar la proteinuria y evitar la nefrotoxicidad manteniendo una dosis por debajo de la inicial durante largos períodos de tiempo.
ANTICALCINEURÍNICOS EN LA GLOMERULOSCLEROSIS FOCAL Y SEGMENTARIA
La GSFS es una importante causa de SN en niños y adultos. Sin tratamiento, más del 50% de los pacientes con SN progresan a insuficiencia renal terminal en 5-10 años. Los esteroides inducen remisión en un número significativo de pacientes. En los adultos, se deben mantener al menos 6 meses antes de concluir que el paciente es corticorresistente. El tratamiento con fármacos citotóxicos en pacientes pediátricos está asociado con un 25% de RC y un 52% de resistencias.
El mayor nivel de evidencia del uso de anticalcineurínicos en la GSFS corticorresistente es el estudio de Cattran et al., en el que 49 pacientes fueron distribuidos aleatoriamente para recibir tratamiento con prednisona en dosis bajas y CsA durante 26 semanas frente a prednisona más placebo. El seguimiento fue de 200 semanas. A las 26 semanas, el 70% de los pacientes del grupo tratado con CsA había alcanzado la remisión frente al 4% en el grupo control. En la semana 78, el 60% de los pacientes que alcanzaron la remisión habían vuelto a recurrir. A pesar de la alta recidiva, el grupo de la CsA presentó una mejor preservación de la función renal al final del seguimiento12.
Ponticelli et al. describen en su estudio que 41 pacientes (adultos y niños) con SN corticorresistente fueron distribuidos aleatoriamente para recibir tratamiento con CsA (5 mg/kg/día en adultos y 6 mg/kg/día en niños, durante 6 meses y posteriormente, disminución de la dosis un 25% cada 2 meses hasta la suspensión) frente a tratamiento conservador. Durante el primer año, 13/22 pacientes con CsA estaban en remisión frente a 3/19 de los controles. Al final del primer año, sólo el 38% se mantenía en remisión13.
Otra experiencia en la bibliografía con casos de GSFS corticorresistente es el estudio de Liebermann et al., en el que 24 niños fueron distribuidos aleatoriamente a recibir tratamiento con CsA o placebo durante 6 meses. Los 12 pacientes tratados con CsA experimentaron disminución de la proteinuria (4 RC) frente a dos en el grupo control. No disponemos de datos de evolución a largo plazo o de recidivas14.
En otro estudio retrospectivo con 106 niños corticorresistentes (n = 45) o corticosensibles (n = 61) se evaluó la eficacia del tratamiento con CsA más prednisona tras un largo período de seguimiento. El tratamiento se mantuvo una media de 22 meses con unos niveles plasmáticos de 80-150 ng/ml. El 79% alcanzó la remisión y el 21% restante presentó resistencia al tratamiento. Los pacientes corticorresistentes presentaron a su vez mayor resistencia al tratamiento con CsA (67,6% de respuesta frente al 100% en los corticosensibles). En contraposición, el porcentaje de recidivas fue mayor en los corticodependientes que en los resistentes. Los efectos secundarios más frecuentes fueron los estéticos, un 12% presentó hipertensión arterial y un 6,6% aumento de la creatinina del 30%. No está definido si el deterioro de la función renal es secundario a la evolución de la enfermedad o a la nefrotoxicidad. Los esteroides fueron suspendidos en 91 pacientes, 31 de los cuales recidivaron. La CsA fue retirada a 20, 16 de ellos recurrieron en la enfermedad, y de éstos, 4 pacientes presentaron resistencia secundaria a la CsA15.
Resultados similares se han descrito en el tratamiento con tacrolimus. Gulati et al. describen la evolución de 22 casos de SN corticorresistente que recibieron tratamiento con tacrolimus (0,1 mg/kg/día, niveles plasmáticos 5-10 ng/ml) durante un año. El 84% alcanzó la RC y el 10% RP, 3 pacientes presentaron fracaso renal en la evolución, dos de ellos reversible, y uno irreversible por un síndrome hemolítico-urémico asociado al tacrolimus. Cuatro de los pacientes habían presentado previamente resistencia a la CsA, dos alcanzaron RC y uno RP con tacrolimus16.
Recientemente, se ha publicado un estudio aleatorizado prospectivo de tratamiento con tacrolimus, 21 pacientes (0,1-0,2 mg/kg/día) frente a CsA, 20 pacientes (5-6 mg/kg/día) en pacientes con SN corticorresistente. Los pacientes recibían, además, tratamiento con esteroides e IECA. La tasa de remisión a los 6 y 12 meses fue similar en ambos grupos (85,7% con tacrolimus y 80% con CsA). El tacrolimus mostró superioridad al reducir la tasa de recidivas (RR, 4,5; IC 95%, 1,1 a 18,2), un mejor perfil de seguridad con menor número de casos de nefrotoxicidad (4,7 frente al 10%) y un menor porcentaje de efectos adversos estéticos. El seguimiento de este grupo de pacientes es escaso por lo que es necesario valorar si esta mejor tasa de recidivas se mantiene en el tiempo17.
Duncan et al. muestran la efectividad del tacrolimus en monoterapia en 6 pacientes con diagnóstico de GSFS. Todos ellos presentaron remisión del SN sin ninguna recidiva, aunque continuaban recibiendo tacrolimus al final del seguimiento. En este mismo estudio, presentan a 5 pacientes CsA-dependientes que son convertidos a tratamiento con tacrolimus: todos mejoran el aclaramiento de creatinina, así como la caída del filtrado glomerular (–1,6 ± 0,7 ml/min/1,73 m2/mes a 0,3 ± 0,5 ml/min/1,73 m2/mes). A pesar de que todos estaban en remisión, se produce un descenso no significativo de la proteinuria18.
En el estudio de Segarra et al. se analizó la eficacia de tacrolimus y esteroides en el tratamiento de 25 casos de GSFS corticorresistentes y resistencia o dependencia a la CsA. A los 2 años de seguimiento, el beneficio de este tratamiento sólo es evidente en los pacientes con resistencia secundaria (aparece tras una respuesta inicial) a la CsA y en una minoría de pacientes resistentes desde el inicio a la CsA. Sin embargo no aporta ningún beneficio en los casos dependientes ya que en éstos se puede mantener la remisión con tratamiento prolongado con CsA19.
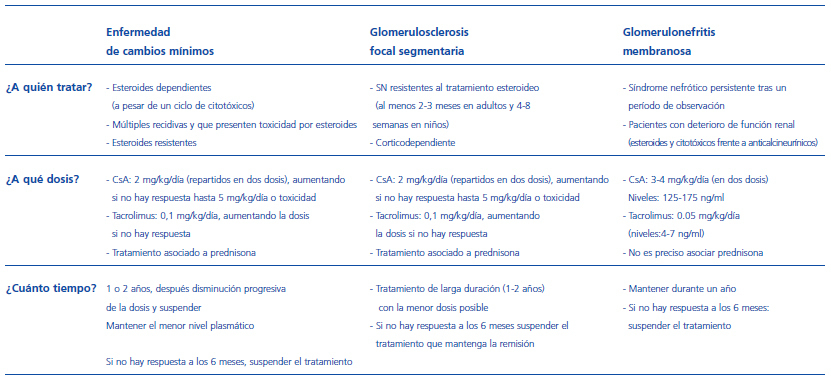
Por tanto, la terapia con anticalcineurínicos en la GSFS estaría indicada en los casos de corticodependencia o resistencia (tabla 2). Los casos dependientes van a tener una mejor respuesta a este tratamiento, pero en la mayoría se producirá una recidiva de la proteinuria al suspen derlo, convirtiéndose en «anticalcineurín-dependientes». Por este motivo, los tratamientos deben ser largos, al menos de un año, y en muchos casos con dependencia habrá que mantenerlo durante largos períodos de tiempo. El descenso lento de la dosis antes de la retirada se ha asociado con una menor tasa de recidivas. Para evitar la nefrotoxicidad, es obligatorio un seguimiento periódico y cuidadoso de la función renal y de los niveles sanguíneos de los fármacos. La dosis óptima será la mínima que mantenga al paciente en remisión.
Aunque existe un trabajo en el que se objetiva respuesta al tratamiento con tacrolimus sin necesidad de añadir esteroides18, de momento esta evidencia es escasa, por lo que los anticalcineurínicos en la GSFS deben ir asociados a tratamiento esteroideo.
El tacrolimus aporta beneficios por su mayor potencia con respecto a la CsA en los casos resistentes a ésta, pero no parece que aporte mejora en los pacientes dependientes.
En uno de los trabajos parece que se asocia a una menor tasa de recidiva, pero el seguimiento de este grupo es corto, por lo que habrá que esperar nuevos estudios con mayor seguimiento para concluir si el tacrolimus es superior a la CsA en el control de la reaparición del síndrome nefrótico.
ANTICALCINEURÍNICOS EN LA GLOMERULONEFRITIS MEMBRANOSA
La GM es la causa más frecuente de SN en los adultos. En un 30% de los casos se produce remisión espontánea del SN y en el 40-50%, deterioro progresivo de la función renal. Los esteroides en monoterapia no han demostrado que mejoren la supervivencia renal de la GM. Los ciclos de 6 meses de citotóxicos (ciclofosfamida o clorambucilo) más esteroides han demostrado una reducción de la proteinuria y de la progresión de la enfermedad renal.
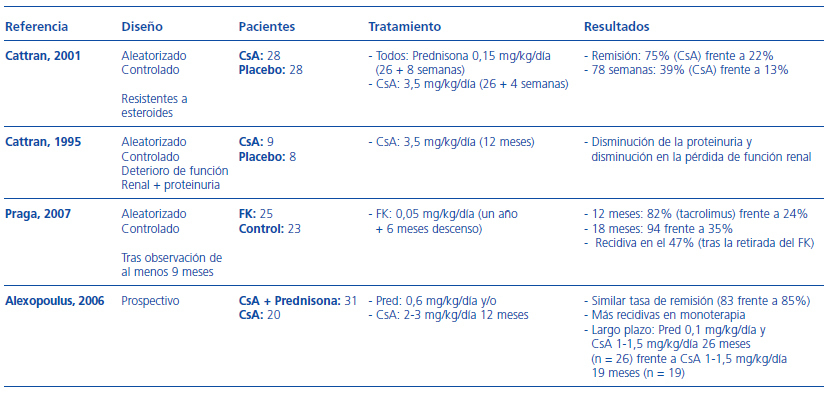
Cattran et al., en 2001, mostraron la eficacia de la CsA en 51 pacientes con enfermedad resistente a esteroides y distribuidos aleatoriamente a recibir tratamiento con CsA (3,5 mg/kg/día durante 26 semanas y descenso lento hasta la suspensión en 4 semanas) o placebo. Todos los pacientes recibían, además, esteroides en dosis de 0,15 mg/kg/día. El 75% de los pacientes incluidos en el grupo de CsA alcanzó la remisión de la enfermedad frente al 22% del grupo control. Al final de un seguimiento de 78 semanas, el 39% de los pacientes del grupo de tratamiento se mantenía en remisión frente al 13% del grupo placebo. El aumento de la presión arterial fue mayor en el grupo tratado con CsA20.
Los anticalcineurínicos también se han usado en pacientes de alto riesgo. En un estudio aleatorizado controlado de pacientes con insuficiencia renal y proteinuria fueron tratados con CsA (3,8 mg/kg/día) (n = 9) frente a placebo (n = 8) durante 12 meses. Los tratados presentaron disminución en la proteinuria, así como enlentecimiento en la progresión a la insuficiencia renal. Estos buenos resultados se mantuvieron en el tiempo hasta 2 años después de finalizado el tratamiento21.
El tacrolimus también ha demostrado ser efectivo en esta enfermedad, incluso en monoterapia sin esteroides. En el ensayo prospectivo aleatorizado de Praga et al., con 48 pacientes diagnosticados de GM con un período previo de observación de al menos 6 meses, 25 pacientes recibieron tratamiento con tacrolimus (0,05 mg/kg/día durante 12 meses con descenso progresivo y retirada en los 6 meses sucesivos) y 23 pacientes formaron el grupo control. A los 12 meses, el 82% de los pacientes con tratamiento estaba en remisión frente al 24% en el grupo control. A los 18 meses, este porcentaje aumentó hasta el 94 frente al 35%. Ningún paciente presentó recidiva durante el período de descenso del tacrolimus. Después de la suspensión del tacrolimus, el SN reapareció en 9 de los 19 pacientes en remisión (47%)22. Es importante destacar el hecho de que los pacientes presenten esta buena tasa de respuesta sin necesidad de asociar tratamiento esteroideo, evitando así todos los efectos secundarios asociados a su uso.
Alexopoulos et al., en un grupo de pacientes (n = 51) que recibió tratamiento prolongado, más de 12 meses, con dosis bajas de CsA, mostraron que es efectivo para mantener la remisión. Las recidivas ocurrieron más frecuentemente en pacientes con niveles bajos de CsA23.
El porcentaje de RC alcanzadas aumenta conforme se incrementa la duración del tratamiento24. La mayoría de las RC aparecen a partir del sexto mes de tratamiento. El número de efectos adversos ocurridos no se relaciona con la duración del tratamiento.
En resumen, los anticalcineurínicos son fármacos útiles para el tratamiento de la GM (tabla 3). En un 60-70% de los casos consiguen una remisión, parcial o completa, de la enfermedad. El tiempo medio para alcanzar esta disminución de la proteinuria es de alrededor de 3 meses. No obstante, son necesarios estudios a más largo plazo para evaluar las recidivas que se producen al retirar el tratamiento e investigar nuevas alternativas a esta alta tasa de recidivas. En el estudio de Ballarín et al. de pacientes tratados con esteroides y tacrolimus hay un 73,3% de recidivas al año de finalizado el tratamiento25.
Este tratamiento es eficaz en pacientes con función renal normal, aunque existe un estudio con distribución aleatoria que demuestra su efectividad en pacientes con insuficiencia renal. Ésta, por tanto, podría ser una alternativa menos tóxica al ciclo de esteroides y citostáticos en pacientes con insuficiencia renal. En este grupo de pacientes es especialmente importante el manejo cuidadoso del fármaco, con evaluación constante de las posibles causas de deterioro de la función renal (nefrotoxicidad frente a progresión de la enfermedad).
USO DE ANTICALCINEURÍNICOS EN LAS GLOMERULONEFRITIS SECUNDARIAS
Los anticalcineurínicos no forman parte de los esquemas terapéuticos habituales de las GN secundarias de origen inmunológico, si bien han sido considerados como agentes alternativos tanto en fase de inducción como de mantenimiento en algunas de ellas.
Lupus eritematoso sistémico
La CsA/tacrolimus se suelen considerar un tratamiento de segunda línea para pacientes resistentes/intolerantes a la terapia convencional (ciclosfosfamida frente a micofenolato) o para aquellos con recaídas frecuentes. La publicación en los últimos meses de dos ensayos clínicos aleatorizados, en los que el uso de tacrolimus en triple terapia (asociado a prednisona y micofenolato) como tratamiento de inducción de la GN lúpica membranosa consiguió mayor un número de remisiones que el tratamiento convencional, ha abierto nuevos horizontes al empleo de este grupo farmacológico en el LES.
Nefropatías lúpicas proliferativas
La mayor experiencia en el uso de anticalcineurínicos en las formas proliferativas de LES se encuentra en la población pediátrica. La especial repercusión de la toxicidad de los fármacos habituales (prednisona-ciclofosfamida) en este grupo de población ha obligado a buscar alternativas que no interfieran en el adecuado desarrollo óseo, ni en la capacidad reproductora
. Fu et al.26 realizaron un ensayo clínico aleatorizado en niños con nefropatía lúpica tipo III-V con persistencia de SN tras administrar prednisona en altas dosis. Los pacientes recibieron CsA en monoterapia (5 mg/kg/día), con ajustes posteriores para conseguir niveles séricos de 75-150 ng/ml frente a prednisona + ciclofosfamida (2 mg/kg/día) durante un año. Ambos grupos consiguieron reducir la proteinuria por debajo de 0,5 g/día, sin que se modificara la función renal de forma significativa. El grupo de CsA consiguió mejorar su curva de crecimiento, no así la segunda pauta.
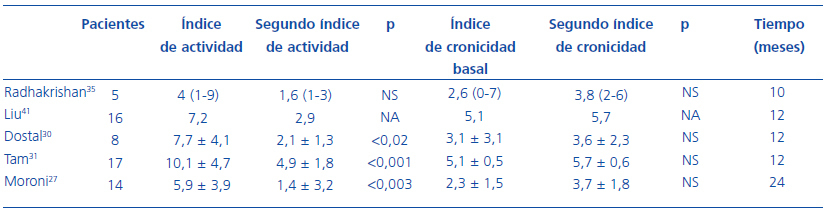
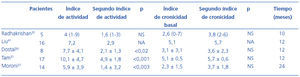
Un grupo de nefrólogos y reumatólogos italianos han publicado recientemente otro ensayo clínico, esta vez en adultos con nefropatía lúpica proliferativa difusa27. En la fase de inducción, todos los pacientes recibieron prednisona + ciclofosfamida. En la de mantenimiento fueron aleatorizados para recibir prednisona + CsA (n = 36) o prednisona + azatioprina (n = 33). El tratamiento se mantuvo durante 4 años, siendo la variable principal de valoración la incidencia de recaídas: siete ocurrieron en el grupo tratado con CsA y ocho en el grupo tratado con azatioprina. Al final del seguimiento, la proteinuria descendió en ambos grupos, aunque el número de pacientes con proteinuria indetectable fue significativamente mayor en el grupo tratado con CsA (42 frente al 15%). No hubo cambios en el filtrado glomerular en ninguno de los dos grupos. Cinco pacientes de cada grupo de tratamiento fueron retirados del estudio por efectos secundarios. La leucopenia y la infección fueron más frecuentes en los tratados con azatioprina, mientras que las artralgias y las alteraciones gastrointestinales lo fueron en los que recibieron CsA. Se realizó biopsia de control a los 2 años de tratamiento a 14 enfermos asignados al grupo de CsA y a 15 del grupo de azatioprina. El índice de actividad decreció de 5,9 ± 3,9 a 1,4 ± 3,2 en el grupo de CsA y de 7,4 ± 4,2 a 0,5 ± 1,3 en el grupo de azatioprina. El índice de cronicidad pasó de 2,3 ± 1,5 a 3,7 ± 1,8 en el grupo CsA y de 1,7 ± 2 a 3,1 ± 2,1 en el grupo de azatioprina.
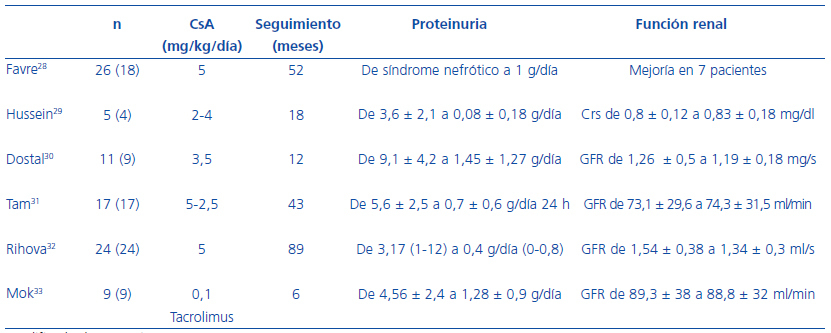
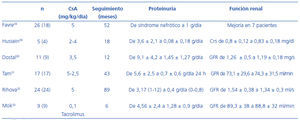
Resultados similares se han observado en otros estudios no controlados28-33 (tabla 5). La CsA demostró poseer un importante efecto antiproteinúrico, con capacidad para conseguir remisiones (parciales o completas) cercanas al 90%. Estos datos son especialmente relevantes, considerando las bajas dosis empleadas. Por todo ello, los anticalcineurínicos son una opción a considerar en nefritis lúpicas proliferativas con mala respuesta a la medicación estándar.
Nefropatía lúpica membranosa
Los datos actuales indican que la CsA y el tacrolimus son efectivos para inducir una RC o RP en pacientes con glomerulonefritis membranosa idiopática (60-75%)22. Por ello, cabría la posibilidad de considerar estos fármacos como una posibilidad terapéutica razonable para la nefropatía lúpica membranosa. Actualmente existen pocos estudios referentes a este tipo histológico. Tres pequeños estudios retrospectivos35- 37 analizan el papel de la CsA para esta patología. Los pacientes fueron tratados con CsA en una dosis inicial de 4-5 mg/kg/día y seguidos durante 17- 36 meses. Aproximadamente el 90% respondió al tratamiento (RC o RP) y la proteinuria se redujo de 5-6 a 0,3-1,4 g/día. Un leve ascenso de creatinina fue observado en 2 estudios35,36.
El único ensayo clínico aleatorizado limitado a pacientes con nefritis lúpica pura, realizado por el National Institutes of Health (NIH) estadounidense, mostró una eficacia equivalente de la pauta de ciclofosfamida + prednisona (6 meses) cuando se comparó con CsA + prednisona (12 meses)38. Hubo una tendencia a un mayor porcentaje de remisión en la CsA (83 frente al 60% en un año), aunque las recaídas durante 10 años de seguimiento fue significativamente más elevadas en el grupo tratado con CsA. No hubo diferencias en el filtrado glomerular estimado medio respecto al valor basal para ninguno de los dos grupos.
Considerando este estudio, la elección entre ciclofosfamida y CsA dependerá del perfil del paciente y del balance riesgo-beneficio.
Los pacientes con nefropatía lúpica membranosa y lesiones proliferativas son de especial mal pronóstico, con bajas tasas de respuesta al tratamiento convencional y peor pronóstico a largo plazo. En un estudio de 85 pacientes con nefritis lúpica proliferativa, aquellos con este subtipo histológico, cuando se compararon con pacientes con nefritis lúpicas proliferativas puras, tuvieron una menor probabilidad de remisión (27 frente al 60%) y una peor supervivencia renal a los 10 años (50 frente al 75%)39.
Los pacientes con este tipo de lesión histológica podrían responder mejor a la terapia de inducción combinada de mofetil micofenolato (MMF) y anticalcineurínicos. Así se sugiere en un pequeño ensayo clínico en el que se incluyen 40 pacientes con nefritis lúpica tipo IV+V40. Los pacientes fueron distribuidos aleatoriamente a recibir tacrolimus, MMF frente a ciclofosfamida (i.v.) durante 6 meses, y el tratamiento pudo prolongarse a 9 meses si no habían alcanzado RC. Las dosis de MMF y tacrolimus fueron ajustadas por el área bajo la curva de una a 12 horas y niveles séricos (5-7 ng/ml), respectivamente. Todos los pacientes recibieron prednisona: 3 bolos de 500 mg/día seguidos de prednisona oral 0,6-0,8 mg/kg/día durante 4 semanas, con lento descenso posterior hasta una dosis de mantenimiento de 10 mg/día. Alcanzaron la RC el 50 y el 65%, a los 6 y 9 meses, respectivamente, de los pacientes tratados con triple terapia frente al 5 y 15% de los tratados con doble. La RP ocurrió en el 40% a los 6 meses en ambos grupos, y en el 30 y 40% a los 9 meses para los tratados con doble frente a triple terapia. Nueve pacientes de los tratados con triple terapia y 6 pacientes de los tratados con doble firmaron el consentimiento informado para realizar una segunda biopsia renal después de haber completado el tratamiento de inducción. En ninguna biopsia se encontraron datos de nefrotoxicidad por tacrolimus. El índice de actividad descendió de 10,6 ± 5,0 a 3,7 ± 2,1 (p <0,001) entre los pacientes que alcanzaron la RC, mientras que no se modificó en los que no la alcanzaron. El principal punto débil de este estudio es el escaso tiempo de seguimiento, que no permite aclarar la eficacia y la seguridad a largo plazo de esta pauta.
Este ensayo clínico crea un importante precedente en la terapéutica de la nefropatía lúpica: frente al tratamiento siempre formulado en dual se plantea la posibilidad del tratamiento triple en semejanza al tratamiento del trasplante. Sería muy interesante poder estudiar esta vía en futuros ensayos clínicos, con los objetivos de mejorar el número de RC y anticipar la consecución de éstas. En la tabla 6 se recogen datos de varios estudios en relación a las modificaciones sobre el índice de actividad y de cronicidad en las biopsia renales tras tratamiento con CsA. El índice de actividad disminuyó en todos los estudios mientras que hubo un leve, aunque no significativo, incremento en el índice de cronicidad y no se documentó ningún caso de nefropatía por CsA severa.
Vasculitis asociadas a ANCA positivos
La utilización de anticalcineurínicos se ha sugerido como tratamiento de mantenimiento alternativo en las vasculitis asociadas a anticuerpos anticitoplasma de neutrófilo (ANCA) positivos con recaídas frecuentes. Existe evidencia de que, además de contribuir a la producción de autoanticuerpos, las células T desempeñan un papel importante en la patogenia de este tipo de vasculitis. Se han descrito niveles elevados del receptor soluble de la IL-2 como marcador de actividad de células T en pacientes con recaídas frecuentes con granulomatosis de Wegener42. A partir de estos supuestos, se realizó un estudio prospectivo en 7 pacientes con vasculitis que hubieran tenido recaídas previas. Recibieron tratamiento de mantenimiento con CsA + prednisona durante 18 meses y el seguimiento se prolon- gó 6 meses más. En este tiempo, ningún paciente tuvo una recaída. Los títulos de ANCA se redujeron en 5 pacientes, y dos los mantuvieron estables43.
Frente a estos resultados, otro ensayo clínico describió una elevada probabilidad de recaídas en pacientes tratados con CsA frente a los que recibieron ciclofosfamida44. Además, se ha descrito como hallazgo clínico la elevada incidencia de recaídas en pacientes trasplantados con granulomatosis de Wegener y tratados con anticalcineurínicos. En la actualidad, sólo se plantea el tratamiento con anticalcineurínicos como segunda o tercera opción para este tipo de vasculitis.
CONCLUSIONES
Los anticalcineurínicos son útiles para el tratamiento de las glomerulonefritis que cursan con SN. Han demostrado su eficacia en los casos de SN por ECM y GSFS en niños y adultos. Su inicio estaría indicado en pacientes corticodependientes o corticorresistentes. La dosis diana debe ser siempre la menor que sea capaz de mantener al paciente en remisión. El tratamiento debe ser prolongado, más de un año, con una disminución muy lenta de la dosis. El mayor problema es la alta tasa de recidivas al retirar el tratamiento. En estos pacientes, se deberá valorar el mantenimiento del tratamiento durante largos períodos con niveles lo más bajos posible.
En la GM su uso estaría dirigido a pacientes con SN mantenido en el tiempo y función renal estable. Aunque en uno de los trabajos se administra a pacientes con deterioro de la función renal, no existe suficiente evidencia para recomendarlo en pacientes con fracaso renal agudo secundario a la GM. En esta entidad, el uso de estos fármacos no es preciso que vaya asociado al tratamiento esteroideo. La respuesta al tratamiento es algo más tardía que en el caso de la ECM. El problema de la recidiva con la retirada del fármaco será similar a las dos entidades anteriores. Es, por tanto, necesario buscar nuevas estrategias para poder realizar la retirada del fármaco sin que ello conlleve una alta probabilidad de recidiva.
Los resultados disponibles en el lupus sugieren que hay que tener en cuenta la posibilidad de administrar anticalcineurínicos en estos pacientes cuando presentan proteinuria persistente a pesar del tratamiento inductor iniciado o intolerante a otros fármacos inmunosupresores. La posibilidad de administrar tratamiento con triple terapia debe ser estudiada en futuros ensayos clínicos. Tanto la CsA como el tacrolimus son fármacos eficaces en el tratamiento del SN. El tacrolimus es útil en casos de resistencia al tratamiento con CsA. Con respecto a los efectos secundarios, aparte de los efectos estéticos, el perfil es similar en ambos. La elección inicial de uno u otro debe ir, en parte, condicionada por la experiencia del nefrólogo en el manejo de los mismos. Es preciso realizar un control estrecho de los niveles plasmáticos y tener conocimiento de los efectos secundarios asociados para modificar el tratamiento cuando sea necesario.
Puntos clave
1. Los anticalcineurínicos son fármacos inmunosupresores que inhiben la calcineurina. Producen una disminución en la producción de citoquinas encargadas de la activación de la célula T.
2. Los anticalcineurínicos son fármacos útiles en el tratamiento del síndrome nefrótico, tanto de niños como de adultos. Existe amplia experiencia de uso en estas entidades. Son fármacos seguros con escasos efectos secundarios.
3. Existe evidencia para usarlos tras un ciclo de agentes citotóxicos en la ECM corticodependiente, en los casos de corticorresistencia o dependencia en la GSFS y como primera opción en la GNM (en monoterapia). La mayoría de estos SN van a responder al tratamiento.
4. El tratamiento se debe mantener al menos un año. La retirada debe ser siempre gradual.
5. En caso de «anticalcineurina dependencia» se debe mantener el tratamiento en la dosis más baja posible que mantenga la remisión para evitar la nefrotoxicidad. Es obligada la monitorización periódica de los niveles de fármacos.
6. Los anticalcineurínicos son útiles en caso de lupus con proteinuria persistente a pesar del tratamiento inductor. Está pendiente de estudiar la posibilidad de tratamiento con triple terapia (esteroides, micofenolato y anticalcineurínicos) en estos pacientes.
Tabla 1. Efectos secundarios de los anticalcineurínicos
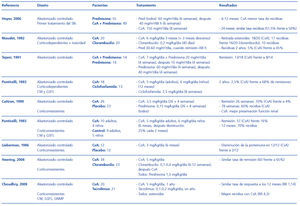
Tabla 2. Principales estudios con anticalcineurínicos en la enfermedad de cambios mínimos y glomerulosclerosis focal y segmentaria
Tabla 3. Principales estudios con anticalcineurínicos en la glomerulonefritis membranosa
Tabla 4. Cómo usar los anticalcineurínicos en el síndrome nefrótico
Tabla 5. Impacto del tratamiento con anticalcineurínicos en la proteinuria y la función renal en pacientes con nefropatía lúpica
Tabla 6. Modificaciones del índice de actividad y cronicidad en biopsias renales repetidas tras tratamiento con ciclosporina A