La ciclofosfamida se utiliza como inmunosupresor en las enfermedades glomerulares desde hace más de 50 años. A lo largo de este tiempo se han ampliado sus indicaciones, se ha modificado su vía de administración, se han empleado dosis más adecuadas y se han prevenido muchos de sus efectos tóxicos. Este aprendizaje ha durado más de lo esperado pero ha colocado al fármaco a la altura de otros de su categoría, aportando su eficacia y seguridad, sobre todo, en estudios retrospectivos, resistiendo el empuje de las nuevas terapias en muchos estudios comparativos y, en definitiva, contribuyendo a la supervivencia renal y de los pacientes. Todavía hoy es un fármaco de primera línea en estos procesos.
INTRODUCCIÓN
La ciclofosfamida es un citostático químicamente perteneciente a las mostazas nitrogenadas. Altera los mecanismos fundamentales del crecimiento celular en cualquier fase del ciclo celular y, por su mecanismo de acción, está encuadrado en el grupo de los agentes alquilantes. Su actividad citotóxica deriva de la gran afinidad que muestra por el ADN y las proteínas, a los que adicionan sus radicales altamente reactivos, formando puentes intercatenarios e intracatenarios en la doble hélice del ADN (alquilación), impidiendo así la replicación del ADN y la transcripción del ARN. El sistema hematopoyético es muy susceptible a sus efectos y los linfocitos son particularmente sensibles a su acción, lo que explicaría su actividad inmunosupresora.
La ciclofosfamida se absorbe bien por vía oral (biodisponibilidad >75%), se metaboliza en el hígado, se une a proteínas (15% y sus metabolitos hasta en un 60%), atraviesa la placenta y la barrera hematoencefálica, inicia su acción en 7-21 días y tiene una vida media de entre 3 y 12 horas, excretándose fundamentalmente por el riñón como metabolitos (85- 90%) y un 10-15% con las heces de forma inalterada1.
DOSIS Y VÍA DE ADMINISTRACIÓN
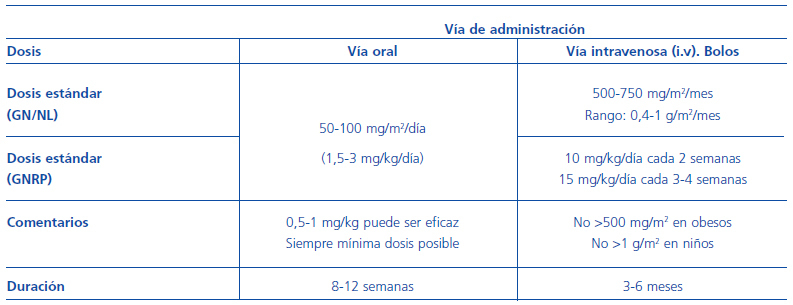
Éste es un apartado extremadamente importante debido a su potencial toxicidad (tabla 1). En cualquier caso, se recomienda hidratar convenientemente al paciente y utilizar quelantes de sus metabolitos tóxicos para evitar la toxicidad vesical, así como pautar antiserotoninérgicos sobre la motilidad intestinal para evitar náuseas y vómitos.
Ajuste de dosis
Al pautar la dosis de ciclofosfamida se deberán tener en cuenta la edad del paciente, el grado de función renal y hepática y la cifra de leucocitos en sangre periférica (tabla 2).
Efectos adversos e interacciones farmacológicas
Los efectos adversos más frecuentes (en más del 10% de los casos) son alopecia (50% reversible), esterilidad (puede ser irreversible), amenorrea, trastornos digestivos transitorios (náuseas, vómitos, diarrea, mucositis, anorexia), cistitis aguda hemorrágica, trastornos hematológicos (fundamentalmente trombocitopenia y anemia, especialmente si se asocia a alopurinol, y generalmente reversibles). Otros son menos frecuentes: sofocación, cefalea, dermatitis, síndrome de secreción inadecuada de hormona antidiurética (SIADH), necrosis tubular aguda, congestión nasal, insuficiencia cardíaca, fibrosis pulmonar, colitis hemorrágica, infecciones y cáncer por la inmunosupresión, etc.2. La ciclofosfamida es un profármaco que se activa en el hígado y, por tanto, algunos inductores o inhibidores hepáticos son susceptibles de aumentar o disminuir su acción y/o toxicidad. No debe usarse en el embarazo ya que es teratógena (al menos cuando se utiliza en el primer trimestre) y se secreta con la leche materna. Está encuadrada en la categoría D de la FDA (riesgo demostrado, evitarlos si existe otra alternativa).
GLOMERULONEFRITIS PRIMARIAS
Alrededor de 1950 la perspectiva del tratamiento de las glomerulonefritis (GN) era desalentadora. La aplicación de ensayos aleatorizados y controlados hizo que se adoptaran algunas formas de tratamiento seguras y efectivas, rechazándose otras como ineficaces o peligrosas y así, enfermedades asociadas con pésimos resultados se transformaban en procesos manejables3. A principios de la década de 1990 se publicó una revisión sistemática que comprendía el análisis de los estudios controlados publicados desde 1966 con inmunosupresores en las GN. De los 34 estudios identificados, sólo 27 tenían un diseño prospectivo y aleatorizado, pero aun así sus autores dieron unas pinceladas sobre la intención de tratar estas enfermedades: esteroides o ciclosporina en la nefropatía de cambios mínimos (CM), clorambucilo en la glomerulosclerosis focal y segmentaria, esteroides y clorambucilo en la GN membranosa, ausencia de terapia documentada frente a la nefropatía IgA y la GN membranoproliferativa y la aceptación del tratamiento combinado con ciclofosfamida y prednisona con/sin plasmaféresis en el tratamiento de la GN rápidamente progresiva, aunque no había estudios controlados4. Hoy día se acepta el uso generalizado de la ciclofosfamida sobre el clorambucilo por la menor incidencia de efectos adversos5.
NEFROPATÍA DE CAMBIOS MÍNIMOS
El tratamiento de elección son los esteroides, pero hasta en un 20-25% el síndrome nefrótico es resistente a esteroides. La ciclofosfamida se usa en recidivas frecuentes (tres o más por año), generalmente tras la remisión con esteroides, y en corticodependencia (quizá de más difícil manejo) asociada a dosis bajas de esteroides6 y, aunque la remisión puede ocurrir en el 90-95% de los pacientes, se necesita tratamiento durante más de 16 semanas7, logrando remisiones incluso más estables que con ciclosporina, aunque ambos tratamientos son efectivos y bien tolerados, como demuestra un estudio abierto, prospec- tivo, aleatorizado, controlado y estratificado para adultos y niños8. En otros estudios, no obstante, el beneficio de la ciclosporina parece más evidente, como en este estudio retrospectivo realizado en niños que expone su experiencia con el tratamiento del síndrome nefrótico resistente o dependiente de esteroides desde 1989 hasta 20069.
GLOMERULOSCLEROSIS SEGMENTARIA Y FOCAL
Hasta un 30% tienen base genética y ausencia de efecto al tratamiento inmunosupresor. Si tras 16 semanas de tratamiento con esteroides hay ausencia de respuesta, se habla de corticorresistencia que, en principio, se trata igual que la corticodependencia, aunque algunos autores creen que la resistencia a los esteroides es también un índice de resistencia a los agentes alquilantes10. La alta tasa de pacientes que desarrollaban enfermedad renal crónica terminal justificaba las pautas combinadas con esteroides e inmunosupresores. En muchos casos, no se encontraban beneficios sobre la monoterapia con esteroides11, y en otros sí12. Otros autores, no obstante, ofrecen más garantías con la ciclosporina13.
GLOMERULONEFRITIS MEMBRANOSA
El curso variable de esta entidad condiciona su tratamiento, ya que hay que tener en cuenta la tendencia a la remisión espontánea y el riesgo teórico de progresión a enfermedad renal crónica de cada paciente14. Sin embargo, un reciente estudio multicéntrico de nuestro grupo observó un alto índice de remisiones espontáneas de la enfermedad incluso en casos de proteinurias masivas15. Varios autores han publicado excelentes resultados con ciclofosfamida y clorambucilo asociados a los esteroides, como el grupo de Ponticelli16 y otros, en ensayos prospectivos de largo seguimiento, como en este comparativo con un grupo histórico control en que la función renal mejoró o se estabilizó en todos los pacientes, aunque con frecuentes efectos adversos y una alta tasa de recidivas17. Y en pacientes con insuficiencia renal, como en un estudio controlado y aleatorizado con una alta tasa de remisión a los 6 meses, en el que se detuvo la enfermedad renal y mejoró la calidad de vida18. La importancia de los efectos adversos justifica las variaciones en la dosis, pudiéndose minimizar de forma eficaz contrarrestando la toxicidad del fármaco19, y en la pauta de administración, sin encontrar diferencias entre la vía oral y la vía i.v.20. En los últimos años se han publicado estudios comparativos con otros fármacos. Un estudio con micofenolato mofetilo (MMF) durante 12 meses ha comparado sus resultados con unos controles históricos con ciclofosfamida, concluyendo que MMF puede ser una alternativa válida, aunque el índice de recidivas y la tasa de remisiones fue superior21, o con tacrolimus convirtiéndolo actualmente en tratamiento de primera línea por no decir de elección22. No obstante, se ha constatado que con la ciclofosfamida se ha descrito una reducción del 70% en la incidencia de enfermedad renal terminal23.
NEFROPATÍA IgA
Una cuarta parte de los pacientes con proteinuria persistente, hipertensión arterial (HTA) e insuficiencia renal progresan a enfermedad renal terminal a los 20 años del diagnóstico. Estos pacientes y aquellos que desarrollan una proliferación extracapilar en la biopsia podrían beneficiarse del tratamiento inmunosupresor24, y deberían tratarse como las GN rápidamente progresivas idiopáticas, con bolos de metilprednisolona y prednisona oral, ciclofosfamida oral o i.v. con/sin plasmaféresis. La ausencia de consenso en la utilización del tratamiento inmunosupresor viene dada por la casi inexistencia de estudios controlados aleatorizados. Recientemente se publicó un estudio retrospectivo con dosis bajas de esteroides y ciclofosfamida y suspensión de ésta a los 6 meses, que reveló un mejor pronóstico renal que el grupo control y con escasos efectos adversos25, que confirmaba los resultados de un trabajo prospectivo y abierto, con bolos de esteroides y ciclofosfamida durante 6 meses en 20 pacientes con nefropatía IgA y al menos un 10% de semilunas o proliferación endocapilar en la biopsia renal, en el que mejoró la función renal y se redujo el grado de proteinuria y la incidencia de enfermedad renal crónica terminal a 36 meses26. En otro estudio, prospectivo y aleatorizado, con 38 pacientes con insuficiencia renal pero sin daño crónico significativo y sin semilunas en la biopsia, en el que un grupo quedaba sin tratamiento específico y el otro recibía la pauta clásica (esteroides y ciclofosfamida/azatioprina), hizo reconsiderar la actitud conservadora sobre la enfermedad, ya que hubo una baja incidencia de efectos adversos, disminución de la proteinuria, estabilización de la función renal y mejora de la supervivencia renal en comparación con el grupo control27.
GLOMERULONEFRITIS MEMBRANOPROLIFERATIVA (GNMP)
Muy pocas evidencias se pueden encontrar sobre el tratamiento con ciclofosfamida en esta patología, con resultados a veces contradictorios y escasa frecuencia de estudios. En el ámbito de la pediatría, se ha publicado hace poco un estudio retrospectivo con 47 niños con GNMP tipo I entre 1971 y 2001, con una media de seguimiento de 3 años, en el que se observó una menor probabilidad de fallo renal con esteroides, mientras que los resultados no eran buenos si se utilizaba ciclofosfamida28.
GLOMERULONEFRITIS RÁPIDAMENTE PROGRESIVA (GNRP)
Debido al alto riesgo de progresión a enfermedad renal terminal, se recomienda un tratamiento empírico y agresivo que incluya bolos de metilprednisolona, esteroides orales, ciclofosfamida oral o i.v., plasmaféresis (en enfermedad por anticuerpos anti-MBG, hemoptisis o insuficiencia renal grave29) y una duración indefinida del tratamiento de mantenimiento con esteroides orales y ciclofosfamida/ azatioprina30 o incluso MMF.
NEFRITIS LÚPICA
La idea de que el tratamiento combinado (esteroides y citotóxicos) mejoraba el pronóstico de la nefritis lúpica (NL) se empieza a plasmar en la década de 1970 a raíz de los trabajos del National Health Institute (NHI)31. A principios de la década de 1990 quedaba demostrado que la ciclofosfamida intravenosa era el mejor tratamiento para prevenir la progresión de la enfermedad renal crónica en pacientes con NL, y que presentaba igual eficacia y menor toxicidad que la administración oral32. Nadie dudaba de la necesidad de un tratamiento de mantenimiento tras la terapia de inducción en la NL y a raíz de un trabajo del NIH se instauró la pauta de ciclofosfamida en bolos cuatrimestrales durante 3 años dado que las recidivas de la enfermedad eran un fuerte predictor de mal pronóstico renal a largo plazo33. Los esfuerzos de los investigadores se centraban en conseguir pautas de inmunosupresión que permitiesen reducir los efectos adversos con igual o mayor eficacia inmunosupresora. Un estudio europeo del grupo Euro-lupus demostró que dosis más bajas de ciclofosfamida eran equivalentes y menos tóxicas34 o que el cambio a azatioprina de mantenimiento tras la inducción con ciclofosfamida y esteroides era seguro y eficaz35. Finalizando el siglo XX, aparecen los primeros estudios en NL con MMF, un citostático selectivo sobre linfocitos, que iba a robar protagonismo a la ciclofosfamida, considerando que su utilización con esteroides era tan efectiva como las pautas inmunosupresoras utilizadas hasta entonces36. Aparecieron los primeros estudios comparativos entre MMF y ciclofosfamida intravenosa, aunque la idea más generalizada es realizar la inducción con ciclofosfamida intravenosa y esteroides y, posteriormente, usar azatioprina o MMF en mantenimiento, con una tasa de infecciones menor y una mayor tasa de supervivencia libre de recidivas37. En 2004 se publicó una revisión sistemática de la colaboración Cochrane. Tras revisar 920 artículos, se efectuó un metaanálisis con 25 artículos anteriores a enero de 2003 en los que se estudiaban 915 pacientes. Sus autores concluyeron que la combinación de ciclofosfamida y esteroides era la mejor opción para preservar la función renal en los pacientes con NL38. Otro estudio, de mayor seguimiento para comparar en inducción ciclofosfamida y MMF, apareció un año después. Con una media de seguimiento de algo más de 5 años, se demostró la eficacia y seguridad de MMF en la inducción y el manteni- miento frente a una pauta de ciclofosfamida seguida de azatioprina, en ambos casos con esteroides39. Aparece un nuevo concepto: ciclofosfamida y MMF son equiparables en inducción en la NL, exceptuando las formas graves con insuficiencia renal en las que se prefiere ciclofosfamida40. Otro metaanálisis con 5 ensayos clínicos aleatorizados y 307 pacientes de Medline, EMBASE y Cochrane Collaboration Database muestra que MMF es tan eficaz en la inducción de remisión como los bolos de ciclofosfamida pero con menos efectos adversos41. Se observa también que a pesar de la progresiva reducción de las dosis de ciclofosfamida, intravenosa en el tratamiento de la NL, debido a la gran sensibilidad de los autores europeos, los resultados siguen siendo satisfactorios42. Recientemente se han publicado resultados del estudio ALMS (Aspreva Lupus Management Study), trabajo aleatorizado que compara MMF y ciclofosfamida en inducción y mantenimiento, sin encontrar diferencias entre ambos grupos de tratamiento en cuanto a eficacia y seguridad y, aunque la mayoría de los pacientes mejoraron clínicamente, no se pudo demostrar la superioridad del MMF sobre la ciclofosfamida43. Y es que la ciclofosfamida, lejos de pasar a un segundo plano en el tratamiento de esta patología, se ha adaptado a las necesidades y sigue siendo un fármaco primordial en la NL.
Nefritis lúpica membranosa
La nefritis lúpica membranosa (NLM) representa, aproximadamente, un 20% de las biopsias de NL y tiene unas consideraciones especiales, con una relativa baja tasa de progresión a enfermedad renal terminal pero una alta tasa de comorbilidades. Una vez asumido que los esteroides en monoterapia no tienen influencia en la proteinuria ni en la función renal44, y los consabidos problemas de nefrotoxicidad y un número no despreciable de recidivas al suspender la ciclosporina45, algunos trabajos se han decantado con éxito por la azatioprina asociada a esteroides46 o por el MMF47. En los últimos 2 años se han publicado algunos estudios con la ciclofosfamida como protagonista. En un ensayo prospectivo y aleatorizado con 40 pacientes con NL clase IV+V se dividía a los pacientes en dos grupos en inducción: en uno recibían esteroides, MMF y tacrolimus (multiterapia) y en el otro esteroides y ciclofosfamida intravenosa. El grupo de multiterapia presentó más remisiones y menos efectos adversos48. En otro estudio, sus autores compararon de manera prospectiva, controlada y aleatorizada una monoterapia con esteroides (grupo control) con una combinación de esteroides y ciclosporina durante 11 meses, o esteroides y 6 bolos i.v. a meses alternos de ciclofosfamida. Al año, la probablidad de remisión con prednisona en monoterapia era del 27%, con ciclofosfamida i.v. del 60% y con CsA del 83%. Las recidivas eran más frecuentes tras abandonar la ciclosporina. Los autores concluyen que las pautas con ciclosporina o ciclofosfamida i.v. son más efectivas que la monoterapia con esteroides en reducir la proteinuria en los pacientes con NLM49. En cualquier caso, quedaba demostrada la eficacia de la ciclofosfamida en la NLM, pudiendo indicarse en esta patología si el clínico lo estima conveniente. Por último, cabe destacar un metaanálisis publicado en 2010 tras una excelente revisión sistemática de estudios aleatorizados y controlados que englobaba a 84 pacientes con NLM durante 24 semanas con MMF o ciclofosfamida, en el que no se encontraron diferencias entre ambos grupos, poniendo de relieve la utilidad de la ciclofosfamida en el momento actual50.
Puntos clave
1. A la hora de pautar ciclofosfamida, hay que individualizar la dosis e intentar minimizarla en lo posible.
2. En general, la vía intravenosa en forma de bolos (quincenales o mensuales) es preferible a la vía oral por eficacia y seguridad.
3. La ciclofosfamida es un fármaco de primera línea en el síndrome nefrótico córtico-dependiente y en los casos de frecuentes recidivas.
4. La ciclofosfamida, en terapia combinada con esteroides, es el fármaco de elección hoy día en la glomerulonefritis rápidamente progresiva con formación de semilunas.
5. La ciclofosfamida es, junto a los derivados del ácido micofenólico, y en combinación con esteroides, el tratamiento de elección en inducción de la nefritis lúpica proliferativa y puede ser muy útil en la nefritis lúpica membranosa.
CONCLUSIONES
Tras más de 50 años de experiencia, la ciclofosfamida sigue siendo un fármaco de primera línea en muchas enfermedades renales. Desde muy temprano, se comprobó su eficacia, aumentando la supervivencia renal y de los pacientes. Una vez que los investigadores adaptaron la dosis y la vía de administración a las distintas patologías, se redujeron sus efectos adversos, mejorando la calidad de vida de los pacientes. Hoy en día es un fármaco de uso habitual en muchas nefropatías, como primera indicación o en casos resistentes a otras terapias, desde la GN extracapilar y la nefritis lúpica hasta el síndrome nefrótico por cambios mínimos de los niños.
Tabla 1. Ciclofosfamida: dosis y vía de administración
Tabla 2. Ciclofosfamida: ajuste de dosis