Las terapias de reemplazo renal (TRR) para el abordaje del fracaso renal agudo (FRA) de los pacientes inestables en la unidad de cuidados intensivos (UCI) se han convertido en una medida rutinaria e imprescindible para su manejo de tal manera que, tanto la hemodiálisis intermitente (HD), como las formas híbridas (HD extendida) o continuas (TRR continua) pueden emplearse indistintamente en estos enfermos. Con esta revisión pretendemos resumir de forma ordenada la evidencia disponible en cuanto a indicación, selección de modalidad, momento de inicio, dosificación y aspectos técnicos de las TRR.
Hemos realizado una revisión narrativa a partir de las guías vigentes, documentos de consenso de los principales grupos de trabajo y últimos ensayos clínicos relevantes sobre la TRR.
En nuestra revisión no hemos encontrado evidencia de que ninguna modalidad de TRR prescrita en pacientes en UCI obtenga beneficios tangibles en términos de supervivencia, estancia en UCI/hospitalización ni recuperación de la función renal; a pesar de su optimización en cuanto a indicaciones, selección de modalidad, momento y/o intensidad de inicio de la técnica. Es más, en la literatura actual todavía existe controversia sobre la superioridad de una modalidad de TRR sobre otra ya que, sólo en los pacientes post- quirúrgicos hemodinámicamente inestables se ha podido demostrar un beneficio al emplearse una TRR continua de alto flujo e inicio precoz frente a una HD.
Con la evidencia actual pormenorizada en nuestra revisión pretendemos poner de manifiesto la tendencia actual al manejo multidisciplinar por intensivistas y nefrólogos de estas terapias en UCI, lo cual podría reportar beneficios en la evolución clínica de los enfermos críticos y dar cabida a que el punto de vista del nefrólogo se tuviera en cuenta de manera rutinaria en la toma de decisiones sobre el estado hemodinámico, las condiciones médicas coexistentes, la disponibilidad recursos y el posible efecto sobre la función renal a largo plazo a la hora de seleccionar y gestionar los problemas de cada modalidad de TRR seleccionada.
Renal replacement therapies (RRT) as support for acute kidney injury in critically ill patients have become a routine and essential practice in their management, resulting in the widespread use of various techniques among these patients, such as intermittent hemodialysis (IHD), extended hemodialysis and continuous RRT (CRRT).
In this review we aim to summarize current evidence of indication, choice of modality, timing of initiation, dosing and technical aspects of RRT. We carried out a narrative review based on guidelines, consensus documents by main working groups and the latest relevant clinical trials on RRT in the critically ill.
We did not find enough evidence of any RRT modality having superior benefits in terms of patient survival, length of intensive care unit/hospital stay or renal outcomes among critically ill patients, in spite of optimization of clinical indication, modality, timing of initiation and intensity of initial therapy. This is still a controverted matter, since only early start of high-flux CRRT has been proven beneficial over IHD among hemodynamically unstable postoperative patients.
Our objective is to portrait current RRT practices in multidisciplinary management of critically ill patients by intensive care and nephrology professionals. Implication of a nephrologist in the assessment of hemodynamic status, coexisting medical conditions, renal outcome expectations and management of resources could potentially have benefits at the time of RRT selection and troubleshooting.
El fracaso renal agudo (FRA) es un trastorno heterogéneo muy común en los enfermos críticos hospitalizados en las unidades de cuidados intensivos (UCI) que asocia una importante morbimortalidad a corto y largo plazo1. Muchos autores proponen la prevención como el mejor tratamiento, optimizando el estado de hidratación, la homeostasis electrolítica y evitando el uso de nefrotóxicos1,2. Aproximadamente el 5-10% de los pacientes con FRA establecido requieren terapia de reemplazo renal (TRR) durante su estancia en la UCI. Estudios realizados por los servicios de medicina intensiva españoles3,4 estiman una prevalencia de FRA en la UCI del 42,4%, con necesidad de TRR en el 38% de los casos y una mortalidad asociada del 29,7%. Sin embargo, hay mucha variabilidad entre estudios por las diferencias en el perfil de pacientes (UCI médicas y quirúrgicas), las definiciones de FRA y las múltiples modalidades de tratamiento2.
Los factores de riesgo para el uso de TRR incluyen edad avanzada, sexo masculino, gravedad de la enfermedad de base, sepsis, insuficiencia cardíaca descompensada, cirugía cardíaca, insuficiencia hepática y el uso de ventilación mecánica5. La indicación de TRR aumenta un 10% al año, quizás por una evolución en el perfil de paciente crítico que cada vez es más añoso, comórbido y sometido a cirugías complejas5. Por todo ello, la TRR, antes considerada una medida extraordinaria en la UCI para pacientes con necesidad de diálisis e inestabilidad hemodinámica, se ha convertido en una técnica rutinaria en el abordaje de estos enfermos.
Los nefrólogos españoles estuvieron muy implicados en los inicios del TRR en las UCI de muchos hospitales, desarrollando adaptaciones técnicas a partir de su experiencia en la hemodiálisis intermitente (HD) convencional. Sin embargo, el manejo de las TRR continuas ha ido desapareciendo del currículo básico de la formación del nefrólogo medio. Solo 4 de los 24 servicios de nefrología de nuestra comunidad autónoma continúan implicados en el manejo completo del FRA en la UCI. En el resto se produce un seguimiento secuencial en el que las TRR continuas dependen de los intensivistas, y en el que el nefrólogo comienza a intervenir cuando el paciente cambia a HD o pasa a la planta convencional. La mayoría de los estudios, revisiones y experiencia reciente sobre los aspectos fundamentales de las TRR proceden del trabajo diario del anestesiólogo o intensivista. Sin embargo, los grupos de trabajo de las sociedades científicas en este campo sí que integran expertos intensivistas y nefrólogos6,7.
Estudios recientes publicados en nuestro país recomiendan una estrecha vigilancia preventiva y un enfoque conjunto de nefroprotección del paciente crítico con comorbilidad asociada8. Parece interesante diseñar protocolos conjuntos que anticipen la intervención del nefrólogo en el proceso completo de seguimiento desde la prevención, TRR en UCI, hasta la eventual diálisis convencional y seguimiento en planta y hasta la recuperación de función renal.
Con esta revisión pretendemos resumir la evidencia disponible y proporcionar una visión multidisciplinar del manejo del paciente crítico sometido a TRR continuas y/o HD que sirva de guía al nefrólogo de a pie. Intentaremos aclarar a quién tratar, cuándo comenzar, qué pauta o modalidad es superior y cómo desescalar el tratamiento.
Hemos realizado una revisión narrativa a partir de las de las guías vigentes, documentos de consenso de los principales grupos de trabajo y los últimos ensayos clínicos relevantes sobre la TRR en UCI. Realizamos una búsqueda bibliográfica de términos MesH [Acute Kidney Injury] and [Critical Care] en MEDLINE OVID SP, EMBASE OVID SP y PUBMED seleccionando los ensayos clínicos y revisiones entre 2009 y 2019. Además, se consultó la Cochrane Kidney and Transplant Specialised Register, Cochrane Central Register of Controlled Trials (CENTRAL).
Selección de la modalidad de terapia de reemplazo renal (qué)Existe controversia sobre cuál es la modalidad óptima de TRR para pacientes con FRA en UCI. La selección de la modalidad inicial se basa con frecuencia en la disponibilidad de recursos, experiencia de cada centro y en la tolerancia condicionada por el estado hemodinámico del paciente. Por otro lado, las transiciones entre diversas modalidades son frecuentes debido a los cambios en la situación clínica del paciente y a las complicaciones específicas de la técnica como la coagulación del sistema.
Las guías Kidney Disease: Improving Global Outcomes (KDIGO)6 recomiendan las siguientes modalidades de TRR en el paciente crítico: HD, TRR continuas y terapias intermitentes prolongadas (un híbrido de las anteriores). El Acute Disease Quality Initiative (ADQI) Workgroup7 insiste en que es importante conocer los mecanismos funcionales de cada técnica que definen sus ventajas e inconvenientes para su utilización en cada momento.
Al prescribir una HD conseguimos un rápido aclaramiento difusivo de moléculas de pequeño tamaño con tratamientos relativamente breves (de 3-5h), condicionando la tasa de ultrafiltración (UF) a la tolerancia hemodinámica del paciente. Con las TRR continuas proporcionaríamos una eliminación más gradual de fluidos y solutos mediante aclaramiento convectivo de moléculas de mayor tamaño durante un tiempo más prolongado (óptimamente 24h al día). Las modalidades híbridas de HD se caracterizan por tratamientos que generalmente duran entre 8-16h, con velocidades de UF y aclaramiento intermedias6–9.
Por lo tanto, las ventajas teóricas de la TRR continua sobre la HD se basan en su funcionamiento lento y progresivo, que conllevaría mayor estabilidad hemodinámica, mejor control del equilibrio hidroelectrolítico, mejoría en la microcirculación por la eliminación preferente de líquido intersticial, flexibilidad para adaptar el tratamiento a las necesidades puntuales del paciente en cada momento y fácil monitorización clínica de la terapia. Los inconvenientes incluyen la necesidad de inmovilización y un incremento del coste frente a la HD. La hipotermia, otra de las clásicas desventajas con importantes riesgos sobreañadidos para el paciente (pérdida de energía, escalofríos, incremento de la demanda de oxígeno, vasoconstricción, inmunosupresión, arritmias, disminución de la contractilidad cardiaca, hipoxia tisular y alteraciones de la coagulación) puede ser subsanada hoy en día con la utilización de sistemas de control de temperatura, como calentadores de líneas o mantas de aire7–9.
Al contrario, la mayor eficacia depurativa de la HD la hace más recomendable para casos de hipercalcemia o hiperpotasemia severa, algunas intoxicaciones agudas y síndromes de lisis tumoral. Su corta duración permite disponer de tiempo para la movilización y rehabilitación precoz, así como para realizar otras intervenciones diagnósticas y terapéuticas sin necesidad de interrumpir la terapia7–9.
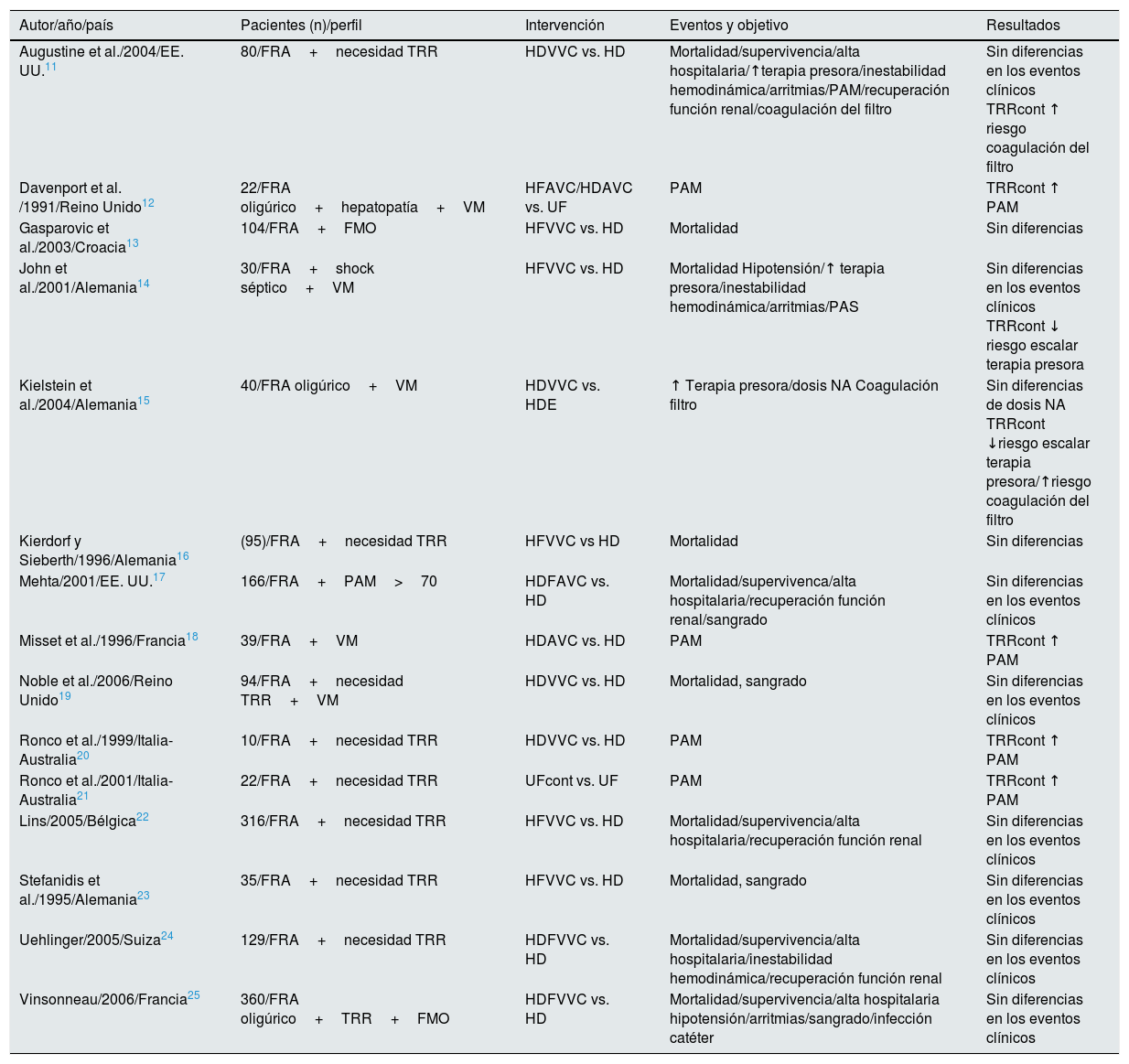
Sin embargo, la revisión sistemática publicada por la Cochrane Library en 200710 no es capaz de demostrar ventajas significativas para ninguna de ellas tras agrupar los 15 ensayos clínicos aleatorizados (RCT) disponibles en ese momento11–25 (tabla 1). Los autores concluyeron que ninguna de las 2 técnicas (HD o TRR continuas) es superior a la otra en riesgo de mortalidad en UCI/hospitalización, tiempo de estancia en UCI/hospitalización, recuperación de la función renal posterior al FRA y/o estabilidad cardiovascular (definida por hipotensión, presión arterial sistólica, dosis de fármacos inotrópicos y riesgo de sangrado). Es más, se evidencia una mayor tendencia a la coagulación de filtros en los tratados con TRR continuas. Estos estudios tienen algunas limitaciones para su integración en un metaanálisis, ya que no se emplean las mismas definiciones de FRA, hay una alta tasa de intercambio entre modalidades de TRR y existen diferencias en aspectos técnicos, como el tipo y la dosis de anticoagulación del sistema.
Comparativa de ensayos clínicos aleatorizados para mortalidad
| Autor/año/país | Pacientes (n)/perfil | Intervención | Eventos y objetivo | Resultados |
|---|---|---|---|---|
| Augustine et al./2004/EE. UU.11 | 80/FRA+necesidad TRR | HDVVC vs. HD | Mortalidad/supervivencia/alta hospitalaria/↑terapia presora/inestabilidad hemodinámica/arritmias/PAM/recuperación función renal/coagulación del filtro | Sin diferencias en los eventos clínicos TRRcont ↑ riesgo coagulación del filtro |
| Davenport et al. /1991/Reino Unido12 | 22/FRA oligúrico+hepatopatía+VM | HFAVC/HDAVC vs. UF | PAM | TRRcont ↑ PAM |
| Gasparovic et al./2003/Croacia13 | 104/FRA+FMO | HFVVC vs. HD | Mortalidad | Sin diferencias |
| John et al./2001/Alemania14 | 30/FRA+shock séptico+VM | HFVVC vs. HD | Mortalidad Hipotensión/↑ terapia presora/inestabilidad hemodinámica/arritmias/PAS | Sin diferencias en los eventos clínicos TRRcont ↓ riesgo escalar terapia presora |
| Kielstein et al./2004/Alemania15 | 40/FRA oligúrico+VM | HDVVC vs. HDE | ↑ Terapia presora/dosis NA Coagulación filtro | Sin diferencias de dosis NA TRRcont ↓riesgo escalar terapia presora/↑riesgo coagulación del filtro |
| Kierdorf y Sieberth/1996/Alemania16 | (95)/FRA+necesidad TRR | HFVVC vs HD | Mortalidad | Sin diferencias |
| Mehta/2001/EE. UU.17 | 166/FRA+PAM>70 | HDFAVC vs. HD | Mortalidad/supervivenca/alta hospitalaria/recuperación función renal/sangrado | Sin diferencias en los eventos clínicos |
| Misset et al./1996/Francia18 | 39/FRA+VM | HDAVC vs. HD | PAM | TRRcont ↑ PAM |
| Noble et al./2006/Reino Unido19 | 94/FRA+necesidad TRR+VM | HDVVC vs. HD | Mortalidad, sangrado | Sin diferencias en los eventos clínicos |
| Ronco et al./1999/Italia-Australia20 | 10/FRA+necesidad TRR | HDVVC vs. HD | PAM | TRRcont ↑ PAM |
| Ronco et al./2001/Italia-Australia21 | 22/FRA+necesidad TRR | UFcont vs. UF | PAM | TRRcont ↑ PAM |
| Lins/2005/Bélgica22 | 316/FRA+necesidad TRR | HFVVC vs. HD | Mortalidad/supervivencia/alta hospitalaria/recuperación función renal | Sin diferencias en los eventos clínicos |
| Stefanidis et al./1995/Alemania23 | 35/FRA+necesidad TRR | HFVVC vs. HD | Mortalidad, sangrado | Sin diferencias en los eventos clínicos |
| Uehlinger/2005/Suiza24 | 129/FRA+necesidad TRR | HDFVVC vs. HD | Mortalidad/supervivencia/alta hospitalaria/inestabilidad hemodinámica/recuperación función renal | Sin diferencias en los eventos clínicos |
| Vinsonneau/2006/Francia25 | 360/FRA oligúrico+TRR+FMO | HDFVVC vs. HD | Mortalidad/supervivencia/alta hospitalaria hipotensión/arritmias/sangrado/infección catéter | Sin diferencias en los eventos clínicos |
FRA: fracaso renal agudo; FMO: fracaso multiorgánico; HD: hemodiálisis intermitente; HDAVC: hemodiálisis arteriovenosa continua; HDVVC: hemodiálisis venovenosa continua; HDFAVC: hemodiafiltración arteriovenosa continua; HFAVC: hemofiltración arteriovenosa continua; HFVVC: hemofiltración vevovenosa continua; NA: noradrenalina; PAM: presión arterial media; PAS: presión arterial media; TRR: terapia de reemplazo renal; TRRcont: terapia de reemplazo renal continua; UF: hemofiltración intermitente; UF cont: hemofiltración lenta continua; VM: ventilación mecánica.
Fuente: Cochrane Library 200710.
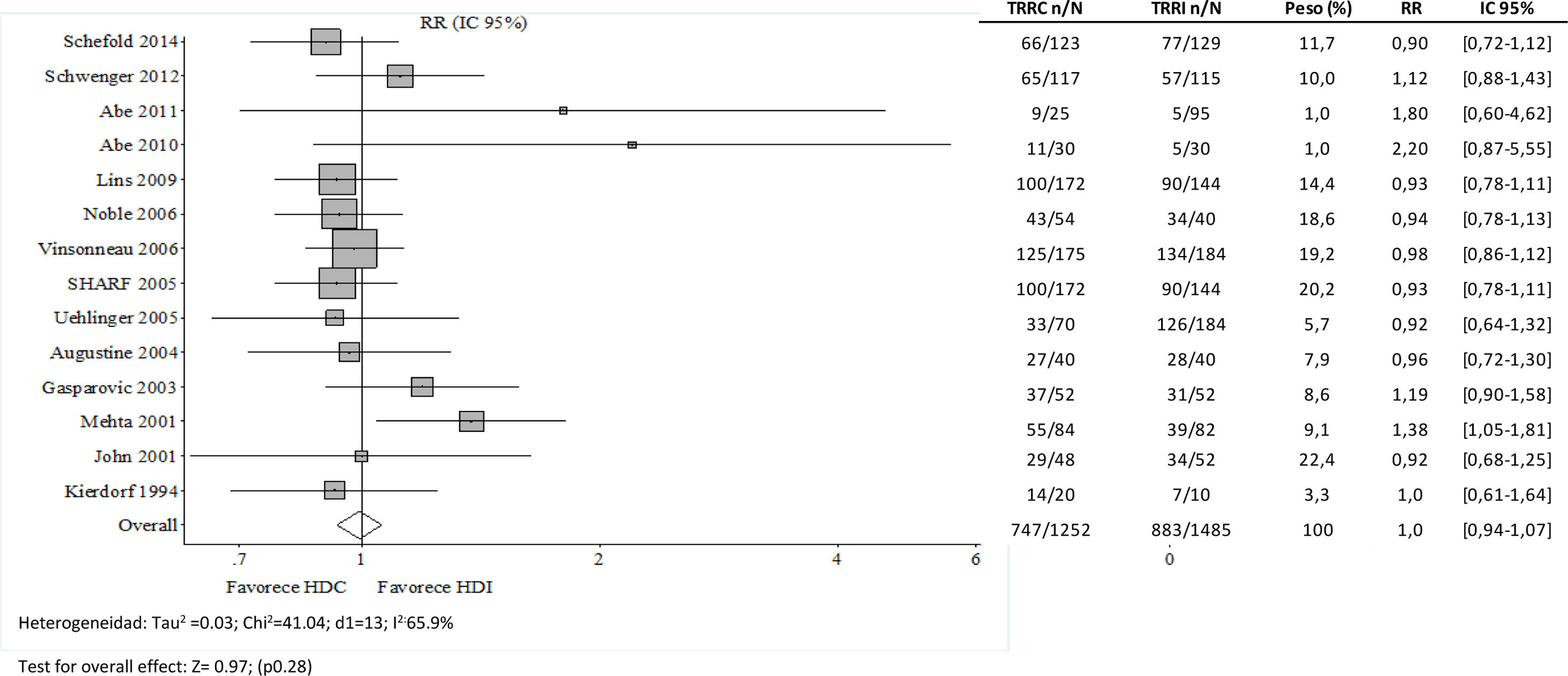
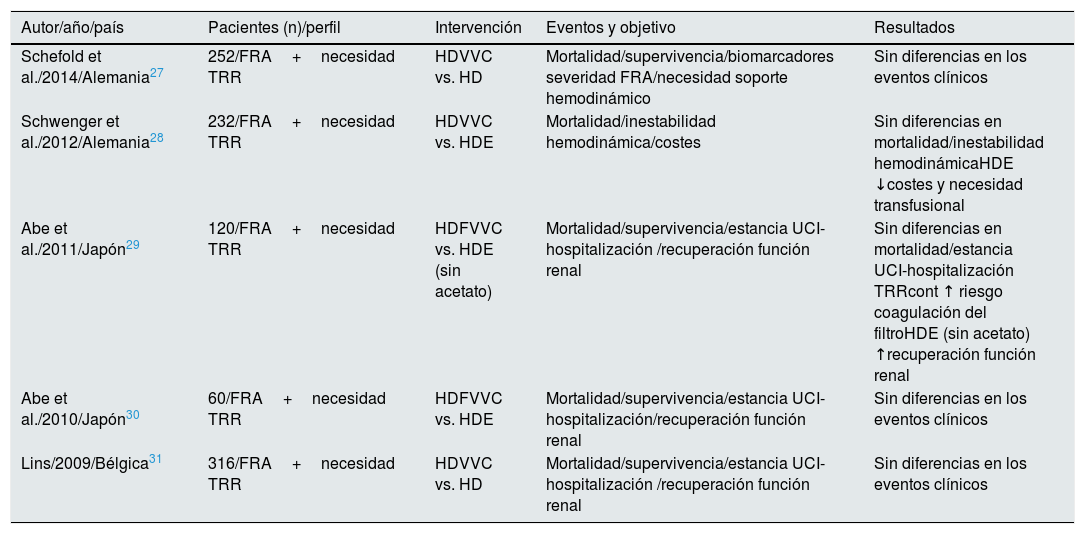
Podría pensarse que los RCT anteriormente recogidos en la tabla 1 (previos a 2008) no reflejan los avances técnicos ni el perfil actual del paciente crítico con FRA. Por ello, hemos integrado dichos estudios con los publicados por Schoenfelder et al.26 en 2017 (tabla 2). Como puede verse en la figura 1, los 5 RCT27–31 añadidos en el nuevo metaanálisis llegan a la misma conclusión, y no se observa una tendencia favorable respecto a los más antiguos. Sin embargo, los estudios observacionales recogidos en este mismo trabajo sí apuntan a que la TRR continua es más efectiva que la HD para lograr un balance hídrico negativo bien tolerado32,33, mejorando el soporte hemodinámico y ampliando la indicación de TRR en el paciente crítico.
Comparativa de ensayos clínicos aleatorizados
| Autor/año/país | Pacientes (n)/perfil | Intervención | Eventos y objetivo | Resultados |
|---|---|---|---|---|
| Schefold et al./2014/Alemania27 | 252/FRA+necesidad TRR | HDVVC vs. HD | Mortalidad/supervivencia/biomarcadores severidad FRA/necesidad soporte hemodinámico | Sin diferencias en los eventos clínicos |
| Schwenger et al./2012/Alemania28 | 232/FRA+necesidad TRR | HDVVC vs. HDE | Mortalidad/inestabilidad hemodinámica/costes | Sin diferencias en mortalidad/inestabilidad hemodinámicaHDE ↓costes y necesidad transfusional |
| Abe et al./2011/Japón29 | 120/FRA+necesidad TRR | HDFVVC vs. HDE (sin acetato) | Mortalidad/supervivencia/estancia UCI-hospitalización /recuperación función renal | Sin diferencias en mortalidad/estancia UCI-hospitalización TRRcont ↑ riesgo coagulación del filtroHDE (sin acetato) ↑recuperación función renal |
| Abe et al./2010/Japón30 | 60/FRA+necesidad TRR | HDFVVC vs. HDE | Mortalidad/supervivencia/estancia UCI-hospitalización/recuperación función renal | Sin diferencias en los eventos clínicos |
| Lins/2009/Bélgica31 | 316/FRA+necesidad TRR | HDVVC vs. HD | Mortalidad/supervivencia/estancia UCI-hospitalización /recuperación función renal | Sin diferencias en los eventos clínicos |
FRA: fracaso renal agudo; HD: hemodiálisis intermitente; HDE: hemodiálisis extendida; HDVVC: hemodiálsis venovenosa continua; HDFVVC: hemodiafiltración venovenosa continua; HFVVC: hemofiltración venovenosa continua; TRR: terapia de reemplazo renal; TRRcont: terapia de reemplazo renal continua; UCI: unidad de cuidados intensivos.
Forest plot de estudios de intervención que comparan hemodiálisis continua (HDC) vs hemodiálisis (HD) en cuanto al riesgo de mortalidad (Integrado de Cochrane 2007 y Schoenfelder 2017)
Pie: HDC: hemodiálisis continua; HDI: hemodiálisis intermitente; TRRC: terapia reemplazo renal continua; TRRI: terapia de reemplazo renal intermitente; RR: riesgo relativo; IC: Intervalo de Confianza 95%.
Otra estrategia potencial futura a considerar a la hora de optimizar el manejo de fluidos y mantener la estabilidad hemodinámica en los pacientes con TRR sería la propuesta por Tumlin et al. en su publicación en 201834, donde se evidencia que con la estrategia de tratamiento vasoactivo con angiotensina ii se conseguiría mejorar la recuperación de la función renal y limitar la necesidad de TRR a largo plazo en el enfermo crítico con FRA. Dicha publicación se ha visto recientemente reforzada tras la aprobación por parte de la Food and Drug Administration35 de la prescripción de la angiotensina ii en el tratamiento del shock distributivo, ya que su administración ha demostrado un aumento de la presión arterial media en dichos pacientes con menos efectos deletéreos (como la retención de agua a nivel renal), en comparación con gran variedad de otros vasopresores con poder modulador del sistema simpático y efecto directo vasoconstrictor sobre el músculo liso (dopamina, felinefrina y vasopresina).
En la misma línea Nash et al.36 publican en 2017 otro metaanálisis que analiza la evolución de pacientes críticos con FRA, sometidos a 3 tipos de técnicas: TRR continua, HD extendida y HD convencional. Los autores no encuentran ventajas significativas para ninguna de ellas ni en mortalidad intrahospitalaria, ni en duración del ingreso. Es probable que las 3 puedan estar más indicadas en una u otra fase de la evolución del paciente. Sería preciso buscar un diseño específico que incluya la secuencia temporal de uso de las TRR y con un seguimiento más largo que analice el efecto más allá del ingreso, incluso el seguimiento ambulatorio a medio plazo en la recuperación de la función renal y la dependencia de diálisis.
Ninguna de estas nuevas evidencias nos permite recomendar un único tipo de TRR para todos los pacientes críticos con necesidad de TRR, y no podemos ir más allá de lo recomendado por las guías KDIGO6, el documento de consenso del grupo ADQI7 y las guías de la Sociedad Española de Nefrología37. Los clínicos deben conocer los pros y los contras de cada técnica y adaptarla de forma dinámica en función de las características clínicas del individuo, el tipo de FRA, sus causas potencialmente reversibles, los recursos de su centro (incluyendo disponibilidad y coste) y la experiencia disponible38. En este escenario los nefrólogos podríamos contribuir a la detección precoz de daño renal, la estratificación de riesgo, la prevención nefroprotectora y una secuencia de TRR adecuada a cada caso, tal y como se recomienda en las guías National Institute for Health and Care Excellence39.
Indicaciones de la terapia de reemplazo renal (a quién)Los niveles de creatinina y el filtrado glomerular se consideran cruciales para definir la severidad del FRA y la necesidad de iniciar la TRR. Inicialmente, la Conferencia de Consenso del grupo ADQI en 200440 definió el método Risk Injury Failure (RIFLE) con 3 niveles de disfunción renal aguda basado en el incremento de Cr y la reducción de diuresis. Esta clasificación se ha visto superada tras la publicación del consenso entre intensivistas y nefrólogos del Acute Kidney Injury Network (AKIN)41, que se ha impuesto por tener mayor especificidad que el RIFLE.
Los pacientes con FRA pueden desarrollar sobrecarga de volumen, alteraciones electrolíticas, acidosis metabólica y/o síntomas urémicos debido a la reducción del filtrado glomerular1. En esos 3 pilares se basa la indicación del TRR.
Es frecuente que pacientes no oligúricos puedan presentar una sobrecarga de volumen por la incapacidad del riñón para eliminar el aporte masivo de sueroterapia, nutrición parenteral, hemoderivados y medicamentos intravenosos requeridos en la situación crítica. No existe un umbral de hipervolemia que determine el inicio de la TRR, pero varios estudios observacionales encuentran asociación entre la cuantía de la sobrecarga de volumen al inicio de la TRR y la mortalidad en la UCI42,43, por lo que muchos recomiendan iniciar la TRR en situaciones de sobrecarga refractaria a diuréticos que comprometa la función de un órgano vital (aumento de poscarga cardiaca, ascitis, distrés respiratorio o aumento de presión intrarrenal).
El efecto de la tasa de UF en la supervivencia de los pacientes críticos sometidos a HDFVVC es controvertido. La UF lenta mantiene más tiempo la situación de edema y disfunción tisular, pero una extracción rápida de líquido constituye un estrés difícil de compensar por el paciente crítico. Si bien algunos estudios promulgan tasas elevadas>25ml/kg/día para una mejor recuperación del paciente44, otros encuentran el resultado contrario. Por ejemplo, en el subanálisis por tertiles del estudio RENAL realizado sobre 1.434 pacientes de 34 UCI se demostró que el riesgo de mortalidad a 90 días era superior en aquellos que recibieron una UF de 1,75ml/kg/h que los que recibieron 1,01ml/kg/h (es decir, 25ml/kg/día)45. Los propios autores reconocen que hay factores de confusión no depurados y que, al tratarse de un estudio observacional no controlado, donde la tasa de UF se dejó a criterio del clínico, no puede determinarse si la UF elevada es deletérea en sí misma o identifica aquellos con mayor sobrecarga y peor estado hemodinámico, que son los que necesitan una dosis mayor.
Disponemos de determinadas estrategias para mejorar la tolerancia a tasas altas de UF en la HD de pacientes crónicos. Por ejemplo, en el estudio ESHOL46 se describe cómo el manejo de biosensores, perfiles de UF/sodio y prescripción de hemofiltración on-line pre/posdilución durante el desarrollo habitual de las sesiones de diálisis, mejora la tolerancia en pacientes crónicos ambulantes. Los resultados de estudio ESHOL no son extrapolables en absoluto a pacientes críticos con FRA, pero podrían marcan nuevas estrategias para mejorar el estado hemodinámico en situación de UF elevada.
La acidosis metabólica forma parte del FRA, por lo que podemos definir un umbral para el inicio de la TRR en aquellos casos con pH<7,1-7,2 o un nivel de bicarbonato<12-15mmol/l1,47. La hiperpotasemia grave (K sérico>6,5mmol/l) resistente al tratamiento médico conlleva un riesgo de cardiotoxicidad y arritmias que precisa el inicio precoz de TRR. Para estos 2 casos (acidosis e hiperpotasemia) la HD es más eficaz que la TRR continua6,47. Sin embargo, si nos enfrentamos a una hiponatremia severa en el contexto de FRA, la elección de una TRR continua permitiría una corrección lenta y controlada de la natremia previniendo las secuelas neurológicas por desmielinización47. Asimismo, el uso de la TRR está indicado para paliar los síntomas y efectos de la uremia (>100-110mg/dl) favoreciendo la disfunción plaquetaria, desnutrición/anorexia, insuficiencia cardíaca y mayor susceptibilidad a la infección y sepsis47-50.
Finalmente, diversos estudios proponen la TRR continua con una tasa convectiva alta como un complemento en el manejo de la sepsis en las UCI para eliminar citoquinas proinflamatorias. Sin embargo, los ensayos revisados no han demostrado beneficio significativo sobre el abordaje con HD habitual, ni siquiera cuando se usan dosis altas de recambio en la TRR continua49,50. Aunque la TRR aumenta el aclaramiento de lactato, existe poca evidencia de que su inicio únicamente por este motivo modifique la evolución clínica en pacientes con acidosis láctica grave sin toxicidad farmacológica asociada (por ejemplo, en el caso de la metformina)51.
Tras revisar la literatura disponible recomendamos que se debería iniciar una TRR en todos aquellos pacientes con FRA AKIN III con clara clínica de sobrecarga hídrica (edema agudo de pulmón, insuficiencia cardiaca, disfunción plaquetaria, congestión intestinal y edema refractario a pesar del empleo de diuréticos) y/o en aquellos casos en los que los síntomas urémicos, alteraciones iónicas o del equilibrio del ácido-base conlleven riesgo vital por comprometer el correcto funcionamiento de órganos principales.
Inicio de la terapia de reemplazo renal (cuándo)No existe un protocolo que defina cuándo iniciar TRR de forma unívoca entre países, centros o incluso entre intensivistas y nefrólogos de un mismo centro. A pesar de que el inicio de la TRR generalmente se establece con un estadio AKIN III41, definido por KDIGO6, algunas situaciones pueden recomendar su inicio de manera temprana, incluso sin disfunción renal, como por ejemplo: alteraciones electrolíticas críticas, sobrecarga hídrica o intoxicaciones. En estos casos deben sopesarse los riesgos inherentes a la técnica como las complicaciones del acceso vascular (hemorragia, trombosis, lesión vascular o infección), la hipotensión intradialítica y el disbalance iónico (hipocalcemia, hipofosfatemia o hipopotasemia).
Desde hace ya más de una década se han intentado establecer recomendaciones para evaluar el mejor momento para el inicio del TRR. Bagshaw et al.52 propusieron un algoritmo basado en indicaciones absolutas, grado RIFLE e indicaciones no renales, y en España Leoz et al.53 publicaron una guía con recomendaciones para el inicio y elección de modalidad más adecuada de TRR en la UCI.
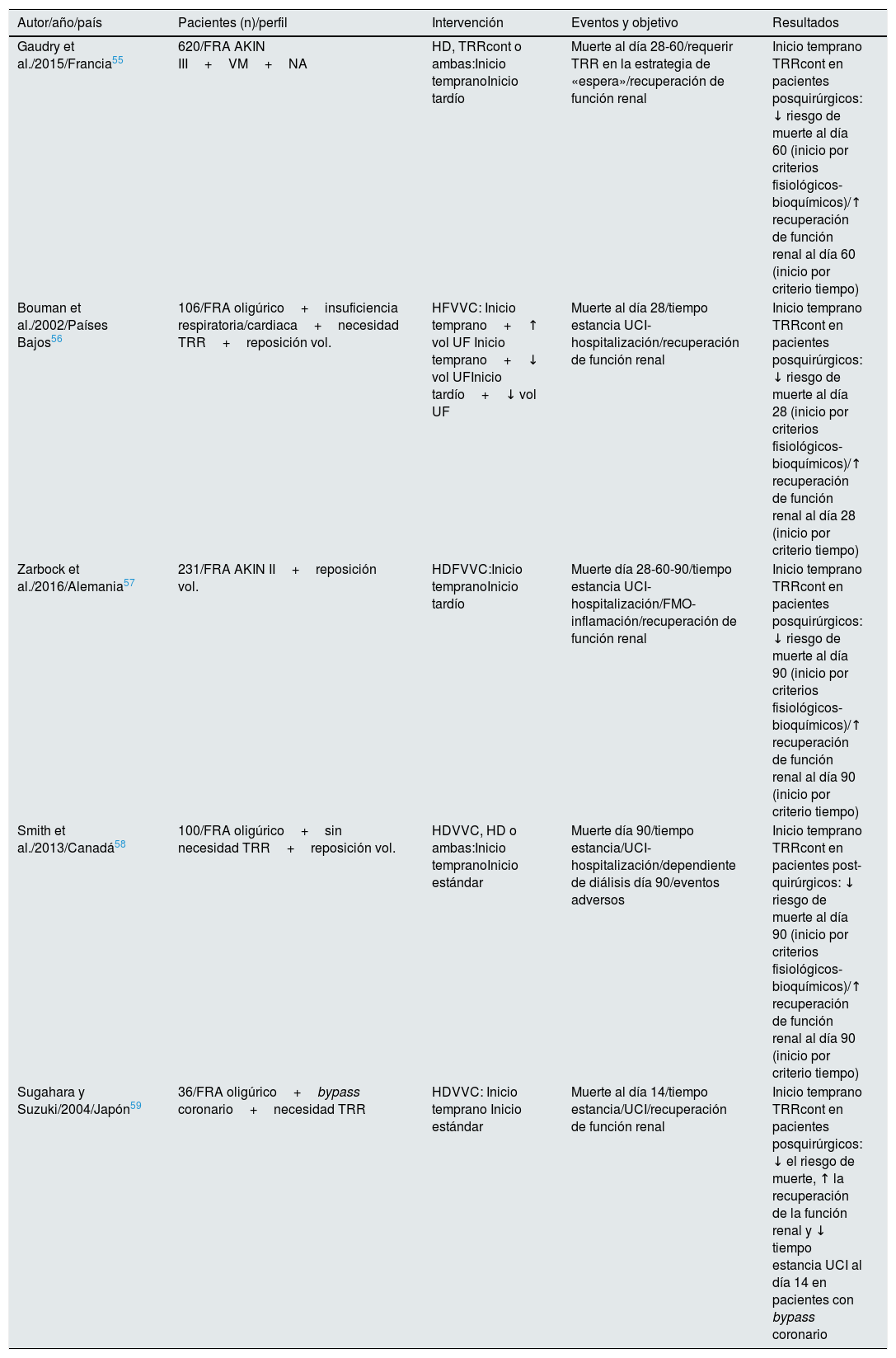
Cabe destacar un metanálisis de la Cochrane Library publicado en 201854 que aborda específicamente la cuestión de cuándo iniciar el TRR y con qué técnica55–59 (tabla 3). En él se evidencia un cierto beneficio para el inicio precoz de la TRR con una tendencia favorable en reducción de la mortalidad, estancia en UCI y recuperación renal. Sin embargo, en el análisis estratificado restringen estos beneficios al subgrupo de pacientes críticos postoperados y tratados siempre con TRR continua. Por otro lado, describen un aumento de la incidencia de efectos adversos relacionados con el inicio precoz de TRR, por lo que concluyen que el grado de evidencia se debe considerar moderado-bajo.
Comparativa de ensayos clínicos aleatorizados para inicio precoz vs. tardío
| Autor/año/país | Pacientes (n)/perfil | Intervención | Eventos y objetivo | Resultados |
|---|---|---|---|---|
| Gaudry et al./2015/Francia55 | 620/FRA AKIN III+VM+NA | HD, TRRcont o ambas:Inicio tempranoInicio tardío | Muerte al día 28-60/requerir TRR en la estrategia de «espera»/recuperación de función renal | Inicio temprano TRRcont en pacientes posquirúrgicos: ↓ riesgo de muerte al día 60 (inicio por criterios fisiológicos-bioquímicos)/↑ recuperación de función renal al día 60 (inicio por criterio tiempo) |
| Bouman et al./2002/Países Bajos56 | 106/FRA oligúrico+insuficiencia respiratoria/cardiaca+necesidad TRR+reposición vol. | HFVVC: Inicio temprano+↑ vol UF Inicio temprano+↓ vol UFInicio tardío+↓ vol UF | Muerte al día 28/tiempo estancia UCI-hospitalización/recuperación de función renal | Inicio temprano TRRcont en pacientes posquirúrgicos: ↓ riesgo de muerte al día 28 (inicio por criterios fisiológicos-bioquímicos)/↑ recuperación de función renal al día 28 (inicio por criterio tiempo) |
| Zarbock et al./2016/Alemania57 | 231/FRA AKIN II+reposición vol. | HDFVVC:Inicio tempranoInicio tardío | Muerte día 28-60-90/tiempo estancia UCI-hospitalización/FMO-inflamación/recuperación de función renal | Inicio temprano TRRcont en pacientes posquirúrgicos: ↓ riesgo de muerte al día 90 (inicio por criterios fisiológicos-bioquímicos)/↑ recuperación de función renal al día 90 (inicio por criterio tiempo) |
| Smith et al./2013/Canadá58 | 100/FRA oligúrico+sin necesidad TRR+reposición vol. | HDVVC, HD o ambas:Inicio tempranoInicio estándar | Muerte día 90/tiempo estancia/UCI-hospitalización/dependiente de diálisis día 90/eventos adversos | Inicio temprano TRRcont en pacientes post-quirúrgicos: ↓ riesgo de muerte al día 90 (inicio por criterios fisiológicos-bioquímicos)/↑ recuperación de función renal al día 90 (inicio por criterio tiempo) |
| Sugahara y Suzuki/2004/Japón59 | 36/FRA oligúrico+bypass coronario+necesidad TRR | HDVVC: Inicio temprano Inicio estándar | Muerte al día 14/tiempo estancia/UCI/recuperación de función renal | Inicio temprano TRRcont en pacientes posquirúrgicos: ↓ el riesgo de muerte, ↑ la recuperación de la función renal y ↓ tiempo estancia UCI al día 14 en pacientes con bypass coronario |
AKIN: Acute Kidney Injury Network; FMO: fracaso multiorgánico; FRA: fracaso renal agudo; HD: hemodiálisis intermitente; HDFVVC: hemodiafiltración venovenosa continua; HDVVC: hemodiálisis venovenosa continua; HFVVC: hemofiltración venovenosa continua; NA: noradrenalina; TRR: terapia de reemplazo renal; TRRcont: terapia de reemplazo renal continua; UCI: unidad de cuidados intensivos; UF: hemofiltración intermitente; UFL: hemofiltración lenta continua; VM: ventilación mecánica.
Fuente: Cochrane Library 201854.
Merece la pena reseñar también los metanálisis más recientes publicados en 2017 por Lai et al.60, Christiansen et al.61 y Zou et al. en 201762, que no encuentran beneficios rotundos para el inicio precoz de TRR en cuanto a mortalidad, recuperación de la función renal ni tiempo de estancia en UCI, aunque una vez más refieren una tendencia favorable en el subgrupo de pacientes sometidos a cirugía cardiaca con inicio de TRR en las primeras 24h poscirugía.
Otro estudio observacional retrospectivo de Jia et al.63 concluye que el inicio tardío de la TRR podría estar asociado con mayor incidencia de mortalidad a corto plazo entre los pacientes críticos en la UCI, y recomienda el inicio temprano de TRR en presencia de oligoanuria previo al desarrollo de AKIN III. Sin embargo, debemos tener muy en cuenta las limitaciones, potencia estadística y diseño retrospectivo en comparación con los previamente mencionados.
Por tanto, tras revisar los ensayos y metaanálisis reseñados en este apartado solo cabría recomendar un inicio precoz de una TRR continua en los pacientes críticos postoperados, ya que esta modalidad prescrita de forma temprana podría reducir la tasa de mortalidad y promover la recuperación de la función renal basal en este perfil de enfermos.
Dosis de la terapia de reemplazo renal (cuánto)Si tenemos en cuenta las bases fisicoquímicas previamente comentadas, el aclaramiento de urea y otros solutos de bajo peso molecular es función directa del flujo del efluente empleado en cualquier modalidad de TRR1,6,7.
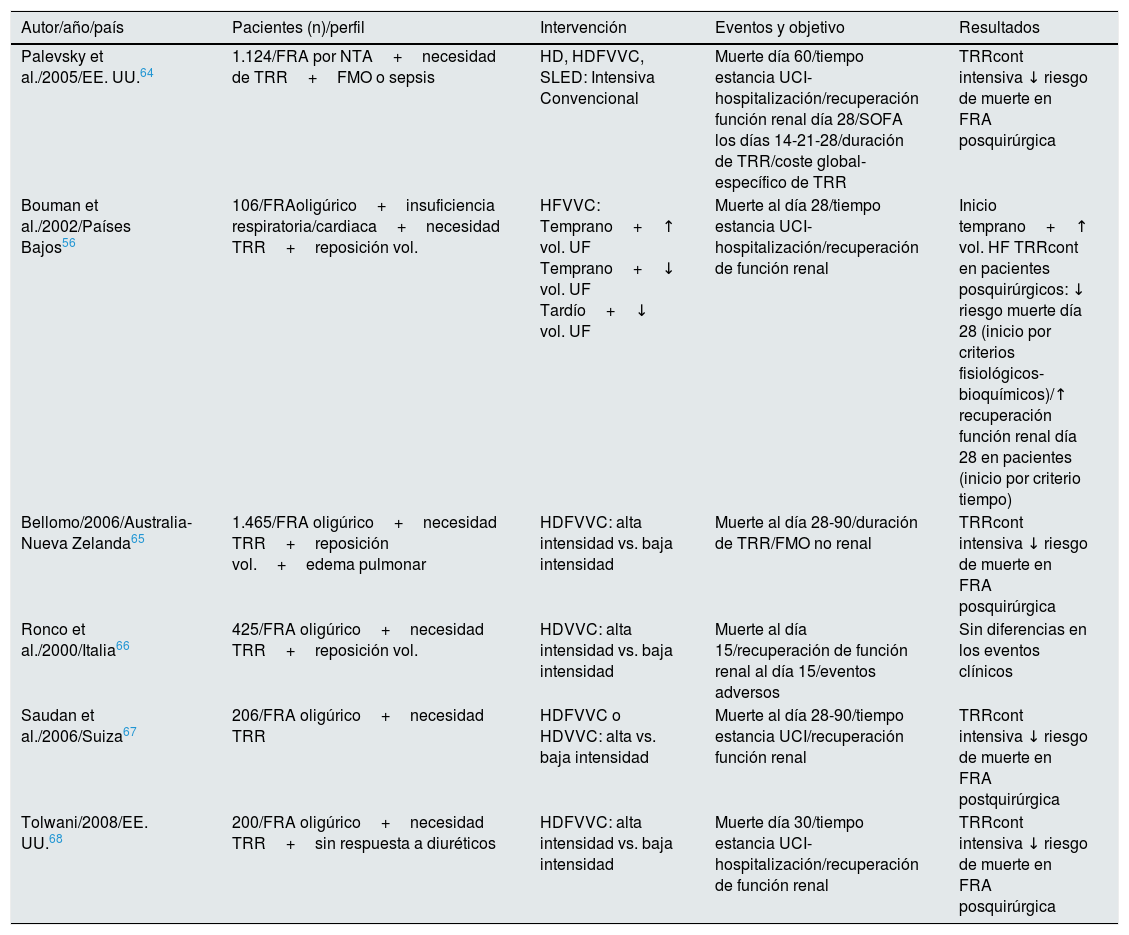
Varios estudios observacionales exploran el efecto de la dosis de diálisis y sugieren que una tasa elevada de flujo del efluente (>35ml/kg/h) se asocia con mejor supervivencia en UCI56,64–68. Sin embargo, estas conclusiones no se han confirmado revisiones sistemáticas posteriores, como la de la Cochrane Library de 201669 (tabla 4). En ninguno de los 6 ensayos clínicos controlados que se incluyen se pudieron demostrar beneficios significativos en mortalidad a los 30 días, tiempo de hospitalización posterior y/o recuperación de la función renal a medio/largo plazo con mayores dosis de flujo del efluente. Únicamente en un subgrupo específico de pacientes críticos, los postoperados, se reduce significativamente el riesgo de mortalidad y se incrementa la posibilidad de recuperar la función renal al empelar TRR continuo de alto flujo. Además, en pacientes con insuficiencia hepática fulminante o lesión cerebral con presión intracraneal elevada también es recomendable una TRR continua de alta dosis, ya que se asocia con un mejor mantenimiento de la perfusión cerebral70,71, a pesar de asumir la posibilidad de iatrogenia por «dialitrauma» y la pérdida de ciertas citoquinas beneficiosas en el manejo inicial de la sepsis comúnmente presente en estos pacientes.
Comparativa de ensayos clínicos aleatorizados para la intensidad de dosis
| Autor/año/país | Pacientes (n)/perfil | Intervención | Eventos y objetivo | Resultados |
|---|---|---|---|---|
| Palevsky et al./2005/EE. UU.64 | 1.124/FRA por NTA+necesidad de TRR+FMO o sepsis | HD, HDFVVC, SLED: Intensiva Convencional | Muerte día 60/tiempo estancia UCI-hospitalización/recuperación función renal día 28/SOFA los días 14-21-28/duración de TRR/coste global-específico de TRR | TRRcont intensiva ↓ riesgo de muerte en FRA posquirúrgica |
| Bouman et al./2002/Países Bajos56 | 106/FRAoligúrico+insuficiencia respiratoria/cardiaca+necesidad TRR+reposición vol. | HFVVC: Temprano+↑ vol. UF Temprano+↓ vol. UF Tardío+↓ vol. UF | Muerte al día 28/tiempo estancia UCI-hospitalización/recuperación de función renal | Inicio temprano+↑ vol. HF TRRcont en pacientes posquirúrgicos: ↓ riesgo muerte día 28 (inicio por criterios fisiológicos-bioquímicos)/↑ recuperación función renal día 28 en pacientes (inicio por criterio tiempo) |
| Bellomo/2006/Australia-Nueva Zelanda65 | 1.465/FRA oligúrico+necesidad TRR+reposición vol.+edema pulmonar | HDFVVC: alta intensidad vs. baja intensidad | Muerte al día 28-90/duración de TRR/FMO no renal | TRRcont intensiva ↓ riesgo de muerte en FRA posquirúrgica |
| Ronco et al./2000/Italia66 | 425/FRA oligúrico+necesidad TRR+reposición vol. | HDVVC: alta intensidad vs. baja intensidad | Muerte al día 15/recuperación de función renal al día 15/eventos adversos | Sin diferencias en los eventos clínicos |
| Saudan et al./2006/Suiza67 | 206/FRA oligúrico+necesidad TRR | HDFVVC o HDVVC: alta vs. baja intensidad | Muerte al día 28-90/tiempo estancia UCI/recuperación función renal | TRRcont intensiva ↓ riesgo de muerte en FRA postquirúrgica |
| Tolwani/2008/EE. UU.68 | 200/FRA oligúrico+necesidad TRR+sin respuesta a diuréticos | HDFVVC: alta intensidad vs. baja intensidad | Muerte día 30/tiempo estancia UCI-hospitalización/recuperación de función renal | TRRcont intensiva ↓ riesgo de muerte en FRA posquirúrgica |
FRA: fracaso renal agudo; FMO: fracaso multiorgánico; HD: hemodiálisis intermitente; HDAVC: hemodiálisis arteriovenosa continua; HDFAVC: hemodiafiltración arteriovenosa continua; HDFVVC: hemodiafiltración vevovenosa continua; HDVVC: hemodiálsis venovenosa continua; HF: hemofiltración intermitente; HFAVC: hemofiltración arteriovenosa continua; HFVVC: hemofiltración venovenosa continua; NA: noradrenalina; NTA: necrosis tubular aguda; PAM: presión arterial media; SCUF: slow ultrafiltración continua; SLED: sustained low-efficiency dialysis; SOFA: Sequential Organ Failure Assessment; TRR: terapia reemplazo renal; TRR cont: terapia reemplazo renal continua; TRRI: terapia reemplazo renal intermitente; VM: ventilación mecánica.
Fuente: Cochrane Library 201669.
Estudios publicados más recientemente sobre el tema, como el IVOIRE72 en 2013 y el RESCUE73 en 2017, no resuelven la incertidumbre, y concluyen que ni siquiera flujos muy elevados de hasta 70ml/kg/h consiguen una mejoría de supervivencia renal o de paciente. Sin embargo, en el subanálisis estratificado de RESCUE sí que se encuentran resultados favorables para el subgrupo de FRA en pacientes quemados con shock séptico tratados con dosis altas de TRR73.
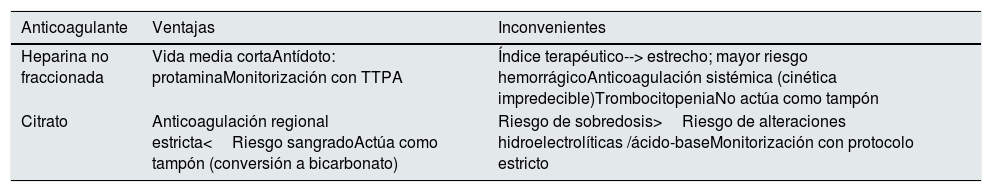
Anticoagulación de la terapia de reemplazo renal (cómo)La coagulación del circuito extracorpóreo es la complicación técnica más común durante las TRR continuas favorecida por el hecho de que el 30-60% de los pacientes no pueden ser anticoagulados por un riesgo hemorrágico añadido74. Las estrategias para minimizar el riesgo de coagulación del circuito son las siguientes: aumentar la tasa de flujo sanguíneo, disminuir la fracción de filtración, comprobar la función óptima del catéter, balancear la dosis de UF/convección (alternando incluso la reposición pre y posfiltro) y aumentar la frecuencia de reemplazo programado del circuito extracorpóreo. Todo ello depende de un estrecho control de la terapia con monitorización clínica y técnica por parte de un equipo multidisciplinar de enfermería especializada, intensivistas y nefrólogos. Una vez optimizadas la estrategia, las terapias de anticoagulación más comúnmente empleadas se basan en la heparina o el citrato74–78 (tabla 5).
Ventajas e inconvenientes de cada sistema de anticoagulación de la terapia renal sustitutiva
| Anticoagulante | Ventajas | Inconvenientes |
|---|---|---|
| Heparina no fraccionada | Vida media cortaAntídoto: protaminaMonitorización con TTPA | Índice terapéutico--> estrecho; mayor riesgo hemorrágicoAnticoagulación sistémica (cinética impredecible)TrombocitopeniaNo actúa como tampón |
| Citrato | Anticoagulación regional estricta<Riesgo sangradoActúa como tampón (conversión a bicarbonato) | Riesgo de sobredosis>Riesgo de alteraciones hidroelectrolíticas /ácido-baseMonitorización con protocolo estricto |
TTPA: tiempo de tromboplastina activado.
La anticoagulación regional con citrato (RCA) se ha utilizado de forma rutinaria para la TRR continua en pacientes críticos durante más de 25 años, y se recomienda para pacientes con y sin contraindicación para la heparina6,7,37. La evidencia reciente75 ha confirmado la superioridad del citrato regional en comparación con la anticoagulación sistémica con heparina, tanto para mantener la permeabilidad del circuito extracorpóreo como para reducir las complicaciones hemorrágicas.
Es por esto que actualmente se ha estandarizado claramente el uso de la RCA en las UCI, y las preocupaciones sobre sus posibles efectos adversos y coste adicional quedan soslayadas con los protocolos y sistemas que exponemos a continuación.
La anticoagulación con citrato se basa en su efecto quelante del Ca en el circuito extracorpóreo, lo que inhibe la cascada de coagulación. Esto sucede cuando el Ca iónico cae por debajo de 0,5mmol/l y alcanza su máxima eficacia por debajo de 0,25mmol/l. El citrato se infunde con bomba en el extremo precircuito de la TRR en proporción al flujo sanguíneo, para que sus niveles alcancen entre 4 a 6mmol/l, que son suficientes para reducir el nivel de Ca iónico en el circuito por debajo de 0,35mmol, consiguiendo la inhibición de la cascada de coagulación76. La mayoría de los protocolos de RCA requieren una infusión de calcio para mantener los niveles fisiológicos de Ca iónico en la circulación sistémica y lograr una anticoagulación efectiva. Las velocidades de infusión de citrato y calcio se pueden ajustar en la mayoría de las máquinas disponibles actualmente, y las bombas para infusión están integradas y conectadas a través del software, por lo cual las preocupaciones de seguridad con respecto a velocidades de infusión no controladas o insuficientes de una u otra solución son innecesarias76. Asimismo, existen nuevos monitores de TRR continua con sistemas dedicados, como el Aquarius™ con RCA integrado, que permiten el empleo de soluciones de citrato ácido dextrosa en la bomba previa de sangre en lugar del clásico citrato trisódico. Estas soluciones, como por ejemplo la Prismocitrate® 10/2, contienen 10mmol/l de citrato, 2mmol/l de ácido cítrico, además de sodio y cloruro en concentraciones fisiológicas. De esta manera se minimiza el riesgo de hipernatremia y alcalosis metabólica, soslayando los problemas de equilibrio electrolítico y ácido-base clásicamente asociados a la RCA75,76. Finalmente, el complejo de citrato-calcio se disocia en la circulación sistémica y se metaboliza rápidamente a bicarbonato por el hígado sirviendo como agente alcalinizante beneficioso en los pacientes con FRA y acidosis77.
Por tanto, tras revisar la evidencia disponible, podemos concluir que la RCA se asocia con una mejor permeabilidad del circuito, menores riesgos de sangrado y evita la trombocitopenia inducida por heparina78. La prescripción debe individualizarse y se beneficiaría de la estrecha monitorización por un equipo multidisciplinar que asegure la eficacia y minimice las complicaciones.
Finalización de la terapia de reemplazo renal (hasta cuándo)La recuperación de un ritmo de diuresis adecuado suele ser el acontecimiento fundamental para plantearse la retirada de la TRR según las recomendaciones de las guías KDIGO6 y grupo ADQI7, aunque la normalización de los parámetros analíticos pueda demorarse más tiempo. Es por esto que la posibilidad de finalizar definitivamente la TRR es poco probable en la práctica clínica real, y se considera recomendable la transición a otras modalidades durante el proceso de recuperación del paciente crítico.
La HD extendida puede usarse como terapia puente entre las técnicas continuas y la HD si lo justifica el estado clínico del paciente. Este aspecto depende tanto del criterio médico individual como de las circunstancias del paciente y medios de los que dispongamos.
La transición de TRR continua a HD permite el comienzo de la recuperación física y la movilización del paciente fuera de la cama, siendo este un aspecto fundamental de su evolución antes de su paso a una planta de hospitalización79.
Por último, no podemos olvidar que es importante asegurar una buena calidad de información para el paciente, familiares o tutores legales sobre cada uno de los aspectos que conlleva una TRR y su pronóstico a corto plazo, tanto por parte del de servicio de medicina intensiva a cargo del enfermo, como por los consultores de nefrología que administran el TRR.
ConclusionesTanto el FRA como la sobrecarga de volumen son complicaciones frecuentes de los pacientes críticos en UCI que comprometen su situación hemodinámica y respiratoria, lo que resulta en un aumento de su morbimortalidad. Muchos grupos de trabajo han propuesto adelantarse a estos factores con un uso casi preventivo de la TRR, lo cual no tiene un claro sustento científico de forma generalizada. Únicamente en los pacientes críticos postoperados se consigue demostrar un descenso en la mortalidad y tiempo de estancia en UCI cuando prescribimos, de forma precoz, una TRR continua de alto flujo. Asimismo, la tendencia en décadas pasadas a un incremento de la dosis de diálisis tampoco ha reportado claros beneficios, solo en este mismo subgrupo de enfermos en los que sí ha mejorado la probabilidad de recuperación de la función renal a largo plazo.
Cabe destacar la evolución en el ámbito de la anticoagulación de los filtros, donde la RCA se va consolidando como técnica de elección a la hora de optimizar la permeabilidad del circuito, disminuir el riesgo de sangrado y la trombocitopenia tan habituales con el empleo de la heparina clásica. Hoy en día los softwares de los monitores facilitan enormemente su manejo, y las soluciones con concentraciones fisiológicas de iones minimizan los riesgos metabólicos relacionados con esta forma de anticoagulación.
Por lo tanto, actualmente con cualquier modalidad de TRR (ya sea continua, híbrida o intermitente) prescrita de forma adecuada, individualizada e incluso secuencial, podemos garantizar una buena tolerancia a pesar de la inestabilidad hemodinámica grave característica de estos enfermos. Tanto los intensivistas como los nefrólogos implicados en su manejo debemos conocer los pros y los contras de cada técnica, para así establecer protocolos comunes de tratamiento personalizado y adaptarlos en función de la evolución clínica de cada individuo.
Para terminar, merece la pena reconocer que seguimos sin resolver la incógnita de cuándo y cómo finalizar un tratamiento con TRR, lo que constituye un reto para futuros estudios.
FinanciaciónFinanciado por un “Unrestricted Grant” de la Fundación Renal Iñigo Álvarez de Toledo (FRIAT) a través de la Fundación Madrileña de Nefrología y del Instituto de Investigación Segovia de Arana-Puerta de Hierro-Majadahonda (018/02FRA).
Conflicto de interesesLos autores firmantes del presente artículo declaran que no existe ningún potencial conflicto de intereses relacionado con el artículo.
Agradecemos la asistencia técnica de la Dra. Paula López Sánchez, PhD, en los aspectos metodológicos y de análisis y de Dña. Cristina Escudero Gómez en la búsqueda bibliográfica.