Los mecanismos de afectación renal de la infección por SARS-CoV-2 aún son inciertos: daño directo del virus o secundarios a depleción y/o liberación de citocinas como complicación severa del cuadro respiratorio1,2. Desde el inicio de la vacunación se vislumbra una luz de esperanza en la población mundial. Sin embargo, esta se ha visto oscurecida por las comunicaciones de efectos adversos, creando una barrera potencial para los esfuerzos de la vacunación a gran escala. Presentamos el caso de un paciente con nefritis tubulointersticial aguda (NTIA) sobre una nefropatía diabética, en el cual ningún agente relacionado fue identificado, a excepción de la vacuna COVID-19 mRNA Pfizer-BioNTech Comirnaty© (BNT162b2).
Varón 78 años con hipertensión arterial, hiperuricemia, dislipidemia, diabetes mellitus con buen control metabólico, enfermedad renal crónica (ERC) estadio 3a-b/A3. En noviembre 2018, creatinina (Cr) de 1,7 mg/dL, filtrado glomerular estimado por CKD-EPI de 39 mL/min/1,73 m2 y cociente albumina/creatinina (CAC) de 1.400 mg/g, sin control ni seguimiento nefrológico posterior. Sin antecedentes de infección por COVID-19. Toma crónicamente estatinas, IECA, alopurinol, vildagliptina y metformina. Acude a urgencias por hallazgo en analítica de Cr de 5,38 mg/dL, urea de 156 mg/dL, anemia con eosinofilia, y CAC de 3.397 mg/g sin síndrome nefrótico. Sedimento urinario con micro-hematuria y leucocituria sin eosinofiluria (tabla 1). Paciente refiere mantener leve hiporexia y astenia desde que recibió la primera dosis de la vacuna del COVID-19-BNT162b2 hace tres semanas, niega fiebre y erupción cutánea; 48 horas antes del ingreso recibió la segunda dosis de la vacuna sin reportar sintomatología alguna adicional. Leves signos de deshidratación en la exploración física. Radiografía de tórax sin alteraciones y PCR para SARS-CoV-2 negativa. Ecografía: riñones de pequeño tamaño (RI 9,4 cm y RD 10 cm) con parénquima discretamente hiperecogénico sin apreciar dilatación del sistema colector. La biopsia renal (fig. 1) mostró un total de 40 glomérulos, 21 estaban globalmente esclerosados (52%), los restantes presentaban lesiones de glomeruloesclerosis nodular. El intersticio mostraba focos de grave infiltrado inflamatorio mononuclear con abundantes eosinófilos, con presencia de daño tubular, fibrosis y atrofia tubular. Las arteriolas no presentaban lesiones destacables y no existían depósitos inmunes en la inmunofluorescencia. Los hallazgos fueron compatibles con el diagnóstico patológico de NTIA inmunoalérgica3,4. Este hecho, junto con las características clínicas y la administración reciente de la vacuna del COVID-19, nos llevó a definir este caso como una NTIA potencialmente inducida por la vacuna BNT162b2. Se inició tratamiento con tres bolos de metilprednisolona de 125 mg/día seguida de prednisona 0,8 mg/kg/día, que se disminuyó progresivamente y se interrumpió después de seis semanas5. Ante la ausencia de recuperación de la función renal y oliguria inicio hemodiálisis, actualmente sin cambios.
Evolución de parámetros analíticos del paciente con nefropatía tubulointersticial aguda
| Parámetros | Basalnov/2018 | Al ingreso | A las 2 semanas* | A las 6 semanas | Valores normales |
|---|---|---|---|---|---|
| Leucocitos | 8,83 | 7,05 | 11,39 | 7,76 | 4 – 10 x103/uL |
| Hemoglobina | 15,3 | 11,2 | 11,1 | 10,8 | 12 – 16 g/dL |
| Plaquetas | 256 | 254 | 165 | 140 | 130 – 450 x103/uL |
| Neutrófilos | 5.67 (64) | 4,98 (70) | 9,9 (87) | 6,2(80) | 2 – 7 x103/uL (40-80%) |
| Linfocitos | 2.16 (24) | 0,94(13,3) | 0,64(5,6) | 0,74(9,5) | 0.6–3,4 x103/uL (14-48%) |
| Eosinófilos | 0,44 (5) | 0,72(8,9) | 0,13(1,1) | 0,21(2,7) | 0-0,6 x103/uL (0-7%) |
| LDH | 215 | 318 | 289 | 242 | 135 - 214 IU/L |
| Bilirrubina total | 0,5 | 0,3 | 0,5 | 0,3 | 0,1 – 1 mg/dL |
| Proteínas totales | 5,4 | 6,4 | 6,5 | 5,6 | 6,4 – 8,7 g/dL |
| Albúmina sérica | 3,9 | 4,2 | 4 | 3,39 | 3 – 5,5 g/dL |
| GOT | 22 | 25 | 27 | 9 | 5- 32 IU/L |
| GPT | 23 | 23 | 22 | 17 | 5 – 33 IU/L |
| Colesterol total | 146 | 119 | 120 | 128 | mg/dL |
| Colesterol LDL | 98 | 55 | - | 49 | mg/dL |
| Triglicéridos | 279 | 178 | 128 | 130 | mg/dL |
| Urea | 65 | 156 | 179 | 205 | 17 – 60 mg/dL |
| Creatinina | 1,7 | 5,38 | 5 | 4,9 | 0,6 – 1,2 mg/dL |
| Ácido úrico | 6,2 | 4,5 | 7 | 7,6 | 3,4 – 7 mg/dl |
| Na+ | 143 | 145 | 140 | 137 | 135 – 145 mmol/L |
| K+ | 4,7 | 5,6 | 3,6 | 3,6 | 3,5 – 5,5 mmol/L |
| Cl- | 105 | 117 | 101 | 95 | 95 – 110 mmol/L |
| Ca+2 | 9,6 | 9,4 | 8,5 | 8,2 | 8,5 – 10,5 mg/dl |
| P+2 | 4,7 | 4,2 | 4,4 | 3,5 – 5,5 mg/dl | |
| Magnesio+2 | 2,3 | 1,69 | 1,9 | 2 | 1,7 – 2,2 mg/dl |
| Bicarbonato | 23 | 19,9 | 27 | 26 | 22 – 28 mEq/L |
| PCR | 0,5 | 0,23 | 1,52 | 1,72 | 0.1 – 0.5 mg/dL |
| Ferritina | - | 139 | 150 | 196 | |
| Procalcitonina | - | 0,19 | 0,2 | 0,21 | < 0,5 ng/mL |
| Hepatitis B, C y VIH | - | Negativos | - | - | NA |
| ANA, Anti-MBG, Anti-DNAds, ANCA, FR y crioglobulinas | - | Negativos | - | - | NA |
| C3 | - | 123 | - | - | |
| C4 | - | 25,5 | - | - | |
| Ac. Anti-PLA2R (ELISA) | - | Negativo | - | - | NA |
| IgG | - | 1070 | - | - | 800 – 1600 mg/dL |
| IgA | - | 179 | - | - | 70 – 400 mg/dL |
| IgM | - | 107 | - | - | 90 – 180 mg/dL |
| Electroforesis sérica | - | Distribución policlonal Igs | - | - | Negativo g/L |
| Inmunofijación sérica/orina | - | Negativo | - | - | NA |
| Diuresis | 1,9 | 1,2 | 0,4 | 0,35 | Lt/24 hrs. |
| Cociente albumina/creatinina (CAC) | 1,4 | 3,3 | 2,8 | - | < 0.03 g/gCr |
| Micro-hematuria | 1-5 | 35-50 | 20-25 | - | /CAP |
| Proteinuria | 1,2 | 3,1 | - | - | g/24 hrs. |
| Na urinario | - | 82 | - | - | 20 – 200 mEq/L |
| Cl urinario | - | 78 | - | - | NA |
| K urinario | - | 34,9 | - | - | 25 – 125 mEq/L |
: control tras inicio de hemodiálisis aguda; NA: no aplicable; Na+: sodio; Cl-: cloro; K+: potasio; Mg+2: magnesio; Ca+2: calcio; PCR: proteína C-reactiva; Ac: anticuerpos; VIH: virus de la inmunodeficiencia humana; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C; ANA: anticuerpos antinucleares; anti-DNAds: anticuerpo anti DNA doble cadena; ANCA: auto anticuerpo citoplasmático antineutrófilo; anti-MBG: anti-membrana basal glomerular; FR: factor reumatoideo; anti-PLA2R-Ab: anticuerpo antirreceptor de fosfolipasa A2; Ig: inmunoglobulinas; ELISA: ensayo por inmunoadsorción ligado a enzimas; C3: factor del complemento C3; C4: factor del complemento C4; CAP: campo de alto potencia.
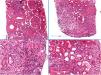
Histología de la biopsia renal.
Hematoxilina-eosina. Se evidencia esclerosis global en 21/40 glomérulos. Ampliación mesangial difusa con imágenes de transformación nodular. Focos graves de edema parcheados con infiltrado inflamatorio mononuclear con abundantes eosinófilos. Fibrosis y atrofia tubular moderada con aplanamiento del epitelio sin tubulitis. Las arterias muestran arterioesclerosis moderada-intensa, y las arteriolas presentan lesiones hialinas intensas.
La vacuna BNT162b2 basada en partículas de ARN modificado con nucleósidos y nanopartículas lipídicas, entra en las células del huésped, y producen la proteína S del SARS-CoV-2 estimulando al sistema inmune a producir anticuerpos contra esta6. Polack et al7 estudiaron la seguridad y eficacia de esta vacuna en 43,548 participantes, concluyendo que un régimen de dos dosis confirió una protección del 95%, durante una mediana de dos meses. Sin embargo, solo el 0,7% (n = 256) tenían ERC. Perpetuando la escasez de datos sobre la inmunogenicidad, eficacia, seguridad y posibles reacciones inmunoalérgicas en pacientes renales8. Menni et al.9, en un estudio observacional prospectivo evaluaron la proporción y probabilidad de efectos secundarios sistémicos, locales y reacciones alérgicas auto informados dentro de los ocho días posteriores a la vacunación entre individuos que recibieron una o dos dosis de la vacuna BNT162b2 y una dosis de la vacuna ChAdOx1-nCoV-19. 282103 recibieron una dosis de BNT162b2, de los cuales 28.207 recibieron una segunda dosis; 71,9 y 68,5% informaron efectos secundarios locales, mientras que solo un 13,5 y 22% informaron efectos secundarios sistémicos después de la primera y segunda dosis, respectivamente. En comparación con aquellos sin infección previa conocida, los efectos secundarios sistémicos fueron 1,6 veces más común después de las primeras dosis en individuos con infección previa por COVID-19.
A pesar del éxito inobjetable de la vacunación, la farmacovigilancia es un tema de interés público que adquiere cada vez mayor importancia. Es por ello que los hallazgos anatomopatológicos de nuestro caso son relevantes, aunque siempre es difícil postular la causalidad en casos de NTIA inducida por fármacos. Se han comunicado casos de diferentes glomerulopatías asociadas al COVID-1910-12. Recientemente se han descrito casos sobre una posible asociación entre las vacunas del COVID-19 y cuadros glomerulares: cinco casos de hematuria macroscópica post-vacunación, tres de ellos con nefropatía IgA (NIgA) conocida13,14 y los dos individuos sanos restantes quienes fueron diagnosticados de NIgA y glomerulonefritis proliferativa extracapilar con semilunas, respectivamente15, y por último dos casos asociados a enfermedad por cambios mínimos16,17. Mientras que solo se ha reportado un caso de NTIA coincidiendo con la vacunación BNT162b218.
En consecuencia, la vigilancia e identificación de efectos adversos supuestamente atribuibles a la vacunación debe ser una de las prioridades en salud pública en todos los países.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.