INTRODUCCIÓN
La hipertensión arterial (HTA), definida como una presión arterial (PA) sistémica igual o superior a 140/90, es el factor de riesgo cardiovascular (RCV) más prevalente entre los receptores de un trasplante renal (TR), afectando a un 70-90% de los pacientes.1,2
Múltiples factores participan en su patogénesis, aunque evidencias indirectas indican que los más importantes serían la presencia de HTA previa al trasplante, la disfunción crónica del injerto y la utilización de agentes inhibidores de la calcineurina (ICN).
Como en todo paciente hipertenso, el objetivo ideal es reducir el riesgo y la mortalidad cardiovascular, lo que incluye prevenir el desarrollo de enfermedad renal crónica (ERC) y proteinuria, factores especialmente frecuentes en pacientes portadores de un TR y, a su vez, factores de RCV.3-5
No disponemos de información generada a través de ensayos clínicos aleatorizados con suficiente potencia estadística y tiempo de seguimiento acerca del tratamiento ideal y de las cifras de PA objetivo en pacientes trasplantados, por lo que es preciso extrapolar los datos.
Sin embargo, disponemos de las recomendaciones de la European Best Practice Guidelines for Renal Transplantation (EDTA) de 2002,6 de las guías de la K/DOQI (NKF) y de la SEN de 2004,7,8 y las más recientes guías conjuntas de la European Society of Hypertension (ESH) y la European Society of Cardiology (ESC), publicadas en 2007.9
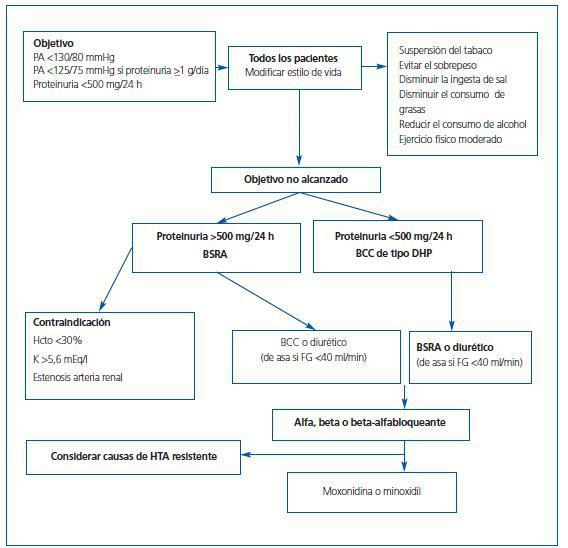
Para pacientes trasplantados, estas guías recomiendan unas cifras objetivo de control similares a las indicadas para pacientes con ERC, con o sin proteinuria:
¿ Pacientes trasplantados en general: <130/80 mmHg.
¿ Pacientes con proteinuria (>1 g/día): <125/75 mmHg, intentando reducir la cuantía de la misma al nivel más próximo a la normalidad.
Para ello, será preciso combinar cambios en el estilo de vida con medidas de tipo farmacológico y, dado el elevado RCV de estos pacientes, en la mayoría ambas formas de tratamiento deberán instaurarse desde el inicio.9
MÉTODOS
La búsqueda se realizó siguiendo la metodología general explicada antes, obteniéndose un total de 62 citas bibliográficas, todas ellas de artículos publicados después de 1995. Finalmente, de ellas se seleccionaron 28 artículos, de los cuales 3 sirvieron para analizar las evidencias existentes respecto al tratamiento no farmacológico de la HTA, 19 artículos en relación con el tratamiento farmacológico y 6 artículos para analizar las evidencias existentes en relación con las variaciones en el tratamiento inmunosupresor y su repercusión en la cifras de tensión arterial. Se descartaron artículos por tratarse de revisiones clínicas, por no estar directamente relacionados con el tema analizado o por tener poca consistencia metodológica. El análisis de calidad y clasificación por niveles de evidencia se realizó siguiendo los criterios de Óxford y se expresó como grado de recomendación.
TRATAMIENTO NO FARMACOLÓGICO
De nuevo, la mayoría de las recomendaciones deben ser extrapoladas de estudios obtenidos en la población general. Estas medidas deben llevarse a cabo en todos los pacientes con HTA, independientemente de la comorbilidad asociada (ERC, diabetes, obesidad o dislipidemia) y, desde luego, en todos los pacientes que precisen tratamiento farmacológico. El propósito es facilitar el control de la PA, reduciendo las necesidades de antihipertensivos y actuar sobre otros factores de RCV. Las recomendaciones más habituales se resumen en la tabla 1.
Desafortunadamente, el cumplimiento de estas medidas es escaso, sobre todo a largo plazo, por lo que es esencial reforzar periódicamente su importancia, sobre todo en pacientes que no reciben tratamiento farmacológico.
TRATAMIENTO FARMACOLÓGICO
Todas las clases de fármacos antihipertensivos son eficaces a la hora de controlar la PAen pacientes trasplantados, y ningún grupo ha demostrado superioridad sobre los demás.1 Su beneficio depende, básicamente, de su capacidad para controlar la PA. Para alcanzar el objetivo de control, más de un 80% de los pacientes precisarán la combinación de dos o más fármacos.10
En ausencia de datos concluyentes aportados por ensayos clínicos aleatorizados en pacientes portadores de un TR, el tratamiento antihipertensivo debe seleccionarse según el filtrado glomerular (FG), la presencia y la intensidad de la proteinuria, el nivel de RCV (diabetes, enfermedad vascular preexistente, etc.) y la presencia de otras comorbilidades.1,11 Otros factores a considerar son: la experiencia con el fármaco, su coste económico, sus posibles interacciones farmacológicas y los efectos adversos o su perfil más favorable en algunos subgrupos de pacientes.
Los bloqueantes de los canales del calcio (BCC) de tipo dihidropiridínico, ampliamente empleados, combinan eficacia antihipertensiva y efecto vasodilatador sobre la arteriola aferente, minimizando la vasoconstricción inducida por los ICN y mejorando el FG a corto y medio plazo.12 No puede determinarse si este efecto hemodinámico modifica la progresión de la enfermedad renal a largo plazo. Se desconoce si el papel de los BCC podría ser menor en pacientes a los que se les retira o minimiza el ICN.
En varios ensayos clínicos y estudios prospectivos, uni o multicéntricos, con períodos de seguimiento de uno a tres años, el uso de estos fármacos se asoció con una mejor preservación del FG, independientemente del control de la PA. Así ocurrió cuando se compararon nifedipino y lisinopril,12 lacidipino y placebo,13 o nifedipino frente a otros esquemas de tratamiento.14 Por el contrario, en pacientes con proteinuria, ésta puede aumentar14 y, potencialmente, acelerar la progresión de la enfermedad renal, excepto cuando se asocian con bloqueantes del sistema renina-angiotensina (BSRA).15
Entre los BCC no dihidropiridínicos, el verapamilo, el diltiazem y, en menor medida, algunos dihidropiridínicos como nicardipino y amlodipino se pueden elevar los niveles de los ICN o los inhibidores de mTOR, efecto que no ocurre con nifedipino o isradipino.
En resumen, los BCC dihidropiridínicos son una buena opción terapéutica inicial, sobre todo en pacientes con proteinuria inferior a 500 mg/dl y/o evidencia de nefrotoxicidad por los ICN.
Los BSRA, inhibidores de la enzima de conversión de la angiotensina (IECA) y antagonistas de los receptores de la angiotensina II (ARA II) son particularmente atractivos en pacientes trasplantados por su efecto antiproteinúrico, antifibrótico y cardioprotector. Sin embargo, los estudios no parecen demostrar beneficios adicionales independientes de sus efectos sobre la PA.
Datos del Registro CTS no demostraron beneficio del empleo de IECA o ARA II sobre la supervivencia del paciente o injerto respecto a los que no los recibieron.16 Por el contrario, en un estudio unicéntrico, publicado también en 2006, sí se demostró un efecto beneficioso sobre la supervivencia del paciente y el injerto, si bien este trabajo presenta diversos problemas metodológicos que limitan el alcance de sus conclusiones.17
Una reciente revisión sistemática de 21 ensayos clínicos confirmó que los pacientes tratados con BSRA, IECA o ARA II durante más de un año presentaban un descenso significativo del FG, el hematocrito y la proteinuria, sin cambios relevantes en las cifras de potasio. No resultaron superiores en eficacia antihipertensiva respecto a otros grupos de fármacos. Los datos fueron insuficientes para determinar su efecto sobre la supervivencia del paciente o injerto. Sin embargo, el número de estudios analizados con más de un año de seguimiento fue pequeño.18
Los datos actuales no permiten recomendar su empleo para prevenir específicamente el desarrollo de ERC en el injerto.
Los BSRA son una buena opción en pacientes estables, con proteinuria superior a 500 mg/día, creatinina inferior a 3 mg/dl y potasio <5,5 mEq/l. Se desaconseja su empleo durante las primeras semanas postrasplante ante el riesgo de hiperpotasemia,19 aunque parecen seguros en pacientes con una buena función renal. Cuando se introducen, es conveniente disponer de un doppler previo que descarte estenosis de arteria renal del injerto, y controlar las cifras de potasio y creatinina tras una o dos semanas de tratamiento.
En fase de mantenimiento, en pacientes con una función conservada y estable, presentan un buen perfil de eficacia y seguridad, aunque deben suspenderse ante incrementos de la creatinina iguales o superiores al 30% y con cifras de potasio superiores a 5,6 mEq/l.
Los BSRA son los fármacos de elección en pacientes con HTA y eritrocitosis postrasplante.
Los betabloqueantes y diuréticos pueden ser útiles en pacientes con cardiopatía, pero el riesgo de diabetes, alteraciones metabólicas o disfunción eréctil limita su uso.
Las tiazidas, a diferencia de otros grupos de hipertensos, tienen un papel limitado en el paciente trasplantado, pero la furosemida o la torasemida son útiles en pacientes con HTA y cardiopatía, edemas o con un FG <40 ml/min, en general asociados a otros fármacos, porque refuerzan su efecto antihipertensivo al disminuir el volumen plasmático en pacientes con insuficiencia renal crónica. El papel de los inhibidores de la aldosterona en pacientes trasplantados está por definir.
La doxazosina, un alfabloqueante, en general es bien tolerada, no asociándose con riesgo de diabetes, anemia o dislipidemia. Es un antihipertensivo eficaz en monoterapia en pacientes con HTA ligera, pero su mayor uso es como agente de asociación, junto a diuréticos, BCC o BSRA, en formas más graves de HTA.20 Puede ser útil en pacientes con prostatismo u otros problemas miccionales.
En pacientes con HTA grave no controlada con combinaciones de tres fármacos, incluidos diuréticos, y una vez descartadas causas secundarias de HTA resistente, puede ser necesario incluir un vasodilatador potente como el minoxidil, o bien otras opciones como la moxonidina, que actúa a nivel del Sistema Nervioso Central (SNC), inhibiendo el flujo simpático eferente, lo que se traduce en un descenso de la actividad simpática y, por tanto, de las resistencias arteriales periféricas. Datos preliminares en pacientes trasplantados demuestran eficacia antihipertensiva y un descenso marcado en el riesgo de pérdida de injerto.21
En la figura 1 se presentan los escalones recomendados en el tratamiento de la HTA postrasplante renal, y en la tabla 1 se resumen las recomendaciones generales de manejo.
MANEJO DEL TRATAMIENTO INMUNOSUPRESOR
Es bien conocida la asociación entre empleo de esteroides o agentes ICN y HTA, tanto en la población general como en los receptores de cualquier tipo de trasplante, ya sea de órgano sólido o médula ósea.
Los mecanismos por los que los esteroides inducen HTA incluyen retención de sal, efecto mineralocorticoide y ganancia de peso. En el caso de los ICN, los factores más importantes serían la inducción de vasoconstricción y la retención de sal.
En la actualidad, el papel de los esteroides como factor de riesgo parece escaso, dadas las dosis empleadas y la tendencia a su minimización o retirada en esquema libres de esteroides. Su retirada completa puede asociarse a una mejoría en el control de la HTA y de otros factores metabólicos como la diabetes o la hiperlipidemia, aunque los resultados no son universales y pueden ser transitorios.22,23 En un estudio muy reciente, la retirada de esteroides a partir del primer año se asoció con una tendencia a un mejor control de la PA respecto a un grupo control y, lo que es más importante, con una reducción en el número de eventos cardiovasculares y mortalidad de cualquier causa.24 Con esta medida, el riesgo de rechazo agudo es, en general, bajo.
Aunque han surgido alternativas terapéuticas a los ICN, su empleo es todavía habitual en tratamientos de novo y en una mayoría de pacientes en fase de mantenimiento. Su retirada o minimización se asocia con una mejoría en el control de la PA. Sin embargo, no está definido el riesgo/beneficio sobre la supervivencia del paciente y el injerto a largo plazo.
El tacrolimus parece asociarse a menos HTA que la CsA,25 y tal conversión podría aconsejarse en pacientes tratados con CsA y HTA de difícil control que tengan un riesgo bajo de desarrollar diabetes mellitus.26
La sustitución del ICN por un inhibidor de mTOR (sirolimus o everolimus) podría mejorar el control de la PA.27 Algunos estudios encuentran una peor evolución de la HTA al combinar sirolimus con tacrolimus.28,29 Se desaconseja la conversión a un inhibidor de mTOR en pacientes con una creatinina superior a 2,5 mg/dl, un FG inferior a 35-40 ml/min o una proteinuria superior a 0,5-0,8 g/día,30 aunque la decisión debe tomarse de forma individualizada.31
A priori, los inhibidores de mTOR no tienen un perfil CV favorable al inducir hiperlipidemia, resistencia a la insulina y proteinuria, aunque estos problemas podrían verse compensados por sus efectos antiproliferativos sobre el remodelado de la pared vascular y por disminuir la Hipertrofia Ventricular Izquierda (HVI) de forma independiente de su efecto sobre la PA, lo que podría traducirse en una disminución en el RCV.32 También el empleo de un IECA puede disminuir la HVI de forma independiente de la PA, al menos en pacientes tratados con CsA.33 Se desconoce si es sinérgico el efecto de ambos, el inhibidor de mTOR y el IECA, sobre la HVI.
Aunque tanto los inhibidores de mTOR como los derivados del ácido micofenólico tienen un efecto neutro sobre la PA, la combinación de tacrolimus con MMF parece asociarse con un mejor control de la PA si se compara con la combinación de tacrolimus y sirolimus.34
Aunque los cambios en la inmunosupresión suelen ser seguros, existe un riesgo bajo de rechazo agudo, por lo que en estos casos debe monitorizarse la función renal. No es aconsejable simultanear cambios significativos en el tratamiento antihipertensivo e inmunosupresor, sobre todo si se introducen BSRA o se retira el ICN, pues podrían dificultar la interpretación de un posible deterioro de la función renal.35
En resumen, la HTA postrasplante renal es una complicación frecuente y potencialmente grave, no siempre reconocida como tal. Para un adecuado control, precisa de un tratamiento individualizado, basado en un seguimiento cercano, un estilo de vida saludable y un tratamiento farmacológico.
Necesitamos disponer de ensayos clínicos específicamente diseñados para pacientes trasplantados que nos permitan conocer mejor los interrogantes que plantea el manejo de la HTA. Por sus características, estos pacientes constituyen una población ideal para estudiar el efecto de la HTA sobre la progresión de la enfermedad renal y el riesgo CV.
Figura 1.
Tabla 1. Tratamiento de la HTA postrasplante