El síndrome hemolítico urémico atípico es una entidad clínica poco frecuente, que puede llevar a la enfermedad renal crónica terminal con necesidad de diálisis o trasplante renal, con alto riesgo de recurrencia y pérdida del injerto. El uso de eculizumab en los últimos años ha cambiado el pronóstico de estos pacientes aumentando la posibilidad de un trasplante renal funcional. Presentamos el caso de un paciente joven con síndrome hemolítico urémico atípico con estudio genético negativo para todas las mutaciones actualmente conocidas, a quien se realizó trasplante renal exitoso con protocolo de eculizumab, timoglobulina, tacrolimus, micofenolato y esteroides, y conservó una adecuada función del injerto y sin recaída a 2 años de seguimiento.
INTRODUCCIÓN
Las microangiopatías trombóticas (MAT) son entidades clínicas que se caracterizan por la presencia de anemia hemolítica microangiopática, coombs negativo y falla de uno o múltiples órganos. Son una enfermedad asociada a una alta morbimortalidad, especialmente si no se detecta tempranamente y/o no se realiza un tratamiento de forma oportuna. Las MAT pueden ser secundarias a diferentes etiologías, entre ellas: a) a una deficiencia congénita o adquirida de la actividad de la enzima ADAMTS 13, que ocasiona la púrpura trombocitopénica trombótica y cuyo tratamiento son los recambios plasmáticos y, en muchos casos, la terapia inmunosupresora; b) a enterobacterias pro ductoras de toxina Shiga, que provoca un síndrome hemolítico urémico típico, el cual requiere abordaje del soporte hasta la recuperación del paciente; c) a otras causas como embarazo, infecciones, neoplasias, medicamentos, tóxicos, enfermedades metabólicas o enfermedades autoinmunes, las cuales son conocidas como MAT secundarias y en las que el tratamiento consiste básicamente en el control de la enfermedad de base, sumado a la terapia de soporte y recambios plasmáticos; y, por último, d) el síndrome hemolítico urémico atípico (SHUa), MAT asociada a una alteración en la regulación del complemento, en el que hasta al 60% de los pacientes se les identifican mutaciones en las proteínas reguladoras de la vía alterna del complemento1.
La mayoría de los pacientes con SHUa presentan insuficiencia renal aguda en el momento del diagnóstico, la cual frecuentemente lleva a una enfermedad renal crónica terminal (ERCT). Previo al año 2011, estos pacientes se consideraban como malos candidatos al trasplante renal, por la alta tasa de recurrencia de la enfermedad en el riñón trasplantado, con pérdida del injerto en la mayoría de los casos2. Sin embargo, la introducción del eculizumab como una de las estrategias de tratamiento en los pacientes con SHUa abrió una posibilidad de trasplante renal exitoso en estos de pacientes, y aunque la experiencia con este medicamento en el trasplante aún es muy limitada, cada día se confirma más su valor en la prevención de la recaída del SHUa2. Lo que ha hecho que el eculizumab se recomiende incluso en los pacientes con SHUa en los que no se logra identificar mutaciones en las vías de complemento3,4.
Adicionalmente, el eculizumab ha permitido la utilización de algunos medicamentos en el trasplante renal, los cuales se consideraban contraindicados en pacientes con SHUa por su riesgo de disparar una MAT en el injerto renal, entre de ellos los medicamentos anticalcineurínicos2,4. El uso de eculizumab ha cambiado este paradigma, y brinda la posibilidad de usar los anticalcineurínicos que hoy en día continúan siendo fundamentales para evitar el rechazo y preservar la función de los injertos5,6.
CASO CLÍNICO
Paciente de 26 años, con diagnóstico de ERCT secundaria a SHUa, con estudio genético negativo para todas las mutaciones actualmente conocidas. El paciente se encontraba en tratamiento con eculizumab 1.200 mg quincenal desde septiembre de 2014, por presentar compromiso multiorgánico (hematológico, renal, neurológico, cardio vascular y ocular) y recaídas frecuentes posteriores a la suspensión de los recambios plasmáticos (publicado por nosotros cuando debutó la enfermedad)7. Completó protocolo de trasplante renal sin encontrarse contraindicación para este. PRA (panel de anticuerpos reactivos) clase I y clase II del 0%. Serología IgG (inmunoglobulina G) para CMV (citomegalovirus) y VEB (virus de Epstein-Barr) positiva y serología para toxoplasma negativa.
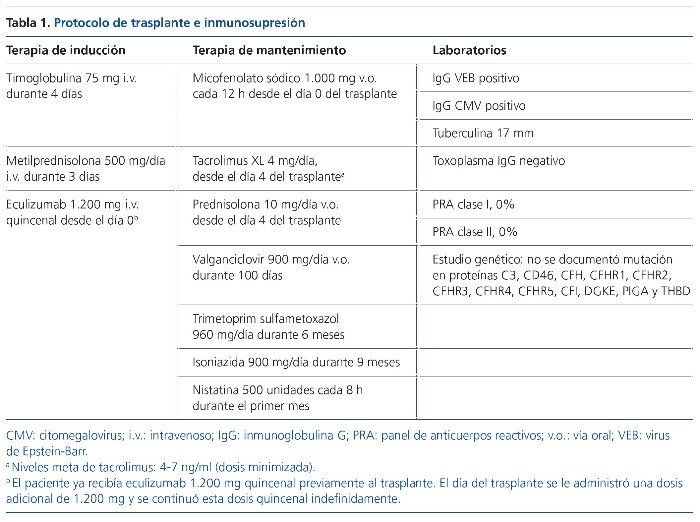
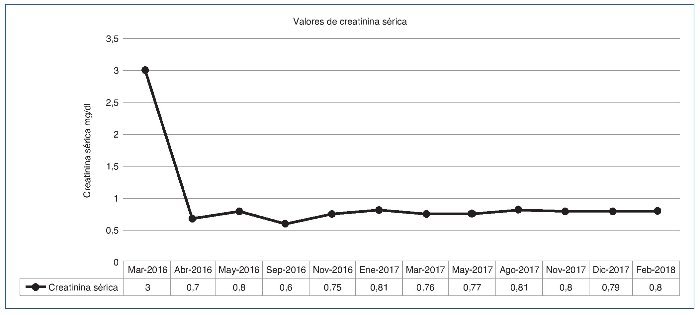
En marzo de 2016, el paciente recibió un trasplante renal en nuestra institución, donante fallecido óptimo, compatibilidad 1A y 1B, tiempo de isquemia fría, 15 h, isquemia caliente, 30 min. Protocolo de inmunosupresión con eculizumab, timoglobulina, metilprednisolona, tacrolimus, mofetil micofenolato y prednisona. Niveles de tacrolimus, 4-7 ng/ml. Profilaxis con valganciclovir, isoniazida, trimetoprim sulfametoxazol y nistatina (tabla 1). Cirugía sin complicaciones, con función del injerto inmediata, y que alcanzó creatinina de 0,8 mg/dl al día 3, la cual ha permanecido estable durante 2 años de seguimiento (fig. 1), sin presentar recurrencia de la microangopatía trombótica evaluada por marcadores periódicos (hemoglobina, plaquetas, deshidrogenasa láctica, haptoglobina, reticulocitos y extendido de sangre periférica).
Figura 1. Evolución de la función renal a los 23 meses de seguimiento.
DISCUSIÓN
Presentamos el caso de un paciente con ERCT secundaria a SHUa, sin mutación identificada. Como protocolo inmunosupresor se utilizó eculizumab, timoglobulina, tacrolimus, micofenolato y esteroides. A 2 años de seguimiento, el paciente mantiene una función renal adecuada, sin presentar recaída de su enfermedad de base.
Los pacientes con SHUa sin tratamiento específico presentan ERCT en un 70-80% de los casos a 1 año de seguimiento3,4,8. El uso de eculizumab en estos pacientes ha permitido la disminución de su mortalidad, pero aun así, muchos pacientes presentan ERCT con necesidad de diálisis7. Actualmente, la mejor estrategia de abordaje para los pacientes con ERCT por SHUa es el trasplante renal; sin embargo, es fundamental contar con una terapia anticomplemento que evite la recurrencia de la enfermedad en el riñón trasplantado, ya que hay múltiples factores que pueden disparar nuevamente el SHUa en el postrasplante como son las cirugías, la lesión de isquemia-reperfusión, los medicamentos, las infecciones, el rechazo, etc.2,9-12. La recurrencia postrasplante del SHUa depende de la mutación que tenga el paciente, y es tan alta como del 50 al 100% en mutaciones del factor H, factor I, C3 o factor B, en quienes es obligatorio la profilaxis para el trasplante con terapia anticomplemento2,5,8,12, moderada en aquellos pacientes sin mutación identificada13 y baja, por ejemplo, en pacientes con mutación de la proteína MCP, en la que no se requiere terapia con eculizumab porque el riñón trasplantado puede producir esta molécula8,14-16; sin embargo, se ha reportado recurrencia de la enfermedad en pacientes con esta mutación, lo cual se explica por la existencia de microquimerismo vascular, en el que células endoteliales del receptor producen proteína MCP mutada en el injerto renal17.
Existe controversia sobre el uso de eculizumab en pacientes con mutaciones de bajo riesgo o en quienes no se ha identificado una mutación, como es el caso que presentamos. Algunos reportes publicados han descrito el uso exitoso de los recambios plasmáticos como terapia preventiva en pacientes con mutación de MCP o sin una mutación conocida, sin evidencia de recurrencia de SHUa16,18; adicionalmente, en ciertos pacientes se han descrito otras alteraciones, como compromiso en la actividad de la enzima diacilglicerol cinasa, deficiencia de cobalamina C, mutación de la trombomodulina y deficiencia de plasminógeno, en los cuales la terapia anticomplemento al parecer no tiene impacto en la fisiopatología de estos casos19. Aun así, las guías KDIGO13, aunque sin mucha evidencia, dan la opción de terapia plasmática o terapia anticomplemento para prevenir la recurrencia de SHUa en los pacientes sin mutación identificada13. Caroti et al20 reportan en 2015 a una paciente con SHUa secundario a mutación del gen de la trombomodulina, en quien solo se utilizó un recambio plasmático antes del trasplante renal, con muy buen resultado y sin recurrencia de la enfermedad al año de trasplante, lo que plantea que el uso de terapia anticomplemento no es necesario en todos los escenarios de SHUa20.
Hasta la fecha, no existen datos concluyentes a favor o en contra del uso de eculizumab como terapia preventiva en el trasplante renal de pacientes sin mutación conocida en las vía del complemento, y tampoco se conoce durante cuánto tiempo utilizarlo. Sin embargo, se sabe que la recaída del SHUa en el trasplante es devastadora para el injerto renal y de muy difícil abordaje, por lo que correr este riesgo es inaceptable, sabiendo que hoy en día se cuenta con una terapia exitosa para prevenirlo5.
Aunque previamente se consideró el uso de inhibidores de la calcineurina como un factor de riesgo para inducción o recurrencia de MAT6,21, trabajos recientes no han reportado esta relación. Una cohorte de 10 años de seguimiento de pacientes trasplantados renales en Estados Unidos no encontró asociación entre el uso de inhibidores de la calcineurina y la recurrencia de SHUa17. Esto se demostró igualmente en la cohorte francesa de Le Quintrec et al14, quienes durante 14 años de seguimiento no encontraron asociación estadísticamente significativa entre el uso de inhibidores de la calcineurina y la aparición o recurrencia de MAT14, y concluyeron que no se debe evitar este tipo de medicamentos en los regímenes de inmunosupresión de estos pacientes, dado que el riesgo de recurrencia es limitado y estos medicamentos siguen siendo hoy en día la piedra angular de la inmunosupresión en el trasplante renal11. En el caso que presentamos, el paciente tenía SHUa confirmado con estudio genético negativo para mutaciones conocidas7, por lo que se decidió utilizar como régimen de inmunosupresión tacrolimus, con niveles minimizados para disminuir la posibilidad de rechazo, sin que se presentara recurrencia de la enfermedad y con excelente evolución del injerto. Lo anterior probablemente se explica por tener un riesgo genético bajo y adicionalmente por el esquema de inmunosupresión utilizado que incluyó eculizumab.
Entre las dudas planteadas con este paciente, se encuentra la posibilidad o no de suspender la terapia anticomplemento. Sabemos que este paciente, aunque no tiene mutación identificada, tiene alto riesgo de recaída porque cuando debutó con la enfermedad era totalmente dependiente de la terapia plasmática, con presencia de recaídas cuando se suspendía7. Sin embargo, hay autores que plantean que se podría suspender el eculizumab posteriormente a 1 año del trasplante renal en los pacientes sin mutaciones de mal pronóstico, con función adecuada del injerto renal y en quienes haya posibilidad de un seguimiento estricto8; sin embargo, otros autores recomiendan no suspender nunca el eculizumab en pacientes trasplantados, porque una recaída podría ser catastrófica para el injerto renal y el paciente, con altas tasas de pérdida del injerto y alto riesgo de muerte13. Por este motivo, el paciente continúa recibiendo eculizumab hasta que se disponga de más evidencia sobre la seguridad de suspenderlo; de ahí, la importancia de reportar todos los casos e ir sumando experiencia mundial sobre el abordaje de esta enfermedad tan devastadora como es el SHUa.
CONCLUSIÓN
El tratamiento de elección para los pacientes con ERCT por SHUa es el trasplante renal, y es fundamental la prevención de la recurrencia en el injerto con terapia anticomplemento idealmente iniciada previamente al trasplante13,20. En pacientes sin mutación identificada, los anticalcineurínicos se podrían usar de forma segura para evitar rechazo del injerto y con escaso riesgo de inducir microangiopatía trombótica, puesto que estos pacientes ya están protegidos con el eculizumab. Hoy en día, se desconoce durante cuánto tiempo se debería usar este tipo de tratamiento posteriormente al trasplante renal.
Conflicto de intereses
El Dr. John Fredy Nieto-Ríos declara que ha recibido aportaciones de Alexion Pharma en concepto de charlas, no relacionadas con la realización del trabajo. El resto de autores declara no tener ningún conflicto de intereses.
Agradecimientos
Al Hospital Pablo Tobón Uribe por permitir la realización de este reporte de caso.
Correspondencia:
John Fredy Nieto-Ríos
Hospital Pablo Tobón Uribe.
Calle 78b, n.º 69-240. Medellín, Colombia.
johnfredynieto@gmail.com; lm.serna@hotmail.com
Revisión por expertos bajo la responsabilidad de la Sociedad Española de Nefrología.