INTRODUCCIÓN
El primer trasplante combinado de hígado y riñón se realizó el 28 de diciembre de 1983 por Margreit et al. en un paciente de 32 años con un trasplante previo de riñón y rechazo crónico que tenía una cirrosis por virus de la hepatitis B1. Previamente, la enfermedad renal terminal se consideraba una contraindicación para el trasplante hepático (TH). Actualmente, por el contrario, la combinación de enfermedad terminal hepática y renal es tratada mediante un trasplante hepático y renal (THR) simultáneo con excelentes resultados. El THR combinado se realiza en casos en que se precisa un TH y se considera que la enfermedad renal terminal no es reversible. En este caso, y a diferencia del trasplante secuencial, el hígado y el riñón provienen del mismo donante. Por otra parte, hay enfermedades genéticas, como la hiperoxaluria primaria o la enfermedad fibropoliquística hepatorrenal, en que está indicado el trasplante combinado aunque el hígado en sí no presente datos de enfermedad hepática terminal.
La selección apropiada de candidatos para el THR es más compleja que para el TH y está menos definida. La política de aplicación de ambos trasplantes, pese a la aparición de guías para su indicación, sigue siendo muy flexible y en muchos casos se aplica basándose en la opinión de los médicos de la unidad paciente por paciente. Esto hace que haya diversas actitudes en la práctica. Teóricamente el trasplante combinado se pude realizar en diferentes grupos de pacientes, desde los que presentan una cirrosis bien compensada con insuficiencia renal crónica en estadio terminal (IRCT), hasta pacientes con enfermedad hepática terminal en hemofiltración continua en la unidad de cuidados intensivos. El primer grupo tiene indicación clara de trasplante de riñón (TR) y el TH no es urgente, pero previene la descompensación de la hepatopatía postrasplante y puede facilitar el TR acortando el tiempo en lista. En el segundo extremo, el asunto es completamente contrario, el TH es urgente, pero el riñón puede ser sustituido manteniendo la diálisis. Sin embargo, la realización de un TR en esos pacientes críticamente enfermos puede evitar las complicaciones relacionadas con el fallo renal en el inmediato postrasplante y reducir el riesgo de fallo renal crónico futuro.
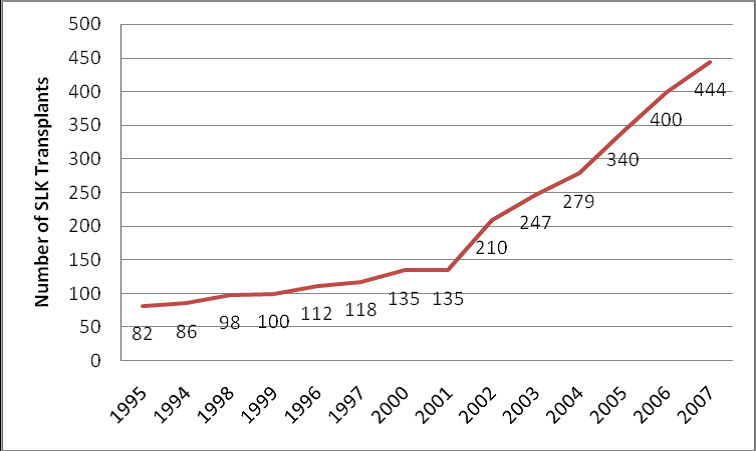
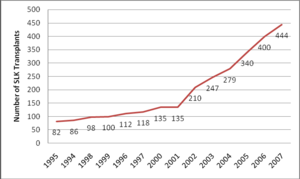
Según datos de UNOS (United Network for Organ Sharing, www.optn.org)2 y de SRTR (Registro Científico de Receptores de Trasplante que mantiene una base de datos de todos los candidatos para un trasplante de órgano sólido y de los pacientes trasplantados en Estados Unidos; los pacientes que reciben un órgano son seguidos de manera periódica con el uso de unas hojas de información completadas por cada programa de trasplante y remitidos a la OPTN [Organ Procurement and Transplantation Network]), el número de trasplantes combinados ha aumentado más de un 300 % desde la introducción del score MELD (Model for End-stage Liver Disease) como sistema para la distribución de órganos y así, mientras en el año 2001 hubo 228 candidatos y 134 receptores, en 2007 hubo 567 candidatos y 444 receptores, aunque la variación fue diferente entre las diferentes regiones de la OPTN (de 0 % a 43,7 % de incremento) (figuras 1 y 2), demostrando la falta de criterios uniformes en sus indicaciones.
Establecer un algoritmo para la realización de THR depende de nuestra habilidad para predecir si la función renal mejorará, se estabilizará o continuará empeorando después del TH en pacientes con disfunción renal en el momento del TH.
El realizar un trasplante combinado innecesario quita órganos de los pacientes en lista para TR, pero no hacerlo en caso necesario y mantener la insuficiencia renal después del TH disminuye la supervivencia de estos pacientes3-8 y los somete a mayor mortalidad mientras esperan un TR posterior9,10. El problema es que no podemos predecir esto con gran seguridad, pues no hay estudios bien hechos sobre la historia de la insuficiencia renal en pacientes con fallo hepático y TH que permitan predecir el pronóstico de la función renal. Tampoco tenemos datos para verificar, y menos cuantificar, el beneficio neto a corto o largo plazo de ofrecer un THR sobre el TH solo a este grupo de pacientes, ya que estos riñones disminuyen el pool de órganos para los candidatos a TR solo por enfermedad renal crónica (ERC). Si después de un THR por un proceso renal reversible se recupera la función de los riñones, la comunidad de pacientes con ECRT en lista de TR se puede cuestionar la equidad de dar a estos pacientes un riñón para evitar un fallo renal futuro con tres riñones funcionantes. Aun así, en los últimos años se han publicado varias recomendaciones para la realización de THR combinado, que no han sido ampliamente seguidas por los programas de TH11-13.
GUÍAS PUBLICADAS Y POLÍTICA DE DISTRIBUCIÓN DE ÓRGANOS DE LA ORGAN PROCUREMENT AND TRANSPLANTATION NETWORK PARA TRASPLANTE COMBINADO HEPATORRENAL
Davis et al. (2007)11
a. Pacientes con ERC con aclaramiento creatinina de <_ 30 ml/min (o preferiblemente un aclaramiento de iotalamato ≤ 30 ml/min).
b. Pacientes con fallo renal agudo (FRA) o síndrome hepatorrenal (SHR) en diálisis durante ≥ 6 semanas.
c. Pacientes con FRA prolongado con biopsia renal que muestra un daño renal fijo.
d. El trasplante combinado no se recomienda en pacientes con FRA que no requieran diálisis.
La mayoría de estas recomendaciones provienen o de datos del registro de SRTR o de estudios de un único centro con escaso número de pacientes y con las mismas limitaciones metodológicas de la SRTR.
Estas limitaciones son fundamentalmente:
1. Los pacientes que reciben un THR, o que están en diálisis antes del trasplante, reciban un THR o un TH únicamente, no son comparables en cuanto a la gravedad de su enfermedad hepática ni en cuanto a la reversibilidad de su función renal.2
2 No se conoce bien la causa ni la duración de la enfermedad renal que condujo a trasplante combinado en la mayoría de los casos, pues los datos de los registros son muy incompletos y no lo indican.
3 No se conocen bien los eventos perioperatorios que impactan sobre el pronóstico de la función renal ya alterada.
4 No hay una forma estandarizada y clara de medir la tasa de filtrado glomerular (TFG) en pacientes con hepatopatía.
5 No hay una definición unificada de FRA y menos en pacientes con cirrosis.
6 No se especifica la duración de la diálisis ni los criterios para iniciarla, que la mayoría de las veces son subjetivos.
GRAVEDAD DE LOS PACIENTES
Según los datos del registro SRTR, los pacientes que reciben un TH solo y están previamente en diálisis son los más graves. Cuando se analizó el MELD de 29 104 candidatos a TH y se consideró que un paciente estaba en diálisis si se le había realizado dos veces diálisis en la semana anterior como mínimo, se observó que el MELD de los pacientes a la entrada en lista y en el momento del trasplante fue más alto en los pacientes que recibieron un TH únicamente y estaban en diálisis, 577 pacientes con MELD 38 y 39; seguidos por los pacientes en diálisis que reciben un THR, 579 pacientes, con MELD 31 y 31; y por los pacientes que sin estar en diálisis reciben un THR, 605 pacientes con MELD 25 y 26; mientras que los pacientes candidatos a TH únicamente y no en diálisis, 27 343, tenían un MELD de 15 y 18. El score medio de la serie fue de 14 a la entrada en lista y 18 al trasplante. Lógicamente habrá pacientes puestos en lista por su IRCT, independientemente de su enfermedad hepática, y por lo tanto comparados a los candidatos a TH solo, en diálisis, pero que en este caso tienen una menor urgencia en la necesidad de su TH12,13 (figura 1).
Pues bien, cuando se analiza la mortalidad en lista en estos pacientes, se observa que los candidatos en diálisis o en lista para THR tienen mayor mortalidad. Por otra parte, la supervivencia postrasplante fue menor en los pacientes en diálisis que recibieron un TH únicamente que los que recibieron un THR (supervivencia a 2 años, 75,9 % para THR y 70,8 % para TH en diálisis al momento del trasplante). Si esta mejor supervivencia es atribuible al TR en sí o a diferencias en la gravedad de la enfermedad hepática, la duración de la enfermedad renal, la causa de la enfermedad renal entre los THR y el TH solo, no se pudo extraer de los datos del registro. Además el 12 % de los pacientes que estaban en lista para recibir un THR recibieron finalmente TH y este grupo tuvo también peor supervivencia postrasplante, pero no se pudo conocer la razón por la que únicamente recibieron un TH (urgencia médica, indicación límite del TR, problemas de donante, etc.), por lo que es difícil extraer conclusiones de esos resultados. De cualquier manera y como forma indirecta de analizar los resultados, la necesidad de recibir un TR en el primer año después de un TH o de un THR fue poco frecuente. Solo 8 (2,4 %) de 331 TH y 6 (2,5 %) de 237 THR en diálisis en el momento del trasplante precisaron un TR en el primer año12,13.
CAUSA DE ENFERMEDAD CRÓNICA
De las muchas causas posibles de IRCT susceptibles de TR, tanto glomerulares como túbulo-intersticiales o debidas a diabetes, hipertensión, congénitas o desórdenes metabólicos, etc., en la mayoría de los pacientes del registro no se refleja el diagnóstico etiológico de la enfermedad renal de los pacientes candidatos a TH o THR, por lo que la prevalencia de las diferentes enfermedades renales que conducen a THR es desconocida. De hecho, no se refiere en casos de trasplante único y en caso de THR es referida en el apartado «otros» en el 40 % de los casos, y cuando se informa de FRA, no se indica la causa tampoco (SHR, necrosis tubular aguda [NTA], toxicidad farmacológica, etc.) (tabla 1).
FACTORES PERIOPERATORIOS
En los datos de registro no se informa detenidamente de los eventos perioperatorios, que contribuyen de forma decisiva en la evolución inicial y a veces a largo plazo de la función renal postrasplante tanto hepático como renal.
TASA DE FILTRADO GLOMERULAR
La creatinina sérica no es un marcador muy exacto de la disfunción renal en cirróticos14,15. Aunque refleja bien la función renal en pacientes con cirrosis compensada, los pacientes con cirrosis descompensada a menudo tienen niveles bajos de creatinina en relación con su TFG debido a la reducción de su producción en el hígado y en el músculo16 y puede estar normal en pacientes con cirrosis descompensada y disfunción renal17. La fórmula de Cockcroft-Gault y la Modificación de Dieta en Enfermedad Renal (MDRD) también sobrestiman la TFG18,19. Las técnicas con marcadores exógenos como inulina o iotalamato dan una medición más segura de la TFG, pero son más laboriosas y caras20. El uso de aclaramiento de Cr-EDTA es mucho más simple, aunque tiende a sobrestimar la TFG en pacientes con ascitis y sobrecarga de volumen, debido a redistribución del trazador en la ascitis y el espacio intersticial, problemas que se solucionan estimando la superficie corporal. Otros marcadores biológicos como la cistatina C y la gelatinasa asociada a lipocalina todavía no son de uso común21-23 o no están validados en cirrosis24.
Por lo tanto, y pese a estas limitaciones, es la creatinina sérica el parámetro utilizado25. Debido a las limitaciones de la creatinina sérica, los pacientes con disfunción renal leve pueden no ser diagnosticados hasta que avance el daño renal.
Definición de fallo renal agudo, renal crónico y renal agudo sobre crónico en cirrosis
Definición de fallo renal agudo
En el año 2004, en respuesta a la falta de definición de FRA, el grupo de trabajo de la Acute Dialysis Quality Initiative (ADQI) desarrolló una definición consensuada y clasificación del FRA: los criterios RIFLE (R = Risk/Riesgo; I = Injury/Daño; F = Failure/Fallo; L = Loss/Pérdida de función renal; E = Endstage/Enfermedad renal terminal), basados en la TFG y en el flujo urinario26. Los criterios RIFLE se han validado en más de 500 000 pacientes con FRA, incluidos pacientes críticamente enfermos pre y pos-TH, y han demostrado predecir el pronóstico con un incremento progresivo en la mortalidad según empeora la clasificación RIFLE, que estratifica la disfunción renal aguda en grados de gravedad creciente del FHA basados en cambios en la creatinina o en el volumen urinario (tabla 2).
Posteriormente a su introducción como medida del FRA, se reconoció que fluctuaciones menores de las cifras de creatinina (0,3 mg/dl) se asociaban a efectos adversos y los criterios se cambiaron en una nueva reunión el año 2007 para ampliar la definición de FRA27. Posteriormente, en el año 2010, los miembros del Club de Ascitis28, que incluye varios miembros de la ADQI, decidieron aplicar los criterios RIFLE para definir el FHA en pacientes con cirrosis independientemente de la causa28 con el fin de desarrollar un estándar para el diagnóstico de FRA en pacientes con cirrosis y avanzar en la investigación para mejorar el pronóstico de estos pacientes. El FRA en cirrosis quedó definido como «todas las causas de deterioro agudo de la función renal manifestado por un incremento de la creatinina de > 50 % sobre la basal o un aumento en la creatinina sérica de 0,3 mg/dl en < 48 horas, independientemente de si la causa está relacionada con un trastorno funcional o estructural»28. El SHR tipo 1 puede ser referido como una forma de FRA (aunque se mantiene como una entidad claramente definida y con tratamiento específico [criterios de diagnóstico de SHR de 2007]29-31).
Definición de enfermedad renal crónica en cirrosis y desórdenes hepatorrenales
Los pacientes con ERC relacionada con cirrosis pueden no tener todos los criterios de ERC, tal como se definen en las guías de Kidney Disease Outcomes Quality Initiatives (K/DOQI) Workgroup. Esto requiere una TFG < 60 ml/min/1,73 m2 por > 3 meses, independientemente de la presencia o no de daño estructural (tabla 3).
Por lo tanto, la aplicación de la definición de ERC en cirrosis a veces es difícil. Cuando la creatinina alcanza el umbral de 1,5 mg/dl, se etiqueta de SHR tipo 2 (tipo 2 o SHR crónico, definido por un fallo renal moderado que progresa gradualmente sobre semanas a meses con creatinina entre 1,5 y 2,5 mg/dl)31. El pronóstico de los pacientes con SHR tipo 2 o enfermedad estructural es peor que el de los pacientes con ECR sin cirrosis, por la enfermedad hepática. Por lo tanto, estos pacientes no sobreviven lo suficiente para demostrar un deterioro lento y progresivo de su disfunción renal ni alcanzarán el deterioro típico para necesitar diálisis. Aun así, el grupo propuso la definición de ERC en cirrosis como una TFG de < 60 ml/min por > 3 meses calculada por MDRD628. El SHR tipo 2 se considera una específica de ERC. No se consideró necesario el uso de criterios de imagen o histológicos, pues el daño renal crónico puede preceder a la imagen y la biopsia renal se considera de riesgo en estos pacientes.
Algunos pacientes con cirrosis tendrán fallo renal crónico, tales como diabéticos, alcohólicos con nefropatía IgA o disfunción renal leve, no alcanzando la creatinina 1,5 mg/dl y, por lo tanto, no cumpliendo criterios de SHR tipo 2. Por lo tanto, el SHR solo describe un grupo de pacientes con disfunción renal. Por eso se propuso el término «desórdenes hepatorrenales» para describir la disfunción renal en pacientes con enfermedad hepática avanzada, funcional o estructural, que no cumplen criterios de fallo agudo, crónico o SHR. Tal definición no significa reemplazar la definición actual de SHR, que es una entidad bien definida, sino ampliar la inclusión de todos los pacientes con disfunción renal.
Definición de enfermedad aguda sobre enfermedad crónica en cirrosis
El FRA puede ocurrir en pacientes con cirrosis y disfunción renal existente; por ejemplo, la aparición de un SHR tipo 1 debido a una peritonitis bacteriana espontánea en un paciente con SHR tipo 2, pero otras veces se superpone a ERC que no cumple los criterios de SHR tipo 2, o porque la enfermedad renal no es lo suficientemente importante o porque hay otras enfermedades renales. Bajo los criterios actuales de SHR, que no permiten la presencia de ninguna evidencia de fallo estructural, sería difícil reconocer esta posibilidad. Aunque no se conoce bien esta entidad de FRA sobre crónico se definió como un incremento de la creatinina sérica, > 50 % o un aumento de 0,3 mg/dl en < 48 horas en un paciente con cirrosis cuya TFG basal es < 60 ml/min calculada por MDRD6 por más de 3 meses, sea el deterioro agudo funcional o estructural28 (tabla 4).
Criterios de diálisis antes del trasplante
En los pacientes con ERC pretrasplante que requerían diálisis antes de decidirse el TH, la duración de la diálisis se conoce con exactitud, pero en los pacientes en que se decidió reemplazar la función renal por fallo agudo pretrasplante los criterios de su inicio fueron subjetivos en la mayor parte de los programas y no figuran en los datos del registro, así como tampoco el momento de inicio de la diálisis. Se consideró que un paciente estaba en diálisis antes del trasplante si había recibido dos sesiones en la semana previa.
Con todas estas limitaciones de los datos de la literatura, consideraremos dos situaciones diferentes:
Enfermedad renal crónica terminal con cirrosis
Hay una escasez de datos sobre la necesidad de TH en pacientes con IRCT y enfermedad hepática asintomática, incluyendo cirrosis. Este problema es importante debido a la incidencia de la hepatitis C (VHC +) en pacientes en diálisis (del 3 % al 40 %, según las series), junto con el hecho de que los pacientes con IRCT tiene una puntuación MELD de 21 con bilirrubina normal e International Normalized Ratio (IRN) normal32,33. Sin embargo, la pregunta sigue siendo si estos pacientes necesitan un TR solo o un THR. En un estudio de pacientes con IRCT y VHC positivos se observó mayor riesgo de mortalidad en aquellos con fibrosis hepática 3 o 4 si solo se hizo TR34. Sin embargo, estos pacientes tenían una mejor supervivencia que los que permanecían en diálisis. Un estudio más reciente examinó a 58 pacientes con VHC sometidos a TR solo35. Este estudio encontró que la mortalidad en pacientes con IRCT sometidos a TR solo no estaba relacionada con el grado de enfermedad del hígado, sino más bien por la presencia de otras comorbilidades, como la diabetes y la edad avanzada. El consenso actual es que los pacientes con cirrosis Child A asintomáticos siguen siendo asintomáticos durante años, por lo que pueden recibir TR solo33. La indicación de THR simultáneo frente a TR solo debe basarse en la histología hepática y los signos de hipertensión portal, siendo la medición del gradiente de presión portal el patrón de oro. En el momento actual, creo que la realización de un Fibroscan® inicial puede evitar gran número de biopsias, técnica con más riesgo en este tipo de pacientes. En caso de cirrosis sin datos de hipertensión portal complicada, el gradiente de presión portal puede ayudar a tomar la decisión. Si este es mayor de 10 mmHg, se valorará THR, y solo TR si es inferior36. Un algoritmo propuesto por el Panel de Expertos de la Sociedad Internacional de Trasplante Hepático en 200812 para indicar THR o TR solo se muestra en la figura 3.
El mismo panel de expertos analizó ciertas características de los candidatos para decidir el tipo de trasplante. La edad del candidato debe ser valorada antes de decidir un THR. Según datos de la UNOS y tomando como referencia la supervivencia de TH en menores de 65 años sin diálisis pretrasplante, la mortalidad se incrementa en mayores de 65 años no en diálisis (riesgo relativo [RR] 1,36) y más en pacientes en diálisis pretrasplante (RR 4,4 en mayores de 65 años y 1,71 en menores) y en pacientes con THR simultáneo (hazard ratio [HR] 3,38 y 1,18 para mayores y jóvenes). Dados los resultados desfavorables de los candidatos a TH mayores de 65 años en diálisis, la selección de pacientes para recibir THR en este grupo deberá ser muy cuidadosa37.
Pacientes con hepatopatía grave y función renal alterada
En el caso de pacientes que precisan un TH por la gravedad de su enfermedad hepática y presentan disfunción renal, la realización de un trasplante combinado puede ser beneficiosa para ellos. Como se ha comentado previamente, la mayoría de los estudios no han caracterizado la disfunción renal en el momento del trasplante sobre si es un FRA o una NTA o una ERC sin diálisis o un FRA añadido a una ERC. Este hecho hace difícil la selección de los pacientes en los que un THR es mejor que un TH únicamente.
Aunque se afirmaba que el pronóstico del THR mejoraba la supervivencia, con relación al TH únicamente, en estos pacientes, este aspecto es controvertido. Los datos de la UNOS demuestran que, en los pacientes no sometidos a diálisis pero con una creatinina superior a 2 mg/dl al trasplante, la supervivencia a los tres años es similar, independientemente de si recibieron TH solo o THR3.
Por otra parte, además del grado de insuficiencia renal, la duración de la disfunción renal pre-TH puede predecir la función renal postrasplante38. En un estudio que comparó la duración de la enfermedad renal pretrasplante (< o > 12 semanas) y el pronóstico postrasplante, se encontró que la duración mayor de 12 semanas predijo un eGFR < 20 ml/min después del trasplante (6 de los 23 que tenían enfermedad renal > 12 semanas tenían TFG > 20 ml/min a 3 años frente a 2 de 37 con duración menor), pero, aunque el tiempo predijo la enfermedad renal postrasplante, solo un pequeño grupo la desarrolló (23 %) y no se pudo encontrar ningún factor predictivo de diálisis crónica o necesidad previa de TR39. Por otra parte, tampoco hay evidencia de que el TH seguido por el TR tenga efectos deletéreos, demostrando una supervivencia similar en trasplante secuencial y simultáneo y pudiendo ahorrar muchos órganos40,41. En un reciente análisis de 4997 pacientes trasplantados de hígado con diferentes grados de insuficiencia renal pretrasplante (pacientes con TFG estimada [TFGe] > 30 ml/min, pacientes con TFGe fluctuante, pacientes con TFGe siempre < 30 ml/min y pacientes en diálisis antes del trasplante por «poco tiempo»), se observó que los pacientes con ERC pretrasplante (TFGe < 30 ml/min siempre) tenían IRCT en un 35 % a los tres años, frente al 10 % en el resto de los grupos. En el análisis multivariante, los factores predisponentes a desarrollo de IRCT postrasplante fueron la diabetes (HR 2,65, p < 0,001) y la raza negra (HR 1,83, p = 0,02). Entre los pacientes con TFGe fluctuante, solo los diabéticos con una TFGe < 30 tuvieron riesgo de IRCT (25,6 %). Según este estudio, se consideraría el trasplante combinado solo en los pacientes diabéticos con TFGe < 30 ml/min por 90 días o más42. Otro estudio unicéntrico de 77 pacientes a los que se les realizó medición de la TFG por scan isotópico encontró que el cut-off más conservador (nTFG ≤ 20) pretrasplante tuvo baja sensibilidad (55,5 %), especificidad (75 %), VPP (67,6 %) y VPN (63,8 %) para predecir la no mejoría de la función renal postrasplante. En el análisis multivariable, el único factor predictivo de no recuperación nativa-basal (nTFG ≤ 20) fue la imagen anormal renal pretrasplante (odds ratio 3,85, intervalo de confianza 1,22-12,5). Por lo tanto, en el momento actual no disponemos de biomarcadores definitivos para predecir la recuperación, o no, de la función renal basal más allá de los criterios clínicos43.
Otro tema controvertido es la necesidad de THR en casos de SHR. Un estudio que examinó el pronóstico renal en receptores de THR con SHR encontró que no hubo diferencias en el postrasplante en la necesidad de diálisis o en la supervivencia a tres años entre los pacientes con SHR (n = 22) y sin él (n = 76)44. Todos los pacientes con SHR requirieron diálisis pretrasplante, la mayoría más de 30 días. También identificaron otros 148 receptores de TH únicamente que presentaban SHR en el momento del trasplante. De estos, 80 requirieron diálisis pretrasplante por menos de 30 días. Compararon los resultados entre estos 80 receptores de TH único y 22 pacientes con THR y SHR. La supervivencia al año no fue significativamente diferente entre ambos grupos (TH y THR). En el grupo de TH único se requirió diálisis postrasplante en el 89 %, pero solo en 8 de ellos más de 30 días, y 3 requirieron diálisis a largo plazo. Por lo tanto, más del 90 % de los pacientes con SHR dializados recuperaron la función renal después del TH. Por el contrario, en un reciente estudio sobre datos de UNOS comparando la supervivencia de 4275 pacientes cirróticos con creatinina > 2,5 mg/dl que recibieron un TH solo (2774) frente a los que recibieron un THR (1501) y de los que 369 tenían SHR, 839 otra causa de enfermedad renal conocida y 293 enfermedad renal de causa desconocida, encontraron una mejor supervivencia para el THR en el SHR y en los pacientes con causa desconocida de su enfermedad renal, sin alcanzar significación entre los que no tenían SHR y la causa de su enfermedad renal era conocida45. La supervivencia del injerto y de los pacientes con SHR que recibieron un THR fue significativamente superior a la de los pacientes que recibieron un TH solo. Ahora bien, las características basales fueron diferentes entre ambos grupos, y en el grupo de THR los pacientes que tenían un MELD > 35 eran menos, así como los hospitalizados y los que estaban en la unidad de cuidados intensivos. Igualmente fue más probable que tuvieran menor lesión hepática (menor cifra de bilirrubina sérica e INR menos alterado). También los donantes fueron más jóvenes y los tiempos de isquemia fría y caliente más cortos. Un mayor número recibía diálisis antes del trasplante, aunque la mayoría por períodos menores a cuatro semanas. En este estudio los factores de riesgo de pérdida del injerto y muerte fueron la positividad VHC en los receptores, la edad del donante y del receptor y el necesitar soporte vital al trasplante. Pese a las múltiples limitaciones del estudio, los autores encuentran una mayor supervivencia en pacientes con SHR o fallo renal de causa no especificada que recibieron un THR, independientemente de estar o no en diálisis en el momento del trasplante, y plantean reconsiderar la indicación de THR en este grupo. La incidencia de disfunción renal postrasplante fue significativamente mayor en los pacientes que recibieron únicamente un TH.
Como vemos, los datos de la literatura son contradictorios, no concluyentes y basados en bases de datos muy incompletas. Ello hace que todas las guías de indicación de THR se basen en la opinión de expertos o en estudios con un bajo grado de evidencia. Así, la Conferencia de Consenso de 200812 establece las indicaciones de THR en:
1 Pacientes con IRCT con cirrosis e hipertensión portal sintomática o gradiente de presión portal > 10 mmHg.
2 Pacientes con ERC con TFG ≤ 30 ml/min.
3 Pacientes con FRA incluyendo SHR con creatinina ≥ 2 mg/dl y diálisis ≥ 8 semanas.
4 Pacientes con enfermedad hepática crónica que requiera trasplante y ERC y biopsia renal con > 30 % de fibrosis.
Otros criterios que se deben considerar son las comorbilidades, como diabetes, hipertensión, enfermedad renal previa con proteinuria, tamaño renal y duración de la elevación de la creatinina.
El beneficio neto se consideraría cuando se evalúan pacientes de más de 65 años.
Posteriormente la OPTN, el Comité de Trasplante Renal y el Comité de Trasplante de Órganos de Intestino e Hígado estableció las siguientes indicaciones (OPTN Policy 3.5.10):
1 IRCT que requiera diálisis con la documentación establecida por la CMS*.
2 ERC (TFG ≤ 30 ml/min por MDRD6 o medición con iotalamato y proteinuria > 3 g/día y relación proteinuria orina 24 horas/creatinina > 3.
3 FRA mantenido que requiera diálisis por seis o más semanas (definido como diálisis dos veces por semana al menos seis semanas consecutivas).
4 FRA (TFG ≤ 25 ml/min por seis semanas o más medido por MDRD6 o medición directa) que no requiera diálisis.
5 FRA mantenido: los pacientes con una combinación de tiempo en categorías 3 y 4 de las anteriores por seis semanas (por ejemplo, pacientes con una TFG < 25 ml/min por tres semanas, seguida de diálisis por tres semanas).
6 Enfermedades metabólicas.
* CMS, Center for Medicare and Medicaid Services. CMS form 2728: hoja requerida por Medicare y Medicaid para establecer que un paciente con diálisis tiene una IRCT sin posibilidades de recuperación.
Muy recientemente, se ha celebrado una reunión de expertos representantes de los Comités de Trasplante Hepático y Renal de la OPTN, de varias regiones de la OPTN, fundamentalmente de aquellas con gran número de candidatos a trasplante hepático y participantes en las anteriores conferencias de THR en Los Ángeles (2011)46. Este grupo, reconociendo las limitaciones de las guías previas por la carencia de evidencias científicas en que se basan, ha sentado unos criterios para la indicación de THR en los pacientes en lista de TH, hasta tanto se obtengan más evidencias científicas:
Criterios para la realización de trasplante simultáneo hepático y renal en pacientes en lista de trasplante hepático
1. Candidatos con FRA persistente por ≥ 4 semanas con una de las siguientes condiciones:
a. Estadio 3 de FRA definido por el score RIFLE modificado (por ejemplo, un incremento de 3 veces en la creatinina basal, creatinina ≥ 4 mg/dl con un incremento agudo de 0,5 mg/dl o en terapia renal sustitutiva.
b. TFGe ≤ 35 ml/min (MDRD6) o TFG ≤ 25 ml/min (aclaramiento de iotalamato).
2. Candidatos con ERC, definida por los criterios de la National Kidney Foundation, por > 3 meses, con una de las siguientes condiciones:
a. TFGe ≤ 40 ml/min (MDRD 6) o TFG ≤ 30 ml/min (aclaramiento de iotalamato).
b. Proteinuria ≥ 2 g/día.
c. Biopsia renal que muestre > 30 % de glomerulosclerosis global o > 30 % de fibrosis intersticial.
d. Enfermedad metabólica.
El grupo consideró que la decisión de THR combinado frente al TH en candidatos a TH con FRA debería tener en cuenta factores de riesgo en el momento del trasplante, como la hipertensión, la diabetes, la edad mayor de 65 años y la etiología del FRA, pues todos ellos se han mostrado asociados a mayor riesgo de muerte, progresión de la ERC y no recuperación de la función renal después del TH.
Conflictos de interés
El autor declara que no tiene conflictos de interés potenciales relacionados con los contenidos de este artículo.
Figura 1. Número total y porcentaje de trasplante combinado de donante de cadáver de OPTN
12081_19115_45517_es_12081_tabla1.docx
Tabla 1. United Network for Organ Sharing (UNOS). Diagnósticos posibles de pacientes en lista de trasplante renal
12081_19115_45518_es_12081_tabla2.docx
Tabla 3. Clasificación de los estadios de enfermedad hepática crónica según las guías K/DOQI de la National Kidney Foundation
12081_19115_45519_es_12081_tabla3.docx
Tabla 4. Criterios diagnósticos propuestos de disfunción renal en cirrosis
12081_19115_45521_es_12081_figura2.docx
Figura 2. Número de trasplantes combinados en relación con el score MELD. Datos de la OPTN.
12081_19115_45522_es_12081_tabla4.docx
Tabla 2. Criterios modificados de RIFLE/FRA para la definición y clasificación de FRA
12081_19115_45523_es_12081_figura3_copy1.ppt
Figura 3. Algoritmo del Panel de Expertos de la Sociedad Internacional de Trasplante Hepático en 2008 para indicar THR o TR solo.