Pese a los avances diagnósticos y terapéuticos, hasta un 50% de los pacientes ingresados por insuficiencia cardiaca presentan congestión al alta. Tanto la congestión persistente como la resistencia diurética se asocian con un peor pronóstico. La combinación de suero salino hipertónico y diurético de asa ha mostrado en diferentes estudios resultados prometedores. Sin embargo, continúa sin lograr un uso estandarizado, en parte por la gran heterogeneidad en la concentración de cloruro sódico de la solución, la dosis de diurético o la cantidad de sodio en la dieta. Clásicamente se ha postulado el movimiento de agua del espacio intracelular gracias al aumento de la osmolaridad extracelular como el principal mecanismo implicado. Sin embargo, el déficit de cloro se postula como el principal regulador al alza de los cambios en el volumen plasmático, pudiendo ser su corrección el principal mecanismo implicado. Este abordaje «cloro-centrista» de la insuficiencia cardiaca abre la puerta a estrategias terapéuticas que incluirían diuréticos que corrijan la hipocloremia, así como el aporte de cloro libre de sodio.
Up to 50% of patients admitted for heart failure have congestion at discharge despite diagnostic and therapeutic advances. Both persistent congestion and diuretic resistance are associated with worse prognosis. The combination of hypertonic saline and loop diuretic has shown promising results in different studies. However, it has not yet achieved a standardized use, partly because of the great heterogeneity in the concentration of sodium chloride, the dose of diuretic or the amount of sodium in the diet. Classically, the movement of water from the intracellular space due to an increase in extracellular osmolarity has been postulated as the main mechanism involved. However, chloride deficit is postulated as the main up-regulator of plasma volume changes, and its correction may be the main mechanism involved. This ‘chloride centric’ approach to heart failure opens the door to therapeutic strategies that would include diuretics to correct hypochloremia, as well as sodium free chloride supplementation.
Durante las últimas décadas, hemos experimentado importantes avances en el manejo de la insuficiencia cardiaca (IC), disponiendo de un amplio abanico terapéutico gracias a grupos farmacológicos como los beta-bloqueantes (BB), inhibidores de la enzima convertidora de la angiotensina (IECA), antagonistas de los receptores de la angiotensina II (ARA-II), inhibidores de la neprilisina, inhibidores del cotransportador sodio-glucosa tipo 2 (iSGLT2) y antagonistas del receptor mineralocorticoide (ARM), entre otros, que han revolucionado el tratamiento. Sin embargo, la IC continúa representando en España la primera causa de hospitalización en pacientes mayores de 65 años, siendo la sintomatología derivada de la congestión el principal motivo de ingreso. Además, se asocia con tasas de mortalidad intrahospitalaria del 4-10%, reingresos de hasta un 20-30% en el primer mes y un coste medio estimado por paciente en torno a los 15.000 euros en 5 años1–4.
La resistencia a los diuréticos, aunque carece de una definición uniforme, se describe a menudo como el fracaso en la descongestión a pesar de dosis adecuadas y crecientes de diuréticos.
La congestión y la resistencia al tratamiento diurético se relacionan con una menor supervivencia y tiempos de hospitalización más prolongados, además de mayores tasas de reingresos. Pese a ello, hasta el 50% de los pacientes ingresados persisten congestivos al alta5. Es más, hasta un 40% de los pacientes presentan congestión pulmonar evaluada mediante ecografía en ausencia de síntomas, concepto recientemente denominado «congestión subclínica» y que se asocia a desenlaces similares a aquellos con congestión clínica. Cerca del 50% de este grupo presentará signos clínicos de congestión en el seguimiento ambulatorio6–8.
Suero salino hipertónico más furosemida: plausibles mecanismos de acciónVarios grupos han estudiado el beneficio de la asociación de suero salino hipertónico (SSH) y diurético como tratamiento del paciente con IC descompensada, mostrando resultados prometedores. Sin embargo, no se ha logrado un uso estandarizado, en parte por la gran heterogeneidad en la concentración de cloruro sódico (NaCl) utilizada en la solución (1,7% a 7,5%), la dosis de diurético de asa o la cantidad de sodio en la dieta9,10.
Una de las principales hipótesis sobre la que se sustenta el posible beneficio de la asociación de SSH y diurético es la movilización del líquido desde el espacio intracelular gracias al incremento de la osmolalidad extracelular, aumentando con ello el volumen circulante efectivo (VCE) y suprimiendo la actividad de la renina11. En tal caso, su empleo parece más apropiado en pacientes con un fenotipo congestivo de predominio tisular demostrado mediante una valoración multiparamétrica que combine la exploración física (edemas, crepitantes, derrame pleural, semiología ascítica) con biomarcadores (antígeno carbohidrato 125, CA 125) y ecografía a pie de cama (Point-of-Care Ultrasound [PoCUS]), demostrando en el estudio pulmonar la presencia de líneas B y/o derrame pleural12–15. Sin embargo, ninguno de los principales estudios publicados sobre el beneficio del SSH en la IC realiza un fenotipado de la congestión, incluyendo probablemente poblaciones heterogéneas en este contexto. Además, esta teoría ha sido cuestionada conceptualmente en los últimos años a raíz de un estudio que demostró que la infusión continua y lenta de SSH (NaCl 1,7%), posiblemente insuficiente para producir arrastre de agua del compartimento intersticial al intravascular por gradiente osmolar, y, en consecuencia, un aumento significativo del VCE, produjo un beneficio similar al de la dosificación en bolos de SSH al 3%16.
Por otro lado, las dietas con restricción de sodio no han demostrado sistemáticamente resultados beneficiosos, siendo incluso perjudiciales en algún estudio, conllevando tan solo un nivel de evidencia C17. El ensayo SODIUM-HF (Study of Dietary Intervention Under 100MMOL in Heart Failure), recientemente publicado, no demostró una reducción de eventos cardiovasculares en pacientes ambulatorios con IC18. La infusión de sodio parece también controvertida, ya que por un lado la mayoría de estos pacientes presentan una cantidad total de sodio aumentada, que no la natremia, y los estudios originales del empleo de SSH más furosemida revelaron un balance neto positivo de sodio19.
El cloro desempeña un papel fundamental en el mantenimiento del equilibrio ácido-base a través de su relación inversa con el bicarbonato y en la homeostasis de la presión osmótica. La presencia de hipocloremia, tanto por dilución como por un déficit absoluto secundario al uso de diuréticos, la restricción de cloro en la dieta, y/o una absorción disminuida en presencia de edema de pared intestinal, juega un rol fundamental en la resistencia diurética independiente de los niveles de sodio sérico, como se demostró en un análisis post hoc del estudio ROSE (Renal Optimization Strategies Evaluation). Además, se asocia de forma independiente con un aumento de la mortalidad en diferentes cohortes de pacientes20–24.
Su presencia induce la expresión del cotransportador sodio-cloro NCC mediante la interacción con una familia de proteínas cinasas WNK, y favorece el desarrollo y perpetuación de la alcalosis metabólica (no siempre presente) a través del intercambiador cloro-bicarbonato vía pendrina. Además, el cloro, y no el sodio, es el principal regulador de la producción de renina en el aparato yuxtaglomerular, aumentando la reabsorción de sodio en presencia de hipocloremia25. De hecho, se ha postulado que el cloro tendría acciones adicionales distintas al sodio para regular el volumen de agua intraeritrocitario y, además, un efecto de tonicidad añadido que favorecería la distribución del líquido del espacio intersticial al intravascular26. Si el déficit de cloro emerge como el principal regulador al alza de los cambios en el volumen plasmático, parecería lógico esperar un beneficio con su reposición27. Es más, si tenemos en cuenta que aproximadamente el 90% del cloro aportado en la dieta es en forma de sal, esto podría explicar la escasa evidencia a favor de la restricción de sal en la dieta28.
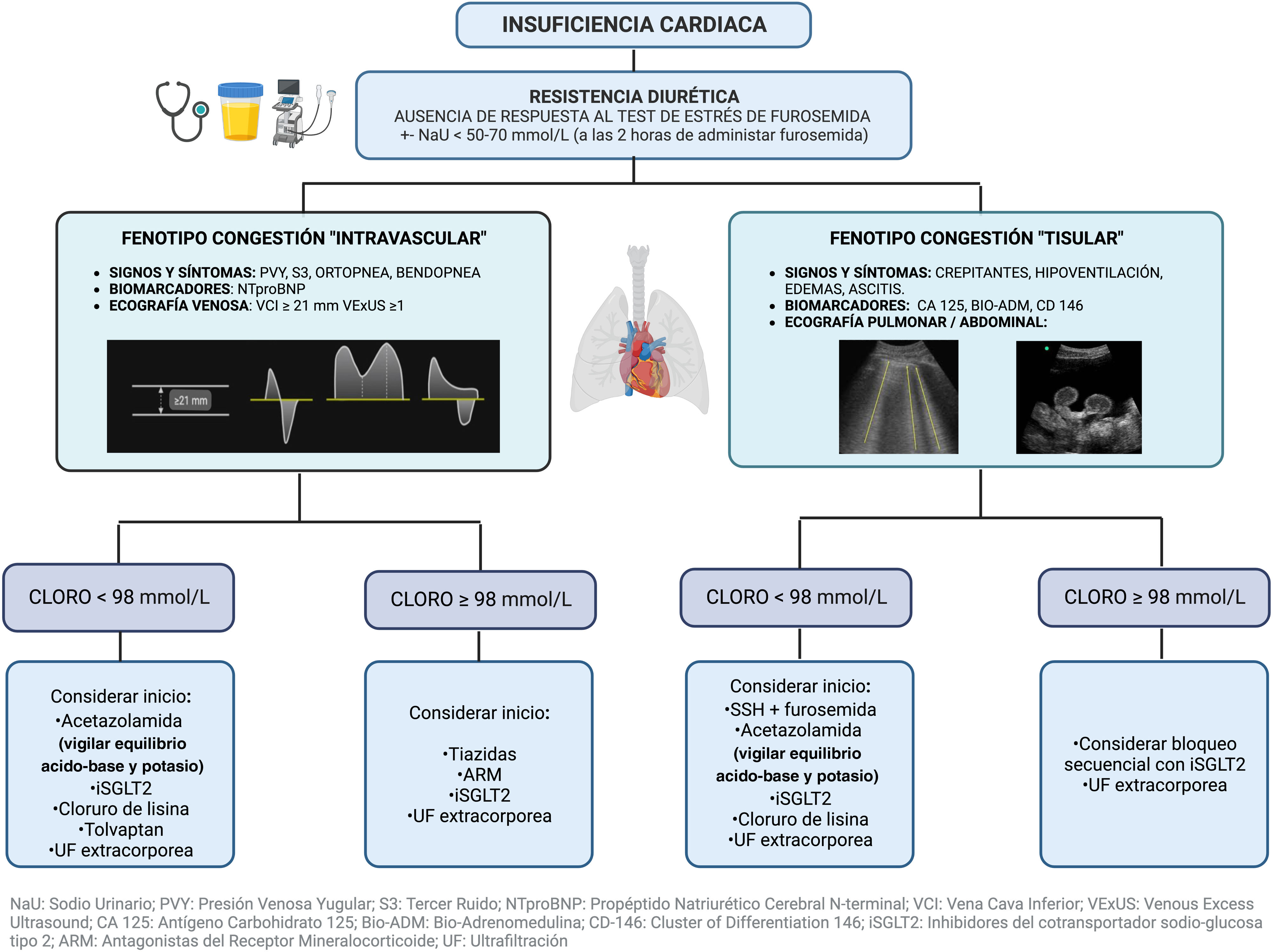
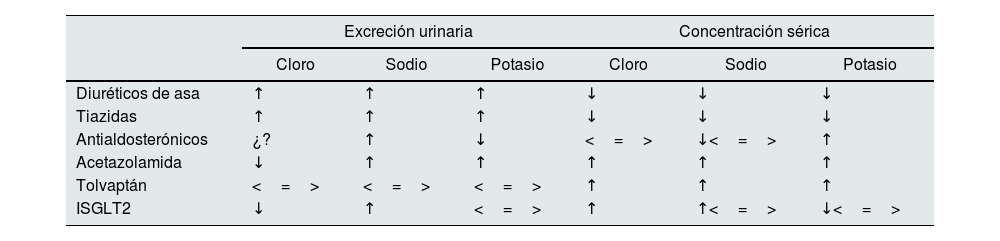
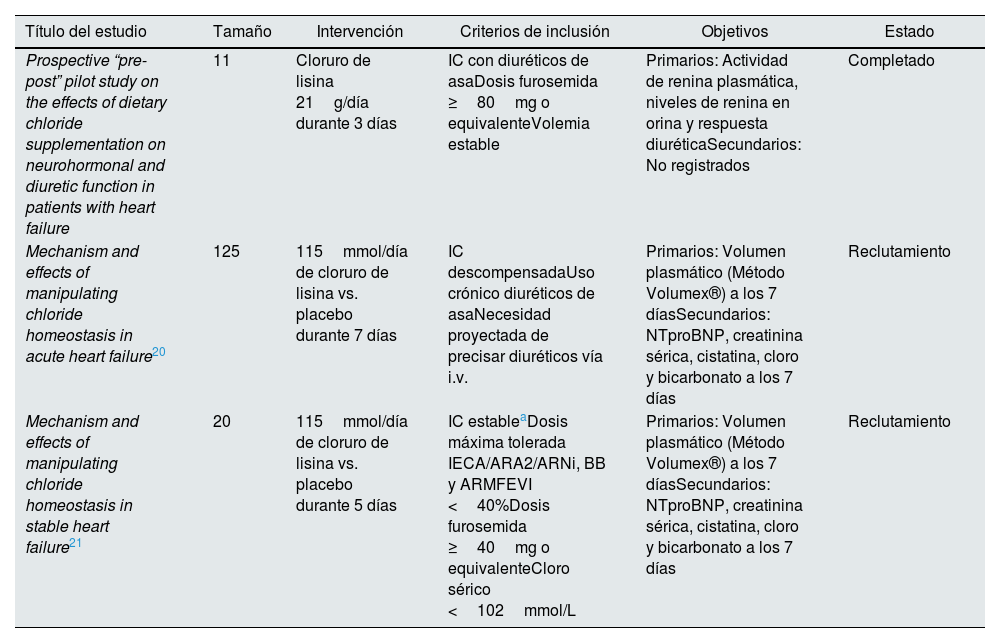
Abordaje «cloro-centrista» de la insuficiencia cardiacaLa combinación de un abordaje multiparamétrico de la congestión y «cloro-centrista» que se resume en la figura 1 plantea evitar un bloqueo secuencial de la nefrona estandarizado en casos de resistencia diurética, y abre la puerta a estrategias terapéuticas que en caso de hipocloremia aporten cloro libre de sodio y/o prioricen fármacos con efecto diurético que aumenten el cloro sérico26, así como con un mayor efecto natriurético o aquarético en función del fenotipo congestivo. Es necesario puntualizar que independientemente de la existencia o no de resistencia diurética, así como del fenotipo congestivo y de los niveles de cloro sérico, el inicio de los iSGLT2 está indicado en todo el espectro de pacientes con IC. En la tabla 1 se resume el efecto de los diferentes fármacos con efecto diurético sobre la excreción urinaria de los principales iones (cloro, sodio, potasio) y su concentración sérica. Los iSGLT2 aumentarían el cloro sérico tanto por su efecto aquarético (diuresis osmótica) como por la activación de la aldosterona, y el descenso en la reabsorción urinaria de bicarbonato (al inhibir el intercambiador NaH3N y aumentar la reabsorción tubular de cloro). La acetazolamida, que también desciende la reabsorción urinaria de bicarbonato y aumenta la reabsorción tubular de cloro, ya ha demostrado su eficacia en la insuficiencia cardiaca aguda, especialmente en presencia de alcalosis metabólica en el estudio ADVOR (Acetazolamide in Decompensated Heart Failure with Volume Overload)29. Cabe resaltar que en este estudio no se permitía el uso de los iSGLT2, ya que durante el periodo de reclutamiento no tenían indicación para el tratamiento de la IC. Pese a ello, teniendo en cuenta los resultados del estudio EMPULSE con mejoría en el combinado de muerte cardiovascular y hospitalización en pacientes con IC aguda a los que se les administraba empagliflozina 10mg durante el ingreso, son necesarios más estudios que demuestren el beneficio del uso combinado de iSGLT2 y acetazolamida30. Actualmente, están en marcha tres ensayos clínicos aleatorizados que evalúan la eficacia de la administración de cloruro de lisina (libre de sodio) tanto en pacientes ambulatorios con IC y fracción de eyección (FEVI) reducida como en hospitalizados con IC descompensada independientemente de la FEVI que se resumen en la tabla 220,21. Si el principal beneficio del SSH más furosemida girase en torno a la corrección de la hipocloremia, un resultado positivo a favor del cloruro de lisina pondría en duda el empleo de cloruro sódico, y, por tanto, de SSH, en pacientes con IC y déficit de cloro.
Efecto de los diferentes grupos farmacológicos con efecto diurético sobre la excreción urinaria y concentración sérica de los principales electrólitos
| Excreción urinaria | Concentración sérica | |||||
|---|---|---|---|---|---|---|
| Cloro | Sodio | Potasio | Cloro | Sodio | Potasio | |
| Diuréticos de asa | ↑ | ↑ | ↑ | ↓ | ↓ | ↓ |
| Tiazidas | ↑ | ↑ | ↑ | ↓ | ↓ | ↓ |
| Antialdosterónicos | ¿? | ↑ | ↓ | <=> | ↓<=> | ↑ |
| Acetazolamida | ↓ | ↑ | ↑ | ↑ | ↑ | ↑ |
| Tolvaptán | <=> | <=> | <=> | ↑ | ↑ | ↑ |
| ISGLT2 | ↓ | ↑ | <=> | ↑ | ↑<=> | ↓<=> |
Fuente: Adaptado de Kataoka25.
Resumen de los ensayos clínicos disponibles sobre el empleo de cloruro de lisina en pacientes con IC
| Título del estudio | Tamaño | Intervención | Criterios de inclusión | Objetivos | Estado |
|---|---|---|---|---|---|
| Prospective “pre-post” pilot study on the effects of dietary chloride supplementation on neurohormonal and diuretic function in patients with heart failure | 11 | Cloruro de lisina 21g/día durante 3 días | IC con diuréticos de asaDosis furosemida ≥80mg o equivalenteVolemia estable | Primarios: Actividad de renina plasmática, niveles de renina en orina y respuesta diuréticaSecundarios: No registrados | Completado |
| Mechanism and effects of manipulating chloride homeostasis in acute heart failure20 | 125 | 115mmol/día de cloruro de lisina vs. placebo durante 7 días | IC descompensadaUso crónico diuréticos de asaNecesidad proyectada de precisar diuréticos vía i.v. | Primarios: Volumen plasmático (Método Volumex®) a los 7 díasSecundarios: NTproBNP, creatinina sérica, cistatina, cloro y bicarbonato a los 7 días | Reclutamiento |
| Mechanism and effects of manipulating chloride homeostasis in stable heart failure21 | 20 | 115mmol/día de cloruro de lisina vs. placebo durante 5 días | IC estableaDosis máxima tolerada IECA/ARA2/ARNi, BB y ARMFEVI <40%Dosis furosemida ≥40mg o equivalenteCloro sérico <102mmol/L | Primarios: Volumen plasmático (Método Volumex®) a los 7 díasSecundarios: NTproBNP, creatinina sérica, cistatina, cloro y bicarbonato a los 7 días | Reclutamiento |
ARA-II: antagonistas del receptor de angiotensina II; ARM: antagonista del receptor mineralocorticoide; ARNi: inhibidor del receptor de angiotensina-neprilisina; BB: betabloqueante; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; IECA: inhibidor de la enzima convertidora de angiotensina; NTproBNP: fragmento N-terminal del péptido natriurético tipo B.
Son necesarios nuevos estudios sobre la utilidad de la combinación SSH más diurético en un intento de desgranar la base fisiopatológica que explique su beneficio, buscando perfiles de pacientes concretos y evitando su empleo de forma generalizada en la refractariedad al tratamiento diurético. Para ello es necesario que se incluyan poblaciones más homogéneas, aleatorizando a los pacientes en función del cloro sérico y del perfil congestivo mediante el empleo de nuevas herramientas como el PoCUS.
Las evidencias que se vayan generando podrían indicar el cambio de un paradigma «sodio-centrista» a un enfoque «cloro-centrista» en el abordaje de la congestión.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
- •
La congestión y la resistencia al tratamiento diurético en la IC se relacionan con una mayor morbimortalidad. Pese a ello, hasta un 40% de los pacientes ingresados por este motivo presentan al alta congestión subclínica, indetectable sin la implementación de la ecografía a pie de cama.
- •
El déficit de cloro, factor de refractariedad al tratamiento diurético y mortalidad en pacientes con IC, emerge como el posible principal regulador al alza de los cambios en el volumen plasmático.
- •
La asociación de SSH y diurético de asa como tratamiento del paciente con IC descompensada no ha logrado un uso estandarizado, en parte por la gran heterogeneidad de la población incluida, la concentración de NaCl utilizada en la solución, la dosis de diurético de asa y/o la cantidad de sodio en la dieta.
- •
El movimiento de agua del espacio intracelular gracias al aumento de la osmolaridad extracelular pudiera no ser el principal mecanismo implicado y sí la corrección de la hipocloremia.
- •
En pacientes con IC y resistencia al tratamiento diurético, sugerimos combinar una valoración multiparamétrica de la congestión con la concentración de cloro sérico, tanto para optimizar la actitud terapéutica como para el diseño de nuevos estudios que valoren la utilidad de la asociación de SSH y diurético de asa.