RESUMEN
Varón de 56 años, hipertenso, con enfermedad renal crónica no filiada que requirió tratamiento renal sustitutivo con diálisis peritoneal y transferencia a hemodiálisis un año después por peritonitis por Staphylococcus aureus.
Receptor de trasplante renal en enero de 2013 de donante de criterios expandidos, compartiendo dos identidades. Recibió inducción con basiliximab, tacrolimus, micofenolato mofetilo y esteroides. Serologías del donante negativas excepto citomegalovirus (CMV), siendo las del receptor CMV y virus de Epstein-Barr (VEB) positivas. En el postrasplante presentó desprendimiento de placa de ateroma de la arteria ilíaca, comprometiendo el flujo vascular con creatinina nadir 240 umol/l. Al mes presentó infección por CMV, que recidivó tras la suspensión del tratamiento con valganciclovir, por lo que se convirtió desde micofenolato mofetilo a iMtor (sirolimus); viremias sucesivas negativas.
En consulta mostraba deterioro de la función renal hasta cifras de 350 umol/l, filtrado glomerular de 19 ml/min, con niveles correctos, proteinuria de 1 g/día y sedimento negativo. Rechazó someterse a biopsia renal.
Ingresa el 23 de enero de 2014 por un cuadro clínico de 10 días de evolución de astenia, hiporexia y pérdida de peso. Destacaba fiebre (38 ºC) con diaforesis y sin focalidad infecciosa. Tensión arterial de 110/70 mmHg sin taquicardia. Explicaba consumo, durante el último mes, de productos de herboristería y homeopatía.
En la analítica destacaba: creatinina 497 umol/l, hipoalbuminemia (25 g/l), anemia microcítica, plaquetopenia leve, linfopenia y monocitosis (29,4 %), con acidosis metabólica, patrón urinario funcional sin aumento de proteinuria y niveles de tacrolimus y sirolimus elevados (11 y 9 μg/l, respectivamente).
Ante el síndrome tóxico grave, se solicitó una PET-TC, en la que destacaban imagen pulmonar en vidrio deslustrado y adenopatías milimétricas mediastínicas, hiliares y retroperitoneales, con débil captación. No presentaba otras captaciones patológicas.
Se solicitó reacción en cadena de la polimerasa (PCR) para virus influenza A y B, CMV, quantiferón para tuberculosis, serología para Leishmania, virus hepatotropos, virus del herpes simple, VH6, VEB, lúes y toxoplasma, y Brucella, siendo todas negativas. Se realizó broncoscopia, sin apreciar lesiones endobronquiales. Se realizó lavado broncoalveolar (BAL).
Evolucionó con persistencia de fiebre, diarreas, empeoramiento del síndrome tóxico, edema generalizado, ascitis y empeoramiento de la función renal, requiriendo inicio de hemodiálisis. Se repitió la PCR para CMV, que fue negativa, y se realizó una colonoscopia con biopsias, aunque sin hallazgos patológicos. El estudio de líquido ascítico fue compatible con trasudado con cultivo negativo.
En el seguimiento analítico había progresión de la plaquetopenia (10.000), pancitopenia y aumento de índices inflamatorios (PCR, velocidad de sedimentación globular y ferritina) y patrón de colestasis. Dada la mala evolución, se decidió retirar el sirolimus.
Ante la ausencia de adenopatías significativas, se realizó una biopsia de médula ósea, que objetivó médula hiperplásica sin evidencia de neoplasia ni hematofagocitosis.
Se inició tratamiento antibiótico empírico para tuberculosis y antifúngico, y posteriormente se recibieron los resultados del BAL: Aspergillus, tuberculosis y Pneumocystis negativos. Se retiró el tacrolimus y se dejó el corticoide.
No se observó mejoría clínica y por empeoramiento del patrón de colestasis y transaminitis se realizó una TC abdominal: hepatoesplenomegalia, ascitis y vesícula biliar distendida. No se observaron otros hallazgos patológicos. Se descartó obstrucción biliar por colangiorresonancia.
Finalmente, se realizó una biopsia hepática transyugular (9.000 plaquetas), que no mostró hallazgos sugestivos de proceso neoplásico/linfomatoso ni proceso vírico. Se descartó la presencia de metales tóxicos en sangre periférica. Evolucionó hacia fracaso multiorgánico, falleciendo tras 45 días de ingreso. Se realizó el diagnostico post mortem.
El caso fue presentado en la Web de Nefrología (www.revistanefrologia.com), y durante 15 días se realizaron distintos comentarios, todos ellos de gran interés, a los que puede accederse en la Web de Nefrología, en el apartado correspondiente al número 1, volumen 8, 2016 de NefroPlus.
INTRODUCCIÓN
En el postrasplante tardío las complicaciones más frecuentes en el contexto de síndrome tóxico y febril son las infecciones y los procesos neoplásicos.
En cuanto a las infecciones se refiere, la aparición de infecciones graves por gérmenes oportunistas (Cryptococcus neoformans, Listeria, Aspergillus, Pneumocistis carinii, Nocardia, tuberculosis y monocytogenes) son más frecuentes en pacientes que han estado sobreinmunodeprimidos; por ejemplo, pacientes que han recibido tratamiento por episodios de rechazo agudo, y por lo tanto se suelen presentar en los primeros meses postrasplante.
La tuberculosis presenta una incidencia de 36 a 74 veces mayor en pacientes inmunodeprimidos y debe tenerse en cuenta en el diagnóstico diferencial de fiebre de origen desconocido en los pacientes receptores de órganos, sobre todo después del primer año del trasplante1.
Con respecto al desarrollo de neoplasias, es notorio que los pacientes trasplantados presentan un riesgo de 2 a 5 veces superior que la población general, siendo las más frecuentes los procesos linfoproliferativos (1-20 %), los cánceres cutáneos no melanomas, cáncer de vejiga, testículo y renal2,3.
Determinadas neoplasias guardan estrecha relación con infecciones víricas como es el caso del VEB con procesos linfoproliferativos, sobre todo en los casos de síndrome linfoproliferativo postrasplante durante el primer año postrasplante4, virus del herpes humano 8 (VHH-8) con el sarcoma de Kaposi, síndrome de Castleman y linfoma de cavidades, y el virus del papiloma humano con las neoplasias de pene, vulva y cuello uterino.
Presentamos el caso de un paciente trasplantado renal de un año de evolución que ingresó en nuestro servicio por presentar síndrome tóxico y fiebre sin focalidad infecciosa asociada.
CASO CLÍNICO
Se trata de un varón de 56 años, hipertenso, con enfermedad renal crónica no filiada que requirió inicio de tratamiento renal sustitutivo (febrero de 2011) con diálisis peritoneal y transferencia a hemodiálisis un año después por peritonitis por Staphylococcus aureus.
Fue receptor de un primer trasplante renal en enero de 2013 de donante de criterios expandidos de bajo riesgo inmunológico con PRA 0 % y aloanticuerpos de fase sólida clase 1 y 2 negativos, compartiendo dos identidades con el donante (1 DR y 1 B), por lo que recibió inducción con basiliximab, tacrolimus, micofenolato mofetilo y esteroides. Serologías de virus de la inmunodeficiencia humana, lúes y hepatitis B y C de donante y receptor negativas con CMV y VEB positivos. En el postrasplante inmediato presentó desprendimiento de placa de ateroma de la arteria ilíaca según el informe quirúrgico, destacando empeoramiento de la perfusión renal y ausencia de pulso arterial, por lo que se deshizo la anastomosis arterial y se objetivó una placa de ateroma parcialmente despegada, realizando fijación de la placa y colocación de parche de dacrón, con reanastomosis posterior sin incidencias. El Doppler de control mostró perfusión homogénea del injerto, condicionando compromiso del flujo vascular, quedando con disfunción importante: creatinina 270 μmol/l con filtrado glomerular según CKD EPI de 21 ml/min.
Al mes postrasplante presentó infección por CMV, que recidivó tras la suspensión del tratamiento con valganciclovir, por lo que se convirtió de micofenolato mofetilo a iMtor (sirolimus), destacando posteriormente viremias sucesivas negativas. Niveles posconversión de tacrolimus de 6,8 μg/l y sirolimus 5,3 μg/l.
En el seguimiento en consultas mostraba deterioro de la función renal hasta cifras de 350 μmol/l, que le condicionaba un filtrado glomerular de 19 ml/min, proteinuria de 1 g/día y sedimento negativo. El paciente rechazó someterse a biopsia renal en el seguimiento en consultas.
Ingresó el 23 de enero de 2014 por un cuadro clínico de 10 días de evolución de astenia, hiporexia y pérdida de peso. Destacaba fiebre (38 ºC) con diaforesis y sin focalidad infecciosa. Tendencia a hipotensión arterial, con valores de 110/70 mmHg sin taquicardia.
Explicaba consumo, durante el último mes, de productos de herboristería y homeopatía.
En la analítica destacaba: creatinina 497 μmol/l, hipoalbuminemia (25 g/l), anemia microcítica, plaquetopenia leve, linfopenia y monocitosis (29,4 %), con acidosis metabólica, patrón urinario funcional sin aumento de la proteinuria y niveles de tacrolimus y sirolimus elevados (11 y 9 μg/l, respectivamente).
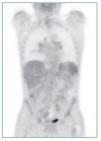
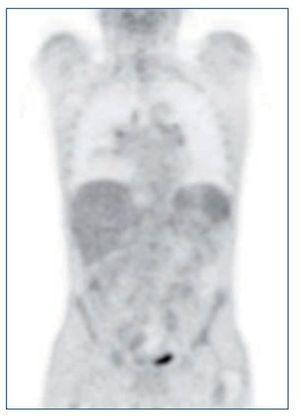
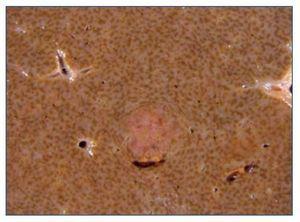
Ante el síndrome tóxico grave, se solicitó una PET-TC (figura 1), que destacaba una imagen pulmonar en vidrio deslustrado y adenopatías milimétricas mediastínicas, hiliares y retroperitoneales, con débil captación. No presentaba otras captaciones patológicas.
Figura 1. PET-TC: imagen pulmonar en vidrio deslustrado y adenopatías milimétricas mediastínicas, hiliares y retroperitoneales, con débil captación. Sin otras captaciones patológicas.
Figura 2. Visión macroscópica del hígado que muestra el carácter parcheado de las lesiones.
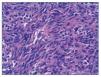
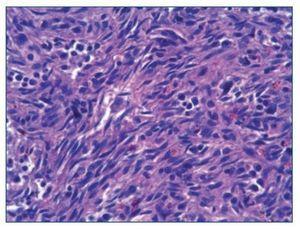
Figura 3. Tinción con hematoxilina-eosina de un ganglio x 630. Células fusiformes características del sarcoma de Kaposi.
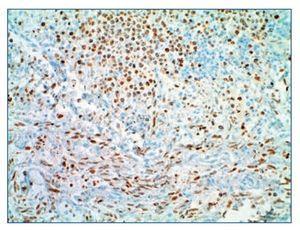
Figura 4. Inmunohistoquímica positiva para virus del herpes humano 8 x 200 de un ganglio. En la parte superior se objetiva el linfoma de cavidades y en la inferior, el sarcoma de Kaposi.
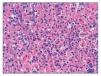
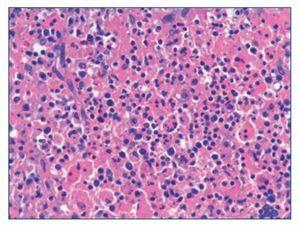
Figura 5. Tinción con hematoxilina/eosina de ganglio x 400. Hemofagocitos.
Se solicitó PCR para virus influenza A y B, CMV, quantiferón para tuberculosis, serología para Leishmania, virus hepatotropos, virus del herpes simple, VH6, VEB, lúes, toxoplasma y Brucella, siendo todas negativas. Se realizó una broncoscopia, que no objetivó lesiones endobronquiales, y se realizó un BAL.
Evolucionó con persistencia de fiebre, diarreas, empeoramiento del síndrome tóxico, anasarca, ascitis y empeoramiento de la función renal, requiriendo inicio de hemodiálisis. Se repitió la PCR para CMV, que fue negativa, y se realizó una colonoscopia con biopsias, sin hallazgos patológicos. Estudio de líquido ascítico compatible con trasudado (glucosa 6,1 mmol/l, proteínas 11 g/l, 500 células [18 % polimorfonucleares, 45 % histiocitos y 37 % linfocitos]) con cultivo negativo.
En el seguimiento analítico había progresión de la plaquetopenia (10.000), pancitopenia, elevación de reactantes de fase aguda (PCR, velocidad de sedimentación globular y ferritina) y patrón de colestasis. Dada la mala evolución, se decidió retirar progresivamente los inmunosupresores manteniendo únicamente monoterapia con corticoides.
Ante la ausencia de adenopatías significativas y la sospecha clínica de enfermedad hematológica, se realizó una biopsia de médula ósea objetivando médula hiperplásica sin evidencia de neoplasia ni hematofagocitosis.
Se inició tratamiento antibiótico empírico para tuberculosis y antifúngico, obteniendo posteriormente los resultados del BAL: Aspergillus, tuberculosis y Pneumocystis negativos.
No se observó mejoría clínica y ante el empeoramiento del patrón de colestasis y transaminitis se realizó una TC abdominal, destacando hepatoesplenomegalia, ascitis y vesícula biliar distendida, sin otros hallazgos patológicos. Se descartó obstrucción biliar por colangiorresonancia.
Finalmente, se realizó biopsia hepática transyugular (9.000 plaquetas), que no mostró hallazgos sugestivos de proceso neoplásico/linfomatoso ni proceso vírico. Se descartó la presencia de metales tóxicos en sangre periférica.
Evolucionó hacia fracaso multiorgánico, falleciendo tras 45 días de ingreso. Se realizó el diagnóstico post mortem de síndrome hemofagocítico asociado a sarcoma de Kaposi ganglionar y linfoma primario de cavidades con afectación parcheada a nivel ganglionar, esplénico, hepático, pulmonar, adrenal, tiroideo y renal.
Destacaba obstrucción de la vía biliar condicionada por adenopatías pericoledocales.
DISCUSIÓN
El VHH-8 se asociaba con el sarcoma de Kaposi, enfermedad de Castleman y el linfoma de cavidades.
El linfoma primario de cavidades es un linfoma célula B no Hodgkin poco frecuente. Se describió por primera vez en 1989 y a pesar de que su patogénesis no es del todo conocida, se considera que la infección por el VHH-8 juega un papel importante en esta enfermedad.
La evidencia de la infección por VHH-8 de las células tumorales se caracteriza por elevados niveles de ADN de VHH-8 e inmunotinción positiva para LANA-1 (antígeno nuclear de latencia asociado).
Se han descrito muy pocos casos en la literatura médica de linfoma primario de cavidades en pacientes trasplantados, presentando todos ellos anticuerpos anti-VHH-85-7.
En los pacientes trasplantados originarios de países con seroprevalencia media alta para el VHH-8, el riesgo de sarcoma de Kaposi depende principalmente de la reactivación del virus más que de la transmisión de infección primaria a través del órgano, y se considera que el proceso es el mismo en el linfoma primario de cavidades8.
Clínicamente, se caracteriza por la presencia de derrame linfomatoso en cavidades serosas: pleural, pericárdica o peritoneal.
Para establecer el diagnóstico es importante la realización del inmunofenotipo de las células neoplásicas linfoides, siendo característico de este linfoma las células no T, no B, CD138+ y LANA-1+.
Por lo que a la evolución y al tratamiento se refiere, los pacientes presentan evolución tórpida, con mortalidad del 100 % de los casos descritos durante los primeros 6 meses tras el diagnóstico, a pesar de recibir tratamiento específico (quimioterapia CHOP) y de la modificación de inhibidores de la calcineurina por rapamicina (se han descrito efectos antitumorales de los iMtor en líneas murinas)9.
El síndrome hemofagocítico es una enfermedad sistémica inflamatoria fulminante que puede ser primaria (enfermedad genética) o secundaria (adquirida) en el contexto de enfermedades hematológicas, neoplásicas o en el contexto de infecciones víricas (VEB, VIH, VHH-8)10.
Se caracteriza por la infiltración histiocítica del sistema retículo endotelial, que produce destrucción de los elementos formes de la sangre11.
El VHH-8 se asocia raramente al síndrome hemofagocítico, siendo esta relación más frecuente en pacientes inmunodeprimidos12.
En pacientes con síndrome hemofagocítico adquirido, como en el caso que presentamos, el tratamiento del linfoma es el tratamiento de elección para tratar el síndrome hemofagocítico.
En nuestro caso, a pesar de las múltiples pruebas diagnósticas para intentar filiar la causa del síndrome tóxico, esto fue únicamente posible post mortem. En el material histológico obtenido a través de las biopsias hepáticas, de colon y de médula ósea, no fue posible identificar las características histológicas típicas del linfoma de cavidades ni del sarcoma de Kaposi, probablemente por la naturaleza “focal” o “parcheada” de las lesiones. Cabe destacar la ausencia de lesiones cutáneas típicas del sarcoma de Kaposi.
Analizando el caso a posteriori, el estudio anatomopatológico del líquido ascítico hubiera podido detectar la presencia de células linfomatosas típicas del linfoma de cavidades, y la determinación del VHH-8 en sangre periférica hubiera podido orientarnos en el diagnóstico ante mortem.
Por este motivo, consideramos añadir la determinación de VHH-8 en el estudio de síndrome tóxico en el paciente trasplantado renal de forma sistemática.
CONCLUSIONES
El linfoma de cavidades, el sarcoma de Kaposi y el síndrome hemofagocítico son entidades de mal pronóstico que pueden asociarse a VHH-8. Según nuestra revisión bibliográfica, el caso que describimos es el primero con presencia de las tres enfermedades en un paciente portador de trasplante renal.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Correspondencia: María Quero Ramos
Servicio de Nefrología. Unidad de Trasplante Renal.
Hospital Universitari de Bellvitge.
C/ Feixa Llarga, s/n. 08907 L’Hospitalet de Llobregat, Barcelona.
maria.quero@bellvitgehospital.cat