El trasplante de células hematopoyéticas es el tratamiento de elección de numerosas enfermedades hematológicas, malignas y no malignas. La insuficiencia renal aguda es una complicación frecuente del trasplante de células hematopoyéticas, que empeora el pronóstico de estos pacientes. La etiología de la insuficiencia renal aguda tras el trasplante de células hematopoyéticas difiere según el momento de aparición y en numerosas ocasiones su origen es multifactorial. El síndrome de obstrucción sinusoidal hepático es una causa de insuficiencia renal aguda, que cursa como síndrome hepatorrenal, casi exclusiva de los pacientes con trasplante de médula ósea. En las formas graves, su pronóstico es fatal. Presentamos un caso de síndrome de obstrucción sinusoidal hepático con insuficiencia renal aguda secundaria por síndrome hepatorrenal y evolución favorable, gracias al diagnóstico e instauración de tratamiento precoz con defibrotide y terlipresina.
INTRODUCCIÓN
El trasplante de células hematopoyéticas es el tratamiento de elección de una gran variedad de enfermedades hematológicas malignas y no malignas. La insuficiencia renal aguda (IRA) es una complicación frecuente tras el trasplante de células hematopoyéticas que ocurre en los tres primeros meses postrasplante y que incrementa el riesgo de mortalidad e insuficiencia renal crónica futura. La etiología de la IRA1 tras el trasplante de células hematopoyéticas es diferente según el momento de aparición: precozmente puede ser secundaria a síndrome de lisis tumoral o a toxicidad asociada a la infusión medular que habitualmente ocurre en los primeros 5 días tras el trasplante. El síndrome hepatorrenal secundario al síndrome de obstrucción sinusoidal (SOS) hepático aparece dentro del primer mes postrasplante2. La IRA que se presenta transcurrido el primer mes postrasplante suele ser secundaria a enfermedad injerto contra huésped (EICH), aguda o crónica, o a toxicidad por inhibidores de la calcineurina. Otras causas no específicas de IRA que pueden surgir en cualquier momento del postrasplante son sepsis, hipotensión, depleción de volumen, nefrotoxicidad medicamentosa y uropatía obstructiva. En muchas ocasiones, la IRA es multifactorial y tiene un curso clínico complicado.
El SOS hepático, llamado previamente enfermedad venooclusiva hepática, es una de las complicaciones más graves del trasplante alogénico y autólogo de células hematopoyéticas3. En las formas graves, con afectación multiorgánica, la mortalidad supera el 80 %. Por ello, es importante llevar a cabo la prevención del mismo en los pacientes de alto riesgo, establecer unos criterios diagnósticos homogéneos e instaurar un tratamiento precoz4.
Presentamos el caso de una paciente con SOS hepático grave con IRA secundaria por síndrome hepatorrenal, tratado de forma exitosa con defibrotide y terlipresina.
CASO CLÍNICO
Presentamos el caso de una mujer de 29 años, alérgica a la penicilina, diagnosticada en 1999 de linfoma de Hodgkin tipo celularidad mixta estadio IV-B. Se trató con 6 ciclos de adriamicina, bleomicina, vinblastina, dacarbacina (ABVD) e irradiación nodal total (20 Gy), con irradiación pulmonar hasta 16 Gy. Dos años después (2001) presentó recidiva axilar, tratada con quimioterapia de segunda línea con cuatro ciclos de etopósido, citarabina, cisplatino, metilprednisolona (ESHAP) y trasplante autólogo de células hematopoyéticas (2002). Tras el trasplante recibió radioterapia (36 Gy) en regiones paraaórticas. En marzo de 2005, se objetivó una lesión esplénica de 3 cm y pélvica, que se trató con radioterapia (36 Gy). En febrero de 2014, la paciente presentó una nueva recidiva con adenopatías en el tronco celiaco, laterocervicales y supraclaviculares izquierdas, subcarinales, paraesofágicas y en el mediastino anterior, que se trataron inicialmente con bendamustina, con remisión completa tras cuatro ciclos.
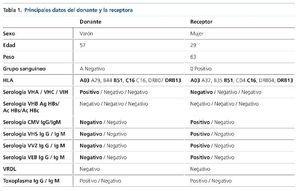
Ingresó en el Servicio de Hematología del Hospital Universitario de Salamanca en octubre de 2014 para la realización de trasplante alogénico haploidéntico en cuarta remisión completa. Se escogió como mejor donante, según el estudio de compatibilidad HLA y genotipo KIR, al padre5,6. El donante y la receptora presentaban incompatibilidad de grupo sanguíneo. Los datos del donante y la receptora aparecen reflejados en la tabla 1. La paciente recibió acondicionamiento con fludarabina, busulfán y ciclofosfamida, y prevención de la EICH con micofenolato mofetilo y tacrolimus. También se utilizó ácido ursodexosicólico. Se empleó como antibioticoterapia de primera línea aztreonam (día +2 a día +36), dada la alergia de la paciente a la penicilina, y a pesar de no existir infección bacteriana documentada fue necesario emplear teicoplanina (día +1 a día +11), vancomicina (día +12 a día +17) y amikacina (día +2 a día +17) por síndrome febril. Tampoco se constató la existencia de infección fúngica, pero se utilizó profilaxis con trimetoprima/sulfametoxazol (día –5 a día –2), posaconazol (día +1 a día +6) sustituido por micafungina (día +6 a día +10) y posteriormente por anidulafungina (día +10 hasta día +14) por sospecha de toxicidad hepática. La prevención de infecciones víricas se realizó con aciclovir. Durante el ingreso la paciente no recibió tratamiento hormonal sustitutivo.
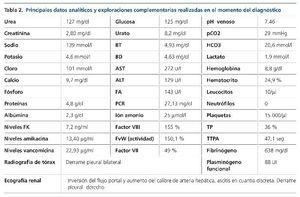
El día +13, la paciente había ganado 3 kg respecto al día previo, refería hepatomegalia dolorosa, y tanto las cifras de presión arterial como la diuresis habían disminuido. En la auscultación pulmonar se ponía de manifiesto hipoventilación desde los campos medios junto con crepitantes bibasales, y en la exploración abdominal se apreciaba aumento del perímetro abdominal (6 cm) y hepatomegalia dolorosa de tres traveses de dedo. En la analítica destacaba la alteración del perfil hepático, con elevación de la bilirrubina, la urea y la creatinina (tabla 2).
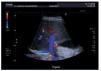
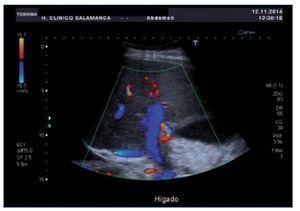
Ante la sospecha inicial de IRA de origen nefrotóxico en una paciente con bajo volumen efectivo circulante, se realizó ajuste posológico, se pautaron expansores del plasma, se forzó la diuresis y se solicitaron una radiografía de tórax y una ecografía renal urgentes (figura 1) que mostraron derrame pleural, ascitis en cuantía discreta, hígado aumentado de tamaño con signos de hepatopatía difusa, inversión del flujo portal y aumento de calibre de la arteria hepática.
Figura 1. Ecografía renal de la paciente en el momento del diagnóstico del SOS hepático. Destaca la inversión del flujo portal y aumento de calibre de la arteria hepática.
En ese momento, el diagnóstico diferencial se estableció con la EICH aguda, que se excluyó al no existir manifestaciones clínicas a otros niveles, con el síndrome de Budd-Chiari, que se descartó al no existir datos ecográficos sugestivos de trombosis de las venas suprahepáticas, y con la nefro/hepatotoxicidad medicamentosa, no presente en ese momento por tener la paciente niveles de medicación dentro del rango terapéutico (tabla 2). Se diagnosticó de SOS hepático con IRA secundaria por síndrome hepatorrenal de acuerdo con los criterios clínicos de Baltimore7 apoyados por los hallazgos ecográficos. En las 24 horas siguientes, tras cesar la clínica hemorrágica, se inició tratamiento con defibrotide, que se mantuvo durante 19 días (día +32) hasta que los signos/síntomas de la enfermedad desaparecieron. El síndrome hepatorrenal se trató con restricción hídrica, expansores del plasma (12 concentrados de hematíes y albúmina), diuréticos (espironolactona y furosemida) y terlipresina. A las 48 horas del diagnóstico, la paciente asoció taquipnea intensa e incremento en las necesidades de oxigenoterapia, que obligó a realizar paracentesis para disminuir la presión intraabdominal. Durante el ingreso, la paciente también recibió transfusión de 40 unidades de plaquetas. La evolución clínica y analítica (figuras 2 y 3) de la paciente fue buena, siendo dada de alta el día +36 con normalización de la función renal y hepática. El control ecográfico posterior (día +28) objetivó flujo portal alternante centrípeto-centrífugo, con normalización del flujo en control ecográfico realizado tras el alta (día +90). La reevaluación de la paciente y la enfermedad hematológica, mediante PET-TC, el día +90 reflejó que la paciente estaba en remisión completa.
Figura 2. Evolución de la Cr (mg/dl) y de la BT (mg/dl) desde la realización del trasplante alogénico.
Figura 3. Evolución de AST (U/l) y ALT (U/l) desde el ingreso de la paciente para la realización del trasplante alogénico.
DISCUSIÓN
Los pacientes con trasplante de células hematopoyéticas tienen mayor riesgo de presentar IRA e insuficiencia renal crónica. La incidencia de IRA varía en la literatura médica según la definición utilizada. El riesgo de IRA es mayor en trasplantes alogénicos (30-70 %) que autólogos (12-24 %) y en trasplantes mieloablativos que en no mieloablativos. Los pacientes con IRA tienen un riesgo aumentado de muerte en los 6 meses que siguen al trasplante, y su supervivencia es 20 % menos en los 1-5 años siguientes respecto a los pacientes sin IRA1,2. La etiología de la IRA es diversa según el momento de aparición y en muchas ocasiones de origen multifactorial. Algunas de las causas son exclusivas de los pacientes con trasplante de médula ósea, como son la toxicidad medular tras la transfusión o el SOS hepático3,4.
El SOS hepático es el término utilizado para describir el síndrome clínico que cursa con ganancia de peso, hepatomegalia e ictericia tras un trasplante de células hematopoyéticas3; es una de las complicaciones más relevantes que aparecen en el postrasplante inmediato4. Sin embargo, también puede ser secundario al empleo de quimioterapia, ingestión de alcaloides, altas dosis de radiación o trasplante hepático8. Su incidencia es del 10-15 % después del trasplante alogénico cuando se utilizan regímenes de acondicionamiento mieloablativos, e inferior al 5 % usando regímenes de acondicionamiento de intensidad reducida o tras trasplante autólogo. Afortunadamente, en la mayoría de los pacientes (75-80 %) se resuelve en 2-3 semanas. Sin embargo, en las formas graves la mortalidad supera el 80 %9,10.
Son factores de riesgo de SOS hepático: edad inferior a 7 años, género femenino (probablemente por el empleo previo de progesterona), mala situación basal, recaída de la enfermedad, enfermedad hepática preexistente, irradiación hepática previa, capacidad de difusión pulmonar alterada, serología para citomegalovirus positiva, infección por hepatitis C, sobrecarga de hierro, administración previa de gemtuzumab, y factores relacionados con el trasplante como trasplante de células hematopoyéticas previo, trasplante alogénico frente a autólogo, incompatibilidades HLA5,6, dosis de irradiación que excedan 13-15,75 Gy (sobre todo en dosis única), regímenes de acondicionamiento11 que incorporen determinados alcaloides tóxicos y fármacos como citarabina, mitomicina, azatioprina o busulfán, sobre todo si se asocia con ciclofosfamida, prevención de la EICH que incluya sirolimus, y administración de diferentes medicaciones durante el trasplante como ketoconazol, metotrexato, anticalcineurínicos, anfotericina B, vancomicina o aciclovir. En nuestro caso, la paciente era candidata a un segundo trasplante, y a pesar de prescribirse un régimen de acondicionamiento de intensidad reducida, tenía numerosos factores de riesgo de SOS hepático: mujer, tres recaídas de la enfermedad con trasplante previo de células hematopoyéticas, irradiación previa con altas dosis, trasplante alogénico con incompatibilidades HLA5,6, régimen de acondicionamiento que incluía ciclofosfamida y busulfán11, y tratamiento posterior con tacrolimus, vancomicina y aciclovir.
Independientemente de la causa, el SOS hepático aparece como consecuencia del daño endotelial7,8. Las células endoteliales sinusoidales y los hepatocitos de la zona 3 de los acinos resultan dañados por metabolitos tóxicos generados por el régimen de acondicionamiento, así como por las citocinas, quimiocinas y heparanasas liberadas por los tejidos dañados. En las células endoteliales dañadas aparecen orificios. Los glóbulos rojos, leucocitos y restos celulares pasan a través de los mismos y se acumulan en el espacio de Dissé, lo que provoca el estrechamiento progresivo de la luz de las vénulas, la reducción en el flujo de salida venoso sinusoidal, la hipertensión portal post-sinusoidal y el síndrome hepatorrenal. Paralelo a las lesiones, existe un estado procoagulante con incremento del factor de von Willebrand, factor VIII, fibrinógeno, complejo trombina-antitrombina, trombomodulina y descenso en los niveles de proteína C, antitrombina y factor VII; estas alteraciones en la coagulación son una consecuencia del daño endotelial y probablemente desempeñen un papel secundario en la patogenia del SOS hepático, independientemente de su contribución a la oclusión sinusoidal. Todas estas alteraciones de la coagulación estaban presentes en nuestro caso.
El SOS hepático se presenta dentro de las primeras 3 semanas tras el trasplante. Suele cursar con ganancia de peso inexplicada, seguida de alteración en la función hepática, hepatomegalia dolorosa y ascitis. Aproximadamente la mitad desarrollan IRA y un cuarto requieren hemodiálisis. Finalmente, una minoría desarrollarán fallo multiorgánico, encefalopatía hepática y muerte. En los casos graves, existe elevación del tiempo de protrombina. La trombocitopenia refractaria a la transfusión de plaquetas es común y puede preceder a otros síntomas. Un porcentaje de pacientes desarrolla confusión, sangrado e insuficiencia cardíaca4,9. La IRA tiene las características del síndrome hepatorrenal12,13.
El diagnóstico de SOS es clínico, y habitualmente no es preciso ni posible realizar biopsia renal o hepática, dada la trombopenia y los trastornos de la coagulación. La medición del gradiente de presión venosa hepática a través de la vena yugular es el método diagnóstico más preciso para confirmar y evaluar la gravedad del SOS hepático. La ecografía puede ayudar a la hora de realizar el diagnóstico diferencial; pone de manifiesto la existencia de hepatomegalia, ascitis y atenuación o inversión del flujo venoso hepático. En nuestro caso, la ecografía contribuyó al diagnóstico de forma significativa. Para diagnosticar el SOS hepático se recurre a los criterios de Seatle14 (dos o más de los siguientes eventos en los 20 días postrasplante: bilirrubina > 2 mg/dl, hepatomegalia o dolor en el hipocondrio derecho, ganancia de peso por retención de líquidos > 2 % del peso basal) o de Baltimore7 (bilirrubina > 2 mg/dl dentro de los 21 días posteriores al trasplante más al menos dos de los siguientes criterios: hepatomegalia, ascitis, ganancia de peso > 5 % respecto al peso pretrasplante). La aproximación clínica a la gravedad del SOS hepático se establece de acuerdo con las siguientes variables: bilirrubina total (leve < 5 mg/dl, moderada 5,1-8 mg/dl, grave > 8 mg/dl), AST (leve < 3 x normal, moderada 3-8 x normal, grave > 8 x normal), ganancia de peso (leve < 2 %, moderada 2-5 %, grave > 5 %), creatinina sérica (leve normal, moderada < 2 x normal, grave > 2 x normal), y tiempo de instauración (leve 6-7 días, moderado 4-5 días, grave 2-3 días)3,7,8. En nuestro caso, la paciente cumplía tanto los criterios clínicos de Seatle14 como de Baltimore7, y presentaba un SOS hepático grave.
El diagnóstico diferencial debe realizarse con el síndrome de Budd-Chiari, la EICH aguda, las infecciones hepáticas y la toxicidad medicamentosa3,10.
La prevención del SOS hepático es preferible al tratamiento. Deben minimizarse los factores de riesgo modificables, evitar el empleo de medicación hepatotóxica y utilizar medidas farmacológicas preventivas como ácido ursodesoxicólico. El tratamiento del SOS hepático depende de la gravedad15. El tratamiento de soporte es fundamental, prestando especial atención al balance de líquidos y sodio, el mantenimiento del volumen intravascular y la perfusión renal. Los diuréticos pueden reducir la retención de agua y sal en pacientes con exceso de volumen extracelular1,2. La terlipresina es el vasoconstrictor más utilizado en los pacientes con síndrome hepatorrenal tipo 1, donde sola o junto con albúmina, reduce la mortalidad de forma significativa12. Otras medidas adicionales, como paracentesis o toracocentesis, deben aplicarse con precaución para evitar la reducción del flujo renal. Cuando la sobrecarga de volumen y la insuficiencia renal no puedan ser controladas médicamente se recurrirá a hemodiálisis/ hemofiltración16. Para los pacientes con formas graves se recomienda el empleo de defibrotide (6,25 mg/kg i.v./6 h)17. Su mecanismo de acción no es bien conocido, pero ha demostrado efectos antiinflamatorios, antitrombóticos y antiapoptóticos sobre
las células del endotelio. Incrementa los niveles de prostaglandinas I2, E2, prostaciclinas, y tPA que aumenta la fibrinólisis. Debido a su modesto efecto anticoagulante, es relativamente seguro en situación de trombopenia18. La administración de defibrotide debe iniciarse precozmente, ya que un retraso en las primeras 48 horas tras el diagnóstico reduce la tasa de remisión completa, y debe mantenerse hasta que los signos/síntomas de la enfermedad desaparezcan o un mínimo de 21 días. En Europa solo está aprobado su uso desde octubre de 2013 para el tratamiento y no prevención de las formas graves de SOS hepático19. No obstante, las guías clínicas de la Sociedad Británica de Sangre y Trasplante de Médula Ósea20 sugieren su empleo preventivo en adultos y en niños con trasplante alogénico de células hematopoyéticas y factores de riesgo20.
En nuestro caso, deberían haberse minimizado los numerosos factores de riesgo modificables de SOS hepático que presentaba la paciente, con el objeto de reducir las posibilidades de aparición del mismo. No obstante, sí se empleó ácido ursodexosicólico como medida preventiva. Tanto la instauración precoz de medidas de soporte, como la utilización de albúmina y terlipresina para el tratamiento del síndrome hepatorrenal y el inicio en las primeras 24 horas tras el diagnóstico del tratamiento con defibrotide, influyeron en el pronóstico de la paciente y en su curación.
En resumen, la IRA es una complicación frecuente en el postrasplante de células hematopoyéticas. Su etiología difiere según el momento de aparición y en muchas ocasiones su origen es multifactorial. Los nefrólogos deben estar familiarizados, especialmente con aquellas etiologías “casi” exclusivas de los pacientes con trasplante de médula ósea, como el SOS hepático. Debemos tener en cuenta que el síndrome hepatorrenal no es una entidad exclusiva de los pacientes cirróticos, sino que puede ser secundario al SOS hepático, entidad cuya gravedad requiere un diagnóstico e inicio de tratamiento precoz con defibrotide.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Correspondencia: Pilar Fraile Gómez
Servicio de Nefrología.
Hospital Universitario de Salamanca.
Paseo de San Vicente, 58-182. 37007 Salamanca.
pilarfg@usal.es