El síndrome de Gitelman es una tubulopatía infrecuente que habitualmente cursa con hipopotasemia e hipomagnesemia. El embarazo, fisiológicamente, implica cambios que incluyen una mayor necesidad de aportes iónicos. La asociación de síndrome de Gitelman y embarazo está descrita en muy pocos casos y su manejo excepcional requiere un control exhaustivo. Se presenta dicha situación en una mujer de 41 años, y se describen las dificultades terapéuticas y su control durante la gestación.
INTRODUCCIÓN
El síndrome de Gitelman (SG) es un trastorno tubular que afecta a la actividad del cotransportador cloro-sodio (CTCN) sensible a tiazidas y a los canales de magnesio localizados en el túbulo contorneado distal (TCD); se caracteriza por hipokaliemia, hipomagnesemia, alcalosis metabólica, hipocalciuria e hiperaldosteronismo hiperreninémico sin hipertensión arterial, debido a una mutación del gen SLC12A3 localizado en el cromosoma 16q13, que muestra una transmisión autosómica recesiva1,2.
Desde el punto de vista clínico, la mayoría de los pacientes presentan síntomas leves neuromusculares, de inicio en la infancia tardía o en la juventud. Los episodios intercurrentes suelen empeorar las alteraciones electrolíticas, con manifestaciones clínicas variables. Se presenta el curso clínico, el enfoque terapéutico planteado y la evolución de una paciente de 41 años diagnosticada de SG que desarrolla una gestación a término.
CASO CLÍNICO
Mujer de 41 años, diagnosticada de SG hacía 5 años debido a las mutaciones p.Ser350Leu y p.Leu859Pr. En situación clínica estable, en tratamiento oral con cloruro potásico, hidróxido de magnesio y espironolactona, expresó su deseo de ser madre mediante fecundación in vitro. En ese momento, basándonos en las recomendaciones de la Food and Drug Administration (FDA) de uso de fármacos en el embarazo, se estimó conveniente la conversión a amiloride (categoría B) en sustitución de espironolactona (categoría C)3,4. Las cifras de K y de Mg se mantuvieron en torno a 3,4 mmol/l y 1,8 mg/dl, respectivamente. La dosificación oral estaba condicionada por una intolerancia digestiva a dosis elevadas de Mg.
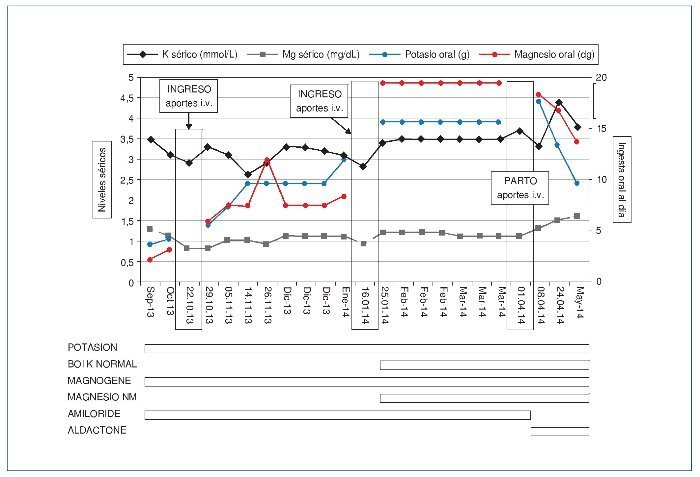
Una vez realizado el procedimiento, con la gestación en curso, se establecieron controles analíticos cada 2-3 semanas. Se ajustaron los aportes orales sobre la base de las cifras iónicas, con incremento de la dosis de amiloride de 5 a 10 mg/día. Se estableció de forma consensuada que si los valores de K eran < 3 mmol/l o los de Mg eran < 1 mg/dl o, independientemente de los valores, se acompañaba de sintomatología, se recurriría a suplementación intravenosa. Durante el embarazo, los valores séricos de K y Mg se monitorizaron estrechamente, y oscilaron entre 2,7 y 3,6 mmol/l y 0,5 y 1,9 mg/dl, respectivamente (figura 1).
Figura 1. Evolución de los valores de K y Mg séricos y las dosis orales durante el seguimiento.
Fechas de ingreso: 22-10-2013 y 16-1-2014. Fecha ingreso por parto: 1-4-2014. Potasion cápsulas: 600 mg; Boi K normal comprimidos: 1.000 mg; Magnogene: 53 mg, y Magnesio NM: 200 mg. Amiloride: 10 mg. Aldactone: 50 mg. i.v.: intravenosos.
Durante el embarazo presentó dos ingresos, el primero en la semana 13 de gestación debido a hipomagnesemia de 0,8 mg/dl e hipopotasemia de 2,9 mmol/l, ambas asintomáticas y sin repercusión fetal, que se resolvieron mediante la administración intravenosa de sulfato magnésico y cloruro potásico durante 2 semanas, presentando al alta hospitalaria una magnesemia de 1,7 mg/dl y una kaliemia de 3 mmol/l, por lo que se intensificó el tratamiento oral, hasta alcanzar dosis de 8,4 g/día de hidróxido de magnesio y 12.000 mg/día de cloruro potásico. Los controles posteriores mostraron cifras de magnesemia > 1 mg/dl y kaliemia > 3 mEq/l, y dichos límites se establecieron como los de seguridad para mantener un tratamiento oral exclusivo. A los 6 meses de gestación fue necesario un segundo ingreso de 1 semana de duración por hipomagnesemia de 0,9 mg/dl e hipopotasemia de 2,8 mmol/l. Pese a ello, el embarazo transcurrió sin complicaciones y la paciente permaneció asintomática durante este. Finalmente, a las 39+3 semanas de gestación, en situación de estabilidad electrolítica, ingresó para la realización de cesárea electiva. Los valores de K y Mg séricos al ingreso fueron de 3,6 mmol/l y 1,7 mg/dl, respectivamente. Se realizó el procedimiento quirúrgico sin complicaciones. Los aportes intravenosos de sulfato de magnesio y cloruro potásico se mantuvieron durante el perioperatorio.
El recién nacido no presentó complicaciones, tenía un peso de 3.010 g y un test de Apgar de 8/9. La paciente fue dada de alta 5 días después de la intervención, con valores de K y Mg séricos de 3,3 mmol/l y 1,3 mg/dl, respectivamente, con una buena situación clínica. Posteriormente se reinstauró la pauta de suplementación oral de hidróxido de magnesio y de cloruro potásico. A su vez se reinició el tratamiento con espironolactona (50 mg/día) durante el período de lactancia, dada su mínima eliminación en la leche materna y su mayor eficacia para el control iónico, suspendiéndose el tratamiento con amiloride.
DISCUSIÓN
El SG es un trastorno tubular hereditario que se transmite mediante herencia autosómica recesiva. Afecta a la actividad del CTCN sensible a tiazidas localizado en el TCD y se debe a una mutación en el gen SLC12A3, la cual inactiva este cotransportador. Se han podido identificar más de 140 mutaciones diferentes a lo largo de toda la proteína que codifica dicho gen e incluso, en una minoría de pacientes, se han identificado mutaciones en el gen CLCNKB, que codifica para el canal de cloro, y se considera una variante del síndrome de Bartter. La prevalencia del SG es de aproximadamente 1:40.000, mientras que la prevalencia de sujetos heterocigotos es aproximadamente de un 1 %, por lo que es una de las enfermedades tubulares renales hereditarias más frecuentes. Su presentación clínica se caracteriza por hipopotasemia, alcalosis metabólica, hipomagnesemia e hipocalciuria y, aunque cursa con hiperaldosteronismo hiperreninémico, generalmente la hipertensión está ausente.
Hasta el momento hay pocos casos descritos en la bibliografía de embarazo en mujeres diagnosticadas de SG, por lo que su impacto a nivel de viabilidad fetal es poco conocido. Con el caso presentado por Mathen et al en 2013 se han contabilizado 25 embarazos en 19 mujeres con SG5-8. Nuestra paciente presenta la particularidad de ser la gestante de mayor edad con SG de todos los casos descritos hasta la fecha que logra una gestación a término.
En el caso que se presenta, aunque la paciente debutó con una marcada hipomagnesemia, esta no siempre se objetiva y en la mayoría de los SG es de carácter leve. La mayor parte de los pacientes con SG están asintomáticos, por lo que se diagnostican de forma tardía, en comparación con otras tubulopatías, y la forma clínica más grave, que se manifiesta por tetania y/o parálisis muscular, se describe en pocos casos. El valor sérico de Mg depende del balance entre la absorción intestinal y la excreción renal de este, ambas reguladas por la expresión del canal TRPM6 localizado en la membrana apical de las células intestinales y del TCD. El 15-20 % del Mg filtrado se reabsorbe en el túbulo proximal y, entre un 50 y 70 %, en la porción gruesa de la rama ascendente de Henle, vía paracelular por difusión pasiva. Finalmente, entre un 5 y un 10 % se reabsorbe en el TCD vía transcelular a través del canal TRPM6, el cual ejerce un papel clave en la regulación de la excreción renal de Mg. En el SG, la disminución de la expresión del canal TRPM6 ocasionada por mutaciones de genes que codifican este canal provoca una disminución de la reabsorción de Mg con la consiguiente hipermagnesuria e hipomagnesemia. Por otro lado, el descenso de actividad CTCN sensible a tiazidas del TCD provoca la pérdida de cloruro sódico y, a su vez, la contracción del volumen intravascular, con la consiguiente activación del eje renina-angiotensina-aldosterona1. El incremento sérico de aldosterona provoca un aumento de la reabsorción de Na a nivel del túbulo colector cortical y la secreción de K e hidrogeniones, dando lugar a hipopotasemia y alcalosis metabólica, alteraciones todas ellas presentes en el SG.
Además de las alteraciones iónicas asociadas a la propia tubulopatía, el embarazo puede disminuir los valores de Mg debido a la expansión del espacio extracelular y al aumento de su excreción renal. El control de los valores séricos de Mg y K en el embarazo es difícil, como se puede objetivar en el caso clínico que se muestra. Sin embargo, a pesar de esto, las complicaciones maternas y fetales son infrecuentes9,10. En los casos clínicos que se han publicado hasta el momento, solo se ha descrito un caso de muerte fetal11. La hipomagnesemia durante el embarazo se asocia a una mayor tasa de abortos, de hemorragia periventricular, de alteraciones en el crecimiento intrauterino y de riesgo de oligohidroamnios. Además, la morbimortalidad materna puede aumentar de manera significativa debido a las complicaciones asociadas al desequilibrio electrolítico2,7. Habitualmente es preciso aumentar la suplementación de Mg y K para reponer el déficit corporal total de estos iones. En nuestro caso, la paciente recibió suplementos orales de cloruro potásico y Mg durante todo el embarazo, precisando el incremento de estos, con aportes intravenosos en dos ocasiones.
En la mitad de los casos descritos en la bibliografía se necesitan aportes intravenosos a lo largo del embarazo, debido a la presencia o exacerbación de los síntomas y/o a alteraciones continuas o persistentes en los valores plasmáticos de Mg y K7-10. En el momento del parto, las mujeres con SG precisan un mayor control, ya que pueden presentar mayor riesgo de complicaciones asociadas a la anestesia y al trabajo del parto, como espasmo laríngeo, arritmias ventriculares, parestesias, tetania, convulsiones e incluso coma. En nuestro caso transcurrió sin incidencias, mediante cesárea con administración intravenosa y ajuste de iones de forma controlada.
Las mujeres con diagnóstico de SG que se quedan o desean quedarse embarazadas deberían ser atendidas por un equipo médico multidisciplinar, con seguimiento estrecho previo del embarazo, con el objeto de optimizar los valores de los electrolitos durante la gestación y disminuir la incidencia de efectos secundarios a la exacerbación de la hipomagnesemia e hipopotasemia. En algunos casos complejos pueden precisar el uso de diuréticos ahorradores de K. Aunque algunos autores ponen en duda el riesgo del uso de espironolactona en el embarazo, en nuestro caso se decidió sustituir el tratamiento de base con espironolactona por amiloride, basándonos en las recomendaciones de la FDA sobre riesgos de uso de fármacos en el embarazo (categoría C frente a B) y los posibles efectos antiandrogénicos asociados a la espironolactona durante la gestación12,13. En este sentido, en el futuro puede jugar un papel el uso de la eplerenona14,15. La tolerancia al amiloride fue excelente, sin hipotensión destacable, como en otros trabajos ya descritos16,17.
Finalmente, una vez acontecido el parto se reinició el tratamiento con espironolactona y se suspendió el amiloride, dado su baja eliminación por la leche materna y su mejor control iónico. Aunque no existen estudios reglados sobre su administración en lactantes, no parece presentar efectos secundarios, con la precaución de no provocar una diuresis intensa que podría condicionar el cese de la lactancia18. En resumen, el SG es una situación de riesgo durante el embarazo, que requiere una aproximación multidisciplinaria y, aunque solo están descritos casos aislados, dichas experiencias pueden aportar información relevante para futuras situaciones.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Correspondencia: José Luis Merino Rivas
Sección de Nefrología.
Hospital Universitario del Henares.
Av. de Marie Curie, 2. 28822 Coslada, Madrid.
jluis.merino@salud.madrid.org