Las glomerulonefritis membranoproliferativas (GNMP) mediadas por inmunocomplejos constituyen un patrón histológico de afectación glomerular producido por diferentes enfermedades. Tanto el aumento de la producción de inmunocomplejos por enfermedades autoinmunes o infecciones como la disminución del aclaramiento hepático de los mismos pueden producir GNMP. Este último mecanismo es menos frecuente y sería la manera por la que un shunt portosistémico podría producir GNMP1.
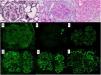
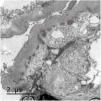
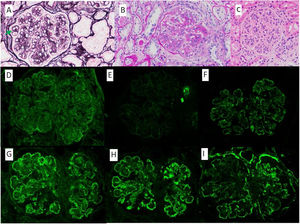
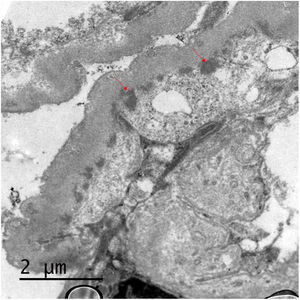
Se presenta el caso de una mujer de 53 años con antecedente de VIH en tratamiento antirretroviral, cirrosis secundaria a VHC (diagnosticada en 2008 y tratada en 2016, con respuesta viral sostenida posterior) sin hipertensión portal, e hipertensión arterial con función renal normal. Se inicia estudio de proteinuria nefrótica al encontrarse en una analítica de rutina una proteinuria de 4.076mg/g de creatinina con albuminuria de 3.662mg/g de creatinina, microhematuria, hipercolesterolemia (263mg/dl), sin hipoalbuminemia y sin síndrome nefrótico clínico. El estudio inmunológico fue normal salvo ANA positivos a 1/160, C4 disminuido (10,7mg/dl) y un factor reumatoide discretamente elevado (con crioglobulinas negativas). En ese momento las cargas virales de VIH y VHC se mantenían indetectables, y como parte del estudio se solicitó un escáner con contraste en el que se observó un shunt entre la vena mesentérica superior y la vena gonadal derecha. En vista de los hallazgos descritos, se decide realizar biopsia renal en la que se observa una lesión difusa con glomérulos hipercelulares, con acentuación del patrón lobular y presencia de dobles contornos con la técnica de PAS (fig. 1). Asimismo, existen depósitos subendoteliales, así como oclusión de las luces capilares. En la inmunofluorescencia se observan depósitos difusos y generalizados en asas capilares y a nivel mesangial de manera focal de aspecto granular de IgA (+), IgG (+++), IgM (++), C3 (+++), cadenas ligeras Kappa (+) y cadenas ligeras Lambda (++) (fig. 1). La microscopia electrónica muestra membranas basales con frecuentes depósitos electrodensos, no estructurados en la vertiente subepitelial de la membrana basal con reduplicación de esta, además de fusión pedicelar extensa (fig. 2).
A) Plata metenamina, ×40: glomérulo con aumento de matriz mesangial y dobles contornos focales (flecha). B) PAS, ×40: glomérulo con presencia de dobles contornos y oclusión de luces capilares. C) HE, ×40: glomérulo con acentuación del patrón lobular y aumento de la celularidad endocapilar. Depósitos mesangiales y en asas capilares granulares de IgG +++ (D), IgA + (E), IgM ++ (F), Kappa + (G), Lambda ++ (H) y C3 +++ (I).
Se diagnostica a la paciente de GNMP en probable relación a shunt portosistémico, por lo que se programa para embolización. Se realiza una primera embolización en julio de 2020 que es parcialmente efectiva, siendo la segunda completamente efectiva en junio de 2021. Tras esta ha presentado una normalización de las cifras de C4 y colesterol, y una disminución de la proteinuria hasta 88mg/g de creatinina en su última revisión (tabla 1).
Evolución analítica de la paciente
| 06/2020 | 10/2020 | 12/2020 | 02/2021 | 07/2021 | 09/2021 | |
|---|---|---|---|---|---|---|
| Colesterol (mg/dl) | 263 | 225 | 219 | 176 | 190 | 185 |
| Proteinuria (mg/g) | 4.076 | 2.173 | 985 | 615 | 529 | 88 |
| Albuminuria (mg/g) | 3.662 | 1.388 | 592 | 419 | 47 | |
| C4 (mg/dl) | 10,7 | 13 | 14,4 | 19 | ||
| Intervenciones | Primera embolización parcialmente eficaz en agosto | Espironolactona 25mg | Embolización eficaz |
Los shunts portosistémicos pueden producir GNMP tanto en pacientes con cirrosis tratados con shunts intrahepáticos transyugulares como en no cirróticos con shunts congénitos2–4. El mecanismo fisiopatológico subyacente parece estar relacionado con las células de Kupffer. A nivel hepático estas células se encargan del aclaramiento de inmunocomplejos3; no obstante, en las circunstancias en las que su función está disminuida (sea por cirrosis o por disminución del flujo portal), se produciría un aumento sistémico de inmunocomplejos circulantes depositándose estos a nivel renal.
Desde el punto de vista anatomopatológico, las GNMP secundarias a shunts pueden producir depósitos C3, C4, IgM, IgG, C1q con predominancia de IgA2,5. Además, la dominancia de los depósitos de IgA parece depender de la magnitud del shunt, siendo mayor en aquellos casos en los que la ratio del shunt es menor4; esto parece tener relación con el hecho de que IgA2 procede fundamentalmente del tracto gastrointestinal, y al producirse un shunt, estos inmunocomplejos pasarían a la circulación sistémica1. En nuestro caso, el depósito de IgA no fue dominante, lo que pudo deberse a que la ratio del shunt era elevada. Por otro lado, en la inmunofluorescencia, además de IgA, IgG, IgM y C3 encontramos cadenas ligeras Kappa y Lambda, hecho que no estaba descrito hasta este momento en la literatura.
Por último, el tratamiento de elección parece ser la embolización del shunt; en muchos casos con esta se consigue la normalización de las cifras del complemento, la hipoalbuminemia, así como la mejoría de la proteinuria y de la encefalopatía hepática4. En nuestro caso, tras la embolización del shunt se observó la normalización del complemento y la hipercolesterolemia, y una mejoría drástica de la proteinuria.