La hemoglobinuria paroxística nocturna (HPN) es un trastorno secundario a la deficiencia de CD55 y CD59, proteínas de superficie reguladoras del complemento, resultando en hemólisis crónica mediada por el complemento1. La afectación renal oscila entre la lesión renal aguda durante las crisis hemolíticas, la disfunción tubular proximal (DTP) y la enfermedad renal crónica (ERC)2. La hemoglobinuria solo ocurre en el 25% de los pacientes3, en series recientes se ha reportado una incidencia del 64% de ERC, con hasta un 20% de ERC estadio 3-54.
Se presentan 2 casos de HPN en el que los depósitos de hemosiderina visualizadas por resonancia magnética (IRM) parecen ser los primeros signos de afectación renal.
Caso 1Varón de 41 años, remitido para evaluación por hallazgo de proteinuria. Diagnóstico de HPN en contexto de anemia hemolítica. No requería transfusiones sanguíneas y no presentaba eventos trombóticos. Las pruebas de laboratorio mostraron actividad hemolítica persistente, LDH elevada (1.800-3.000U/l) y haptoglobina indetectable, hemoglobina de 8,5mg/dl, leucopenia y trombocitopenia leves, ferritina normal de 25ng/ml.
Presentaba crisis hemolíticas recurrentes con fatiga, disfagia, dolor abdominal y orina oscura. Los episodios solían durar de 1-3 días, cada 2-3 meses.
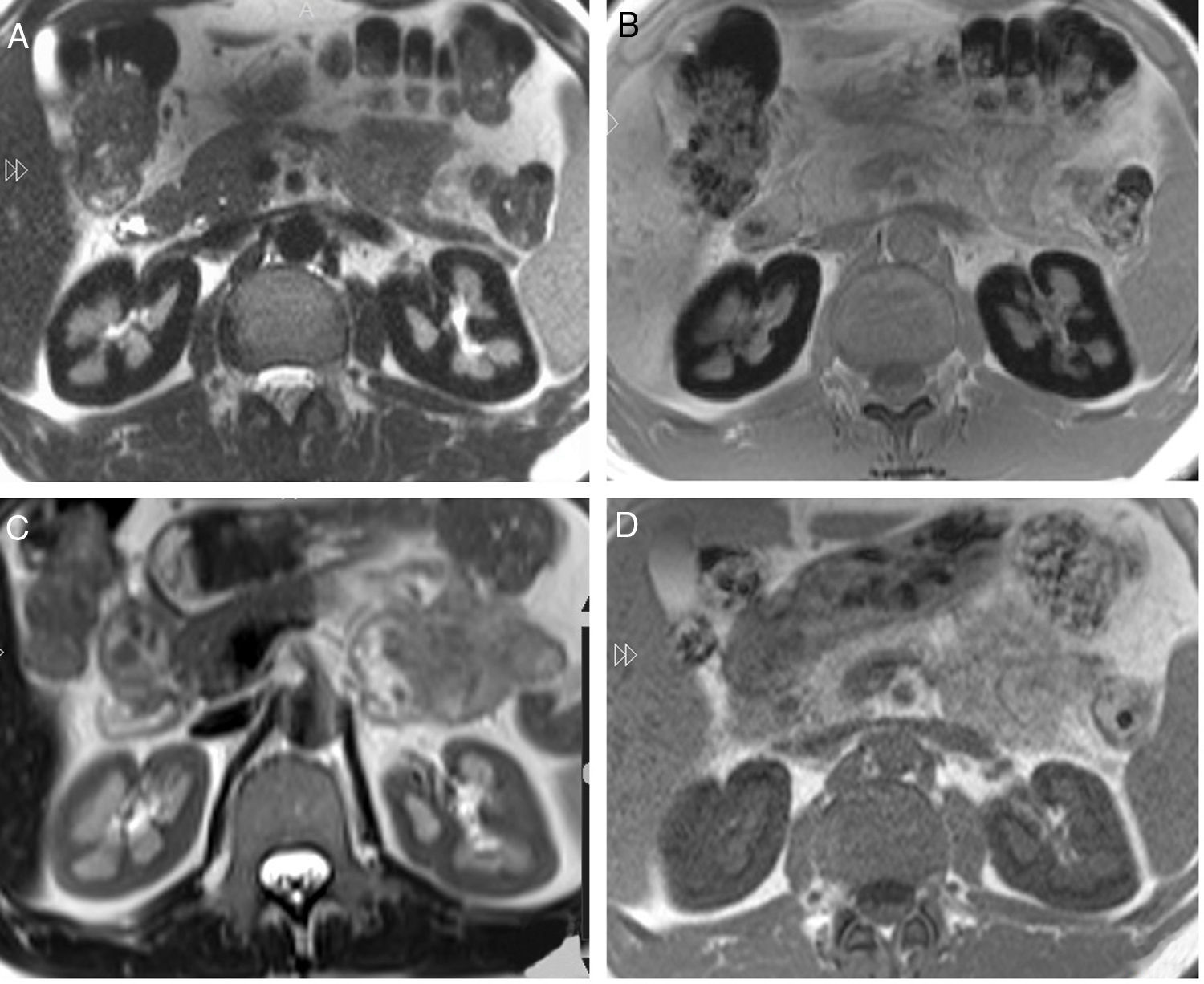
La función renal era normal, creatinina sérica de 0,9mg/dl y FG (MDRD)>60ml/min. Hemoglobinuria persistente con sedimento urinario normal, y proteinuria de 1,3g/día con albuminuria 170mg/día y aminoaciduria no selectiva, indicando DTP. El estado ácido-base, fosfato y ácido úrico eran normales. Se consideró la posibilidad de DTP por depósito de hemosiderina, por lo que se realizó una IRM con el hallazgo de hipointensidad cortical renal bilateral compatible con depósito de hierro (fig. 1A y B). Se planteó inicio de terapia con eculizumab, pero se desestimó debido a la falta de requerimiento transfusional y normalidad del FG.
A) Secuencia axial T2. Hipointensidad difusa de la corteza renal en comparación con el hígado y el músculo esquelético. B) Secuencia axial T1, también muestra una señal baja de la corteza renal en comparación con el hígado y el músculo esquelético. C) RMI del mismo paciente, 14 meses después del inicio del tratamiento. Secuencia de imágenes T2 axial con importante mejora de la hipointensidad de señal en T2. D) Axial T1 confirma el importante aumento de la señal de la corteza renal en comparación con el estudio anterior.
Dos años más tarde, presentó una crisis hemolítica severa con insuficiencia renal aguda, la cual se atribuyó a hemoglobinuria. El paciente fue tratado con medidas conservadoras, presentando recuperación de la función renal en 18 días. Tras este episodio se comenzó tratamiento con eculizumab. En unas pocas semanas, la LDH y la hemoglobina casi se normalizaron, manteniendo bajos niveles de haptoglobina. En los siguientes meses, la proteinuria tubular se normalizó progresivamente.
Catorce meses después del inicio de eculizumab, una nueva IRM mostró una mejora en la hipointensidad de señal en la corteza renal del 34 y 51% en los riñones izquierdo y derecho, respectivamente, indicando la eliminación parcial de los depósitos de hierro en el riñón (fig. 1C y D).
Caso 2Varón de 40 años con diagnóstico reciente de la HPN, remitido para evaluación renal. En los 9 meses anteriores había presentado episodios repetidos de orina oscura y dolor lumbar bajo. Presentaba anemia hemolítica severa, hemoglobina de 7,7mg/dl, haptoglobina indetectable, LDH elevada 3.800 U/l, requiriendo transfusión de hematíes. La ferritina y saturación de transferan normales. Función renal normal, creatinina 0,8mg/dl, proteinuria de 427mg/24h, con albuminuria de 120mg/24h. Hemoglobinuria con sedimento normal, glucosuria negativa y excreción fraccional de fosfato normal.
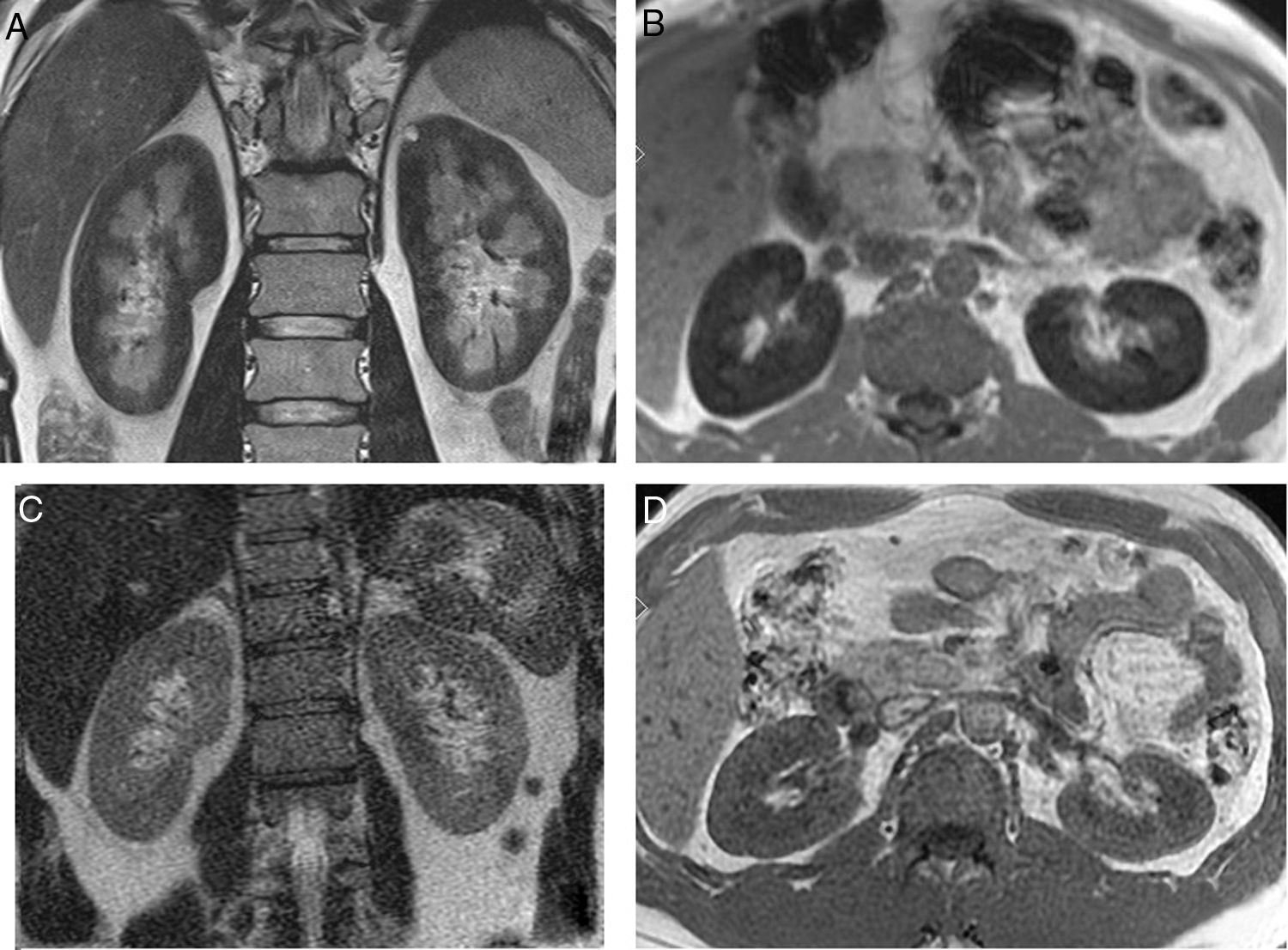
En los 10 meses posteriores presentó crisis hemolíticas repetidas, con hemoglobinuria macroscópica. Refería dificultad para concentrarse y dolor de cabeza recurrente. Una IRM evidenció una marcada hipointensidad de señal en la corteza renal en todas las secuencias (fig. 2A y B), y una IRM cerebral reveló múltiples lesiones lacunares subcorticales. Debido a la implicación cerebral atribuible a HPN, se inició tratamiento con eculizumab.
A) Secuencia coronal en T2: La hipointensidad difusa en la señal de la corteza renal sugiere la presencia de depósitos de hierro. B) Axial T1 muestra, también, una señal baja en la corteza renal en comparación con el hígado y el músculo esquelético. C) RMI del mismo paciente, 17 meses después del inicio del tratamiento. Secuencia de imágenes T2 coronal con desaparición de la hipointensidad de señal en T2. D) Axial T1, también demuestra intensidad normal en la corteza renal.
El paciente evolucionó, sin nuevas crisis de hemoglobinuria, con resolución de la anemia y normalización de LDH (persistiendo haptoglobina disminuida).
Diecisiete meses después del comienzo del tratamiento, una nueva IRM mostró normalización de la señal en la corteza renal (fig. 2C y D). La función renal se mantuvo normal, con proteinuria 130mg/día y hemoglobinuria negativa.
DiscusiónEl acúmulo de hierro visceral produce un artefacto con pérdida de señal en las secuencias de eco de gradiente y T2. Resulta de utilidad comparar la señal de la corteza renal con la del músculo esquelético, si es más baja que la muscular sugiere la presencia de hierro5.
La acumulación de hemosiderina genera radicales libres de oxígeno que conducen a la lesión mitocondrial, con los consecuentes efectos deletéreos sobre el transporte apical y basolateral6–8.
La mejora de la hipointensidad cortical indica la disminución en el depósito de hierro9,10. En nuestros pacientes, la mejora de la hipointensidad fue acompañada de la recuperación de la proteinuria tubular. Los depósitos de hemosiderina por IRM pueden ser previos a la proteinuria (caso 2).
Se ha reportado que el tratamiento con eculizumab se asoció con una mejora en el grado de la ERC después de 18 meses. Este efecto fue más pronunciado en los pacientes con ERC estadio 1-2, sugiriendo que la terapia debe iniciarse de forma precoz11.
En resumen, presentamos 2 casos de HPN con afectación renal manifiesta como proteinuria tubulointersticial y depósitos de hemosiderina, evidenciadas por resonancia magnética como la primera manifestación.