INTRODUCCIÓN
Las enfermedades glomerulares son un grupo heterogéneo de entidades, la mayoría de ellas de origen inmunológico. La morfología de la enfermedades glomerulares es muy dispar y oscila desde la normalidad óptica del glomérulo del síndrome nefrótico por cambios mínimos al exceso de células de las glomerulonefritis postinfecciosas y a la práctica sustitución del ovillo glomerular por matriz extracelular en los estados avanzados de glomerulosclerosis. Los recientes avances en el conocimiento de la patogenia del daño renal no se han traducido hasta el momento en grandes cambios terapéuticos. El estándar aceptado actualmente para este tipo de enfermedades es el uso de glucocorticoides y de otros inmunosupresores tipo ciclofosfamida, anticalcineurínicos, etc. Los tratamientos que provocan depleción de células B, tales como rituximab, están siendo considerados como un tratamiento potencial y usados cada vez con más frecuencia y, a veces, con resultados muy positivos. Revisaremos los fundamentos para este tratamiento y el estado actual de la evidencia acerca de su eficacia y toxicidad.
CD20: LA MOLÉCULA DIANA DEL RITUXIMAB
El antígeno de diferenciación restringido a los linfocitos B humanos (CD20) es una proteína hidrofóbica transmembrana de un peso molecular de 33-35 kD. Las células B se generan a partir de las células madre de la médula ósea, donde maduran desde el estadio de célula pro-B hasta el de célula B inmadura, pasando por el de célula pre-B. Tras la maduración y la selección en la médula ósea, las células B maduras salen a la circulación sanguínea como células vírgenes que, después del encuentro con el antígeno para el que son específicas, se activan y migran al compartimento perifolicular del centro germinal donde estas células B sufren un nuevo proceso de selección periférica y maduración para convertirse en células B de memoria o en células plasmáticas productoras de anticuerpos de alta afinidad. La expresión de CD20 incluye desde el estadio de célula pre-B al de célula B de memoria. Además, CD20 se expresa en más del 90% de las células B del linfoma no hodgkiniano, pero no se detecta en las células madre, pro-B o plasmáticas. De este modo, cualquier terapia dirigida frente a CD20 no actuará sobre las células plasmáticas.
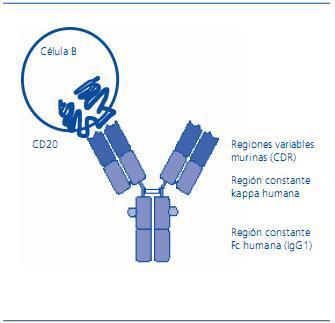
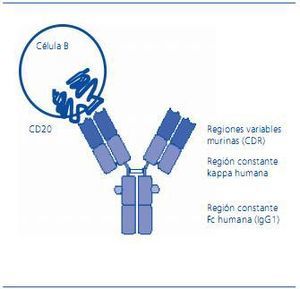
CD20 es una molécula transmembrana que presenta dos dominios pequeños extracelulares y tres dominios intracelulares que incluyen sus extremos amino-terminal y carboxi-terminal (figura 1). El dominio extracelular de 44 aminoácidos (entre el 142 y el 186) es el lugar de unión de los anticuerpos monoclonales anti-CD20 desarrollados hasta ahora, incluido el rituximab. Aunque no está claramente definida su función, parece que es el canal del calcio que actuaría en los pasos iniciales de la activación de las células B, las cuales conducen a la iniciación del ciclo celular y a su diferenciación. CD20 no se libera de la membrana, por lo que no se detecta en forma soluble, y no se internaliza tras la unión de un anticuerpo específico. De todos modos, no se ha encontrado aún el ligando fisiológico de CD20.
RITUXIMAB, UN ANTICUERPO MONOCLONAL ANTI-CD20
Rituximab es un anticuerpo monoclonal quimérico que se une de forma específica a la molécula CD20 humana. El principal mecanismo de acción atribuido a rituximab es la eliminación de las células B CD20+ fundamentalmente facilitada por la citotoxicidad dependiente de anticuerpos. Este tipo de citotoxicidad es mediada por el receptor para las IgG FcγRIII. Por ello, en los pacientes que padecen lupus eritematoso sistémico (LES), se ha descrito que este efecto del rituximab depende del alotipo del FcγRIII, el cual cambia la afinidad por el anticuerpo IgG. Actualmente, no se sabe si los polimorfismos del FcγRIII pueden modificar el efecto de rituximab en las posibles indicaciones. Además, la lisis dependiente de complemento y la apoptosis pueden contribuir a la eliminación de las células B inducida por rituximab. La inducción de apoptosis sólo se ha demostrado en líneas celulares B. De todos modos, el predominio de un mecanismo u otro parece depender del tejido u órgano donde realice su función. En este sentido, el microambiente tisular determina, en principio, un cierto estado protector de las células frente a la muerte inducida por rituximab. Así, aunque es capaz de eliminar desde las células pre-B hasta las células B de memoria, puesto que todas ellas expresan CD20, las células B del centro germinal y de la zona marginal son algo más resistentes al anticuerpo monoclonal en un modelo murino.
La eliminación de las células B circulantes y de los tejidos tras la administración de rituximab es rápida y mantenida. Con una sola dosis, ya se comprueba la reducción de células B (detectadas mediante la expresión de CD19, un correceptor del receptor de las células B) en los ganglios linfáticos a los 14 días. Las células B se eliminan en grado variable tras tres infusiones de rituximab y empiezan a recuperarse a los 6 meses, para alcanzar valores normales en sangre a los 12 meses. Dado que no se eliminan las células plasmáticas, sólo un pequeño porcentaje (<20%) de pacientes tratados con anticuerpos monoclonales muestra un descenso de la concentración sérica de inmunoglobulinas (IgG y/o IgM) por debajo de los valores de referencia de los 5 a los 11 meses de la administración de rituximab. En este sentido, ciertos autores proponen un límite superior a 300 mg/dl de IgG sérica para monitorizar un tratamiento correcto.
Rituximab, aprobado por la FDA en 1997, ha sido empleado en más de medio millón de pacientes con enfermedades hematológicas malignas bien como tratamiento de primera línea o bien en terapia de mantenimiento. Su uso ha sido también autorizado para el tratamiento de la artritis reumatoide. La dosis empleada para el tratamiento de enfermedades hematológicas es de una dosis de 375 mg/m2 semanal durante 4 semanas (dosis para «linfoma»), lo cual consigue una depleción de células B durante 6-9 meses en más del 80% de los pacientes. La experiencia en artritis reumatoide ha llevado al desarrollo de un protocolo de sólo dos dosis de 1.000 mg cada 2 semanas (dosis para «artritis reumatoide»).
SEGURIDAD CLÍNICA DE RITUXIMAB
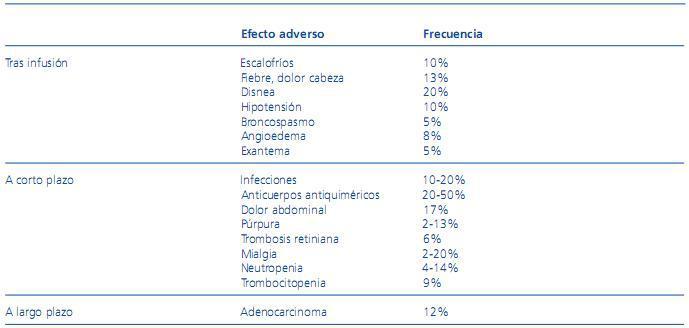
Es difícil establecer la seguridad clínica de rituximab, dado que la evidencia existente procede de los miles de pacientes tratados por neoplasias hematológicas. No es tarea fácil trasladarlo al contexto del paciente renal porque, en su mayor parte, la experiencia procede de casos esporádicos o de estudios realizados sobre poblaciones muy pequeñas y de un solo centro. Además, muchas de las reacciones adversas descritas pueden ser secundarias a la quimioterapia que se suele administrar al mismo tiempo. No obstante, estos datos sugieren que se trata de un fármaco bastante seguro y, en la mayoría de las patologías tratadas, la incidencia de efectos adversos es menor del 10% (tabla 1)1. Gran parte de los efectos adversos comunicados durante la infusión de rituximab son reacciones de hipersensibilidad que muestran una severidad clínica moderada y que se tratan con la medicación estándar. Otro tipo de efectos se observan más tardíamente, coincidiendo con la depleción de linfocitos B, entre los que destacan las infecciones, fundamentalmente del tracto respiratorio superior, con una buena respuesta a la antibioterapia. Dado que es un anticuerpo quimérico se ha descrito el desarrollo de anticuerpos antiquiméricos con significación incierta aunque relacionado probablemente con la pérdida de efectividad del rituximab.
FUNDAMENTO PARA EL TRATAMIENTO CON RITUXIMAB
Las células B ocupan un papel central en la respuesta inmune. En el contexto de la autoinmunidad, la autorreactividad T-dependiente, un importante componente de las enfermedades autoinmunes, depende de las células B bien a través de su papel como presentadoras de antígeno o bien mediante su papel como coestimuladoras. Teniendo en cuenta que la producción patológica de anticuerpos es la característica de numerosas enfermedades sistémicas que afectan al riñón, rituximab ha comenzado a emplearse en una gran variedad de estas patologías, aunque el mecanismo exacto por el cual actúa no está claramente definido. En concreto, este anticuerpo monoclonal se ha empleado, entre otros trastornos, en la glomerulonefritis membranosa, la crioglobulinemia, el lupus eritematoso, las vasculitis asociadas a ANCA, la hialinosis segmentaria y focal, en el contexto del trasplante renal para el tratamiento del rechazo humoral, etc.1. Sin embargo, las series publicadas hasta ahora en este tipo de trastornos son pequeñas, sin estudios controlados y probablemente no se han publicado aquellos casos con resultados negativos. Son necesarios estudios controlados aleatorizados que garanticen las diversas indicaciones del rituximab.
A continuación se detallan las experiencias encontradas en la literatura para el tratamiento de enfermedades glomerulares.
Rituximab en la nefropatía membranosa
El depósito subendotelial de IgG en la membrana basal glomerular en respuesta a un antígeno desconocido es la base de esta glomerulonefritis (GN). Este
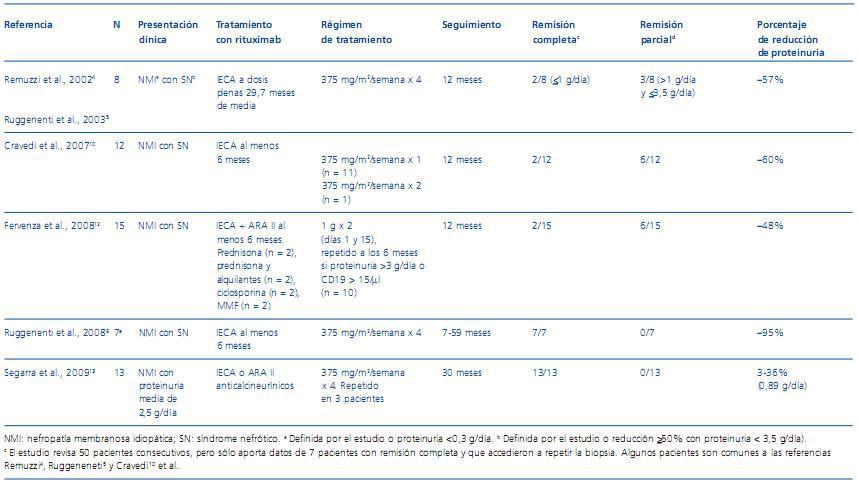
hecho, junto con la identificación de células CD20+ en las biopsias de pacientes con GN membranosa, constituye el razonamiento para la indicación de rituximab3. Se ha publicado una pequeña pero creciente literatura respecto al uso de rituximab en la nefropatía membranosa. De los más de 80 casos publicados, más de la mitad proceden de un único centro donde el rituximab se empleó como terapia inicial, siendo en el resto de los casos empleado como segunda línea de tratamiento. Los datos disponibles sugieren que rituximab consigue un 15-20% de remisiones completas y un 35-40% de remisiones parciales3. En la tabla 2 se resumen los estudios más destacados que se detallan a continuación. Remuzzi et al. y Ruggenenti et al., en dos trabajos consecutivos, publicaron hace varios años una serie de 8 pacientes con síndrome nefrótico persistente tras 6 meses con tratamiento conservador y sin ningún inmunosupresor, en los cuales, la administración de una dosis semanal de 375 mg/m2 durante 4 semanas se observó una reducción importante de la proteinuria (de 8,6 a 3,8 g/día), permaneciendo en el rango nefrótico en 5 pacientes. Dos pacientes alcanzaron la remisión completa a los 5 meses, y se observó la depleción de células B en todos los sujetos tratados. Durante 12 meses más de seguimiento no se consiguieron más remisiones completas, pero en 2 pacientes se detectó una mayor reducción de la proteinuria a cifras inferiores a 3,5 g/día. La terapia en general fue bien tolerada4,5. Rossi et al. describen un caso de una nefropatía membranosa con síndrome nefrótico complicada con anemia autoinmune hemolítica tratada con éxito con rituximab. En este caso el tratamiento fue más prolongado (una dosis semanal durante 4 semanas y posteriormente una dosis mensual durante 5 meses) y asociado a prednisona, observándose mejoría desde la primera dosis6. Cobo et al. describen el caso de un paciente con síndrome nefrótico por nefropatía membranosa sin respuesta a prednisona y clorambucil y en el que tras 4 semanas de una dosis semanal de rituximab (375 mg/m2) se observó reducción progresiva de la proteinuria y una mejoría de la función renal7. En el primer caso publicado en un paciente sometido a trasplante renal con recidiva de una nefropatía membranosa a los 4 meses del trasplante, el tratamiento con 4 dosis de rituximab de 375 mg/m2 en un mes se acompañó de una reducción importante de la proteinuria, manteniendo el paciente a los 3 años del trasplante una proteinuria inferior a 0,5 g/día8. Existen publicaciones recientes que han incluido a un mayor número de pacientes. De hecho, el grupo de Remuzzi et al. trató a 50 pacientes consecutivos con nefropatía membranosa idiopática de medio-alto riesgo con el mismo régimen que habían usado previamente5, consiguiéndose la remisión (proteinuria <0,5 g/día) en el 20%, lo que se asoció con una mejoría en los hallazgos histológicos en biopsias repetidas (dato que sólo se recogió en 7 pacientes)9. También recientemente, Cravedi et al. estudian a 12 pacientes con nefropatía membranosa tratados con una única dosis 375 mg/m2 de rituximab comparándolos con la serie histórica de 24 casos tratados con 4 dosis obteniendo un grado de depleción de células B similar en ambos grupos y un porcentaje de remisiones similares (25%), lo cual plantea la cuestión de evitar la administración innecesaria de dosis repetidas que puedan aumentar los efectos secundarios y el desarrollo de anticuerpos antiquiméricos4,10,11. En un estudio piloto, Fervenza et al. usaron rituximab en un régimen similar al de la artritis reumatoide (1 g los días 1 y 15) tratando a 15 pacientes con nefropatía membranosa que tenían proteinuria importante (media de 13 g/día). La mitad de los pacientes no habían respondido a tratamientos previos. A los 6 meses de tratamiento, 4 pacientes consiguieron una remisión parcial. Diez pacientes fueron tratados con un segundo ciclo de rituximab, ya que continuaban con proteinuria nefrótica y habían aumentado de nuevo las células B. En resumen, a los 12 meses, de los 14 pacientes que completaron el estudio, dos (14%) habían conseguido una remisión completa y seis (43%), una remisión parcial. En conjunto, la proteinuria se redujo un 48% a los 12 meses. Cinco pacientes no tuvieron respuesta a 2 ciclos de rituximab y dos de ellos progresaron a insuficiencia renal terminal12. Estos autores no encontraron diferencias histológicas sustanciales entre los respondedores y los no respondedores. El trabajo más reciente y con resultados muy interesantes pertenece a investigadores españoles, quienes trataron con rituximab a 13 pacientes con nefropatía membranosa anticalcineurinadependientes (con ciclosporina o tacrolimus)13. Los pacientes recibieron tratamiento con 4 dosis semanales de 375 mg/m2 de rituximab. Después del tratamiento se objetivó una reducción significativa de la proteinuria (2,5 ± 0,76 basal frente a 0,85 ± 0,17 g/día a los 6 meses). Los anticalcineurínicos y otros fármacos inmunosupresores pudieron retirarse sin evidencia de recidiva. El filtrado glomerular mejoró significativamente (90,3 ± 15 basal a 106,4 ± 20 ml/min a los 3 meses). Tres pacientes presentaron un aumento de la proteinuria a los 19, 23 y 28 meses, y fueron tratados de nuevo con éxito con un segundo ciclo de rituximab. A los 30 meses todos los pacientes estaban en remisión13.
Los resultados preliminares parecen alentadores, pero todavía se debe investigar para recomendar el uso derituximab como tratamiento sistemático, y más aún como tratamiento inicial. Las dosis óptimas y la frecuencia de administración de rituximab para el tratamiento de la nefropatía membranosa deben definirse. Los regímenes utilizados actualmente están adaptados del tratamiento del linfoma o del de la artritis reumatoide, pero la farmacocinética del rituximab podría ser diferente en los pacientes con nefropatía membranosa. La proteinuria no selectiva tan elevada de estos pacientes podría llevar a una pérdida teórica del rituximab por la orina y, por lo tanto, disminuir la eficacia del fármaco.
Glomerulosclerosis segmentaria y focal
La patogenia de esta glomerulonefritis se desconoce, pero diversos datos clínicos y experimentales apuntan hacia la existencia de un factor circulante no conocido, si bien en las biopsias se observan generalmente escasos depósitos inmunes. Ésta podría ser, en cierto modo, la justificación para el uso de rituximab en esta glomerulonefritis, aunque la experiencia es muy escasa. Rituximab indujo accidentalmente una remisión en 2 casos de glomerulosclerosis segmentaria y focal de 2 niños tratados con rituximab por enfermedad linfoproliferativa. Ninguno de los 2 pacientes había recibido tratamiento previo con plasmaféresis o ciclosporina. Rituximab se empleó a la dosis de 375 mg/m2 a la semana durante 4 y 6 semanas, respectivamente, manteniéndose la remisión a los 4 y 7 meses tras el tratamiento14,15. Benz et al. describen el caso de un síndrome nefrótico corticodependiente previamente tratado con esteroides, ciclofosfamida, ciclosporina y tacrólimus sin éxito. El paciente desarrolló también una púrpura trombocitopénica relacionada con el tratamiento. Después de 35 recaídas en 15 años, el tratamiento con dosis estándar de rituximab conllevó una remisión de, al menos, 13 meses16. Kamar et al. describen 2 casos de recidiva tras el trasplante. En el primer caso, a pesar de tratamiento pretrasplante con plasmaféresis y ciclosporina, la proteinuria aparece al día siguiente del trasplante, obteniéndose la remisión completa tras 2 dosis de rituximab. Una nueva recaída se objetiva a los 40 días que, igualmente, responde a una dosis adicional de rituximab. En el segundo caso, también la proteinuria aparece al día siguiente del trasplante, sin respuesta a 13 sesiones de plasmaféresis y tratamiento con ciclofosfamida. A los 13 meses postrasplante se administran 4 dosis de rituximab, siendo en este caso el tratamiento inefectivo17. Hristea et al. también describen un caso de tratamiento con rituximab y plasmaféresis en una recidiva postrasplante de una hialinosis con buena respuesta18. En resumen, se han publicado muy pocos casos sobre la eficacia de rituximab en el síndrome nefrótico corticorresistente y la mayoría han sido anecdóticos, publicados en niños o adolescentes, o en recidiva de hialinosis tras el trasplante. La única serie retrospectiva publicada en adultos con síndrome nefrótico corticorresistente por glomerulosclerosis segmentaria y focal en riñones nativos se recogió como una iniciativa del grupo GLOSEN (Grupo Español para el Estudio de las Enfermedades Glomerulares)19. Se estudiaron 8 pacientes con síndrome nefrótico y biopsia confirmada que no habían respondido a tratamientos inmunosupresores y a los que se les administró rituximab. La pauta empleada fue habitualmente 4 dosis de 375 mg/m2, aunque a 3 pacientes se les repitió la dosis. Sólo 3 de los 8 pacientes mostraron un efecto positivo al tratamiento, pero no se consiguió la remisión completa en ningún caso19. Por tanto, estos resultados no apoyan el uso generalizado de rituximab en esta patología. Serían necesarios más estudios para caracterizar su utilidad y los posibles pacientes que podrían beneficiarse de su uso.
Glomerulonefritis crioglobulinémica
La crioglobulinemia esencial o asociada al virus C, en tanto que enfermedad por inmunocomplejos que desempeñan un papel importante, ha sido también objeto de tratamiento con rituximab. Conlleva una glomerulonefritis membranoproliferativa generalmente acompañada de vasculitis. No todas las series o casos publicados presentan afectación renal, lo que limita el análisis. Lamprecht et al. comunicaron el caso de un paciente virus C positivo con vasculitis crioglobulinémica en asociación con un linfoma no hodgkiniano que no respondió a interferón y ciclofosfamida, pero sí a un curso prolongado de rituximab20. Rocatello et al. también publicaron 6 casos de crioglobulinemia asociada al virus C (en 5 casos con afectación renal) que no habían respondido a tratamiento inmunosupresor convencional y que fueron tratados con un régimen de rituximab (durante un mes y 2 meses mensualmente), sin otros inmunosupresores. Desde el punto de vista renal se objetivó una desaparición de la proteinuria en todos los casos, con mejoría de función renal en 5 casos a los 12-18 meses de seguimiento. No se comunicaron efectos secundarios al tratamiento21. Zaja et al. describen sus experiencia en 15 pacientes con crioglobulinemia mixta esencial (en 12 casos virus C positivo) tratados con el protocolo estándar de rituximab. De los 2 casos con afectación renal uno mejoró y el otro no concluyó el tratamiento por efectos adversos (trombosis arterial retiniana)22. Finalmente, un paciente que precisaba diálisis por una glomerulonefritis membranoproliferativa en el contexto de crioglobulinemia virus C negativa y resistente al tratamiento convencional recobró la función renal y pudo abandonar la diálisis tras 8 dosis de 375 mg/m2 de rituximab23. Quartuccio et al. han publicado 5 casos de glomerulonefritis crioglobulinémica virus C positivo (3 casos sin tratamiento previo) en los que se objetivó una mejoría de la afectación renal, recidivando en 3 casos, con respuesta al retratamiento24. Rocatello et al. Publicaron 12 casos de crioglobulinemia virus C positivo (7 casos con afectación renal con biopsia) en los que se objetivó un descenso de la proteinuria y una mejoría de la función renal25. Curiosamente, Ghobrial et al. Publicaron un caso de incremento inicial de crioglobulinas tras administrar rituximab antes de la mejoría de síntomas. Los mecanismos implicados resultan inciertos26.
Recientemente, Cacoub et al. han publicado una revisión de toda esta literatura para analizar la eficacia y seguridad de rituximab en las vasculitis crioglobulinémicas. Se identificaron un total de 57 casos, de los cuales el 75,4% eran secundarios al virus C y el resto eran rioglobulinemias mixtas esenciales. En el 31% de los casos existía afectación renal. El motivo de tratamiento fue la ausencia de respuesta a tratamientos previos (n = 50), la intolerancia a tratamientos previos (n = 3) o como primera línea de tratamiento (n = 2). La mayoría de pacientes recibieron 4 dosis de 375 mg/m2 de rituximab. El tratamiento con este fármaco tuvo una gran eficacia en los principales signos de vasculitis con una respuesta clínica parcial o completa bastante favorable. Desde el punto de vista nefrológico hubo respuesta en 15 de los 18 pacientes con afectación glomerular. El tratamiento, en general, fue bien tolerado y con pocos efectos secundarios27. Sin embargo, un 39% de pacientes presentaron recidivas que, en algunos casos, respondieron a un segundo ciclo de rituximab. Esta revisión tiene sus limitaciones para poder xtraer conclusiones. Como comentan sus autores, el número de casos con afectación renal es escaso, el seguimiento no es muy largo (9,7 meses de media), es probable que los casos negativos no estén publicados, la mayoría de estudios no indican la dosis de esteroides usados concomitantemente, etc. Por tanto, aunque los datos disponibles refieren una gran eficacia de rituximab en las principales manifestaciones de vasculitis, incluida la glomerulonefritis, las recidivas son frecuentes y deben realizarse más estudios a largo plazo para valorar el beneficio-riesgo de dicho tratamiento.
Vasculitis sistémicas
Las vasculitis sistémicas de pequeño vaso generalmente se acompañan de la presencia de ANCA. Existen evidencias suficientes que apoyan su papel patogénico y que, por ende, justificarían el uso de rituximab. La experiencia con éxito en casos de vasculitis asociada a ANCA y que no han respondido a tratamiento convencional o éste estaba contraindicado ha sido comunicada por varios grupos. En algunos de los casos referidos no todos los pacientes presentaban afectación renal. De los 11 casos de Keogh et al., cinco presentaban afectación renal. La mayoría de los síntomas respondieron al tratamiento, excepto en un caso de persistencia de un nódulo pulmonar. La remisión se consiguió en todos los casos tras tratamiento con rituximab y altas dosis de esteroides, y se mantuvo entre uno y 2 años. Algún caso requirió un segundo ciclo de tratamiento28. En un ensayo de Smith et al., 12 pacientes fueron tratados con un protocolo estándar de rituximab más una única dosis de ciclofosfamida. Durante 14 semanas 10 pacientes mantuvieron remisión completa, pero cuatro recayeron cuando las cifras de células B ascendieron29. En la mayoría de las series, la respuesta clínica se correlaciona con la depleción de células B y las recaídas ocurren cuando las células B y los ANCA emergen de nuevo. Sin embargo, la respuesta clínica no es exclusiva de los pacientes ANCA positivo y no siempre se asocia con el mantenimiento de un estado ANCA negativo. Ericsson et al. Comunicaron 8 remisiones completas y una parcial en 9 pacientes con vasculitis ANCA positivas y resistentes a tratamiento convencional y tratados con rituximab (2 a 4 dosis semanales de 500 mg de rituximab asociado a esteroides, ciclofosfamida, micofenotalo mofetil o azatioprina). Se produjeron dos recaídas menores y 7 pacientes continuaron siendo ANCA negativos30. Más recientemente Keogh et al. comunicaron un ensayo abierto con 10 pacientes con granulomatosis de Wegener refractaria tratados con rituximab y esteroides. En siete de ellos existía afectación renal demostrada por biopsia. En todos se consiguió remisión completa en 3 meses. El ascenso del título de ANCA o de células B respondió al tratamiento preventivo con rituximab31. En este trabajo se plantea la cuestión de si el rituximab puede ser empleado no sólo para inducir la remisión sino también como tratamiento de mantenimiento. Otra cuestión que plantea este artículo en su discusión es el empleo de rituximab solo o acompañado de otros agentes inmunosupresores. Se necesitan datos más completos para emitir conclusiones, en especial si se tiene en cuenta que existen también experiencias de tratamiento con rituximab en vasculitis no tan significativas. Aries et al. presentan los casos de 8 pacientes con enfermedad de Wegener grave refractaria. A pesar de la depleción de células B, no se objetivaron cambios en el título de ANCA. Sólo 2 pacientes entraron en remisión y tres presentaron una progresión de la enfermedad. Curiosamente en estos casos no se emplearon corticoides32. Omdal et al. comunicaron los casos de 3 pacientes tratados con varios regímenes de rituximab en quienes los granulomas retroorbitarios no regresaron a pesar de la depleción de células B, la disminución del título de ANCA y la remisión de otros síntomas de enfermedad33. Sería necesario definir los factores que predicen la respuesta al tratamiento (en presencia o en ausencia de disminución del título de ANCA) y correlacionar estos factores con las características fenotípicas (lesiones predominantemente granulomatosas o vasculíticas), duración, extensión y gravedad de la enfermedad, así como diferencias en los tratamientos acompañantes. Todo esto se debería realizar en el contexto de un ensayo clínico.
Nefropatía lúpica
El lupus eritematoso sistémico (LES) es una enfermedad autoinmune multisistémica caracterizada por el depósito de inmunocomplejos y la presencia de autoanticuerpos anti-ADN. Las anifestaciones clínicas son amplias e incluyen la afectación renal en un porcentaje elevado de pacientes. Los linfocitos B desempeñan un papel crucial en la patogenia del LES mediante la producción de anticuerpos, y el procesamiento y la presentación de autoantígenos a las células T, entre otros. La experiencia clínica con rituximab en el LES es mucho más extensa que la experiencia publicada y la probabilidad de sesgo en las publicaciones positivas debe ser considerada. Los primeros estudios sobre el empleo clínico de rituximab en el LES fueron publicados por Leandro et al. y Perrota et al. en 200234,35. Su eficacia fue documentada en pacientes con nefritis lúpica, artralgias, artritis, serositis, vasculitis cutánea, mucositis, fatiga y síntomas neurológicos en uso combinado con corticoides y otros inmunosupresores. Otros estudios han documentado el éxito de rituximab en nefritis lúpica muy grave refractaria a ciclofosfamida o micofenolato mofetil combinado con corticoides. Hasta el momento es elevado el número de pacientes con LES y nefritis lúpica tratados con rituximab y es actualmente la glomerulonefritis en la que se posee una mayor experiencia con el empleo de rituximab. Los protocolos de administración de dicho fármaco a pacientes con LES han variado desde las dosis para «el linfoma» y las dosis para la «artritis reumatoide». La mayoría de pacientes tratados hasta el momento presentaban enfermedad activa grave, refractaria a tratamientos convencionales (glucocorti- coides y otros agentes inmunosupresores concomitantes) y casi el 50% presentaban nefritis lúpica. Sin embargo, dado que los pacientes tratados con rituximab presentan signos heterogéneos de enfermedad, diferentes órganos afectados y tratamientos previos diversos, así como diferentes pautas de rituximab, la correcta evaluación de los beneficios clínicos resulta difícil. En cuanto a la nefritis lúpica, el grado de remisión entre los pacientes que han sido publicados alcanza el 80%36-38. En resumen, aunque los datos son todavía limitados, los hallazgos indican que rituximab en monoterapia o en combinación con los inmunosupresores clásicos puede ser una terapia válida en pacientes con enfermedad grave. Sin embargo, las indicaciones específicas, el protocolo de dosificación, la necesidad de terapias concomitantes, el empleo de rituximab como tratamiento de inicio y la frecuencia de efectos secundarios todavía deben determinarse.
Otras glomerulonefritis
Como tratamiento experimental, las publicaciones sobre rituximab y otras enfermedades glomerulares están limitadas a casos aislados. Gilbert et al. Describen un único caso de un paciente con un síndrome nefrótico corticosensible, pero dependiente de dosis elevadas de corticoides, que fue tratado con rituximab. Durante el tiempo en el que las células B fueron indetectables en la sangre el paciente permaneció libre de enfermedad, lo que hizo posible la pauta de esteroides a días alternos. El paciente recayó cuando los linfocitos comenzaron a ascender de nuevo39. Collins et al. describen a 3 pacientes con glomerulonefritis fibrilar que fueron tratados con rituximab por proteinuria nefrótica. Los pacientes estaban en tratamiento convencional del síndrome nefrótico incluyendo el bloqueo del sistema renina- angiotensina y un estricto control de la presión arterial.Todos los pacientes tuvieron un descenso de la proteinuria a menos de 1,5 g/día a los 27 meses, con la función renal preservada40. Betjes et al. describen el caso de un paciente con nefropatía IgM que presentó recidiva tras el trasplante y que respondió a rituximab41. Todos stos resultados hay que tomarlos con cautela, siempre teniendo en cuenta el sesgo de las publicaciones positivas.
CONCLUSIÓN
El uso de rituximab en las enfermedades glomerulares y autoinmunes en general se está incrementando progresivamente; su eficacia y su seguridad son variables según el tipo de patología. Los estudios publicados indican que rituximab puede ser una alternativa terapéutica. La mayoría de estudios han empleado el protocolo de dosificación utilizado en los linfomas. Sin embargo, la biología de las células B en el linfoma y en las enfermedades autoinmunes es diferente. Es de suponer que las células B son anormales si se comparan con las células B normales, pero no malignas. Además, el objetivo de tratamiento con rituximab en las enfermedades autoinmunes es diferente al del tratamiento del linfoma, ya que cada enfermedad autoinmune es diferente. Habría que diseñar e implementar protocolos. En la tabla 3 se expone un resumen de los protocolos de dosificación estándar con las adaptaciones que se han ido haciendo según las publicaciones, incluyendo las prolongaciones de tratamiento1. Es necesario que la investigación sobre el uso de rituximab aclare aspectos sobre:
- Evaluación de la efectividad y seguridad del tratamientocon rituximab en pacientes con glomerulonefritis primarias y secundarias.
- Evaluación a largo plazo de los pacientes que han sido tratados con rituximab: enfermedad renal terminal, mortalidad y efectos adversos.
- Comprensión de la fisiopatología del proceso autoinmune o del papel del rituximab en dicho proceso.
- Relación entre la depleción de células B de sangre periférica y los niveles séricos de rituximab y la actividad de las glomerulonefritis primarias y secundarias.
- Intentar establecer protocolos de dosificación de rituximab para el tratamiento de las glomerulonefritis primarias y secundarias.
Puntos clave
1. La respuesta inmune mediada por células B (que produce anticuerpos y citoquinas y que presenta el antígeno a la célula) desempeña un papel importante en las enfermedades autoinmunes que afectan al riñón.
2. La depleción de células B podría alterar el curso de la respuesta autoimune y, por tanto, plantearse como diana de tratamiento en estas enfermedades.
3. El rituximab, un anticuerpo monoclonal dirigido contra el antígeno de diferenciación de linfocitos B CD20 y que se ha usado con éxito en enfermedades hematológicas y artritis reumatoide, se ha comenzado a emplear también en muchas enfermedades renales. Este uso de rituximab en las enfermedades glomerulares y autoinmunes en general se está incrementando de forma progresiva, y su eficacia y su seguridad son variables según el tipo de patología.
4. Los estudios publicados indican que rituximab puede ser una alternativa terapéutica válida en la nefropatía membranosa, en la nefropatía lúpica o en la glomerulonefritis crioglobulinémica. Sin embargo, las series publicadas hasta el momento sobre este tipo de trastornos son pequeñas, sin estudios controlados y probablemente no se han publicado los casos con resultados negativos. Muchas veces el uso de rituximab se ha producido tras el fracaso de tratamientos previos.
5. Son necesarios estudios controlados aleatorizados que garanticen las diversas indicaciones del rituximab, el uso como tratamiento de inicio, protocolos de dosificación, etc.
Figura 1. Representación esquemática de CD20 y del anticuerpo monoclo- nal quimérico anti-CD20, rituximab. CD20 es una molécula de membrana expresada en todas las etapas de diferenciación de las células B, excepto en las células pro-B y las plasmáticas. Es una molé
Tabla 1. Efectos adversos atribuidos a la terapia con rituximab
Tabla 2. Estudios seleccionados del uso de rituximab en nefropatía membranosa
Tabla 3. Protocolos de tratamiento con rituximab en las enfermedades renales