INTRODUCCIÓN
La estenosis de arteria renal aterosclerótica (EARA) es una causa reconocida de insuficiencia renal y de hipertensión arterial (HTA) secundaria. El pronóstico de los pacientes que la padecen, tanto por las consecuencias de su evolución como por las comorbilidades asociadas, es poco halagüeño. Los importantes avances en la última década en cuanto a pruebas de imagen, tratamiento médico y técnicas de revascularización renal han cambiado de forma sustancial el panorama de la enfermedad renovascular. Esto es así particularmente en el caso de la EARA, que sigue siendo una de las causas más frecuentes de HTA acelerada a la vez que una de las lesiones vasculares que con más frecuencia se detectan de forma casual. A pesar de, o precisamente debido a, estos avances, el manejo óptimo de los pacientes con EARA es una de las cuestiones clínicas que provoca más controversia1. En este artículo revisaremos, a la luz de la evidencia actual, todos estos aspectos relacionados con la EARA, su prevalencia, consecuencias clínicas y pronósticas, además de las herramientas diagnósticas y terapéuticas.
En primer lugar, vamos a definir algunos de los conceptos principales en relación con esta patología. Así, se entiende por hipertensión renovascular aquella hipertensión sistémica resultante de una afectación de la arteria renal, frecuentemente debida a lesiones oclusivas de las arterias renales principales2. Clásicamente, relacionar directamente la HTA con una lesión arterial dependía de la resolución de la HTA después de solventar la obstrucción. En la práctica, raramente se consigue la «reversión» completa de la HTA. La estenosis de arteria renal se define como un estrechamiento de la luz de la arteria renal. Aproximadamente en el 90% de los casos es debido a aterosclerosis, afectando en estos casos mayoritariamente al primer centímetro (1 cm) del origen de la arteria renal. La enfermedad renovascular aterosclerótica es una combinación de estenosis de arteria renal e isquemia renal. Puede haber afectación unilateral con arteria renal normal en el riñón contralateral o bien afectación bilateral (o lo que es equivalente, afectación unilateral sobre riñón único funcionante). Debido a su naturaleza sistémica, la enfermedad renovascular aterosclerótica afecta con frecuencia tanto a arterias grandes como a las arterias pequeñas de ambos riñones, dando lugar en último término a deterioro progresivo de la función renal por isquemia de las áreas renales afectadas, a la vez que, potencialmente, provoca daño hipertensivo en las zonas del riñón que habían estado perfundidas por arterias renales relativamente normales. Así pues, la EARA puede dar lugar a nefropatía isquémica, que se define como una reducción en el filtrado glomerular o una pérdida del parénquima renal por estenosis de arteria renal hemodinámicamente significativa (estenosis que reduce el diámetro del vaso al menos en un 60%)3-5. Se puede decir, por tanto, que las principales consecuencias clínicas de la estenosis de arteria renal son la HTA y la disfunción renal. Sin embargo, en una reciente y amplia revisión de la literatura se observó que, en pacientes en los que se había descubierto EARA de forma incidental, la prevalencia de HTA y de insuficiencia renal era sólo del 65,5 y del 27,5%, respectivamente, subrayando el hecho de que tales hallazgos clínicos no son secuelas obligatorias de la EARA6.
Desde el punto de vista fisiopatológico, clásicamente se consideraba que la disminución de la presión de perfusión renal debida a la estenosis de la arteria renal da lugar a la liberación de renina por parte de las células yuxtaglomerulares y, consecuentemente, a la activación del sistema renina-angiotensina-aldosterona (SRAA), especialmente si la afectación es unilateral. En realidad, la presión de perfusión renal no se reduce hasta que la estenosis es al menos del 50% y la presión arterial no suele elevarse hasta que la estenosis es del 60-70%. Tras esta activación del SRAA, el incremento en la retención de sodio se compensa vía natriuresis de presión por parte de las áreas renales no afectadas, aunque si esta condición no se resuelve o si ya existe daño renal subyacente, este mecanismo compensador acabará fracasando. Ésta es la llamada HTA «renina-dependiente». Cuando la estenosis de arteria renal es bilateral (o unilateral en riñón único), la elevación del volumen intravascular por la retención de sal y agua debida a la activación del SRAA mantendrá la HTA de forma persistente, la denominada HTA «volumen-dependiente». Sin embargo, ahora se sabe que el papel predominante del SRAA es transitorio durante el inicio de la HTA vasculorrenal. Modelos experimentales, confirmados luego en estudios con humanos, han demostrado que después de este inicio se pierde la dependencia de la angiotensina y tiene lugar el reclutamiento de mecanismos presores renovasculares adicionales, como la liberación de endotelina, la activación del sistema nervioso simpático y fenómenos de estrés oxidativo, los cuales mantienen elevados el tono vasoconstrictor y la presión arterial, sin estar ya directamente relacionados con el SRAA. Asimismo, la disminución de la perfusión renal, sobre todo si se combina con la existencia de hipercolesterolemia, estimula la activación de mecanismos profibróticos en el riñón. Puesto que las necesidades metabólicas del riñón se satisfacen con menos del 10% del flujo sanguíneo, se ha sugerido que episodios repetidos de descenso del mismo podrían acabar produciendo daño parenquimatoso irreversible más allá de la lesión estenótica de la arteria renal principal, causando nefropatía isquémica a través de éstos u otros mecanismos aún no bien conocidos4,5,7-9. En la mayoría de pacientes con enfermedad renovascular aterosclerótica suele haber afectación asimétrica en los dos riñones, por lo que los pacientes se encontrarán en algún punto del espectro que va desde la HTA puramente mediada por renina a aquella totalmente dependiente de volumen. Esto se verá posteriormente modificado por el grado de daño isquémico que tenga lugar en ambos riñones.
Pero, ¿qué nivel de oclusión vascular es necesario para iniciar este «síndrome» de hipertensión renovascular? Estudios recientes confirman que la activación de la liberación de renina depende del gradiente entre la aorta y los segmentos postestenóticos de la arteria renal. No parece producirse liberación de renina hasta que dicho gradiente es de 10-20 mmHg, para lo cual sería necesario una obstrucción de más del 70-75% de la luz del vaso10.
PREVALENCIA DE HIPERTENSIÓN ARTERIAL VASCULORRENAL DE ORIGEN ATEROSCLERÓTICO
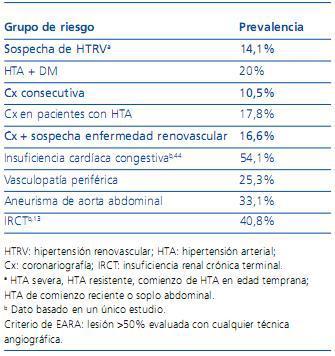
La prevalencia de la HTA renovascular considerada globalmente arroja cifras muy dispares en función de los diferentes grupos de riesgo evaluados. Así, en pacientes con sospecha de HTA renovascular (HTA severa, HTA resistente, inicio de HTA en edad temprana, HTA de comienzo reciente o soplo abdominal), la prevalencia es del 14,1%. En pacientes sometidos a coronariografía, bien sea de forma consecutiva, bien con HTA diagnosticada, o en los que se sospecha enfermedad renovascular, las tasas de prevalencia halladas son del 20, del 10,5% y del 17,8%, respectivamente. En insuficiencia cardíaca congestiva un único estudio ha comunicado un 54,1% de HTA renovascular. La prevalencia en pacientes con vasculopatía periférica (25,3%) o con aneurisma de aorta abdominal (33,1%) es también elevada. Estos datos pertenecen a una amplia revisión de estudios en los que el criterio de inclusión era la detección, mediante cualquier método de angiografía, de lesión de la arteria renal de, al menos, el 50%6. Puesto que la disfunción renal es otra manifestación frecuente de la estenosis de arteria renal, ésta es también frecuente en este grupo de población. Así, el 6% de todos los pacientes que inician programa de diálisis y el 14% de aquellos mayores de 50 años tienen HTA renovascular como causa de fracaso renal11, aunque algunos trabajos han estimado tasas de prevalencia aún mayores en esta población12 (tabla 1).
Si atendemos a la prevalencia de la EARA estrictamente hablando, las cifras no son muy diferentes. Si bien en la población general la prevalencia de enfermedad renovascular aterosclerótica se ha establecido alrededor del 1%, ésta se ve incrementada de forma considerable al considerar a enfermos de riesgo. En adultos mayores de 65 años es del 7%, y su evaluación en sujetos sometidos a coronariografía o en aquellos que son estudiados por enfermedad arterial periférica muestra cifras del 12 y del 26%, respectivamente5,13.
Sin embargo, y desmitificando un poco la simplificación en que a veces se ha incurrido con respecto a esta patología, debe tenerse en cuenta que, mientras que la EARA es prevalente en enfermos con HTA no controlada o con afectación vascular en órganos diana, también está presente en muchos pacientes sin HTA. Y, por otro lado, aun cuando la EARA es frecuente en los pacientes con HTA, especialmente en aquellos con complicaciones con otra patología aterosclerótica, la presencia de estenosis de arteria renal anatómica no siempre se asocia con HTA.
CRITERIOS CLÍNICOS DE SOSPECHA
De forma general, podríamos decir que los pacientes con enfermedad coronaria aterosclerótica o enfermedad arterial periférica, sobre todo si se asocia con HTA no controlada y/o con insuficiencia renal, tienen un riesgo incrementado para la existencia de EARA14. Así pues, dado que la EARA es una manifestación más de la enfermedad aterosclerótica sistémica, compartirá con ésta muchos de los factores de riesgo clásicos claramente establecidos, como son la HTA, la diabetes mellitus, la dislipemia, la obesidad, el tabaquismo, el sexo masculino, la edad avanzada y la historia familiar positiva. También se ha sugerido que algunos de los llamados factores de riesgo «emergentes» para la enfermedad cardiovascular y la aterosclerosis, como el fibrinógeno y la proteína-C reactiva, lo serían también para la EARA, pues se ha visto asociación entre niveles elevados de los mismos y existencia de EARA y, sobre todo, con restenosis de estas lesiones. Probablemente en estos casos, más que de factores de riesgo deberíamos hablar de biomarcadores en relación con la aterosclerosis propiamente dicha5,13,15-17.
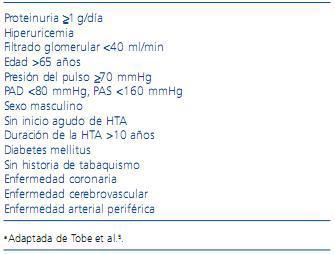
Además de estos factores de riesgo, en la tabla 2 se enumeran los datos clínicos clave que apoyan la puesta en marcha de exploraciones adecuadas para la detección razonable de EARA.
VALOR PRONÓSTICO
La supervivencia de los pacientes con EARA puede verse disminuida, especialmente si dicha patología coexiste con enfermedad vascular periférica, insuficiencia renal crónica terminal, o si estos pacientes se someten a coronariografía o aortografía abdominal, exploraciones que ponen a estos pacientes en situación de riesgo elevado de complicaciones ateroembólicas. En estos casos y, especialmente cuando es hemodinámicamente significativa, la estenosis de arteria renal se asocia a y parece ser un predictor independiente de episodios cardiovasculares adversos, esto es, infarto de miocardio, ictus o muerte cardiovascular6,18,19. El valor pronóstico de la EARA parece verse influido tanto por el grado de estenosis como por la existencia o no de lesión única. Así, la supervivencia a los 4 años de los pacientes con EARA severa (> _75%) es menor que la de aquellos sin o con EARA leve (el 57 frente al 89%)20, e inferior en aquellos con EARA bilateral respecto a los pacientes con EARA unilateral (el 47 frente al 59%)21.
En cualquier caso, el principal determinante de la evolución del paciente será el grado de daño en el parénquima renal, y no tanto el grado de estenosis de la arterial renal. La progresión a oclusión total de ésta es del 3 al 5%, y sólo tiene lugar en aquellos pacientes con estenosis > _60%. Probablemente, en el contexto de la enfermedad aterosclerótica, sucede lo mismo en vasos más pequeños del árbol circulatorio más allá de la arteria principal, por lo que considerar relevantes las estenosis del 50% o bien del 70% carece seguramente de evidencia clínica suficiente. En realidad, se sabe que la EARA es un proceso progresivo que ocasiona, en último lugar, atrofia del parénquima renal. Y, a su vez, la evidencia de nefropatía isquémica es también un marcador de riesgo cardiovascular y renal. Probablemente por ello, aunque, aparentemente y a la luz de la experimentación animal, la función renal debería empeorar de forma gradual con el tiempo, no se ha hallado una relación clara entre el grado de estenosis y las medidas de función renal5,15,22. En la tabla 3 se resumen estos factores de peor pronóstico.
Otro aspecto importante en cuanto al valor pronóstico de la EARA es que ésta puede tener, probablemente, un papel importante en la fisiopatología y progresión de la insuficiencia cardíaca congestiva en algunos pacientes. Aunque no existen grandes series de casos, parece que los pacientes con EARA sin enfermedad coronaria pueden presentar edema pulmonar flash o insuficiencia cardíaca congestiva, de aparición brusca y frecuentemente acompañados de hipertensión. Sobre todo si la EARA es bilateral, la retención de sodio explicaría, al menos en parte, la predisposición de estos enfermos a desarrollar edema pulmonar flash, frecuentemente en el contexto de disfunción sistólica de ventrículo izquierdo sin evidencia de enfermedad coronaria, o con disfunción diastólica junto a hipertensión e insuficiencia renal. Otras veces puede ser que la enfermedad renovascular acelere una hipertensión preexistente y, en último término, amenace la viabilidad del riñón postestenosis, empeorando la excreción de sodio en pacientes con ICC2,5,11.
Finalmente, se ha apuntado que algunos de los factores de riesgo para la progresión de la enfermedad arterial renal podrían ser: la presión arterial sistólica superior a 160 mmHg, la diabetes mellitus y la severidad importante de la EAR ipsilateral o contralateral19.
PROCEDIMIENTOS DIAGNÓSTICOS
Antes de proceder a detallar las exploraciones complementarias que pueden ayudarnos en el diagnóstico de EARA, es importante hacer algunas consideraciones. Por un lado, puesto que no está claro que el diagnóstico de EARA vaya a alterar el manejo del paciente, la detección de sospecha de EARA no es siempre, ni mucho menos, obligada. En segundo lugar, incluso utilizando algoritmos validados para la selección de pacientes susceptibles de ser estudiados con mayor profundidad para descartar estenosis de arteria renal, las posibilidades de obtener un resultado positivo no son superiores al 30%. Ninguna de las pruebas desarrolladas en los últimos 30 años ha demostrado una fiabilidad suficiente, aunque, en cualquier caso, las técnicas de imagen proporcionan resultados mejores que los tests funcionales. Aun cuando los conceptos fisiopatológicos dan pie a pensar que el renograma con o sin inhibición de la enzima conversora de angiotensina o el test de captopril deberían ser útiles para el diagnóstico de EARA funcional, en la práctica han resultado ser ineficaces. Una explicación posible sería el hecho de que parece que hay diferencias significativas en el flujo sanguíneo renal entre ambos riñones aunque no haya anomalías angiográficas, con lo que un resultado asimétrico en un test funcional no indicaría necesariamente la presencia de EARA. Por el contrario, no puede excluirse la posibilidad de que exista EARA con perfusión renal simétrica15. En la tabla 4 resumimos las propiedades que deberían caracterizar a una técnica de imagen ideal para la identificación de EARA.
La detección de la EARA es adecuada en pacientes con alto riesgo de padecerla, según los criterios comentados anteriormente. Debería hacerse una distinción entre la realización del diagnóstico de EARA, que ayuda al tratamiento del paciente, y la selección de pacientes susceptibles de revascularización, que requiere un cuidadoso análisis del riesgo/beneficio. De forma global, la detección de la EARA debería hacerse de forma no invasiva siempre que sea posible. Los tests no invasivos que resultan no concluyentes deberían completarse con angiografía invasiva23.
Evaluación no invasiva
En la tabla 5 se esquematizan las características, ventajas e inconvenientes, sensibilidad y especificidad, de las pruebas no invasivas para el diagnóstico de EARA. Además de éstas, se ha apuntado que algunos biomarcadores, tales como la determinación del péptido natriurético cerebral (BNP), podrían ser útiles en la evaluación de estenosis de arteria renal. Sin embargo, estos resultados deberían confirmarse en estudios posteriores14,24. Otras pruebas como el renograma tras administración de un inhibidor de la enzima conversora de la angiotensina han caído recientemente en desuso frente a otras pruebas, en especial porque su sensibilidad y especificidad disminuyen ante la presencia de estenosis bilateral, insuficiencia renal o daño parenquimatoso intrarrenal, frecuentes en pacientes con EARA, si bien un resultado enteramente normal parece excluir de forma fiable la enfermedad renovascular2,5,15,17.
Evaluación invasiva
Básicamente se realizará mediante la angiografía renal, que continúa siendo la exploración gold standard para el diagnóstico de EARA y para decidir su indicación terapéutica2,25. Además, dos parámetros que pueden obtenerse con la misma, el gradiente de presión translesional y la reserva de flujo fraccional renal, podrían ser útiles para predecir aquellas lesiones que se beneficiarían de ser revascularizadas, aunque son necesarios más estudios para confirmar su aplicabilidad:
Angiografía renal
- Recomendación clase I en pacientes con factores de riesgo o evidencia clínica de estenosis de arteria renal, a los que se realice angiografía por otras indicaciones clínicas (p. ej., cateterismo coronario).
- Una estenosis estimada visualmente como > _70% se considera hemodinámicamente significativa y tributaria de revascularización.
- Limitaciones:
- Gran variabilidad interobservador en cuanto a la valoración del grado de estenosis.
- Puede dar lugar a complicaciones en relación con el acceso vascular o traumatismo causado por el catéter: ateroembolismo, disección vascular, perforación arterial.
- También puede causar toxicidad renal o sistémica por el contraste yodado, bien como reacción anafiláctica (<3%) o en forma de nefropatía inducida por contraste (mayor riesgo en pacientes con insuficiencia renal, diabetes, mieloma o en tratamiento con fármacos nefrotóxicos). Los pacientes que la desarrollan tienen peor pronóstico, y puede prevenirse mediante hidratación vigorosa, utilización del mínimo contraste posible y pretratamiento con N-acetilcisteína y/o bicarbonato intravenoso (aunque su efectividad es aún poco evidente).
Gradiente de presión translesional
- Recomendación AHA-2002: en pacientes sintomáticos con EARA, serían lesiones candidatas a revascularización aquellas con pico de gradiente sistólico de al menos 20 mmHg o un gradiente de presión medio de 10 mmHg (sin embargo, estos valores han sido cuestionados)26.
- Limitaciones:
- Puede ser indicador poco fiable en lesiones limítrofes.
- La perfusión del órgano se relaciona con la presión de perfusión distal a la estenosis, y no tanto con el gradiente de presión propiamente dicho.
- Los factores que afecten al flujo sanguíneo (gasto cardíaco, presión arterial sistémica, etc.) pueden alterar este gradiente.
- Un gradiente Pd/Pa <0,9 parece indicar mayor significación de la estenosis y predecir beneficio con la revascularización (Pd = presión sistólica en la arteria renal distal a la estenosis; Pa = presión arterial sistólica en la aorta)10.
- Gradiente sistólico hiperémico: valores > _21 mmHg indicarían la máxima precisión en predecir una mejora de la HTA tras revascularización de la arteria renal27.
Reserva de flujo fraccional (RFF)
- Es una medida de presión en la circulación coronaria basada en el principio de que el flujo a través de una arteria de conducción es proporcional a la presión a través del lecho vascular e inversamente proporcional a la resistencia del lecho vascular.
- Una RFF <0,80 sería predictora de mejora de la PA tras revascularización de la EARA unilateral moderada-severa (50-90%)28.
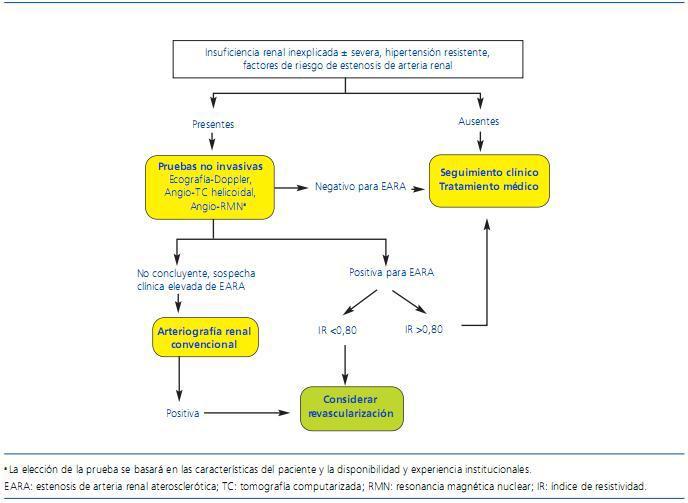
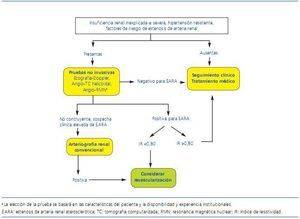
En la figura 1 se esquematiza un algoritmo para el diagnóstico de estenosis de arteria renal. En cualquier caso, se trata de una propuesta que debe adaptarse siempre a cada paciente en particular y a la disponibilidad de exploraciones y experiencia en cada centro.
TRATAMIENTO
El objetivo principal del tratamiento de la HTA vasculorrenal es el control de la presión arterial y la preservación o mejoría de la función renal17. Existen grandes interrogantes a la hora de considerar las estrategias óptimas para el tratamiento de la EARA, así como en relación con sus riesgos y beneficios. Las opciones de tratamiento incluyen el tratamiento médico, la angioplastia transluminal percutánea (ATP) con endoprótesis y la revascularización quirúrgica. El bloqueo farmacológico del SRAA, la utilización de estatinas y el tratamiento antiagregante son, sin lugar a dudas, fundamentales para el manejo clínico de la enfermedad aterosclerótica, incluyendo la EARA. El tratamiento quirúrgico debería reservarse para aquellos casos de enfermedad aórtica y renal combinadas que lo requieran, ante fracaso de la endoprótesis, o cuando sea necesaria la nefrectomía. Por otro lado, tras la revascularización endovascular con endoprótesis se observa una gran discordancia entre la elevada tasa (>95%) de éxito del procedimiento y la tasa moderada (60-70%) de la respuesta clínica. Diversos factores pueden ser responsables, como una selección pobre de los pacientes, una evaluación angiográfica inadecuada de la severidad de la lesión o la presencia de enfermedad renal parenquimatosa14,29. Muchos pacientes presentan HTA esencial durante años y desarrollarán EARA mucho más tarde. La presencia de EARA anatómica no implica que ésta sea la causa de la HTA o la insuficiencia renal de un paciente. Como ya se ha mencionado, en la EARA el grado de severidad de la oclusión vascular tiene poca relación con el flujo sanguíneo medido, el tamaño renal, el grado de fibrosis o el filtrado glomerular renal. De hecho, el mejor determinante de la evolución del paciente no es el grado de estenosis de la arteria renal, sino el grado de daño parenquimatoso renal. Uno de los mejores predictores de mejora en la función renal después de la revascularización es la rapidez del comienzo y la severidad de la insuficiencia renal previos; cuanto más importantes, mayor probabilidad de que la revascularización sea beneficiosa30. También parece que se obtendrían mejores resultados con determinados subgrupos de pacientes, en especial en aquellos que previamente a la intervención requieren un mayor número de fármacos antihipertensivos, los que presentan presión arterial media superior a 110 mmHg y los casos de EARA bilateral31. Considerando el balance beneficio/riesgo sobre aspectos relacionados con la función renal, la HTA y la afectación cardiaca, en la tabla 6 se apuntan las indicaciones de revascularización de la EARA. Además, en la tabla 7 se exponen algunos factores asociados con poca probabilidad de respuesta a la revascularización renal.
En general, el tratamiento basado en ATP ha sustituido a la revascularización renal quirúrgica en la EARA14. A la vez, existente evidencia suficiente para considerar que es más efectiva la ATP con colocación de endoprótesis que la ATP sola. Las tasas de permeabilidad primaria y secundaria de la endoprótesis a los 5 años son de cerca del 80% y de >90%, repectivamente. Sin embargo, la ATP no está exenta de riesgos. Así, entre sus complicaciones destaca el insuficiente control de la presión arterial, enfermedad ateroembólica (renal o extrarrenal), fracasos técnicos, como la migración de la endoprótesis, rotura u oclusión, restenosis (estimada en un 15-20%) y, menos frecuentes, disección aórtica y/o renal y hemorragia7. La utilización de protección embólica podría, según algunos autores, minimizar los fenómenos ateroembólicos durante el procedimiento32,33. En la EARA parecen ser útiles los filtros o los balones de oclusión distal con aspiración de detritus, y también se está investigando acerca del beneficio de la utilización intravenosa del inhibidor del receptor de plaquetas glicoproteína IIb/IIIa, protegiendo la microcirculación renal, o de endoprótesis recubiertas con fármacos, especialmente en pacientes con alto riesgo de restenosis34.
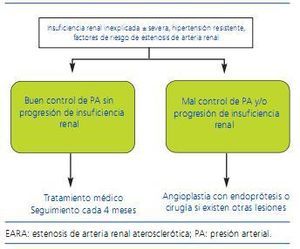
Por otro lado, los estudios que han comparado el tratamiento médico con la ATP35-37 y un metaanálisis38 de los mismos sugieren resultados algo mejores para esta última tanto en cuanto al control de la presión arterial como de la función renal, aunque la interpretación debe ser muy cautelosa dado que las poblaciones no son equiparables, algunos incluyen pocos pacientes y en otros hay un porcentaje importante de crossover entre los grupos de tratamiento. Para confirmar o no estos resultados, más recientemente se han puesto en marcha estudios prospectivos aleatorizados que evalúan tratamiento médico frente a revascularización con endoprótesis en pacientes con EARA, algunos de los cuales ya han finalizado. Así, en el estudio STAR39 se hizo un seguimiento a 2 años de 140 pacientes con aclaramiento de creatinina <80 ml/min/1,73 m2 y EARA ostial > _50%, aleatorizados a tratamiento médico optimizado sólo o junto con revascularización con endoprótesis. No se hallaron diferencias significativas en cuanto al objetivo primario (descenso del aclaramiento de creatinina > _20%), si bien el estudio tenía limitaciones importantes, como una potencia estadística insuficiente o la sobrestimación del grado de estenosis en algunos pacientes. De forma similar, los resultados preliminares del estudio ASTRAL40,41 no han mostrado beneficios asociados con la revascularización. Una revisión sistemática de estudios prospectivos con tratamiento médico o revascularización de pacientes con EARA publicada muy recientemente concluye que en la actualidad no se dispone de evidencia suficiente para primar una estrategia terapéutica u otra42. Finalmente, el estudio CORAL (Cardiovascular Outcomes for Renal Atherosclerotic Lesions)43, cuya finalización se prevé en 2010, se espera que aporte datos más concluyentes al respeto. En él más de 1.000 pacientes son aleatorizados a recibir tratamiento médico óptimo sólo o junto a ATP con endoprótesis, siendo los objetivos de morbimortalidad cardiovascular y de función renal. En la figura 2 se expone el algoritmo propuesto por la European Society of Hypertension para el tratamiento de la EARA.
CONCLUSIONES
La EARA es, pues, una patología en el contexto de una enfermedad sistémica, la aterosclerosis, que viene a añadir mayor complejidad y riesgo asociado a la misma. Como causa tratable de HTA secundaria, ha despertado entusiasmo durante años en los clínicos que atienden a este tipo de pacientes. Sin embargo, la escasez de estudios prospectivos, aleatorizados, bien diseñados, con poblaciones homogéneas, ha sido causa de controversia respecto a la idoneidad de su tratamiento: cómo, cuándo y a quién. Esto obliga a ser cauteloso en la toma de decisiones y en la previsión de resultados, a la vez que sugiere la necesidad de implementar con contundencia el tratamiento médico que se sabe es beneficioso en la aterosclerosis en general, así como de proseguir tanto en la investigación de exploraciones adecuadas para el diagnóstico preciso de estas lesiones como en la elaboración de algoritmos que permitan seleccionar con rigor a aquellos pacientes que se beneficiarán del tratamiento mediante revascularización. Tal vez, dados los pobres resultados en la revascularización tardía, debería plantearse la posibilidad de intervenir en una fase más precoz, con la finalidad de preservar la función renal y prevenir o tratar la HTA renovascular, pero para ello es necesario antes demostrarlo en un gran estudio aleatorizado.
Puntos clave
1. La estenosis de arteria renal aterosclerótica (EARA) es una expresión más de la aterosclerosis, siendo a la vez un predictor independiente de complicaciones cardiovasculares tales como infarto de miocardio, ictus o insuficiencia renal terminal.
2. Su prevalencia varía según la población estudiada, oscilando entre el 7% en la población general mayor de 65 años y el 15-25% en pacientes con enfermedad coronaria o enfermedad vascular periférica.
3. La EARA es, además, una causa no infrecuente y prevenible de insuficiencia renal crónica terminal.
4. La detección de HTA vasculorrenal debería hacerse en pacientes con criterios de sospecha mediante pruebas no invasivas (p. ej., ecografía-Doppler renal, angiorresonancia o angiotomografía computarizada helicoidal) de acuerdo con la disponibilidad y experiencia de cada institución.
5. Queda por confirmar la utilidad de determinados parámetros complementarios, como el índice de resistividad, que podrían incrementar la capacidad predictiva de respuesta al tratamiento.
6. Hoy por hoy, la angiografía renal continúa siendo la exploración «patrón oro» para el diagnóstico de la EARA. La medida del gradiente de presión translesional puede ser importante para determinar la indicación de tratamiento.
7. El grado de daño parenquimatoso renal es el principal determinante de buena respuesta al tratamiento. La rapidez y la severidad en la instauración, previa al tratamiento, de HTA y de disfunción renal, son buenos predictores de respuesta a la revascularización.
8. Mayoritariamente, el tratamiento de elección es la angioplastia con endoprótesis.
9. El tratamiento médico debe incluir la optimización del tratamiento de la aterosclerosis con antihipertensivos, estatinas y antiagregantes, así como control del metabolismo hidrocarbonado y abandono del tabaquismo si es el caso.
10. El fracaso de la respuesta clínica a la revascularización debe buscarse no en causas en relación con la técnica, sino en la selección de pacientes, la precisión en el diagnóstico y la existencia de daño parenquimatoso renal.
Tabla 1. Prevalencia de hipertensión renovascular según los diferentes grupos de riesgo
Tabla 2. Criterios de sospecha de estenosis de arteria renal aterosclerótica
Tabla 3. Factores determinantes de peor pronóstico de la estenosis de arteria renal aterosclerótica
Tabla 4. Propiedades que debería tener la prueba de imagen ideal para la identificación y evaluación de estenosis de arteria renal
Figura 1. Algoritmo para el diagnóstico de estenosis de arteria renal. (Adaptado de Kendrick y col. 4)
Tabla 6. Indicaciones de revascularización en la EARAa
Tabla 7. Factores asociados con poca probabilidad de respuesta a la revascularización en la EARA
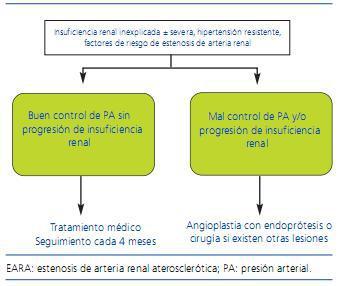
Figura 2. Algoritmo para el tratamiento de pacientes con EARA. (Adaptado de Alcázar y col. 17)
Tabla 5. Pruebas no invasivas para el diagnóstico de EARA