A pesar de los avances en el tratamiento inmunosupresor y en los cuidados del enfermo trasplantado, a los tres años del trasplante el 20-30% de los receptores habrán perdido el injerto y la pérdida continuará a razón de un 2-4% anual. Estos enfermos de nuevo se incluyen en programas de diálisis, y constituyen entre el 4 y 10% de los enfermos admitidos anualmente para tratamiento dialítico. De ellos, el 40-60% según las series se incluyen en lista de espera para un segundo trasplante, lo que origina un aumento del número de enfermos en espera de trasplante y plantea el dilema sobre los derechos a trasplantarse en los programas basados en donantes cadáver. Como característica importante, los enfermos en espera de un segundo o tercer trasplante con frecuencia tienen anticuerpos circulantes frente a los antígenos HLA. El retrasplante constituye la mejor forma de tratamiento de la insuficiencia renal crónica (IRC), y los resultados de la supervivencia del injerto se acercan a los del primer trasplante, a pesar de ser considerados enfermos de alto riesgo. También mejora la supervivencia del enfermo respecto a aquel que permanece en lista de espera. Los grupos más favorecidos por el retrasplante son los enfermos en que la diabetes tipo I fue la causa del fallo renal y el grupo de edad entre 18 y 50 años (evidencia C). A pesar de las ventajas terapéuticas del retrasplante, el porcentaje de enfermos que se somete a un segundo trasplante permanece estacionario, posiblemente por la aplicación de criterios más amplios en cuanto a la aceptación de candidatos a trasplantarse (evidencia B). En el segundo trasplante, se pueden repetir los antígenos HLA-AB no compartidos si el receptor no ha desarrollado anticuerpos específicos. La prueba cruzada reciente e histórica debe ser negativa. Las pautas de inmunosupresión a utilizar son las mismas que en el primer trasplante. Complicaciones asociadas a la inmunosupresión, como la enfermedad linfoproliferativa y la nefropatía por el virus BK, así como las glomerulopatías recidivantes, no son contraindicaciones para el retrasplante (evidencia C).
Despite the advances in immunosuppressive therapy and in patient care, about 20-30% of patients wi l l have lost their grafts after 3 years and this loss will continue by 3-4% per year. These patients are included in maintenance dialysis programmes and account for 4 to 10% of those admitted every year for maintenance dialysis therapy. Among those patients who loss their grafts 40-60% are included in transplant waiting l ists. This increases the number of patients waiting for a graft and raises the di lemma about the rights to be included in deceased donor programmes. A common characteristic of these patients waiting for a second or even third transplant is the presence in the blood of antibodies to HLA antigens. A new transplant is the best therapeutic option for these patients, and the results are quite close to those achieved for the first graft. Moreover, a new transplant improves patient outcome when compared with those remaining in the waiting l ist. The best results are obtained in diabetic patients and in those between 18 to 50 years old (Evidence C). However, the percentage of patients retransplanted has not varied in the last years, possibly due to the wider criteria adopted on candidate selection that increases the waiting l ists (Evidence B). In the second transplant, mismatched HLA-A,B antigens could be repeated if the recipient has not developed specific antibodies to these antigens. Recent cross-match has to be negative. Immunosuppressive therapy is simi lar to that used with first transplants. Lymphoprol iferative diseases, BK virus nephropathy and primary glomerulonephritis do not preclude a second transplant (Evidence C).
INTRODUCCIÓN
Un trasplante renal funcionante es el mejor tratamiento de la IRC en comparación con la diálisis, puesto que restaura las funciones realizadas por los riñones, mejora la supervivencia del enfermo y la calidad de vida1,2. No obstante, no es un tratamiento definitivo y es importante constatar que, a pesar del desarrollo de nuevos fármacos inmunosupresores, de la mejora en los cuidados generales de los enfermos, de la nueva generación de antibióticos y la disponibilidad de fármacos antivirales, la supervivencia del injerto a largo plazo no ha mejorado significativamente. Así, después de tres años de seguimiento, un 30% de los receptores de un trasplante renal habrán perdido el injerto, y la pérdida continuará a razón de un 2-4% anual. Las causas de las pérdidas si se producen precozmente son el rechazo agudo, los fallos técnicos y la no viabilidad del órgano trasplantado. Cuando la pérdida se produce tardíamente, las causas son la nefropatía crónica del injerto y la muerte con injerto funcionante. La pérdida de función del injerto renal es una causa importante de admisión para tratamiento con diálisis. También es una de las causas del aumento de las listas de espera. Como en el caso de la insuficiencia renal por enfermedad de los riñones nativos, tras el fallo de uno o más injertos, el trasplante renal sigue siendo el mejor tratamiento de estos enfermos, salvo que la situación clínica del enfermo no lo aconseje2,3. La elección de un receptor para un segundo trasplante plantea un dilema ético. Su realización puede tener implicaciones positivas en cuanto a la supervivencia y la calidad de vida del receptor, pero, por otra parte, se restan órganos a aquellos receptores que están esperando su primer trasplante, contraviniendo el principio de igualdad de oportunidades. Quizás por este motivo y por la ampliación de los criterios de aceptación de enfermos, el porcentaje de retrasplantes ha permanecido estabilizado.
El objetivo del presente trabajo es: 1) analizar el impacto del fallo del primer injerto en las necesidades de diálisis y el acceso a las listas de trasplante, así como la adecuación del porcentaje de retrasplantes al número de enfermos en listas de espera; 2) establecer algunas recomendaciones en cuanto a criterios de inclusión de enfermos para retrasplante, inmunosupresión, etc.; 3) revisar los resultados en cuanto a supervivencia del injerto y del enfermo, y de los factores que los influencian; y 4) determinar cómo afectan al injerto y al enfermo las enfermedades con posibilidad de recurrencia.
LISTA DE ESPERA Y PORCENTAJE DE RETRASPLANTES
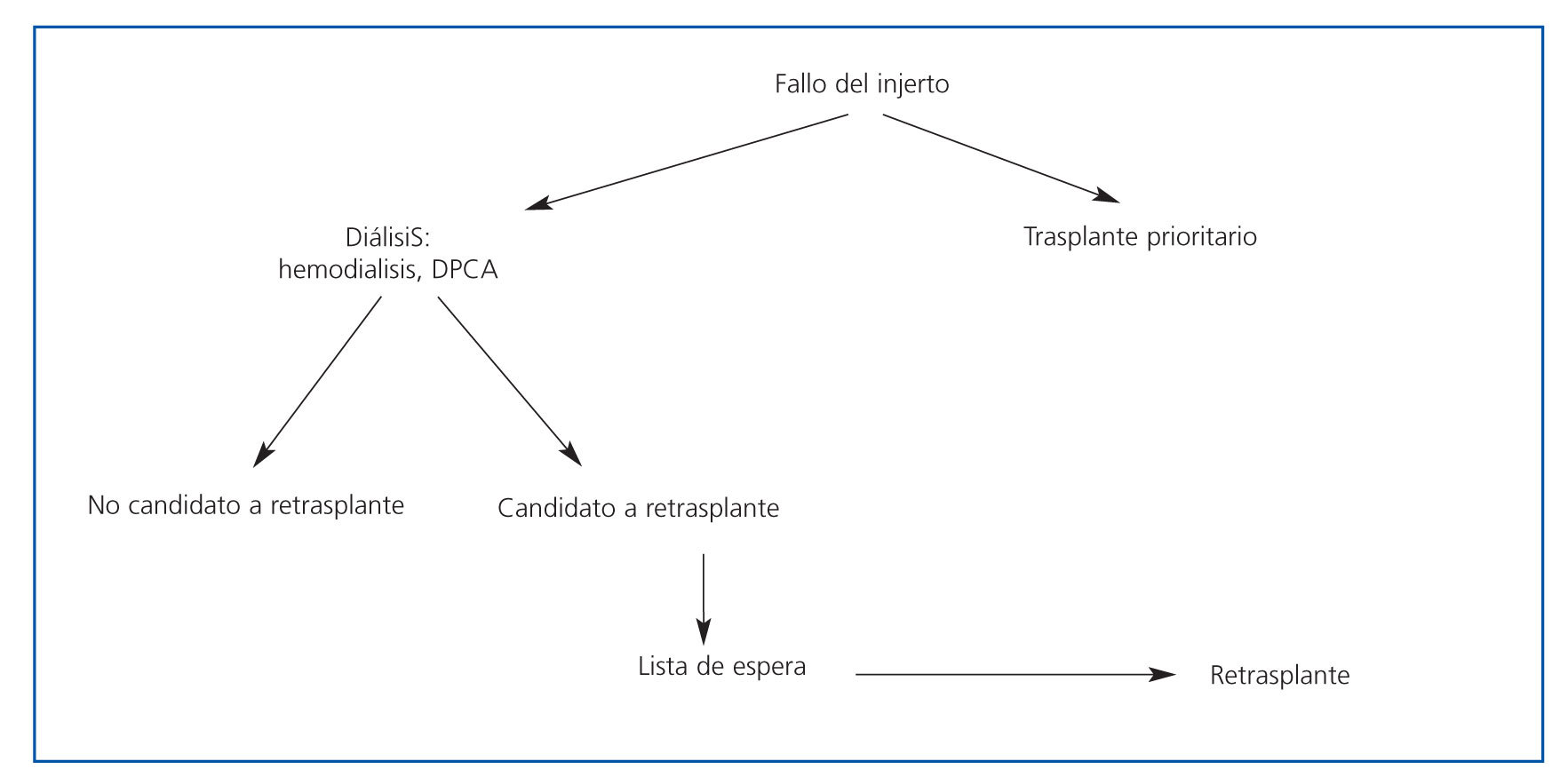
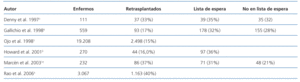
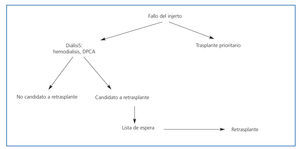
El fallo del injerto trasplantado determina la necesidad de recomenzar el tratamiento con diálisis para mantener al enfermo vivo. En la actualidad, es una causa importante de admisión para tratamiento con diálisis. En Europa, el número de enfermos con fallo del injerto que recomenzaron tratamiento con diálisis en 1995 fue el 4% del total de los admitidos5. Similares porcentajes, un 4,8%, se han publicado referidos al 2004 en los Estados Unidos6. En el Hospital Ramón y Cajal, 10 enfermos (10,9%) de los 92 enfermos admitidos para tratamiento con diálisis en 2006 procedían del programa de trasplante. Algunos enfermos que han perdido un primer injerto son candidatos a un nuevo trasplante, por lo que su inclusión aumentará las listas de espera. El porcentaje de enfermos incluidos en listas de espera es variable. Según datos de centros aislados7-10 y registros americanos2,3, entre el 40 y el 70% de los enfermos que han perdido un injerto renal son incluidos en lista para un segundo trasplante (tabla 1). Las causas de exclusión fundamentales son la situación clínica y la propia decisión del enfermo. Entre estos enfermos incluidos en lista, el porcentaje de trasplantados es variable y depende de muchos factores no suficientemente conocidos, entre los que estarían incluidos la edad, el sexo, la raza, la duración del primer injerto y los niveles de anticuerpos frente a un panel de células (PRA). Aunque no es una situación que se presente de momento en España, la raza condiciona la probabilidad de repetir el trasplante en países como los Estados Unidos, en que los afroamericanos y los de otras razas no caucásicas tenían un 53 y un 38%, respectivamente, menos probabilidades de repetir un trasplante. Datos algo antiguos del registro de la EDTA mostraban que entre 1984 y 1993 el 5% de los trasplantes realizados correspondían a retrasplantes11. En los Estados Unidos, durante el mismo período, el 13% de los trasplantes se realizaron a enfermos que habían perdido un injerto, pero los enfermos que esperaban un retrasplante constituían el 25-30% de los enfermos en lista2. En Francia, entre 1989 y 1999, el 13,3% de los trasplantes eran retrasplantes, pero el 42% de los enfermos en lista de espera eran candidatos a un segundo trasplante12. A pesar del incremento del número de trasplantes, el porcentaje de enfermos admitidos para retrasplante ha cambiado poco en la última década. Según datos de la OPTN, en el año 2005, entre el 10 y el 13% de los trasplantes realizados fueron retrasplantes, siendo el grupo de edad entre 18 y 49 años el que presentaba el mayor porcentaje de segundos o terceros trasplantes13. Las posibilidades de tratamiento del enfermo que ha perdido un injerto renal están contenidas en la figura 1.
CARACTERÍSTICAS DE LOS ENFERMOS QUE HAN PERDIDO UN INJERTO
Los enfermos con disfunción del injerto en estadios avanzados de enfermedad renal crónica se caracterizan por tener un seguimiento por médicos experimentados en el cuidado de la IRC, por lo que deberían tener una buena información acerca de las modalidades de diálisis y del tiempo de realización del acceso para la diálisis, y un tratamiento adecuado de las enfermedades asociadas. Cuando se comparan con la población que comienza diálisis, los enfermos que han perdido un injerto suelen ser más jóvenes, predominan los varones y tienen una menor comorbilidad. El tiempo medio de duración del injerto funcionante es muy variable según las series, pero en general suele ser de algunos años. Al analizar parámetros de cuidado, los niveles de hemoglobina, el uso de eritropoyetina, los niveles de albúmina y el filtrado glomerular al comenzar el tratamiento con diálisis, no se encuentran diferencias o son algo peores que las de los enfermos de la población general incluidos en diálisis14,15. Los parámetros analizados muestran que es posible mejorar la situación del enfermo de acuerdo con las recomendaciones de las guías de tratamiento de la enfermedad renal crónica.
En caso de una pérdida precoz, el primer injerto tendrá efectos sobre el enfermo en función de las condiciones en que se haya producido la pérdida. Si ésta se produjo por una complicación técnica en los días inmediatos al trasplante, el enfermo habrá sufrido los efectos de la cirugía del trasplante y de la nefrectomía, más el impacto psicológico correspondiente por la oportunidad perdida. En caso de que la pérdida haya sido por rechazo agudo tras un plazo más o menos prolongado de ausencia de función, además de los efectos anteriores, se habrá sometido al enfermo a una inmunosupresión intensa, con las consiguientes complicaciones en cuanto a alteraciones metabólicas, toxicidad hematológica, infecciones, etc. Cuando la pérdida es tardía por nefropatía crónica del injerto o recidiva de enfermedad primaria, la inmunosupresión crónica y sus efectos secundarios, así como la situación de fallo renal, van a determinar el aumento del riesgo cardiovascular. Por otra parte, la pérdida del injerto por causa inmunológica es una causa importante de sensibilización y se acompaña de producción de anticuerpos frente a un panel de células (PRA). El grado de sensibilización se correlaciona de forma directa con el grado de compatibilidades en los antígenos HLA-A, -B (clase I) en el trasplante previo. Al igual que ocurre en el primer trasplante, la incidencia de rechazo aumenta en relación con el aumento del PRA. Se ha señalado que los enfermos hipersensibilizados retrasplantados tienen un mayor riesgo de presentar episodios de rechazo que los receptores de un primer injerto hiperinmunizados, lo que sugiere la existencia de algún otro mecanismo, además de los anticuerpos preformados, que aumenta la incidencia de rechazo.
Como consecuencia de lo expuesto previamente, un porcentaje variable de candidatos a un segundo trasplante están sensibilizados12,13,16. El nivel de sensibilización se expresa por el porcentaje de células, adecuadamente tipadas, de un panel con las que reacciona un suero. Un enfermo altamente sensibilizado sería aquél con uno o más sueros que reaccionan con el 80% o más de las células del panel. Estos enfermos tienen una gran dificultad de obtener un órgano, ya que la prueba cruzada va a ser sistemáticamente positiva, lo que en el mejor de los casos conlleva que el tiempo de espera para un nuevo trasplante sea muy largo o, por el contrario, que no se trasplanten nunca. La única forma de poder ser trasplantados es mediante programas nacionales o regionales que les den prioridad o reduciendo la alosensibilización HLA. En algunas comunidades, los enfermos hipersensibilizados de los diferentes hospitales están en una lista común y son testados siempre que hay un donante, teniendo preferencia para trasplantarse.
En relación con la alosensibilización, en los últimos años se han desarrollado algunos protocolos de tratamiento con cierto grado de efectividad. 1) Inmunoglobulina intravenosa: procede del plasma de cientos de donantes que posee efectos moduladores de los anticuerpos anti-HLA. Se utiliza tras la evaluación de su eficacia mediante un test in vitro. Se administra a una dosis de 2 g/kg durante las cuatro horas de una sesión de hemodiálisis, una vez al mes durante al menos cuatro meses. Este tratamiento, además de reducir la alosensibilización, reduce el daño inducido por isquemia-reperfusión, reduce los episodios de rechazo y mejora la supervivencia del injerto a largo plazo16. 2) Combinación de inmunoabsorción o plasmaféresis e inmunoglobulina intravenosa. La inmunoabsorción y la plasmaféresis eliminan los anticuerpos circulantes y la inmunoglobulina bloquea la producción de anticuerpos. El tratamiento se continúa hasta que no se detectan anticuerpos anti-HLA en el suero del enfermo. Esta combinación terapéutica se ha utilizado también en trasplante de donante vivo con una prueba cruzada positiva y como terapia de rescate de rechazo agudo humoral17,18.
SELECCIÓN DEL RECEPTOR
Criterios no inmunológicos
En el segundo trasplante, los criterios no inmunológicos a aplicar deben ser en su mayor parte semejantes al primer trasplante. Los injertos deben ajustarse al receptor de acuerdo con la edad, la masa corporal, la situación clínica del enfermo y el tiempo de espera. En los registros, no existe diferencia con el primer injerto en cuanto al porcentaje de utilización de donantes idóneos o de donantes llamados subóptimos. La aceptación de un receptor para un nuevo trasplante cuando el primero se perdió por incumplimiento terapéutico ha sido ampliamente debatida. Los datos de los que se dispone no sostienen la exclusión de estos enfermos.
Criterios inmunológicos
La elección de los receptores se realizará de acuerdo con la compatibilidad del grupo sanguíneo ABO. Se pueden repetir las incompatibilidades del sistema HLA siempre y cuando los receptores no hayan desarrollado anticuerpos específicos a los antígenos HLA clase I o antígenos HLA clase II compartidos por ambos donantes16. En algunos centros, se recomienda la utilización de órganos que compartan cuatro antígenos HLA, sobre todo en aquellos receptores con niveles elevados de PRA12. La prueba cruzada tanto reciente como histórica debe ser negativa. Una prueba cruzada a células B, sin reactividad anticélulas T del donante, no debe considerarse una contraindicación al trasplante.
Se ha debatido mucho acerca del método a utilizar en la realización de la prueba cruzada. La prueba convencional detecta aquellos anticuerpos anti-HLA capaces de fijar complemento. Se ha considerado que esta prueba puede ser poco sensible en la detección de grados mínimos de sensibilización. Por dicho motivo, se han desarrollado pruebas más sensibles, como son la técnica de la antiglobulina humana y la citometría de flujo. Esta última detecta anticuerpos citotóxicos que no son dependientes de complemento, y es la más sensible de las tres20. La significación de los anticuerpos detectados por la citometría de flujo viene determinada por la aparición de efectos sobre el injerto a corto plazo: mayor incidencia de función retrasada del injerto, rechazo agudo y mayores pérdidas de injertos por este motivo; y a largo plazo: menor supervivencia del injerto en los enfermos con una prueba cruzada convencional negativa y una prueba cruzada positiva por citometría de flujo20,21. Para algunos autores, hasta un 25% de las pruebas cruzadas convencionales negativas son positivas cuando se realiza mediante citometría de flujo.
Los autoanticuerpos son generalmente inmunoglobulinas de la clase M (IgM) que pueden producir una prueba cruzada positiva y que no contraindicarían el trasplante. La mejor forma de eliminar los autoanticuerpos es mediante la absorción con células autólogas que hacen desaparecer la positividad de la prueba. Alternativamente, se puede usar el ditiotreitol (DTT), que elimina los anticuerpos IgM16.
EVOLUCIÓN DEL INJERTO
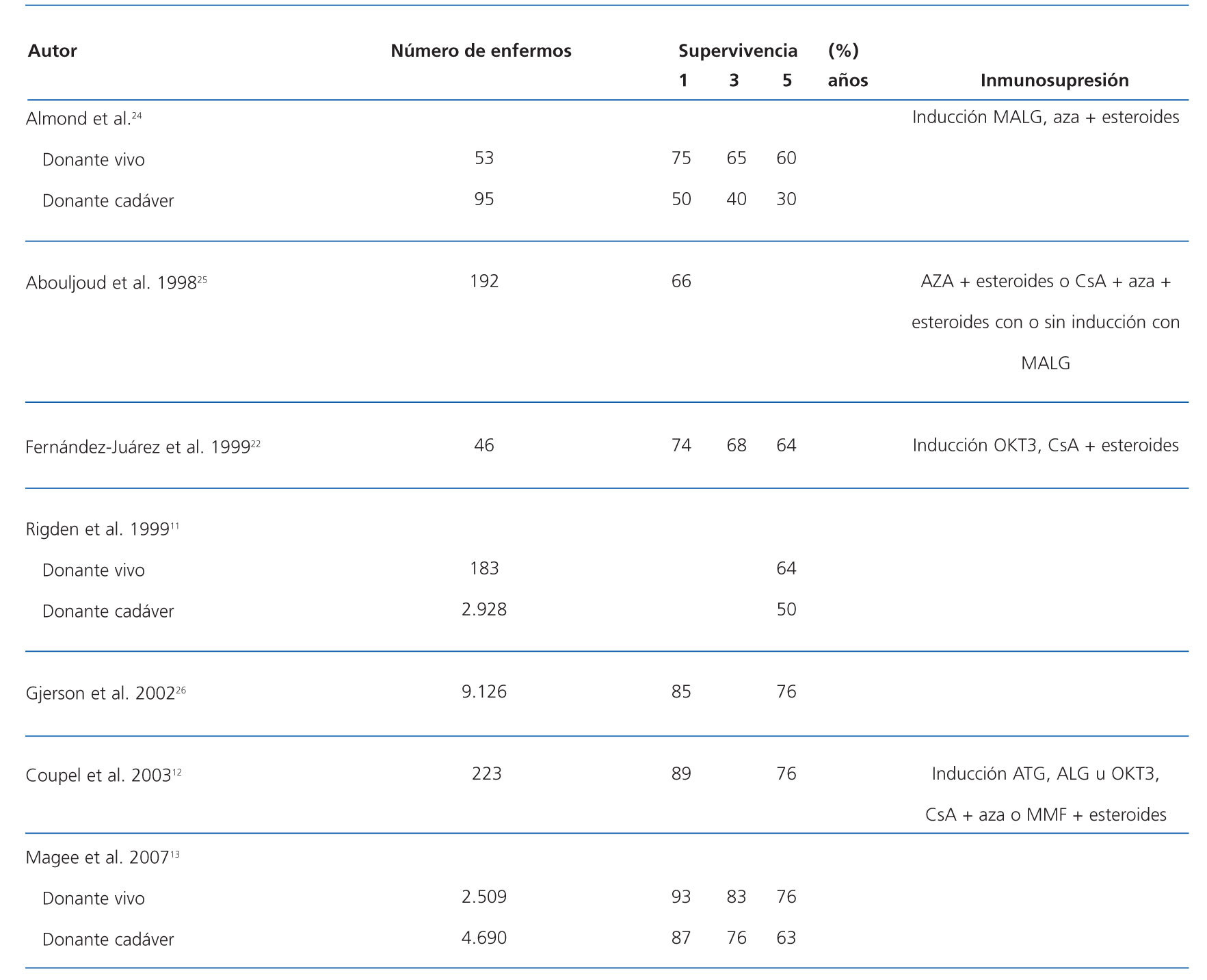
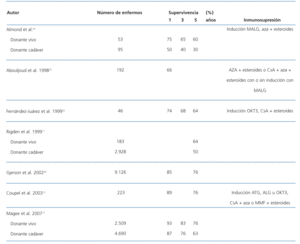
Los enfermos que reciben un segundo injerto tienen, en algunas series, una mayor incidencia de función renal retrasada y una mayor necesidad de diálisis en el postrasplante inmediato que los receptores de un primer trasplante, por lo que el retrasplante se ha considerado un factor de riesgo de función retrasada del injerto. También se ha descrito un mayor porcentaje de injertos nunca funcionantes, que se ha atribuido a rechazo hiperagudo no diagnosticado, debido a la presencia de anticuerpos a los antígenos HLA no detectados por la prueba cruzada convencional. La incidencia de rechazo agudo es más elevada que en el primer trasplante. Las causas de pérdida del segundo injerto son similares a las del primero: nefropatía crónica del injerto, fallecimiento con injerto funcionante y rechazo agudo12. La supervivencia del segundo trasplante ha sido variable según épocas y resultados publicados. En los años 90 mejoró y se aproximaba a los del primer injerto, las diferencias en la supervivencia del injerto entre el primer y el segundo trasplante descendieron desde el 10% en 1984 hasta el 1% en 199216. No obstante, estudios de registro más recientes han mostrado la reaparición de algunas diferencias. Así, la supervivencia para el primer y el segundo trasplante a uno, tres y cinco años, tanto para injerto de donante vivo como para injerto de donante cadáver, fue de un 5% peor para los retrasplantes13. En nuestra propia experiencia, las diferencias entre el primer y el segundo trasplante en el Hospital Ramón y Cajal fue del 5% a los cinco años, si bien no se alcanzó significación estadística por el número de casos22. La falta de órganos para trasplante ha hecho que se hayan flexibilizado las exigencias requeridas para la donación de órganos. Se han utilizado órganos procedentes de donantes de más de 60 años o de 50-60 años con alguna de las siguientes características: fallecimiento por accidente cerebrovascular, creatinina sérica superior a 1,5 mg/dl o historia de hipertensión arterial. Son los llamados en los Estados Unidos donantes con criterios ampliados. En España no suele haber límite de edad en la donación, aunque no se suelen utilizar órganos de donantes de más de 80 años. Los resultados del retrasplante con este tipo de injertos en cuanto a la supervivencia del injerto son inferiores a los de donantes convencionales23. En la tabla 2 se muestra un resumen de la supervivencia del injerto, según datos de estudios multicéntricos y de registros.
FACTORES QUE INFLUYEN EN LA SUPERVIVENCIA DEL INJERTO
Se han descrito varios factores que influyen de una u otra forma en la supervivencia del retrasplante. Estos factores dependen de las características del primer trasplante, del receptor, del donante y del órgano trasplantado. Algunas de ellas son las mismas que influyen en la evolución del primer injerto, como puede verse en la tabla 316,24-26.
La mayoría de autores están de acuerdo en que la supervivencia del primer injerto es un factor predictor importante de un trasplante posterior. Una supervivencia de un primer trasplante superior a seis meses o un año se asocia con una evolución más favorable de un retrasplante, mientras que una pérdida precoz se asocia con una mala evolución11,16,24-26. La supervivencia a largo plazo puede ser un marcador subrogado de una respuesta inmunológica baja, y una pérdida precoz indicaría una respuesta inmunológica fuerte. También la supervivencia del segundo injerto es más baja si el primero se perdió por rechazo en los primeros seis meses. Pero la supervivencia del segundo injerto es similar a la del primero cuando la causa de la pérdida es el rechazo tras más de seis meses o causas no inmunológicas24.
El efecto de la nefrectomía del injerto no funcionante en la supervivencia del retrasplante es controvertida. Lair et al.27, en un estudio de un centro, comparan la evolución del segundo trasplante según se haya realizado o no nefrectomía previa, y no encuentran que la presencia del injerto no funcionante in situ en el momento de un nuevo trasplante tenga algún efecto beneficioso en la supervivencia del injerto a 10 años. Tampoco encuentran diferencias en la incidencia de rechazo, en la función renal ni en las causas de pérdida del segundo injerto. Sin embargo, estos autores no refieren las complicaciones de la nefrectomía. Datos de registro han encontrado que la nefrectomía tras un fallo precoz del injerto se ha asociado con un riesgo menor de nuevo fallo del injerto, efecto que desaparecía después de censurar los enfermos que perdieron el injerto por fallecimiento. En caso de fallo tardío, la nefrectomía puede ser deletérea para la evolución del segundo injerto, y el efecto se mantiene incluso después de censurar los enfermos cuya causa de pérdida del injerto fue el fallecimiento25,28. La extirpación de un injerto no funcionante se asocia con sensibilización fundamentalmente en los enfermos con un título de anticuerpos bajo antes del primer trasplante28,29. Los injertos no funcionantes pueden retenerse in situ con una dosis mínima de inmunosupresión o, incluso, sin inmunosupresión, pero pueden estar implicados en el desarrollo y el mantenimiento de un estado inflamatorio crónico30.
La influencia de la secuencia del tipo de donante en la evolución del retrasplante se ha analizado en algunos estudios. Si el segundo trasplante procede de un donante cadáver, la supervivencia no está influida por la procedencia del primer injerto, vivo o cadáver. Sin embargo, como la inmunización es más intensa con el trasplante de donante cadáver, se debe preferir el trasplante de donante vivo como primera opción16. En caso de que el segundo trasplante proceda de un donante vivo, tampoco parece que se influyan por la procedencia del primer injerto11; aunque los resultados sean inferiores a los del primer injerto, son mejores que los de donante cadáver11,13,24,26.
La presencia de aloanticuerpos contra los antígenos HLA en el suero de los receptores de un trasplante tiene un efecto negativo en la supervivencia del injerto24, y su presencia precede la aparición de rechazo agudo o crónico. Los enfermos que han rechazado previamente un injerto y están en espera de otro con frecuencia tienen anticuerpos circulantes en la sangre. Se ha postulado que la ausencia de estos anticuerpos se debe a la falta de sensibilidad en los métodos usados en su detección o a la absorción de éstos por el injerto. La utilización de pruebas más sensibles, como se ha indicado previamente, puede ayudar a una mejor selección de los candidatos. La mejoría en la supervivencia del segundo injerto observada en algunos centros se ha atribuido a la realización de la prueba cruzada mediante citometría de flujo, que evita la realización de trasplantes con anticuerpos IgG frente a los antígenos HLA de clase I dirigidos a los antígenos del donante16,19,20. Sin embargo, hay otros estudios que no han observado diferencias en la supervivencia del injerto en relación con la técnica usada en la realización de la prueba cruzada31. Al igual que en el primer trasplante, la edad del donante es uno de los factores más importantes que influyen en la supervivencia del injerto, sobre todo a medio plazo25. Los órganos procedentes de donantes muy jóvenes (<16 años) o mayores de 35 tienen una peor supervivencia que aquellos procedentes de donantes de entre 17 y 35 años. La producción de orina en el primer día del trasplante y la necesidad de diálisis también son dos factores pronósticos importantes16. La isquemia fría debe reducirse, ya que una isquemia fría prolongada más de 24 horas afecta los resultados a corto plazo, si bien no parece tener efecto a largo plazo26.
Algunos autores creen que una buena compatibilidad HLADR mejora la supervivencia, mientras que no tiene influencia la compatibilidad HLA-A, -B12,16,26. Otros consideran que la compatibilidad HLA tiene una influencia escasa en la evolución, ya que la potente inmunosupresión de la que disponemos en la actualidad controla los posibles efectos negativos de una mala compatibilidad. La repetición de incompatibilidades tiene un efecto variable, mientras que en presencia de una prueba cruzada negativa la repetición de antígenos HLA de los locus A y B no influye negativamente en la supervivencia del injerto. La repetición de los antígenos del locus DR tiene un efecto negativo, por lo que se recomienda no repetirlos21,32.
EVOLUCIÓN DEL ENFERMO
Como ya se ha dicho, el trasplante renal es el mejor tratamiento de la IRC. Consecuentemente, este principio deberá aplicarse también al retrasplante. Existen estudios comparativos entre los enfermos que pierden el injerto en los que se comparó la supervivencia de los enfermos según su situación: no incluidos en lista de trasplante, incluidos en lista y trasplantados de nuevo que lo demuestran. En un estudio de un solo centro, Denny et al.7 observaron en 111 enfermos con fallo del injerto que la mortalidad era mayor entre los enfermos incluidos de nuevo y no incluidos en lista que en los retrasplantados, sin encontrar diferencias entre los dos grupos no retrasplantados. Estos resultados concuerdan con los publicados por Ojo et al.3 extraídos del registro USRDS, que observaron en 19.208 enfermos con pérdida del injerto que un nuevo trasplante reducía la mortalidad entre el 23 y el 45%, fundamentalmente en los enfermos en los que la diabetes tipo 1 había sido la causa de la IRC. Datos del registro canadiense han mostrado en 3.067 enfermos que el retrasplante redujo la mortalidad en un 50% respecto a los enfermos en diálisis después de ajustar entre otras variables por edad, sexo, raza, enfermedad renal primaria, tiempo en diálisis y tiempo entre el primer trasplante y el fallo del injerto. Al igual que en el estudio anterior, algunas poblaciones se beneficiaron más que otras. La mejoría de la supervivencia fue mayor para trasplantes de donante de vivo en comparación con los receptores de donante cadáver4. En la experiencia del Hospital Ramón y Cajal, los resultados fueron diferentes de los previamente citados: la supervivencia del enfermo fue similar en el grupo retrasplantado que en el grupo incluido en lista no retrasplantado10. El retrasplante con injerto procedente de donantes con criterios ampliados no parece mostrar beneficios en cuanto a la supervivencia del enfermo, aunque no hay que descartar otros, como la posible mejoría en la calidad de vida. A diferencia del retrasplante con injertos procedentes de donantes estándar, Miles et al.33 no encontraron diferencias en la supervivencia del enfermo entre los retrasplantados con riñones procedentes de donantes con criterios ampliados y la terapia convencional.
INMUNOSUPRESIÓN
Al ser el retrasplante de mayor riesgo inmunológico, y por consiguiente con mayor incidencia de rechazo que el primer trasplante, sería acertado considerar que el régimen inmunosupresor a administrar debería ser más potente que en el primer trasplante. No obstante, no hay unanimidad en cuanto al régimen inmunosupresor más adecuado. En la época de la ciclosporina, ésta se utilizaba en combinación con azatioprina y esteroides. Algunos autores recomendaban la utilización de gammaglobulina antilinfocítica (ALG o ATG) o anticuerpos monoclonales (OKT3), de manera sistemática a todos los enfermos durante los primeros 14 días postrasplante o solamente a aquéllos con función retrasada del injerto hasta que ésta se restablecía, o en el caso de que la pérdida del injerto previo se hubiese debido a rechazo agudo12,22,26. Esta pauta con inducción con anticuerpos se asoció con una menor duración de la ausencia de función en el inmediato posoperatorio y mejor supervivencia del injerto a cinco años, que se atribuyó al posible descenso del efecto nefrotóxico de la ciclosporina en el inmediato postrasplante. La aparición del micofenolato mofetil, del tacrolimus y de la rapamicina, y su utilización en diversas combinaciones, ha descendido de forma drástica la incidencia de rechazo agudo. En la actualidad, los receptores de un segundo trasplante que no estén hiperinmunizados se tratan con los mismos protocolos terapéuticos que el primer trasplante. En los casos de enfermos inmunizados, sería recomendable la utilización de la combinación de tacrolimus con micofenolato mofetil o ácido micofenólico y esteroides, por ser la pauta de inmunosupresión más potente, posiblemente asociada a inducción con gammaglobulina antilinfocito o con anticuerpos monoclonales anti-CD-25.
RETRASPLANTE EN RECEPTORES CON ENFERMEDADES RECURRENTES
Las glomerulonefritis está entre las causas más frecuentes de enfermedad renal crónica, y estos enfermos tienen riesgo de recurrencia de su enfermedad original tras un trasplante renal. Este riesgo no está influido por la inmunosupresión por ciclosporina, pero aumenta con el tiempo de supervivencia del injerto. La verdadera recurrencia de las glomerulonefritis no es muy bien conocida, puesto que no se realizan biopsias renales de forma rutinaria en todos receptores y, por tanto, la incidencia publicada está subestimada. Por otra parte, la incidencia y el impacto de la recurrencia varía entre los diferentes tipos de glomerulonefritis. Briganti et al.34 han publicado, basándose en los resultados de biopsias de los riñones nativos y del injerto en 1.505 enfermos, que la recurrencia de la glomerulonefritis fue la tercera causa de pérdida del injerto tras 10 años de seguimiento. La recurrencia fue más frecuente entre los receptores con hialinosis segmentaria y focal, y glomerulonefritis mesangiocapilar tipo I, pero no se pudo identificar ningún factor predictivo de recurrencia de los diferentes tipos de glomerulonefritis. Al igual que en el primer injerto, las glomerulonefritis pueden recurrir en el retrasplante, y se ha descrito su presentación en el segundo injerto en receptores con glomeruloesclerosis focal y glomerulonefritis mesangiocapilar. Pardon et al.35 observaron que la glomeruloesclerosis focal recurrió en tres enfermos que se retrasplantaron. El tratamiento es el mismo que el recomendado en el primer injerto: control de la hipertensión arterial, de la proteinuria y de la hiperlipidemia36. La recurrencia de las glomerulonefritis en el primer injerto no contraindica un segundo trasplante, pero debe considerarse la posibilidad de que esto ocurra.
Las enfermedades linfoproliferativas postrasplante (PTLD en la nomenclatura anglosajona) son una complicación que puede poner en peligro la vida en los enfermos trasplantados. El riesgo de padecerlas no es mayor en el segundo trasplante que en el primero, a pesar de repetirse la inmunosupresión12. Muchos casos son originarios de células B y se relacionan con la inmunosupresión e infección con virus de Epstein-Barr (EBV). El tratamiento incluye reducción o suspensión de la inmunosupresión y el uso de anticuerpos específicos anticélulas B o antivirales. Como consecuencia de la suspensión de la inmunosupresión, se pierden algunos injertos, y estos enfermos son potenciales candidatos a un segundo trasplante.
Como van a persistir los mismos factores de riesgo, injerto extraño, inmunosupresión e infección por EBV, hay resistencia a incluir estos enfermos en la lista de espera y realizar un nuevo trasplante. No obstante, se han publicado algunos casos aislados y algunas series pequeñas de retrasplante con éxito en enfermos que habían padecido PTLD37,38. Birkeland et al.39 han publicado un estudio de cinco enfermos con PTLD que fueron retrasplantados y no presentaban signos de recurrencia de la enfermedad tres años después. En dicho estudio, la inmunosupresión consistió en timoglobulina y basiliximab como terapia de inducción y ciclosporina, o tacrolimus y MMF como inmunosupresión de mantenimiento. Karras et al.40 mostraron resultados similares en un estudio multicéntrico. Seis enfermos, seguidos al menos dos años después de una remisión completa del PTLD, se incluyeron en lista de espera y fueron retrasplantados con un tiempo de espera de 77 meses después del diagnóstico de PTLD. De ellos, cuatro enfermos recibieron inducción con anticuerpos policlonales y dos con basiliximab. El tratamiento inmunosupresor de mantenimiento incluyó ciclosporina o tacrolimus, y micofenolato mofetil o azatioprina. Ninguno desarrolló recurrencia después de un seguimiento medio de 30 meses. Teniendo en cuenta los resultados de estos estudios, el diagnóstico de PTLD no debe considerarse una contraindicación para un segundo trasplante. Los nuevos inmunosupresores han hecho descender la incidencia del rechazo y han mejorado la supervivencia a corto plazo del injerto, pero han desencadenado la aparición de nuevas infecciones víricas. La nefropatía por el virus polioma BK se ha descrito hasta en el 8% de los receptores de injerto renal y puede ser la causa de la pérdida de la función del injerto41. Como en el caso de la PTLD, se puede producir la reactivación del virus con la inmunosupresión. Por este motivo, es importante conocer si los enfermos que perdieron el injerto por nefropatía por el virus BK pueden volver a trasplantarse. Poduval et al.42 describieron el primer caso exitoso de retrasplante tras la pérdida del primer injerto por nefropatía por virus BK. Ramos et al.43 publicaron la primera serie de 10 enfermos con nefropatía por virus BK que se retrasplantaron. El segundo trasplante se realizó en ausencia de infección activa por el virus, descartada por citología urinaria para células decoy. Tras un seguimiento de 34,6 meses, sólo un enfermo presentó recurrencia de la nefropatía por virus BK. Womer et al.44 realizaron con éxito un segundo trasplante de donante vivo en dos enfermos con nefropatía por virus BK antes de ser incluidos en diálisis y a pesar de presentar viremia. La inmunosupresión no se suspendió, aunque sí se redujo y se realizó nefrectomía del primer injerto durante la cirugía del segundo trasplante. La necesidad de nefrectomía del injerto previa al retrasplante es controvertida, ya que no parece proteger contra la recurrencia. Se recomienda que tanto la inmunosupresión intensa como el retrasplante deben evitarse cuando hay replicación viral. De acuerdo con las publicaciones previas, los enfermos con pérdida del injerto renal por nefropatía por virus BK pueden ser trasplantados con inmunosupresión estándar. No obstante, como el seguimiento de la mayoría de los enfermos ha sido corto, se necesita uno más largo para conocer la evolución a largo plazo.
Tabla 1. Enfermos con pérdida del primer injerto incluidos en lista y retrasplantados
Tabla 2. Supervivencia del retrasplante
Tabla 3. Factores que pueden influir en la supervivencia del segundo injerto
Figura 1. Esquema de tratamiento tras pérdida del injerto renal