En la actualidad se reconoce que contaminantes ambientales como el cadmio, el plomo y el arsénico tienen un papel importante en la génesis de la insuficiencia renal crónica. Estudios epidemiológicos han demostrado la fuerte asociación entre exposición a estos metales y la presencia de daño renal crónico. Los mecanismos fisiopatológicos de daño renal por metales son complejos y aún se desconocen varios aspectos de su metabolismo y mecanismos de daño en el organismo. Es objetivo de esta revisión analizar dichos mecanismos fisiopatológicos de daño renal por cadmio, plomo y arsénico.
We currently recognise that environmental toxins such as cadmium, lead, and arsenic play a significant role in the development of chronic renal failure. Epidemiological studies have shown a strong association between exposure to these metals and the presence of chronic kidney injury. The physiopathological mechanisms behind metal-induced kidney injury are complex, and some aspects of their metabolism and damage mechanisms remain unknown. This review aims to analyse the physiopathological mechanisms of kidney injury due to cadmium, lead and arsenic.
INTRODUCCIÓN
La incidencia y la prevalencia de la insuficiencia renal crónica han tenido un incremento constante en las últimas tres décadas, lo cual representa un problema creciente de salud pública; la identificación de factores de riesgo asociados a ella es esencial con la finalidad de prevenir el desarrollo y el crecimiento de este problema.
El estudio de los efectos tóxicos de metales pesados en el ser humano ha cobrado particular importancia en los últimos 50 años debido a que grandes cantidades de estos productos fueron desechados como parte de la actividad industrial, no son biodegradables y persisten en el medio ambiente durante largos períodos de tiempo; por este motivo, y a pesar de que las estrictas medidas de control establecidas principalmente en Europa y Norteamérica disminuyeron el desecho de estos metales, niveles elevados de estos compuestos aún persisten en suelos y sedimento con la consecuente exposición crónica por parte de la población.
Los metales pesados son un grupo de elementos químicos mal definidos. Algunos de ellos son necesarios para el ser humano, como el hierro (Fe), el cobalto (Co), el cobre (Cu), el manganeso (Mn), el molibdeno (Mb) y el zinc (Zn). De otro grupo de metales, como el plomo (Pb), el cadmio (Cd) y el arsénico (As), se desconoce si tienen alguna función en el organismo; presentan efectos directos sobre el riñón y son particularmente nefrotóxicos incluso a concentraciones consideradas como «normales». No hay evidencia clara de nefrotoxicidad por otros metales como el uranio y el mercurio1.
Es objetivo de la presente revisión analizar la epidemiología, fisiopatología y manifestaciones clínicas de la nefrotoxicidad asociada a estos metales.
ABSORCIÓN Y METABOLISMO DE LOS METALES DIVALENTES
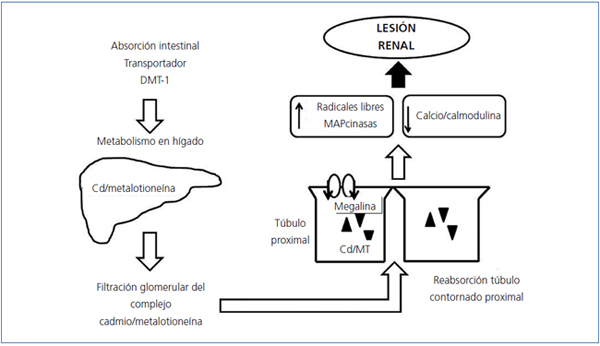
La absorción intestinal de los metales divalentes como el Cd y el Pb se lleva a cabo por el transportador de metales divalentes-1 (DMT-1 por sus siglas en inglés). El DMT-1 se encuentra localizado en el duodeno, los eritrocitos, el hígado y las células del túbulo contorneado proximal (TCP), es la proteína transportadora de Fe y muestra gran afinidad por otros metales divalentes como Cd, níquel (Ni), Pb, Co, Mn, Zn y Cu2. La disminución en la ingesta de Fe y Zn ocasiona un incremento en la expresión del DMT-1, lo cual aumenta la absorción intestinal de Cd y Pb y favorece la toxicidad por estos metales3. Experimentos en líneas celulares en las cuales se ha bloqueado la expresión del DMT-1 sugieren la presencia de un transportador diferente para el Pb4.
Los metales pesados son metabolizados en el hígado, donde se unen a proteínas de bajo peso molecular (< 10 kD) denominadas metalotioneínas (MT). Estas proteínas se encuentran ampliamente distribuidas en el organismo y contienen en su estructura una gran cantidad del aminoácido cisteína, lo cual les confiere una elevada afinidad para reaccionar y almacenar metales como Zn, Cd, mercurio (Hg), Cu, Pb, Ni, Co y Fe.
La función principal de las MT es la de almacenar en el medio intracelular metales esenciales como el Zn y Cu y transferirlos a metaloproteínas, factores de transcripción y enzimas. Las MT también participan en la eliminación de radicales libres y en procesos de reparación y regeneración celular5. El incremento en los niveles intracelulares de Cd y Pb aumenta la expresión de MT, y el ratón knock-out a MT presenta mayor susceptibilidad a la toxicidad por estos metales6.
NEFROTOXICIDAD POR CADMIO
El Cd es uno de los elementos más tóxicos al cual está expuesto el hombre; la exposición ambiental ocurre principalmente a través del humo de tabaco, el agua y alimentos como vegetales, cereales y moluscos. La acumulación de este metal en el organismo es gradual y se incrementa con la edad debido a su larga vida media, mayor de 20 años7.
Epidemiología
Varios estudios epidemiológicos han demostrado el riesgo de la exposición ambiental al Cd y el desarrollo de daño renal. En la década de los cincuenta se comenzó a reconocer en Japón la asociación de la exposición ambiental al Cd con una mayor frecuencia de mujeres con enfermedad renal caracterizada por disfunción tubular, enfermedad renal crónica y osteomalacia denominada enfermedad «itai-itai»8. Posteriormente se reconoció que trabajadores con exposición industrial al Cd presentaban mayor riesgo de enfermedad renal9; sin embargo, no fue hasta los estudios de Bernard en Bélgica cuando se reconoció que incluso la exposición a concentraciones bajas de Cd representaban un efecto nefrotóxico y que hasta el 7% de la población expuesta desarrollaba daño renal10.
Järup et al.11 estudiaron a 1021 personas y demostraron que la prevalencia de encontrar el marcador de daño tubular α1-microglobulina fue significativamente mayor en aquellas personas con excreción urinaria de Cd en límites normales altos (odds ratio [OR]: 6, intervalo de confianza [IC] 95%: 1,6-22). Noonan et al.12 demostraron la misma relación entre niveles urinarios normales altos de Cd y presencia de los marcadores de daño tubular NAG (N-acetil-β-D-glucosaminidasa) y alanina aminopeptidasa. Hasta el momento no hay reportes en la literatura sobre los efectos del Cd en la progresión del daño renal crónico, aunque Hellstrom et al.13 en un estudio realizado en Suecia demostraron una mayor incidencia de pacientes en diálisis (OR: 18, IC 95%: 1,3-2,3) en personas con exposición al Cd en relación con aquellas no expuestas.
Además del efecto nefrotóxico, otros efectos del Cd en el organismo se encuentran relacionados con mayor riesgo de desarrollar diabetes14, cáncer y enfermedad cardiovascular. Menke et al.15, en una muestra de 13.958 adultos participantes en el NHANES III (National Health and Nutrition Examination Survey III), demostraron que niveles urinarios altos de Cd estaban asociados a una mayor mortalidad general y mayor riesgo de cáncer. La exposición al Cd también incrementa el riesgo de hipertensión arterial y es considerado como un factor de riesgo para mayor morbimortalidad cardiovascular16.
Fisiopatología
El Cd en los alimentos se encuentra unido a las proteínas metalotioneína y fitoquelatina (las fitoquelatinas intervienen en el confinamiento vacuolar de los metales pesados en los vegetales), que son degradadas por los jugos gástricos liberando al Cd para su absorción intestinal por los transportadores DMT-1 y ZIP-817,18.
En la circulación se une a la albúmina y es transportado al hígado, donde se une al glutatión (GSH) y a la metalotioneína-1 (MT1). El complejo Cd-MT1 es secretado en la bilis y posteriormente reabsorbido a la sangre por medio de la circulación enterohepática. El Cd-MT1 es un complejo de bajo peso molecular (< 7 kD), que se filtra fácilmente a través del glomérulo y es reabsorbido en su totalidad en el segmento S1 del TCP por endocitosis en un proceso mediado por las proteínas megalina y cubilina19.
El transportador ZIP-8 se localiza también en las células del TCP y es capaz de transportar Cd y otros metales divalentes a través de la membrana apical de estas células; sin embargo, su papel en la toxicidad por este metal se desconoce17.
En el medio intracelular de las células del TCP, el complejo Cd-MT1 es almacenado y degradado en los lisosomas; subsecuentemente, el Cd libre es transportado hacia el citoplasma por el DMT-1 lisosomal6. La activación de la proteína cinasa C incrementa la expresión del transportador DMT-1 y por lo tanto la toxicidad tubular del Cd20.
El Cd libre se acumula en la mitocondria inhibiendo la cadena respiratoria en el complejo III; esto resulta en disfunción mitocondrial y formación de radicales libres, lo cual activa las enzimas caspasas y el desarrollo de apoptosis. También se une a los grupos sulfhidrilo de las proteínas afectando su estructura y función. Se ha demostrado que el Cd interfiere con las actividades enzimáticas del complejo calcio/calmodulina, inhibe la acción de la Na-K-ATPasa y estimula la actividad de las MAPcinasas. En las uniones paracelulares, a afecta la distribución de las proteínas de la unión paracelular y disminuye la resistencia transepitelial21,22.
Únicamente el 10% del Cd filtrado se reabsorbe en los segmentos distales de la nefrona y es posible que el efecto hipercalciúrico del Cd sea consecuencia de la inhibición de la actividad del canal de calcio en el túbulo distal23.
Otro mecanismo de nefrotoxicidad es el mediado por la formación de anticuerpos a la MT; la exposición al Cd incrementa la producción de MT en el hígado y el riñón, lo que constituye una respuesta protectora para limitar su toxicidad. Sin embargo, una vez que se excede la capacidad de las MT de almacenar Cd, éste en forma libre tiene la capacidad de inducir la formación de auto-anticuerpos a las MT, los cuales son también tóxicos para las células del TCP24 (figura 1).
El efecto de la exposición en el útero al Cd se desconoce. Jacquillet et al.25 demostraron que la descendencia de ratas expuestas al Cd durante el embarazo presentaban en la edad adulta disminución de la función renal, daño tubular proximal y alteración de las uniones paracelulares en glomérulo y TCP caracterizadas por alteraciones en la expresión y organización de la claudina-2 y la claudina-5.
Manifestaciones clínicas
Los principales efectos de la intoxicación crónica por Cd son el daño renal, la desmineralización ósea, la hipertensión arterial, las alteraciones de la función pulmonar principalmente de tipo obstructivo y diferentes tipos de cáncer (vejiga, pulmón).
En riñón, el Cd afecta de forma predominante a las células del TCP; este daño se manifiesta clínicamente por proteinuria de bajo peso molecular, aminoaciduria, bicarbonaturia, glucosuria y fosfaturia. Los marcadores de daño tubular como la α1-microglobulina, β2-microglobulina, NAG y KIM-1 (kidney injury molecule-1) son de utilidad para la detección de daño tubular temprano26.
Aquellas personas con daño renal incipiente presentan mayor susceptibilidad al efecto nefrotóxico inducido por Cd27. En pacientes con nefropatía diabética, la excreción urinaria de Cd se encuentra relacionada de manera directa con mayor excreción urinaria de β2-microglobulina y albuminuria28.
La medición de Cd en sangre refleja una exposición aguda, mientras que la medición urinaria refleja la concentración renal de este compuesto y es de utilidad para valorar la exposición crónica29.
La prevención es el factor más importante para manejar la exposición a este metal, ya que no existe ningún tratamiento efectivo para esta toxicidad.
NEFROTOXICIDAD POR PLOMO
Los efectos tóxicos del Pb han sido reconocidos desde hace más de 2000 años, ya que la ingestión del Pb era común entre los romanos. En la actualidad, la exposición a concentraciones elevadas de Pb ha disminuido debido al mejor control industrial y la remoción del Pb de pinturas y gasolina; sin embargo, la contaminación por Pb continúa siendo un problema de salud pública en varios países de África, Asia y Latinoamérica por exposición doméstica al agua y suelos contaminados30.
Epidemiología
El primer caso reportado de nefrotoxicidad asociada al Pb fue descrito en el siglo XIX y desde entonces la exposición a concentraciones elevadas de Pb ha sido considerada como un factor de riesgo para el desarrollo de hipertensión arterial y daño renal. Sin embargo, no fue hasta estudios recientes cuando se reconoció que la exposición a dosis consideradas incluso como «normales» tiene un efecto directo sobre el funcionamiento del riñón y mayor riesgo de morbilidad cardiovascular31.
Menke et al.32, basándose en resultados obtenidos del NHANES III y con un seguimiento de la población a 12 años, demostraron que, a mayor concentración de Pb, mayor mortalidad principalmente de etiología cardiovascular.
Muntner et al.33 encontraron, en 4813 personas con hipertensión arterial, un mayor riesgo de insuficiencia renal crónica (OR: 2,6, IC 95%: 1,5-4,45) en aquéllas con mayores niveles séricos de Pb. Lin et al.34,35, en estudios de seguimiento realizados en Taiwán, encontraron que, en personas con nefropatía crónica (tasa de filtración glomerular [TFG] < 60 ml/min), aquéllas con un contenido corporal elevado de Pb presentan un deterioro más rápido de la función renal y que el tratamiento quelante con ácido etilen-ediaminetetraacético (EDTA) disminuía la progresión del daño.
Existe controversia sobre cuáles deben ser considerados como los niveles máximos no tóxicos de Pb en sangre y orina, ya que cada vez existe mayor evidencia de que niveles anteriormente considerados como no tóxicos se asocian a una mayor morbimortalidad de la población general31.
Fisiopatología
El Pb se absorbe principalmente por vía intestinal y respiratoria y, en menor medida, a través de la piel. La absorción intestinal es mediada por el transportador DMT-1 y se incrementa con la ingesta deficiente de Fe y Zn. La absorción respiratoria es una vía altamente eficiente con una captación mayor del 40% del Pb inhalado, aunque el mecanismo molecular por el cual se absorbe se desconoce.
Una vez en la sangre, el 99% del Pb se une a proteínas del eritrocito y es distribuido a tejidos blandos y hueso; el hueso es el principal reservorio de Pb en el organismo, y en períodos de mayor recambio óseo, como la adolescencia y el embarazo, el paso de Pb a la sangre se incrementa31. La excreción urinaria es la principal vía de pérdida de Pb del organismo.
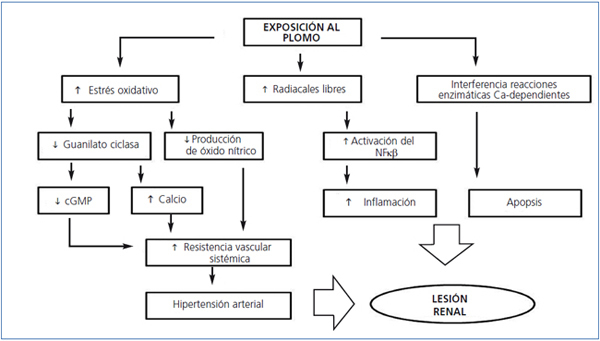
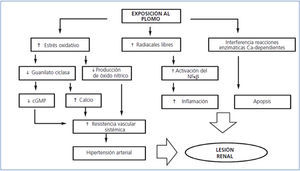
El Pb unido a proteínas de bajo peso molecular (< del 1% del total) se filtra libremente a través del glomérulo y es reabsorbido por las células del TCP por el proceso de endocitosis. En el interior de la célula, el Pb causa daño mitocondrial, formación de radicales libres, depleción intracelular de GSH y apoptosis (figura 2)36. El Pb afecta también a reacciones enzimáticas en las cuales interviene el calcio e incluso el receptor sensor de calcio puede ser activado por Pb, lo cual sugiere otros mecanismos de nefrotoxicidad por este metal37,38.
El Pb induce activación del factor de transcripción nuclear-κβ, la activación del sistema intrarrenal de renina-angiotensina y la atracción de macrófagos, lo cual genera un proceso inflamatorio en el intersticio renal que podría estar implicado en el desarrollo de daño al tubulointersticio y en la hipertensión arterial39.
En células endoteliales, se ha demostrado que el incremento en la formación de radicales libres por Pb disminuye la producción de óxido nítrico y la expresión de la enzima guanilato-ciclasa. Estos efectos permiten explicar la patogénesis de la hipertensión arterial inducida por este metal36-41. Además, estimula la actividad de la NADP(H) oxidasa incrementando la producción de superóxido y peróxido de hidrógeno, lo que afecta al estrés oxidativo y el potencial REDOX intracelular42.
Manifestaciones clínicas
La exposición aguda a dosis elevadas de Pb podría causar lesión en el TCP, lo cual se manifiesta clínicamente como aminoaciduria, glucosuria e hiperfosfaturia. Otras manifestaciones clínicas son la anemia hemolítica, ataques agudos de gota, dolor abdominal intenso («saturnismo») y encefalopatía43.
El diagnóstico de nefropatía crónica por Pb es difícil, ya que los síntomas y hallazgos urinarios son variables y poco específicos, por lo que el diagnóstico se encuentra basado en gran parte en los antecedentes clínicos de exposición. La exposición crónica se asocia con una nefropatía túbulo-intersticial y el deterioro progresivo de la función renal. La excreción urinaria de uratos disminuye por afección del TCP, y disminuye también el flujo sanguíneo renal, lo que hace que se incrementen los niveles de uratos en sangre44.
En el hueso, la exposición crónica se relaciona con la patogénesis y el desarrollo de osteoporosis, ya que el Pb tiene efectos adversos sobre los osteoblastos y los osteoclastos que afectan a la formación y reabsorción ósea45.
No existe un tratamiento adecuado para disminuir los niveles elevados de Pb en sangre, pero el tratamiento quelante con EDTA (1 g en 200 ml de solución salina al 0,9%, administrado semanalmente durante tres meses) ayuda a disminuir la toxicidad por este compuesto. La prevención reduciendo la exposición a este metal constituye la mejor manera de evitar los niveles altos en sangre35.
NEFROTOXICIDAD POR ARSÉNICO
El As inorgánico es uno de los contaminantes ambientales más abundantes y millones de personas (principalmente en Asia y Latinoamérica) se encuentran expuestas a él, ya que es un contaminante frecuente del agua para beber. Otras formas de exposición menos frecuentes es a través de medicamentos con As, como el trióxido de arsénico que se utiliza en el tratamiento de la leucemia promielocítica aguda, y otros medicamentos utilizados en el manejo de la enfermedad del sueño y la leishmaniasis46.
Epidemiología
La asociación causal del As y la formación de tumores en piel, pulmón, vejiga, hígado y riñón ha sido ampliamente descrita; algunos estudios epidemiológicos han demostrado la asociación de exposición a niveles elevados de As con mayor riesgo cardiovascular y diabetes mellitus. Sin embargo, los estudios realizados en zonas con exposición de baja a moderada no han demostrado esta asociación de manera concluyente.
Hasta el momento han sido pocos los reportes en la literatura sobre los efectos del As en la función renal de población abierta. Hsueh et al.47 estudiaron a 125 personas con TFG < 60 ml/min y a 229 personas con función renal normal y encontraron una débil asociación entre los niveles urinarios de As y la disminución de la función renal (r2 = 0,04, p ≤ 0,001); Meliker et al.48 demostraron que en pacientes con deterioro de la función renal las mayores concentraciones de As se asocian con una mayor mortalidad (OR: 1,11, IC 95%: 1,09-1,13).
Fisiopatología
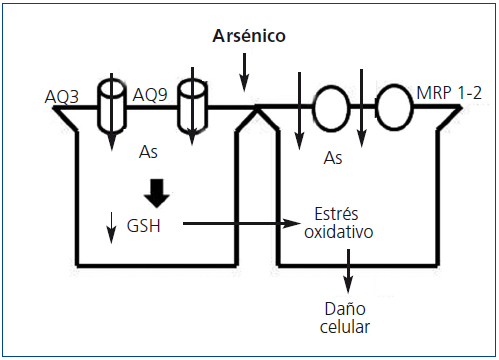
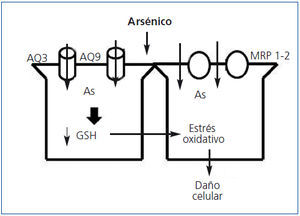
El As se absorbe por vía intestinal, por vía pulmonar (inhalación) y en menores cantidades por la piel. Una vez absorbido se distribuye ampliamente por todos los tejidos del cuerpo y la ingesta de selenio y vitamina B disminuyen la absorción intestinal de As. En el hígado es metilado en un proceso mediado por el GSH, lo cual disminuye su toxicidad y facilita su excreción biliar y urinaria49. El As entra en el medio intracelular a través de las aquagliceroporinas AQ3 y AQ9, y estudios en cultivos celulares han demostrado que el incremento en la expresión celular de AQ3 y AQ9 aumenta la acumulación intracelular de As; en el hígado la AQ9 es importante para la excreción biliar de As50.
Otro grupo de proteínas transportadoras de As son los MRP-1 y 2 (ATP binding cassette-multidrug resistance protein), que se describieron primeramente en hígado, donde transportan el As conjugado con GSH a la bilis. El transportador MRP-2 también se localiza en las células del túbulo proximal, lo que favorece la introducción de As en estas células51. La toxicidad de As en las células del TCP se debe a la depleción de GSH y al incremento en la actividad oxidativa de los radicales libres (figura 3).
Hasta el momento, no existe suficiente información en la literatura acerca de las manifestaciones clínicas en riñón de la intoxicación por As, pero es probable que se manifieste por datos de daño tubular, como proteinuria de bajo peso molecular, aminoaciduria, glucosuria y fosfaturia, así como deterioro progresivo de la función renal52.
CONCLUSIÓN
En conclusión, existe suficiente evidencia de daño renal asociado a estos metales; además, se ha demostrado un efecto nefrotóxico aditivo entre los diferentes contaminantes. Debido a lo frecuente de estos metales en el ambiente y a la carencia de medidas terapéuticas que disminuyan sus efectos sistémicos, se necesita mayor vigilancia para disminuir las concentraciones ambientales de estos compuestos.
Conflictos de interés
Los autores declaran conflictos de interés potenciales:
- Percepción de becas: Fondos Mixtos del Estado de Querétaro. Consejo Nacional de Ciencia y Tecnología.
CONCEPTOS CLAVE
Figura 1. Mecanismos fisiopatológicos de lesión renal por cadmio
Figura 2. Mecanismos fisiopatológicos de lesión renal por plomo
Figura 3. Mecanismos fisiopatológicos de lesión renal por arsénico