EVALUACIÓN DEL PROBLEMA DEL METABOLISMO ÓSEO-MINERAL
Definiciones
Osteodistrofia renal ha sido un término empleado tradicionalmente para referirse a las alteraciones del metabolismo óseo-mineral de los pacientes con enfermedad renal crónica (ERC). Recientemente, la Fundación KDIGO (Kidney Disease: Improving Global Outcomes) ha propuesto nuevas definiciones y un sistema de clasificación más integrado, relegando el término tradicional de osteodistrofia renal1-5.
Osteodistrofia renal (ODR). Este término queda restringido a las alteraciones de la morfología y arquitectura ósea propias de la ERC (figura 1). El diagnóstico de confirmación es la biopsia ósea.
Alteración óseo-mineral asociada a la ERC. Esta expresión (en inglés CKD-MBD por «Chronic Kidney Disease-Mineral Bone Disorder») integra todas las alteraciones bioquímicas, esqueléticas y calcificaciones extraesqueléticas que ocurren como consecuencia de las alteraciones del metabolismo mineral en la ERC como una entidad sistémica (figura 2). Se manifiesta por una o por la combinación de las siguientes manifestaciones:
1. Anormalidades del calcio (Ca), fósforo (P), hormona paratiroidea (PTH) y vitamina D.
2. Alteraciones en el remodelado, mineralización, volumen, crecimiento o fragilidad del esqueleto.
3. Calcificaciones cardiovasculares o de otros tejidos blandos.
Fisiopatología
Las diferentes alteraciones metabólicas son secundarias a la pérdida progresiva de masa y función renal.
Es conocido que moderados descensos del aclaramiento de creatinina (inferior a 70 ml/min aproximadamente) pueden provocar un aumento de la fosfatemia tras una sobrecarga de fósforo, junto con una potencial disminución de la calcemia, que pueden objetivarse de forma puntual y precoz en la evolución de la ERC6.
El incremento de los valores séricos de fósforo ocurre en estadios 4 y 5 de ERC, si bien la retención de fósforo se produce más precozmente, no siendo detectada en las determinaciones séricas. Es posible que el aumento precoz de FGF-23 (fibroblast growth factor-23) en el plasma pueda ser un indicador de retención de fósforo, como también lo puede ser un aumento de la fracción excretada de fósforo urinario.
También de forma precoz se observa un descenso discreto pero significativo del calcitriol (1,25[OH]D3) en pacientes con ERC, secundario a:
1. Pérdida de masa renal, que ocasiona menor disponibilidad de 1-alfa-hidroxilasa.
2. Descenso del filtrado glomerular, que conlleva disminución de la 25(OH)D3 tubular. La 25(OH)D3 debe ser filtrada por el glomérulo para alcanzar el túbulo contorneado proximal y allí penetrar por endocitosis dentro de la célula (con la intervención de la megalina, un receptor endocítico situado en la membrana apical).
3. Retención de fósforo, que disminuye la síntesis renal de calcitriol, directa o indirectamente, a través del aumento del FGF-23.
El déficit de síntesis de calcitriol disminuye la absorción intestinal de calcio. Este fenómeno ocurre precozmente ya en estadios 2 y 3 de ERC.
La retención de fósforo, junto con el déficit de calcitriol y la enfermedad renal per se, son también responsables de la resistencia esquelética a la acción de la PTH5.
El incremento de los niveles de PTH se observa especialmente con filtrados glomerulares inferiores a 60 ml/min/1,73 m2.
Junto con la retención de fósforo, déficit de calcitriol e hipocalcemia, en el establecimiento del hiperparatiroidismo secundario (HPT2), es posible que también puedan desempeñar un papel precoz moléculas producidas por el propio tejido renal enfermo, o bien la disminución, falta de afinidad o infrarregulación de receptores como la megalina u otros factores correguladores.
El propio déficit de 25(OH)D3 (falta de ingestión o exposición solar insuficiente), puede contribuir también en la ERC, al igual que en la población general, al desarrollo de HPT2 y enfermedad metabólica ósea, especialmente en estadios precoces1.
En las glándulas paratiroides existen, al menos, dos receptores clásicos conocidos a través de los que se canalizan los efectos de las moléculas y hormonas que modulan tanto la síntesis y secreción de PTH como el tamaño glandular y que serán de gran importancia para valorar las alternativas terapéuticas frente al HPT2.
Estos dos receptores de las glándulas paratiroides son:
1. Receptor de vitamina D (VDR).
a) La acción de la vitamina D sobre la PTH es mediada por este receptor, que es un receptor citosólico.
b) Con la progresión de la ERC el número de VDR decrece, el propio estado urémico puede disminuir la estabilidad del ARNm VDR, produciendo un descenso en los niveles de proteína del receptor. Además, «toxinas urémicas» disminuyen el paso del complejo VDR–vitamina D al núcleo y su unión al elemento de respuesta del ADN7.
c) El déficit de VDR produce resistencia a la acción inhibitoria de la vitamina D sobre la síntesis de PTH.
d) La hiperplasia de las glándulas paratiroides se acompaña de disminución en la densidad de VDR. En estados avanzados de hiperplasia, «hiperplasia nodular», la disminución de los VDR es muy marcada.
2. Receptor-sensor de calcio (CaR).
Situado en la superficie de las células paratiroideas, detecta cambios mínimos en los niveles séricos de calcio. Cuando el nivel de calcio sérico desciende, no hay suficiente calcio unido a los receptores del calcio y se deja de inhibir la secreción de PTH.
a) Su déficit produce resistencia a la acción del Ca sobre la glándula paratiroidea.
b) El desarrollo progresivo de hiperplasia paratiroidea secundaria a la ERC está asociado a una disminución de los receptores de calcio en las células paratiroides.
Recientemente se ha demostrado en la paratiroides la existencia del receptor para el FGF-23 (FGF-R) y su «correceptor», la proteína Klotho, permite al FGF-23 ejercer una acción inhibitoria sobre la glándula paratiroidea. En experimentos en animales urémicos y en muestras de paratiroides hiperplásicas de pacientes urémicos se ha evidenciado una disminución de los FGF-R y de Klotho, lo que conduce a una resistencia de las paratiroides hiperplásicas a la acción inhibitoria del FGF23.
Efecto de moléculas y hormonas sobre los receptores
1. El descenso del calcio extracelular es detectado por el receptor de calcio en la membrana plasmática estimulando la producción de PTH.
2. La retención de fósforo estimula la síntesis y secreción de PTH. Además, induce hiperplasia de las paratiroides que, a su vez, disminuye la expresión del CaR y del VDR, que a su vez también favorece la síntesis y secreción de PTH.
3. La vitamina D actúa sobre el VDR suprimiendo la síntesis y secreción de PTH. Su déficit disminuye este efecto.
4. Un deficit de calcitriol provoca infrarregulación de la expresión del ARNm de VDR. Igualmente, una disminución de calcio infrarregula la expresión del CaR y del VDR. Por el contrario, se sabe que el calcitriol es capaz de sobrerregular su propio receptor en distintos tejidos. También se conoce que existen diferencias entre distintos análogos de la vitamina D (activadores selectivos de los receptores de vitamina D [AsVDR]) y también parece que los calcimiméticos podrían aumentar la expresión del receptor de vitamina D en la glándula paratiroides8.
5. El calcitriol también puede aumentar la expresión del receptor de Ca. Este efecto se debilita cuando existe hipocalcemia y es más importante cuando los niveles de calcio son normales o altos, o cuando se administran calcimiméticos9.
Lesiones asociadas
Como consecuencia de estas alteraciones se producirá un daño en los tejidos diana. El esqueleto y el sistema cardiovascular son los tejidos principalmente afectados. Las calcificaciones de tejidos blandos y la calcifilaxis son también complicaciones de gran importancia, pues se asocian con un aumento importante de la morbimortalidad de los pacientes con ERC.
Las calcificaciones vasculares no se presentan como un proceso pasivo. Se ha observado que el incremento de los niveles de fósforo, calcio, los mediadores inflamatorios y la uremia per se favorecen la transformación de las células musculares lisas en células de estirpe osteogénica, que producen matriz colágena que posteriormente se mineraliza. La acidosis disminuye las calcificaciones10.
Otros procesos relacionados con la edad, como el incremento de fragilidad ósea, la debilidad muscular y propensión a las caídas o la enfermedad arteriosclerótica, no pueden considerarse asociados directamente a la ERC, pero sí coexistir con ella. Más aún, influyen sobre el diagnóstico, tratamiento y pronóstico de los efectos de la ERC sobre sus órganos diana.
Es probable que estos efectos deletéreos se deban a efectos que trascienden las alteraciones óseas. La hiperfosfatemia se ha asociado con aumento del grosor íntima-media, rigidez y calcificación vascular, hipertrofia miocárdica y mortalidad11, entre otras, además de con la progresión de la ERC. La hormona paratiroidea (PTH) se ha considerado clásicamente como una toxina urémica y se ha asociado con distintos efectos sistémicos5. Más recientemente, ha adquirido importancia el déficit de vitamina D, también frecuente en la población general, que se asocia a alteración inmunorregulación, respuesta inflamatoria, regulación de proliferación celular, secreción de insulina y producción de renina. Además, la 25(OH)D (calcidiol) tiene una acción directa sobre el metabolismo óseo y es sustrato para la generación de calcitriol. Como consecuencia de estos efectos, las alteraciones del metabolismo mineral han demostrado, en la población urémica, ser predictoras independientes de mortalidad, especialmente de causa cardiovascular12-21 .
ESTRATEGIAS DIAGNÓSTICAS
El objetivo es definir los métodos diagnósticos idóneos para el estudio y tratamiento de las alteraciones del metabolismo mineral. Esta información resulta de la síntesis de las recomendaciones extraídas de las guías de actuación clínica, tales como las guías K/DOQI, las recientemente publicadas KDIGO y el «KDOQI US Commentary on the 2009 KDIGO» americano, de la opinión de expertos obtenida de la bibliografía y de la propia opinión de los autores de estas recomendaciones1,2,4,22,23.
En cuanto a la periodicidad de las determinaciones bioquímicas, si bien están establecidas en la Guía de Calidad de la S.E.N.24 avanzamos, a continuación, algunas recomendaciones más precisas.
Parámetros bioquímicos (tabla 1, tabla 2, tabla 3)
Al igual que otras guías internacionales, recomendamos que los laboratorios informen a los clínicos del método de medición usada y reportar cualquier cambio en la metodología, muestra de origen (suero o plasma), así como la manipulación adecuada de las muestras para facilitar una adecuada interpretación de los resultados bioquímicos (1B).
Calcio y fósforo
Los niveles de calcio y fósforo tienen poca capacidad predictiva de la enfermedad ósea subyacente y son frecuentemente normales porque existe una elevación de los niveles de PTH. Sin embargo, su determinación periódica, junto a la PTH, es decisiva para el tratamiento del paciente (1C).
De manera ideal, debe usarse el calcio iónico, pero hay problemas de procesado y coste para su uso sistemático. Empleando el calcio total, es recomendable ajustar para los niveles de albúmina (o proteínas plasmáticas) en caso de hipoalbuminemia o hipoproteinemia.
Ca total corregido (mg/dl) = Ca total (mg/dl) + 0,8 [4 - albúmina (g/dl)]
Debemos tener en cuenta, no obstante, que la precisión del uso de calcio corregido por albúmina y calcio ionizado es sólo débil, probablemente debido a las variaciones de albúmina, pH, fenómenos de hemoconcentración y otros, presentes en pacientes en diálisis o con ERC25,26.
Incluso se han desarrollado fórmulas de corrección que tienen también en cuenta el fósforo plasmático, además de la albúmina27.
Es importante también recordar que la concentración extracelular de calcio no siempre se correlaciona con el balance de calcio (que puede ser positivo o negativo con calcio plasmático normal).
Nos parecen razonables los intervalos de monitorización sugeridos por las KDIGO de: a) estadio 3: Ca y P cada 6-12 meses; b) estadio 4: Ca y P cada 3-6 meses; c) estadio 5: Ca y P cada 1-3 meses, pero, en cambio, en estadio 5D la determinación mensual nos parece más adecuada que la propugnada por las KDIGO (igual cada 1-3 meses) (BC).
Puede ser necesaria una mayor frecuencia en pacientes bajo tratamiento con calcimiméticos o con derivados de la vitamina D, tanto metabolitos activos como análogos o AsVDR, especialmente en etapas de titulación de dosis (NG).
La extracción en los pacientes en hemodiálisis debería realizarse en el período corto, es decir, prediálisis a mitad de semana (BC).
El producto calcio-fósforo proporciona una información útil en pacientes en diálisis, pero nunca de forma aislada (sin niveles de calcio y fósforo). En el paciente prediálisis es el parámetro menos útil para la detección de una alteración del metabolismo mineral (2D).
Hormona paratiroidea (PTH)
Los valores séricos de PTHi (PTH intacta, rango normal 10-65 pg/ml con el desaparecido kit clásico Allegro de Nichols) medidos por inmunorradiometría o inmunoquimioluminiscencia, son el parámetro bioquímico que mejor se correlaciona con las lesiones histológicas de HPT2, especialmente con la actividad osteoblástica.
Por esta razón, los niveles de PTH (en relación con los de calcio y fósforo) son considerados un buen marcador (al menos el mejor del que se dispone) de la enfermedad ósea subyacente, evitándose así la necesidad de recurrir a la biopsia ósea diagnóstica en la mayoría de las situaciones (2B).
Es posible que los nuevos tratamientos del HPT2 o las nuevas técnicas de medición de la PTH modifiquen en un futuro próximo los niveles de PTH considerados como adecuados.
Niveles de PTHi >450-500 pg/ml (o equivalentes) son específicos de enfermedad ósea de alto remodelado, concretamente la osteítis fibrosa o forma mixta, y excluyen prácticamente la enfermedad de bajo remodelado con una elevada especificidad (1B).
Niveles de PTHi <100-120 pg/ml (o equivalentes) se asocian con enfermedad ósea de bajo remodelado (forma adinámica u osteomalacia), con un valor predictivo cercano al 90% (1B).
No se ha establecido una asociación entre niveles de PTH y lesiones cardiovasculares. Niveles relativamente más elevados o más bajos de PTH se han correlacionado con mayor riesgo de mortalidad, especialmente cardiovascular, aunque no hay un rango definitivamente establecido. Sin embargo, el remodelado óseo bajo parece asociarse con mayor grado de calcificaciones vasculares (2D).
Los niveles de PTH deben medirse, en estadios 3-4, cada 6-12 meses en función del valor basal y del grado de progresión de la ERC; aunque no se vaya a modificar el tratamiento es conveniente conocer la velocidad de aumento de la PTH para tomar medidas en casos extremos. En estadio 5 (incluyendo 5D) cada 3-6 meses según recomiendan las KDIGO (NG).
Puede ser necesaria una mayor frecuencia en pacientes bajo tratamiento, especialmente en etapa de titulación de dosis para analizar eficacia y efectos secundarios, así como para detectar o establecer tendencias (esto es aplicable a ERC 3-4). En este sentido, es importante resaltar que más que tratar valores individuales de calcio, fósforo o PTH aislados, deberíamos tener en cuenta las tendencias más que datos aislados, que pueden ser puntualmente discordantes, así como su consideración conjunta y con los otros parámetros del complejo CKD-MBD (calcificación vascular, etc.) (1C).
En la actualidad tenemos muchos problemas derivados de la ausencia de homogeneidad de los diferentes métodos de determinación de la PTH, no existiendo buenos coeficientes de correlación entre ellos, lo que dificulta la interpretación correcta de los resultados de laboratorio. La S.E.N. elaboró un documento que pretende clarificar la interpretación de estos diferentes métodos29 y fórmulas de corrección de PTH intacta a la referencia «equivalente» del kit clásico usado (Allegro de Nichols) del que se obtuvo originalmente casi toda la información derivada de esta PTH.
La medición de PTH «entera» (Scantibodies) o «bio-PTH» (Nichols Institute), que teóricamente miden sólo la PTH 1-74, así como el cálculo del cociente entre distintos fragmentos de PTH30, no es práctica aún recomendada en la práctica clínica diaria aunque su uso es cada vez más frecuente (NG).
25-(OH)-Vitamina D
Es aconsejable la medición de niveles de vitamina D (calcidiol) para prevenir y tratar la frecuente insuficiencia o deficiencia.
Tradicionalmente se viene definiendo, tanto en población general como en afectados de ERC, a la «insuficiencia» de vitamina como valores séricos de calcidiol <30 ng/l y a la «deficiencia» como valores séricos <15 ng/l. Muy recientemente, el comité para la revisión de los valores dietéticos de referencia para calcio y vitamina D del Institute of Medicine de EE.UU. refiere, para la población general, que valores séricos de vitamina D superiores a 20 ng/l pueden ser suficientes31 (2B).
Valores inferiores aconsejan, en pacientes con ERC, el aporte nutricional o suplementos de vitamina D nativa como los recomendados para la población general1 (2C).
Se desconoce la importancia relativa de la medición con los distintos kits disponibles en el mercado o el mejor momento del año para efectuar estas determinaciones.
Existe una tendencia creciente a su uso, desde la población general a los pacientes en programa de diálisis, por los potenciales efectos pleiotrópicos de la vitamina D más allá del hueso, y la prevención de caídas32. En estudios experimentales, la combinación de calcidiol con paricalcitol parece proporcionar los mejores resultados antiinflamatorios y antifibróticos33.
Sin embargo, no se ha descrito mejoría de la supervivencia de pacientes en diálisis con el uso de formas nativas de la vitamina D, aunque sí distintos efectos pleiotrópicos.
Los valores séricos bajos de 25-OH-vitamina D se han relacionado con una mayor mortalidad en pacientes incidentes en hemodiálisis y se ha descrito que el uso de derivados activos de la vitamina D parece hacer desaparecer dicha asociación35.
Una cuestión que aún no está resuelta es por qué los niveles de calcidiol son más bajos en el paciente con ERC que en la población general. Un estudio reciente muestra que la capacidad del hígado de producir 25 (OH) está disminuida en ratas urémicas y que la paratiroidectomía mejora la capacidad del hígado de producir 25(OH)36.
Fosfatasa alcalina
La fosfatasa alcalina total, puede ser útil, junto con la PTH, como predictora del recambio óseo. La fosfatasa alcalina ósea probablemente tiene ventajas marginales, pero éstas no justifican el coste adicional (2C).
Se considera hoy día también un marcador de riesgo de mortalidad en pacientes en hemodiálisis37, así como se ha descrito recientemente la asociación independiente de niveles >120 U/l con la calcificación coronaria38.
1,25-(OH)2 Vitamina D
No existe evidencia de que su determinación seriada sea útil para el control del paciente con enfermedad renal, aunque puede usarse con fines de investigación o en el diagnóstico diferencial de algunos casos de hipercalcemia. En presencia de niveles aumentados de PTH se desconoce cuáles serían los valores normales o aconsejables.
Calciuria-fosfaturia
A lo largo de la evolución de la enfermedad renal, se puede producir una disminución de la capacidad excretora de calcio o de fósforo. Se ha sugerido que, determinaciones seriadas de calciuria permitirían monitorizar la potencial sobrecarga de calcio en pacientes con ERC. También la fracción de excreción de fósforo puede ser un marcador precoz de sobrecarga de fósforo (NG).
La reducción del filtrado glomerular es el determinante principal de un aumento de la fracción de excreción de fósforo, al igual que ocurre con otros muchos solutos. El reparto de una misma carga de soluto filtrado entre menos unidades funcionantes hace que la fracción que se reabsorbe sea menor y, por tanto, la que se excreta, mayor.
No obstante, cuanto mayor sea la carga de fósforo en relación con el filtrado glomerular, la fracción de excreción aumentará, regulada en gran parte por las fosfatoninas y PTH. Pero esta fracción de excreción tiene un límite máximo (aproximadamente 50-55% en pacientes sin tubulopatías proximales) que condiciona que ante una determinada carga de fósforo, una reducción crítica del filtrado glomerular no pueda hacer frente a la excreción, y de este modo se produzca un balance positivo de fósforo.
Otros marcadores del remodelado óseo
Ciertos marcadores del remodelado óseo, como la osteocalcina, las piridolinas libres en suero, y el telopéptido C-terminal de la colágena, muestran buenas correlaciones con la histología ósea, pero no mejoran el poder predictivo de la PTH, por tanto su uso sistemático no está justificado (2C).
Fibroblast Growth Factor 23
Esta fosfatonina está adquiriendo relevancia no sólo como importante mediadora de la fisiopatología del hiperparatiroidismo secundario (su incremento precede al de la PTH) sino también por su asociación con la supervivencia de pacientes con ERC o como marcador precoz de sobrecarga de fósforo o pronóstico del tratamiento del paciente con HPT2. Sin embargo, su medición en el ámbito clínico aún no está recomendada (NG).
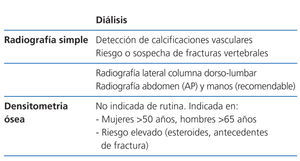
Técnicas de imagen. Radiología ósea (tabla 4, tabla 5, tabla 6)
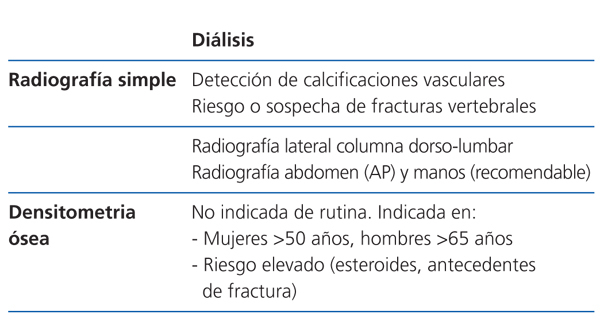
Los estudios radiológicos son útiles como primer escalón de estudio para detectar calcificaciones vasculares y de amiloidosis asociada con depósitos de beta-2-microglobulina. La radiografía simple de abdomen y manos permite detectar calcificaciones vasculares. La radiografía de columna lateral dorsolumbar está indicada en pacientes sintomáticos o en riesgo para la detección de fracturas vertebrales (2C).
Las técnicas de imagen ósea son, en general, de escasa ayuda diagnóstica, ya que los cambios bioquímicos preceden a los radiológicos. En la actualidad la evaluación radiológica ósea sistemática de los pacientes asintomáticos no está justificada (NG).
La resorción subperióstica en la cara radial de las falanges es el signo más precoz y específico de osteítis fibrosa. Otros lesiones clásicas son la acrosteólisis, cráneo «en sal y pimienta», vértebras «en jersey de rugby» que apoyan el diagnóstico de osteítis fibrosa, o las líneas de Looser propias de la osteomalacia. Todas ellas suelen ser manifestaciones tardías de la enfermedad ósea subyacente.
Se han descrito correlaciones directas entre presencia de calcificaciones vasculares observadas en la radiografía simple y riesgo cardiovascular en pacientes en hemodiálisis39,40. Por tanto, el hallazgo de calcificaciones vasculares puede condicionar las elecciones terapéuticas posteriores. Los pacientes con calcificaciones vasculares o valvulares deben ser considerados en el grupo de riesgo cardiovascular más elevado (2A).
Una radiografía lateral de abdomen (columna dorsolumbar), así como el ecocardiograma, pueden usarse para detectar la presencia o ausencia de calcificaciones vasculares o valvulares como alternativas razonables a la tomografía computarizada. Ambas tienen un bajo poder predictivo negativo (si son negativas no podemos asegurar ausencia de calcificaciones) (2C).
Densitometría ósea (tabla 4, tabla 5, tabla 6)
La absorciometría de rayos X dual (DXA) es, actualmente, el método estándar para determinar la densidad mineral ósea (DMO) en la población general. Esto se debe a que ofrece determinaciones precisas en sitios clínicamente importantes y con mínima radiación. Se determina habitualmente en cuello femoral y en columna vertebral (proyecciones anteroposteriores y laterales), aunque no hay consenso definitivo.
Proporciona información de cambios en el contenido mineral óseo, pero no del tipo de enfermedad ósea subyacente y esto es una consideración especialmente importante en el paciente con ERC.
La relación de la DMO con el riesgo de fractura en la población con ERC es inconsistente. Sin embargo, varios estudios han mostrado que su medición en el radio distal es predictivo del riesgo de fractura41 y se correlaciona (negativamente) con la PTH en pacientes en hemodiálisis42. Por lo tanto, de usarse, el radio distal es el lugar preferido de medida en los pacientes con ERC, evitando brazo de fistula A-V funcionante43. Esto concuerda con las recomendaciones de la Sociedad Internacional de Densitometría Clínica de 2005 (www.iscd.org/Visitors/positions) (2B).
Existe la preocupación de que los resultados de la DMO de cadera o lumbar pudieran ser malinterpretados y conducir a la administración inadecuada de fármacos antirresortivos.
No se recomienda realizar la medición de la DMO de modo sistemático en pacientes con ERC en estadio 3-5D; en cambio, ha demostrado ser de gran utilidad para el seguimiento de la masa ósea postrasplante o para el estudio de cambios de masa ósea en el mismo enfermo (2B).
Histología
La biopsia ósea de cresta ilíaca con doble marcaje con tetraciclinas y el estudio histomorfométrico es el método más preciso para el diagnóstico de la lesión ósea subyacente y el «patrón oro» para estudiar el valor predictivo de otras técnicas diagnósticas menos invasivas (1A).
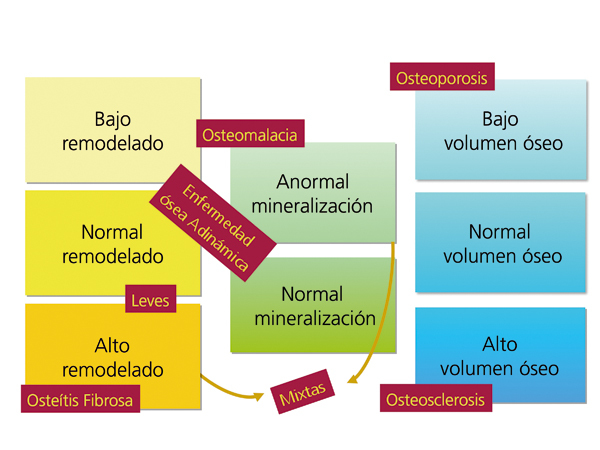
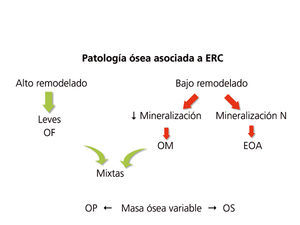
La aplicación de criterios histomorfométricos ha hecho posible uniformizar las clasificaciones de ODR. Actualmente este término, como ya se mencionó en la Introducción, se aplica exclusivamente para definir las alteraciones morfológicas óseas asociadas a la ERC, e incluye parámetros de remodelado óseo, tasa de mineralización y volumen óseo (cantidad de hueso por unidad de volumen de tejido óseo total). Se está intentando introducir la clasificación TMV para la valoración histomorfométrica del hueso (T = Turnover, M = Mineralization, V = Bone Volume).
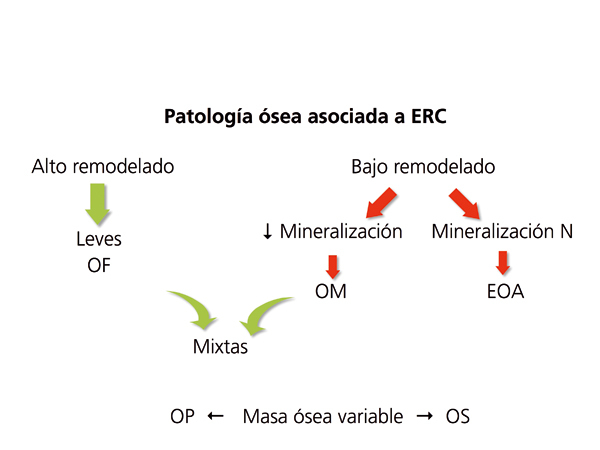
Clásicamente, las lesiones óseas se clasificaban (figura 1) en: formas de alto remodelado (AR) y bajo remodelado (BR). Dentro de las formas de AR, la forma más característica es la osteítis fibrosa (OF) y su única causa, el HPT2. Las formas de BR se subdividen en función de la tasa de mineralización. Si cursan con mineralización normal se denominan enfermedad ósea adinámica (EOA) y si cursan con fallo en la mineralización (con el aumento consiguiente de tejido osteoide), osteomalacia (OM). A su vez todas las alteraciones morfológicas pueden cursar con masa ósea variable.
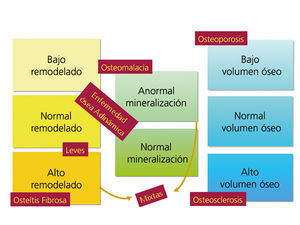
El grupo KDIGO ha clasificado las formas de ODR en función del tipo de remodelado, la tasa de mineralización y el volumen óseo:
Indicación de biopsia ósea
El mejor conocimiento de la enfermedad y del valor predictivo de los parámetros bioquímicos han logrado que la biopsia ósea sea de indicación excepcional.
Actualmente la biopsia ósea transilíaca está indicada en las siguientes situaciones (aunque no está limitada sólo a ellas) (NG):
1. Hipercalcemia e hipofosfatemia inexplicables.
2. Fracturas patológicas en ausencia o ante un mínimo traumatismo.
3. Enfermos sintomáticos (p. ej., con dolor óseo inexplicable) en presencia de parámetros clínicos incongruentes. Un caso característico es la presencia de hipercalcemia inexplicable por causa farmacológica o enfermedad sistémica, con valores séricos de PTHi no concluyentes (entre 120 y 450 [100-500] pg/ml como rango orientativo).
4. Enfermos con sospecha de enfermedad ósea inducida por aluminio (historia de exposición, con PTH <100-120 pg/ml y, eventualmente, test de desferrioxamina positivo) antes de decidir un tratamiento quelante con desferrioxamina.
5. Preparatiroidectomía si ha habido una exposición importante al aluminio en el pasado o si los parámetros bioquímicos de HPT2 no son evidentes.
6. Antes del inicio de tratamiento con bifosfonatos en pacientes con filtrado glomerular muy reducido, sobre todo si el valor de PTHi es muy bajo.
Otras técnicas de imagen. Evaluación de las calcificaciones extraesqueléticas
No hay guías de actuación clínica consensuadas para la evaluación y seguimiento de las calcificaciones extraóseas en la ERC.
Radiografía simple
Herramienta diagnóstica sencilla y económica para la detección de calcificaciones vasculares en el adulto. Algunos estudios muestran que, mediante un simple score, la radiología de manos, pelvis y columna lumbar lateral, nos puede ayudar a calcular la severidad de las calcificaciones vasculares y tiene importancia pronóstica40. Por tanto, una radiografía simple basal (PA de abdomen, columna dorsolumbar lateral y, a ser posible, manos) debería practicarse en todos los pacientes con ERC para valorar las calcificaciones vasculares (2C).
Otros instrumentos para el diagnóstico por imagen se emplean en función de la disponibilidad en los sitios de trabajo, la experiencia del operador y el tipo de diseño del estudio que debe realizarse.
Ecocardiograma
Es útil para evaluar las calcificaciones valvulares y también la geometría y la función cardíaca. Como se comentó anteriormente, tiene un bajo poder predictivo negativo.
Ecografía carotídea
Detecta calcificaciones en placas de ateroma y permite medir el grosor íntima-media en vasos carotídeos. Permite también la localización de la calcificación en la placa de ateroma o incluso la presencia de calcificaciones que afectan sólo a la lámina elástica interna.
Velocidad de la onda del pulso carótido-femoral (VOP)
Se usará para medir la rigidez (o pérdida de distensibilidad) arterial. Es un método no invasivo, inocuo para el paciente, de fácil realización y alta reproducibilidad. Existe correlación ente la velocidad de la onda de pulso y el grado de calcificación vascular.
Técnicas de angiotomografía
Esta modalidad, menos invasiva que la arteriografía, proporciona imágenes de buena calidad para el estudio morfológico del árbol vascular.
TAC helicoidal o tomografía con multidetectores
Es útil para la valoración de calcificaciones coronarias.
Electron-beam computed tomography (EBCT)
La mejor técnica validada para la detección de calcificaciones coronarias, pero es extraordinariamente cara.
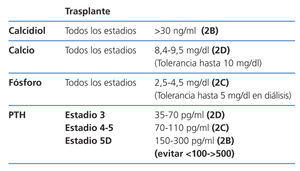
VALORES BIOQUÍMICOS RECOMENDADOS SEGÚN DIFERENTES ESTADIOS
Los valores séricos recomendados, según las K-DOQI, K-DIGO y revisión de la literatura, son los que se exponen en la tabla 5.
No existen evidencias claras, especialmente en prediálisis (2D), para aconsejar unos valores bioquímicos determinados, especialmente de PTH, cuya especificidad es baja especialmente para valores de PTH intermedios.
Algunos autores recomiendan la normalización de los valores de PTH, otros aconsejan el inicio de tratamiento al aumentar la PTH respecto a una basal si se dispone de ella (aun dentro del rango de la normalidad) y otros consideran que un cierto grado de hiperparatiroidismo es necesario para mantener una tasa de remodelado óseo normal en caso de presencia indudable de insuficiencia renal.
En cualquier caso, las recomendaciones sobre los parámetros bioquímicos se basan en trabajos observacionales que, en realidad, sólo nos pueden hablar de asociaciones.
De este modo, se sugiere mantener los niveles de calcio (2D) y fósforo (2C) en el rango normal de laboratorio siempre que las medidas para conseguirlo sean razonables.
No hay que olvidar que los objetivos terapéuticos de las alteraciones del metabolismo óseo mineral deben adecuarse a las características clínicas y objetivos terapéuticos globales de cada paciente, sin que se deba sólo perseguir el alcanzar determinadas cifras o concentraciones plasmáticas.
También hay que advertir que los tratamientos de la enfermedad ósea mineral pueden provocar a veces efectos adversos, en algún caso graves, más frecuentes cuanto más agresivo es el tratamiento.
ALTERNATIVAS TERAPÉUTICAS
Estadios 1-2
Tanto las Guías K/DOQI como las K-DIGO todavía no recomiendan ningún tratamiento en estadios 1-2 de la ERC. Sin embargo, si queremos ser coherentes con los datos obtenidos de varios estudios, podríamos poner en marcha mecanismos, si no de tratamiento, al menos de prevención.
Dieta
Es conocido que pacientes con discreta pérdida de la función renal ya presentan retención de fósforo, con descensos no detectables del calcio total y aumento de PTH si son sometidos a una sobrecarga de fósforo, por lo que comenzar con una discreta restricción del mismo parece adecuado.
Por otro lado, el paciente estará más receptivo a someterse a una dieta cuando se le acaba de diagnosticar una enfermedad renal que cuando el diagnóstico se ha realizado tiempo atrás y nadie le hubiera hablado de dieta.
La dieta podría comenzarse con una ingesta de 1 g de proteínas/peso corporal ideal/día; esto condicionaría dos beneficios: por un lado una disminución en el aporte de fósforo y, por otro, una disminución de los efectos perjudiciales de la hiperfiltración glomerular (44-49) (2D).
25(OH)D3 (calcidiol)
Los niveles adecuados de 25(OH)D3 son especialmente importantes, ya que serán el sustrato para la producción de 1-25(OH)2 D3, además de que su déficit agrava el HPT2. En estos estadios, el déficit de 25(OH)D3 puede ser la única causa de HPT2, y por tanto, parece aconsejable su determinación (2C), así como iniciar su suplementación (2C) y con ello asegurar los efectos pleiotrópicos de la vitamina D más allá del control del HPT2. Es bien conocido que el VDR es ubicuo y se expresa en muchos tejidos además de los clásicos.
Se sugiere también la medición de los niveles de calcidiol en pacientes con ERC a partir del estadio 3, incluyendo los pacientes en diálisis (2C). La repetición de su medición estará en función de los valores basales y las intervenciones terapéuticas que se decidan.
La deficiencia o insuficiencia de vitamina D se debería reponer siguiendo las estrategias recomendadas en la población general (2C).
Las dosis precisas no están bien definidas (los ensayos clínicos en población general han usado generalmente dosis de 300 a 800 U/día), considerándose un máximo de 2.000 U/día (aproximadamente 60.000 unidades/mes)50,51, aunque una reciente revisión concluyó que la máxima dosis para adultos (sin ERC) podría ser incluso de hasta 10.000 U/día52. El comité para la revisión de los valores dietéticos de referencia para calcio y vitamina D del Institute of Medicine de EE.UU. considera la dosis diaria segura hasta 4.000 U/día31.
En España no disponemos de farmacopea para vitamina D2 (ergocalciferol) excepto en preparados multivitamínicos. Por otra parte, disponemos de vitamina D3 en forma de gotas (en frascos de 10 ml = 20.000 U/frasco = 2.000 U/ml = 30 gotas) o varios preparados que contienen 200-800 U de vitamina D3 + diversas cantidades de calcio. Se recomienda ser prudente con el uso de estas asociaciones, especialmente en pacientes con calcificaciones vasculares o riesgo de padecerlas.
Otra posibilidad más cómoda es el empleo de calcifediol (ampollas de 266 µg = 16.000 U). La administración de calcifediol con periodicidad quincenal o mensual, con controles de los niveles de calcidiol, es una alternativa cómoda para adecuar los aportes nutricionales en los pacientes con ERC, pero debe acompañarse también de controles ocasionales de calcio y fósforo plasmáticos.
Calcio
En cuanto al aporte de calcio, es imprescindible un aporte suficiente para reducir la estimulación de la PTH. Una cantidad entre 15 y 20 mg/kg/día en la dieta sería suficiente para asegurar la cobertura de necesidades de dicho elemento. La cantidad recomendada diaria en la población general varía según edad y sexo entre 1.000 y 1.300 mg/día, considerándose como límite máximo total tolerable 2.500 mg/día (2B). No es conocido si estas cantidades deberían limitarse en pacientes con calcificaciones vasculares.
Bifosfonatos
Hoy día existen muy pocos datos en este tipo de pacientes, lo cual podríamos considerar paradójico, si además consideramos que los pacientes con ERC presentan un mayor riesgo de fracturas que la población general.
En los diferentes estudios realizados en población general, se han incluido pacientes con deterioro de función renal, habiéndose observado mejoría de densidad mineral ósea (DMO) y disminución del riesgo de fracturas, independientemente de la función renal. Asimismo, en los pocos estudios publicados de pacientes en diálisis también se ha observado mejoría de DMO, sobre todo cuando los pacientes presentaban PTH elevada53.
Se desconoce si la acumulación en el hueso se incrementa con el deterioro de la función renal. Habría que considerar que en estos pacientes, la acumulación podría provocar una disminución del remodelado óseo con dificultad en la reparación de microfracturas y deterioro de la calidad ósea, aunque esto no se ha demostrado, pues hay pocos datos de biopsia ósea y además son contradictorios.
En pacientes con estadios 1-2 con osteoporosis y/o alto riesgo de fractura, según los criterios de la OMS, se recomienda el mismo tratamiento que en la población normal, al igual que se sugiere que en pacientes en estadio 3 con PTH normal, osteoporosis y/o alto riesgo de fractura (1A). En pacientes con estadios 4-5D con disminución significativa de DMO y/o fracturas de estrés, se sugiere investigación adicional con biopsia antes de usar agentes antirresortivos (NG).
Podríamos resumir en que, en los pacientes con ERC avanzada o en diálisis, los bifosfonatos sólo estarían indicados ante la presencia de osteoporosis y un indudable alto remodelado óseo (siendo probablemente aconsejable una biopsia ósea previa) (NG).
Hay que sopesar con cuidado la indicación de bifosfonatos en pacientes con sospecha de enfermedad ósea adinámica, siendo en este caso mandatoria la biopsia ósea.
Si bien, se han descrito muy pocos efectos negativos sobre el riñón, con la administración intravenosa es importante mantener e incluso alargar el tiempo de infusión para evitar efectos secundarios (NG). La administración oral no parece alterar la función renal54(2B).
Mención especial merece la osteonecrosis de mandíbula que se ha relacionado en los últimos años con el tratamiento con bifosfonatos, si bien su incidencia es muy baja. Esta lesión se define como la presencia de una o varias lesiones ulceradas con exposición ósea en el maxilar superior y/o la mandíbula de más de 8 semanas de evolución. Es excepcional que se presente con los bifosfonatos orales. Los factores de riesgo incluyen la administración de bifosfonatos intravenosos durante un largo período de tiempo, neoplasias, quimioterapia, radioterapia, altas dosis de esteroides, abuso de alcohol y/o tabaco y, sobre todo, factores locales como patología periodontal, extracción dental y cirugía maxilofacial.
En los pacientes con ERC, aunque hasta el momento actual no se ha descrito ningún caso de osteonecrosis, es importante considerar su prevención.
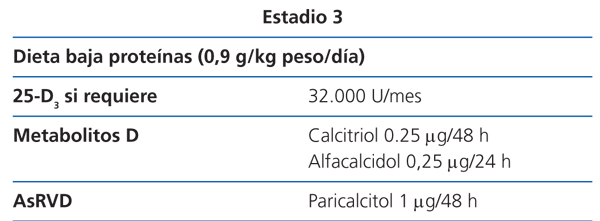
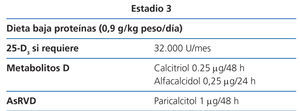
Estadio 3 (tabla 8)
Durante este período se observa el ascenso claro de los valores de PTH que comienzan a dibujar un incremento exponencial.
Las recomendaciones cambian respecto las anteriores etapas.
Dieta
La restricción proteica será discretamente más severa (0,9 g/kg de peso/día), con el fin de evitar el aporte de fósforo y la hiperfiltración. El paciente tolerará fácilmente el cambio, si ya se había adecuado a la dieta desde los estadios anteriores (2D).
Algunos autores sólo limitan productos con contenido desproporcionado en fósforo respecto al contenido proteico (abuso de lácteos, sodas, productos preparados) pues muchos pacientes pierden apetito hacia las proteínas, a medida que avanza la enfermedad renal, de un modo espontáneo.
25(OH)D3 (calcidiol)
Los valores de 25(OH)D3 se seguirán vigilando, para asegurarse de que sean normales (2C).
Captores de fósforo
Con este grado de función renal y la dieta no es difícil mantener una fosfatemia normal. Si no fuera así, se puede comenzar con captores de fósforo de contenido cálcico con las comidas, aunque se deberían usar con prudencia en pacientes con calcificaciones vasculares.
El acetato cálcico posee un poder captor similar al carbonato cálcico, pero con una menor sobrecarga de calcio, por lo que tendría ciertas ventajas, además de su mayor efecto en distintos rangos de pH (2C). El carbonato de calcio es, por otra parte, el más barato de los captores.
En estos momentos ya tienen indicación también el carbonato de lantano y el carbonato de sevelamer antes de la diálisis (aunque la ficha técnica especifica valores de fosfato >1,78 mmol/l [5,5 mg/dl]).
Metabolitos activos y análogos de la vitamina D
Como se ha mencionado anteriormente, si la PTH aumenta de forma progresiva por encima de los valores normales a pesar de la corrección de factores modificables (hiperfosfatemia, hipocalcemia, déficit de vitamina D), el tratamiento con metabolitos activos de la vitamina D o activadores selectivos del receptor de la vitamina D (AsRVD) podría estar indicado (2C).
Dosis bajas de metabolitos activos no suelen provocan hipercalcemia ni hiperfosfatemia y han mostrado, en estudios experimentales, que podrían incluso disminuir la progresión de la ERC54.
Por otra parte, el calcitriol controla su propio metabolismo, y evita que se pierdan sus receptores (VDR), por lo que la respuesta de la glándula paratiroides a calcitriol se mantiene intacta. También mantiene la densidad del receptor megalina localizado en las células tubulares renales.
Asimismo, también mantiene el número de receptores de Ca (CaR) de la glándula paratiroides.
Tanto el uso de calcitriol como de alfacalcidol se ha asociado, en estudios observacionales, con una mejor supervivencia de pacientes con ERC prediálisis55-57.
La dosis recomendada inicial de calcitriol es de 0,25 µg cada 48 horas y la de alfacalcidol de 0,25 µg cada 24 horas58. Estas dosis deben ajustarse con controles bioquímicos periódicos.
Activadores selectivos del receptor de vitamina D (AsRVD)
En nuestro país sólo se encuentra comercializado el paricalcitol. Se trata de la 19-nor-vitamina D2 que posee diferentes afinidades sobre el VDR, presentando mayor afinidad en las células paratiroideas respecto a osteoblastos, células de pared intestinal y células musculares lisas vasculares. Por ello parece ser menos hipercalcemiante e hiperfosforemiante que calcitriol, como se ha demostrado en diferentes estudios publicados.
Su uso se ha asociado no sólo con el control del hiperparatiroidismo secundario sino también con otros efectos pleiotrópicos de la vitamina D, como la disminución de la proteinuria en orina de 24 horas en pacientes diabéticos, probablemente asociado a su efecto antirrenina, aunque los resultados de estos estudios son todavía preliminares.
Por otro lado, parece ejercer, por mecanismos no aclarados, un efecto positivo sobre la supervivencia de los pacientes en diálisis59,60.
En estudios experimentales, paricalcitol provoca menos calcificaciones vasculares comparado con dosis equipotentes de calcitriol61. La dosis recomendada de paricalcitol en este estadio es de 1 µg cada 24/48 horas o 2 µg tres veces por semana. Esta dosis debería ajustarse con controles bioquímicos periódicos.
Bifosfonatos
En pacientes con filtrado glomerular inferior a 30 ml/min, en caso de utilizarlos, es aconsejable reducir la dosis a la mitad de la recomendada para pacientes con función renal normal53(NG).
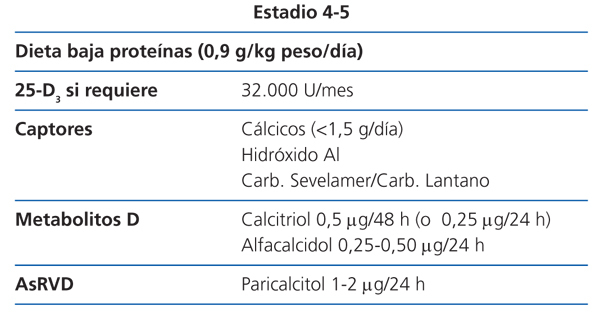
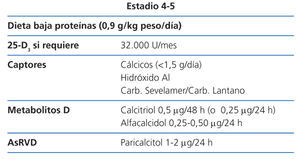
Estadio 4 (tabla 9)
En esta fase la elevación del valor de PTH es más severa y más rápida, por lo que se debe ser más estricto en dieta y tratamiento.
Dieta
La restricción proteica será discretamente más severa (0,8 g/kg de peso/día). Una ingesta proteica superior a 0,8 mg/kg/día asegura una nutrición adecuada (2D).
25(OH)D3 (calcidiol)
Los valores de 25(OH)D3 se seguirán vigilando, para asegurarse de que sean normales (2C).
Captores de fósforo
Con este grado de función renal, comienza a ser algo difícil mantener una fosfatemia normal a pesar de la dieta; si no fuera así se puede utilizar una mayor dosis de captores con las comidas, que si son con contenido cálcico, no deberían sobrepasar los 1.500 mg/día (NG).
Si no fuera suficiente se puede utilizar hidróxido de aluminio durante un corto período de tiempo, administrándolo sólo en las comidas cuyo contenido en fósforo lo justifique (BC).
La cantidad segura de captores con aluminio se desconoce. Además, varias condiciones pueden favorecer su absorción intestinal, como la diabetes mellitus, el HPT2, el estado de la vitamina D, la toma de citrato y el estado de los depósitos de hierro.
El aluminio sérico debería medirse dos veces al año en aquellos pacientes que reciban captores de fósforo que contienen aluminio (BC). Valores basales de aluminio sérico <20 µg/l indican una probable ausencia de sobrecarga de aluminio. Valores repetidos entre 20 y 60 µg/l son de difícil interpretación. Los valores repetidos >60 µg/l indican una sobrecarga alumínica (esto no siempre implica enfermedad ósea por aluminio).
En pacientes con depleción de hierro, el riesgo de incorporación tisular de aluminio es mayor, por lo tanto, valores muy inferiores a los ya mencionados pueden tener un significado patológico.
De las otras alternativas de captores, en estos momentos ya tienen indicación también el carbonato de lantano y el carbonato de sevelamer.
Metabolitos activos y análogos de la vitamina D
En este estadio, según los niveles de PTH, la dosis inicial recomendada de calcitriol es de 0,25-0,50 µg cada 24-48 horas y la de alfacalcidol de 0,25 µg cada 24 horas (2D). Estas dosis deberían ajustarse con controles bioquímicos periódicos.
AsRVD
El menor efecto sobre la absorción de fósforo puede hacer recomendable su uso en este estadio (NG).
La dosis inicial recomendada de paricalcitol en este estadio es de 1 µg cada 24 horas horas (o 2 µg cada 48 horas) (2D). Esta dosis debería ajustarse con controles bioquímicos periódicos.
Estadio 5 (tabla 9)
En esta fase el control del HPT2 es más difícil. La función renal está severamente deteriorada y tanto la función excretora como las funciones endocrinas son deficientes, la variabilidad bioquímica es importante y la situación puede variar en poco tiempo, por lo que el tratamiento es más difícil de estandarizar.
Si el paciente ha sido controlado desde estadios precoces, generalmente, la pauta del estadio anterior es suficiente.
Dieta
La restricción proteica será discretamente más severa (máximo 0,8 g/kg de peso/día), cuidando no comprometer una adecuada nutrición (2D).
25(OH)D3 (calcidiol)
Los valores de 25(OH)D se seguirán vigilando, para continuar asegurándonos de que sean normales (2C).
Captores de fósforo
Con este grado de función renal, es muy difícil mantener una fosfatemia normal si no se administran captores de fósforo con las comidas. La pauta es la misma que en el estadio anterior, con dosis habitualmente más elevadas (NG).
Metabolitos activos y análogos de la vitamina D
En este estadio, las dosis recomendadas son las mismas que en el anterior, aunque se podrán modificar en función de la calcemia, fosfatemia y valores séricos de PTH (2D).
AsRVD
La dosis inicial recomendada de paricalcitol en este estadio, a modo de orientación, es de 1 µg cada 24 horas si la PTH es inferior a 500 pg/ml y de 2 µg cada 24 horas si la PTH es superior a 500 pg/ml, también modificable en función de calcemia, fosfatemia y valores séricos de PTH (2D).
Estadio 5D (diálisis)
Control del fósforo
El incremento de los niveles séricos de fósforo es uno de los principales problemas que presentan los pacientes con ERC en tratamiento con diálisis. Evitar la hiperfosfatemia tiene dos objetivos: uno conseguir un adecuado control del metabolismo óseo-mineral, preferentemente para evitar el desarrollo y las complicaciones del HPT2, y otro, reducir el riesgo cardiovascular y la alta tasa de morbimortalidad de estos pacientes. La asociación independiente entre hiperfosfatemia y mortalidad ha sido demostrada con el análisis retrospectivo de varias amplias bases de datos.
Por tanto, mantener el fósforo dentro de la normalidad se ha convertido en un objetivo prioritario.
En este caso, el tratamiento de la hiperfosfatemia se basa en tres pilares fundamentales:
1. Restricción de la ingestión dietética de alimentos con alto contenido en fósforo sin comprometer el aporte básico de proteínas.
2. Modificaciones de las características y esquema de diálisis para optimizar la eliminación de este soluto.
3. Administración de captores del fósforo.
En la mayoría de los casos se requiere una combinación de estas tres alternativas terapéuticas.
Dieta
En hemodiálisis los requerimientos proteicos deben ser superiores a los recomendados para la población general, dada la condición catabólica de la técnica y la enfermedad. Lógicamente, también son superiores a las recomendadas al enfermo urémico aún no en diálisis.
En primer lugar, debe garantizarse un adecuado soporte calórico, proteico y mineral. Nunca el precio a pagar por una dieta presuntamente adecuada debe ser una nutrición insuficiente. El sentido común marca las normas de una dieta equilibrada. Cuatro comidas al menos, equilibrada en cuanto a los principios inmediatos (hidratos de carbono, grasas y proteínas).
Se considera que el aporte óptimo de proteínas debe ser de 1-1,2 g/kg/día (de las cuales el 50% deben ser de alto valor biológico, es decir, proteínas animales) y la calórica de 30-35 kcal/kg de peso (35 para menores y 30 para mayores de 65 años). En diálisis peritoneal la recomendación incluso es mayor (1,2-1,3 g/kg de peso/día) (2D).
Esta mayor liberación de la dieta proteica puede ocasionar un efecto adverso en la entrada de fósforo. Es decir, el precio a pagar por asegurar los requerimientos proteicos mínimos es la necesidad de mayores dosis de captores intestinales del fósforo.
Diálisis
La duración idónea de la sesión de diálisis es un tema muy controvertido. Actualmente, se considera que la duración de la diálisis debe individualizarse de acuerdo a los requerimientos de cada paciente. Si bien no hay evidencia clara de que exista un efecto independiente del tiempo de diálisis sobre el control del fósforo62-70, hoy día se recomienda una duración mínima de 4 horas tres veces por semana, exceptuando pacientes con una elevada función renal residual.
En términos generales, un incremento del tiempo y la frecuencia de la diálisis mejoran la eliminación de solutos (2B).
El tiempo de duración de la sesión de diálisis puede ser determinante en la eliminación de pequeños solutos, que están principalmente localizados en el espacio intracelular, como es el caso del fósforo.
No existen estudios prospectivos, controlados y aleatorizados que confirmen de forma definitiva que un incremento del tiempo de diálisis tenga un efecto sobre el control de la hiperfosforemia.
Sin embargo, la mayoría de los estudios publicados describen un efecto beneficioso del aumento de la duración de la sesión de hemodiálisis sobre la eliminación de fósforo.
Incrementar la frecuencia de las sesiones de hemodiálisis es otra alternativa. Tampoco existen estudios adecuados para valorar el efecto del incremento de la frecuencia sobre el aclaramiento del fósforo. La mayoría de estos trabajos son estudios observacionales, con un escaso número de pacientes seleccionados, seguidos durante un corto espacio de tiempo.
Para lograr una reducción significativa de los niveles de fósforo sérico, se requiere que la duración de la sesión sea superior a las 2 horas. Actualmente, existe una tendencia a aumentar la duración de la sesión de hemodiálisis a un esquema de 2,5-3,0 horas cinco-seis veces por semana. En pacientes con fósforo elevado y hemodiálisis a días alternos, la duración mínima debería ser de 4 horas.
Como se ha mencionado, el incremento de ambos parámetros, tiempo y frecuencia, pueda ser un procedimiento eficaz para el tratamiento de la hiperfosforemia refractaria. Con la diálisis larga nocturna diaria (cinco-seis sesiones de 6-10 horas de duración) existe una importante disminución de la hiperfosforemia, con una reducción de las dosis de captores del fósforo, incluso a pesar de haberse objetivado que los pacientes incrementan el aporte diario de fósforo.
Técnicas con alto transporte convectivo
Su empleo puede ser considerado como una alternativa terapéutica de la hiperfosforemia.
Las membranas de alto flujo tienen una mayor capacidad de eliminación de fósforo que las de bajo flujo. Por otra parte, varios estudios aleatorizados han confirmado que la hemodiafiltración (difusión y convención) con alto transporte convectivo incrementa el aclaramiento de un amplio espectro de solutos, en concreto el fósforo, cuando se compara con la hemodiálisis con membranas de bajo y alto flujo. No obstante, actualmente, tampoco existe una evidencia clara de las ventajas potenciales de las membranas de alto flujo ni de la hemodiafiltración.
Captores de fósforo
Como ya se ha mencionado en el apartado anterior, la mayoría de los pacientes en hemodiálisis van a presentar un balance positivo de fósforo, por lo que van a requerir un tratamiento adicional con captores intestinales de fósforo, para evitar la hiperfosforemia.
Las limitaciones potenciales de los captores cálcicos e hidróxido de aluminio son las mismas que en estadios anteriores. Existe una amplia experiencia, tanto con sevelamer como con carbonato de lantano71,72.
El sevelamer es un captor de fósforo que no contiene ni calcio ni aluminio. Se trata de un polímero que se une al fósforo en el intestino e impide su absorción. Varios estudios prospectivos demuestran que es capaz de atenuar la progresión de calcificaciones coronarias y aórticas, y también reduce los niveles de lípidos, entre otros múltiples efectos pleiotrópicos demostrados experimentalmente. Sin embargo, en un estudio practicado en una población en hemodiálisis de mayor riesgo cardiovascular no se observó la superioridad de sevelamer en la progresión de la calcificación vascular en comparación con el acetato de calcio si se intentaban mantener los niveles de LDL <70 mg/dl con estatinas. Las razones por las que sevelamer no disminuyó la progresión de la calcificación en este estudio no son aparentes73,74.
Frente a dichas ventajas, el sevelamer tiene el inconveniente de presentar una eficacia limitada, lo que conlleva que en muchos casos se necesitan tomar un elevado número de comprimidos que pueden ser mal tolerados por los pacientes. Es probable que las nuevas dosificaciones en forma de carbonato de sevelamer (polvo para suspensión oral triplicando la dosis) puedan mitigar este problema.
Es de destacar que un estudio muestra una mejoría de supervivencia en los pacientes incidentes en diálisis tratados con sevelamer en comparación con captores cálcicos75, si bien otro estudio prospectivo limita la mejoría de la supervivencia a determinadas subpoblaciones (población de más de 65 años)76.
El carbonato de lantano es un captor de fósforo potente que no contiene ni aluminio ni calcio y que ofrece la posibilidad de mejorar el control del fósforo sérico sin efectos secundarios relevantes como han mostrado diferentes estudios publicados77,78. Estudios preliminares observacionales parecen también mostrar efectos beneficiosos sobre la atenuación de la progresión de calcificación vascular y la supervivencia con carbonato de lantano en comparación con quelantes cálcicos79.
Recientemente se ha comercializado en España la asociación de acetato de calcio con carbonato de magnesio para pacientes en programa de diálisis. Los resultados parecen prometedores y no se han asociado con problemas derivados de la posible hipermagnesemia, habiéndose acompañado además de disminución de los niveles de PTH80. Se han descrito también potenciales efectos anticalcificantes del magnesio, tanto en estudios experimentales como en estudios preliminares en clínica81.
Se aconseja la monitorización del magnesio sérico y del ECG en pacientes tratados con digital.
Hasta el momento, no hay ningún trabajo que demuestre de forma convincente cuál debe ser el captor de primera elección. Muy frecuentemente la hiperfosfatemia se trata con una asociación de varios de estos captores, aunque tampoco existe evidencia de una mayor efectividad de su uso combinado.
Como hemos mencionado con anterioridad para pacientes en prediálisis, se considera razonable que en la elección del captor se tenga en cuenta el estadio de ERC, la presencia de otros componentes del complejo CKD-MBD (i.e. calcificación vascular), terapias concomitantes y perfil de efectos secundarios (NG). Asimismo, se recomienda la restricción de captores basados en calcio en presencia de hipercalcemia persistente o recurrente (1B) y se sugiere en presencia de calcificación arterial y/o enfermedad adinámica del hueso y/o si los niveles séricos de PTH son persistentemente bajos (2C).
Control del calcio
El calcio en los pacientes debe mantenerse en el rango normal, aconsejándose que los valores estén entre 8,4 y 9,5 mg/dl en pacientes en diálisis (2D). En la época anterior a los calcimiméticos se había descrito un incremento de la mortalidad con niveles altos de calcio en estudios retrospectivos de amplias bases de datos, aunque estos resultados no han sido siempre confirmados. Especialmente se debería evitar la asociación de niveles elevados de calcio con PTH baja, así como la asociación de niveles elevados de calcio y fósforo, combinaciones que se han asociado con aumentos de mortalidad en pacientes en diálisis o con la presencia de calcificaciones vasculares.
Dieta
El incremento proporcional de calcio con el incremento de las recomendaciones proteicas varía en función de la cantidad de lácteos. De forma orientativa, una dieta de 1-1,2 g/kg/día de proteínas contiene entre 550 y 950 mg de calcio (NG).
La ingesta total de calcio elemento al día no debe exceder los 2 g, incluyendo tanto el calcio de la dieta como el incluido en los captores del fósforo o resinas de intercambio iónico (p. ej., resín-calcio).
Diálisis
Ajustes en la concentración de calcio en el líquido de diálisis pueden contribuir a optimizar el balance de calcio en estos enfermos.
No existe un consenso sobre cuál debe ser el contenido de calcio en el líquido de diálisis. Valores de 1,25 mM (2,5 mEq/l; 5 mg/dl) se han asociado con balance negativo de calcio y tendencia al incremento de la PTH. Además con 1,25 mM existe una peor tolerancia hemodinámica a la ultrafiltración, que se potencia si el contenido de magnesio no es adecuado. Niveles más elevados, 1,75 mM (3,5 mEq/l; 7 mg/dl) frenan la secreción de PTH, pero producen un balance positivo de calcio.
Si es posible, se debe individualizar el contenido de calcio en el líquido de diálisis de acuerdo a las características de cada paciente. No parece aconsejable el aumento persistente del calcio en el líquido de diálisis como respuesta a la hipocalcemia inducida por calciméticos. Por otro lado, en pacientes con PTH baja, el líquido de diálisis con Ca de 1,25 mM/l (incluso de 1 mM/l) puede estar indicado para estimular la secreción de PTH, y evitar la enfermedad ósea adinámica, aunque las concentraciones bajas de calcio en el baño pueden predisponer a arritmias e inestabilidad hemodinámica.
La concentración recomendable en situación de normocalcemia y PTH controlada parece ser de 1,5 mmol/l (3 mEq/l; 6 mg/dl) (NG), aunque las guías KDIGO sugieren el uso de líquido en el baño entre 1,25 y 1,50 mmol/l (2,5-3 mEq/l) (2D). Se desconoce aún cuál es el balance de calcio según el líquido de diálisis en pacientes con hipocalcemia secundaria al uso de calcimiméticos. Todas estas consideraciones son aplicables a la diálisis peritoneal.
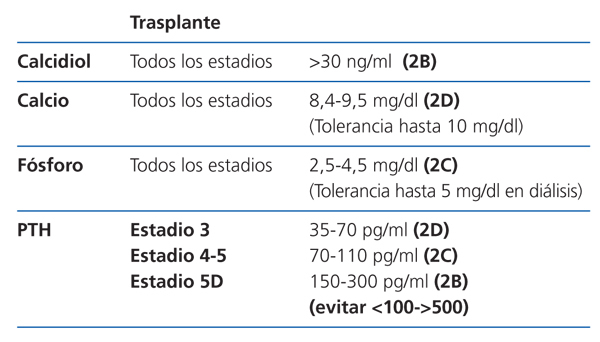
Control de la PTH
Se sugiere mantener la PTHi entre 150 y 300 pg/ml corregida para el kit usado (2C). Cifras fuera de este rango de PTH se han asociado con un incremento de la morbimortalidad en los pacientes en hemodiálisis, aconsejando evitar especialmente valores por debajo de 100 y por encima de 500 pg/ml, como ya se mencionaba en las guías anteriores (2C). Estos últimos valores coinciden aproximadamente con los valores considerados como «extremos de riesgo» expresados en las guías KDIGO (evitar valores <2 y >9 veces los límites superiores de la normalidad del kit usado para la medición de PTHi).
El grupo de trabajo considera que establecer como único margen de control de calidad adecuado valores <2 y >9 veces los límites superiores de la normalidad del kit usado como sugieren las KDIGO es posiblemente inapropiado puesto que llevaría indefectiblemente a que un número significativo de pacientes estarían fuera de estos rangos debido a la distribución gaussiana en las poblaciones. Estableciendo un objetivo terapéutico más estrecho como el sugerido se aseguraría que un mayor número de pacientes se encontrarían en el margen de seguridad (BC).
Para mantener este rango de PTH es prioritario tener bien controlados los niveles de calcio, fósforo y probablemente calcidiol séricos (NG). Si una vez logrado este objetivo persisten valores elevados o crecientes de PTH se sugiere el uso de metabolitos activos de la vitamina D, calcimiméticos o ambos para disminuir la PTH (NG).
También aquí se considera razonable basar la terapia inicial en los niveles de calcio y fósforo, así como otros aspectos de la CKD-MBD (p. ej., calcificación vascular), y que la dosis de captores del fósforo se ajuste para que los tratamientos para controlar la PTH no comprometan los niveles de calcio y fósforo (NG).
25(OH)D3 (calcidiol)
Existen evidencias indicando que en esta etapa también es necesario mantener niveles adecuados de 25(OH)D3. Ello podría ser útil para el control del HPT2, pero especialmente para otros efectos pleiotrópicos de la vitamina D (2D).
Metabolitos activos y análogos de la vitamina D
El tratamiento con metabolitos activos (calcitriol o alfa-calcidiol) permite reducir los niveles de PTH, pero un uso inadecuado puede conducir a una elevación del fósforo, calcio y producto calcio ´x fósforo. Todos los metabolitos activos se han asociado en estudios retrospectivos con aumentos de supervivencia de los pacientes en diálisis.
Se debe minimizar o suspender el tratamiento con metabolitos activos de vitamina D si se observan cifras elevadas de calcio y/o de fósforo o si la PTH equivalente es inferior a 100 pg/ml (o aproximadamente <2 veces el límite superior de la normalidad para el kit) (1B).
Activadores selectivos del receptor de vitamina D (AsRVD)
Los AsRVD (paricalcitol) tienen menor efecto en la elevación de Ca, P y Ca ´ P, y desciende más rápidamente la PTH. El menor efecto sobre la absorción de calcio y fósforo puede hacer recomendable su uso en este estadio.
En estudios retrospectivos se ha asociado su uso a ventajas de supervivencia respecto calcitriol en pacientes en diálisis.
Al igual que con los metabolitos de vitamina D, se debe minimizar o suspender el tratamiento ante cifras elevadas de calcio y/o de fósforo o si la PTH equivalente es inferior a 100 pg/ml (o aproximadamente <2 veces el límite superior de la normalidad para el kit) (1B).
No obstante, algunos autores opinan que una dosis mínima entre 1 y 5 µg semanales de paricalcitol deberían mantenerse para asegurar la activación de los receptores de vitamina D (NG).
Tanto los metabolitos activos como los AsRVD se pueden administrar por vía oral o intravenosa, a dosis que dependerán de los niveles séricos de PTH, y siempre y cuando los niveles de calcio y fósforo estén controlados (p. ej., <9,5 mg/dl y <5 mg/dl, respectivamente) (NG).
En nuestra experiencia, las dosis iniciales de paricalcitol calculadas según el valor de PTHi deberían ser menores a las recomendadas en su ficha técnica (PTHi/80). Consideramos que son aconsejables dosis menores (máximo de 1 μg por PTHi/120) para un adecuado control del HPT2 y menor en terapia combinada con calcimiméticos (BC).
Calcimiméticos
El cinacalcet es un agente calcimimético que se une al receptor del calcio de la glándula paratiroidea y lo modifica alostéricamente de manera que lo hace más sensible a las acciones del calcio extracelular.
El cinacalcet reduce de forma significativa los niveles de PTH, y como consecuencia, reduce los valores séricos de calcio y, eventualmente, también de fósforo82-88. Experimentalmente se han descrito también distintos efectos pleiotrópicos, entre los que destaca su efecto positivo sobre la calcificación vascular89.
En estudios clínicos retrospectivos su uso se ha asociado con una disminución significativa de paratiroidectomías, fractura y hospitalizaciones de causa vascular. Recientemente se ha descrito en humanos la posible reducción del tamaño y vascularización de las glándulas paratiroides.
La disminución de la PTH con cinacalcet es rápida y transitoria, con un efecto máximo después de las 4 horas, seguido de un aumento lento hacia los niveles previos sin llegar a alcanzar los niveles basales. Después de unas semanas o meses se estabilizan los niveles de PTH, aunque persiste la oscilación diaria.
Entre los efectos secundarios destacan la intolerancia gastrointestinal que en algunos casos ha obligado a suspender el fármaco y la aparición de hipocalcemia. La intolerancia gastrointestinal mejora con la administración después de la comida o en dosis divididas.
No se ha demostrado ninguna interacción entre cinacalcet e inhibidores de la bomba de protones o captores del fósforo.
El cinacalcet se metaboliza a través de las acciones sobre el citocromo P450, por lo que la inhibición de esta enzima puede resultar en aumento de los niveles de cinacalcet (ketaconazol, itraconazol, cimetidina, claritromicina, ritonavir, zumo de pomelo) o disminución de los niveles (barbitúricos, fenitoína, carbamacepina, dexametasona, rifampicina).
Debe valorarse también el ajuste de dosis de fármacos metabolizados por CYP2D6 de margen terapéutico estrecho (flecainida, quinidina, antidepresivos tricíclicos, vinblastina, tioridazina, propafenona, metoprolol, etc.). Se debe ser prudente en pacientes con antecedentes de epilepsia.
En los pacientes que reciben cinacalcet se deben realizar controles frecuentes de calcio al inicio del tratamiento, ajustando los captores del fósforo, y asociando al tratamiento metabolitos o AsRVD si se requiere.
Recomendaciones
1. No debe iniciarse el tratamiento con cinacalcet en pacientes con una concentración sérica de calcio (corregida por la albúmina) por debajo del límite inferior del intervalo de normalidad (< 8,4 mg/dl). Por debajo de este valor sí puede mantenerse el tratamiento si la situación clínica y la seguridad lo permiten (2D).
2. En pacientes en diálisis, se podría considerar utilizar cinacalcet si la PTHi es inferior a 300 pg/ml, siempre y cuando el producto Ca ´ P esté elevado (NG).
3. La dosis inicial recomendada para adultos es de 30 mg una vez al día, que deberá ajustarse cada 2 a 4 semanas no superando la dosis máxima de 180 mg una vez al día. En caso de necesidad de usar dosis menores, se ha empleado la administración del fármaco cada 48 horas, aunque no existe experiencia documentada al respecto. Otras dosis intermedias se consiguen con la administración de dosis diferentes (p. ej., 60 mg-30 mg a días alternos corresponderían a una dosificación de 45 mg/día) (NG).
4. Los niveles de PTH se han de evaluar al menos 12 horas después de la ingestión del fármaco.
5. Con cada ajuste de dosis debe determinarse el calcio sérico semanalmente. En caso de producirse hipocalcemia (cifras inferiores a 7,5 mg/dl), se aconseja, asociar o aumentar las dosis de vitamina D (metabolitos o AsRVD), reducir la dosis del cinacalcet o interrumpir su administración (2D).
Asociación de cinacalcet y metabolitos de vitamina D o AsRVD
Es posible que la asociación de metabolitos de la vitamina D o AsRVD y cinacalcet pueda ser aditiva y/o sinergística en el control del HPT2 o presentar otros efectos beneficiosos (p. ej., sobre la calcificación vascular). Se ha observado que el uso de calcimiméticos se ha asociado con una disminución de las necesidades de metabolitos de vitamina D o AsRVD y viceversa.
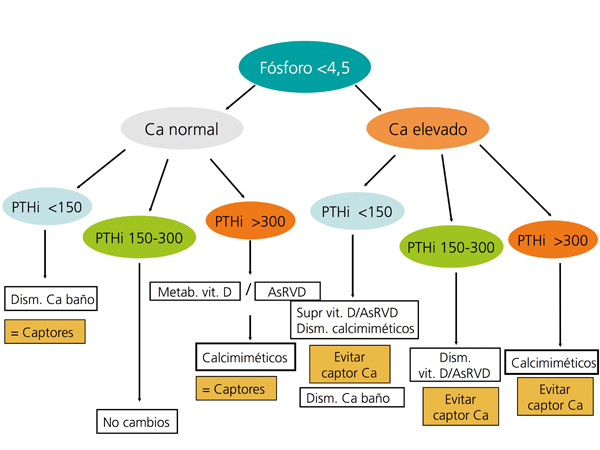
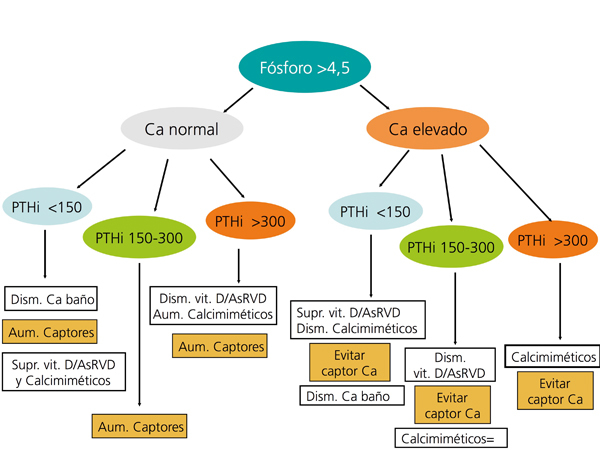
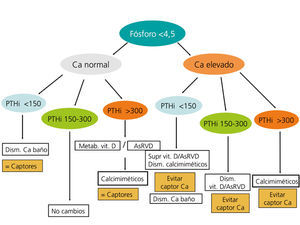
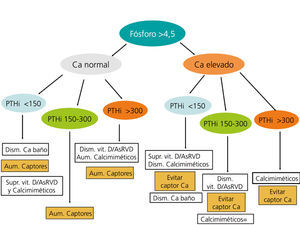
En la figura 3 y en la figura 4 se expone un algoritmo orientativo de manejo de las alteraciones bioquímicas del metabolismo óseo-mineral de pacientes en estadio 5D, en función de la PTHi o del fósforo sérico.
Estadio 5T (trasplante renal)
Después del trasplante renal es frecuente la persistencia del hiperparatiroidismo, la mayoría de los receptores padecen una enfermedad ósea de bajo o alto remodelado, y los inmunosupresores, fundamentalmente los esteroides, tienen efectos nocivos sobre el hueso. A esto hay que añadir la persistencia de diferentes grados de insuficiencia renal, ocasionalmente acidosis, y el efecto negativo sobre el balance de calcio del uso de diuréticos de asa. Todo ello se traduce, básicamente, en los siguientes problemas:
1. Hiperparatiroidismo secundario persistente.
2. Pérdida de masa ósea y fracturas.
Hiperparatiroidismo secundario
El HPT secundario persistente se encuentra entre un 15 y un 50% de los pacientes después del primer año del trasplante, siendo los pacientes que presentan unos valores séricos más elevados de PTH y calcio en el momento del trasplante los que presentarán mayor persistencia de HPT a largo plazo90.
Actualmente, desde la introducción del cinacalcet, el porcentaje de pacientes en diálisis que acceden al trasplante con PTH controlada se ha incrementado notablemente, presentándose un nuevo problema como es el de la decisión de suspender o no el cinacalcet en el momento del trasplante.
La persistencia del HPT es un factor de riesgo de:
1. Pérdida de masa ósea e incremento del riesgo de fractura.
2. Hipercalcemia. Su incidencia varía mucho dependiendo del valor considerado y el momento post-TR considerado. Entre otros efectos negativos cardiovasculares, también se ha considerado como uno de los múltiples factores responsables del fracaso del injerto renal a medio plazo91.
3. Hipofosfatemia. Probablemente también es secundaria a los valores persistentemente elevados de FGF-2392.
4. Deterioro de función renal y aparición de calcificaciones túbulo-intersticiales93.
Para el control de estas alteraciones, muchas veces lo más prudente puede ser esperar la evolución, manteniendo un estrecho control de los valores séricos de calcio, fósforo y PTH.
Las alternativas de tratamiento son dos:
1. Paratiroidectomía. Junto con el control de la calcemia también se lograba mejoría de la DMO, aunque también se ha descrito un deterioro de función renal a corto plazo tras la paratiroidectomía94. Desde que se ha extendido el uso del cinacalcet, pensamos que la paratiroidectomía podría quedar reservada para los pacientes que no responden al tratamiento con este fármaco (BC).
2. Calcimiméticos (cinacalcet). Ha demostrado ser efectivo en la normalización de la hipercalcemia y de la hipofosfatemia secundarias al hiperparatiroidismo persistente. No se ha descrito ningún efecto negativo sobre la función renal ni interacción con los inmunosupresores (anticalcineurínicos, MMF o inhibidores m-TOR)95-99. Además, podrían tener efecto beneficioso sobre la DMO100, aunque este hecho también necesita más estudios para su confirmación.
Lo más aconsejable sería, en pacientes con calcemia superior a 10,5 mg/dl y PTHi >100 pg/ml, iniciar el tratamiento con 30 mg/día y modificar dosis en función de la respuesta (BC).
Pérdida de masa ósea y fracturas
Diferentes estudios prospectivos han demostrado que en los primeros 6 meses del trasplante renal ocurre una pérdida rápida de DMO, del orden del 7 al 10%, que afecta principalmente al hueso esponjoso. En la columna lumbar esta pérdida es del 1,5% por mes. En el fémur proximal también se ha descrito una pérdida ósea significativa. Esta disminución de DMO se estabiliza o tiende a recuperarse después de los 12 meses101-104.
Estos hallazgos destacan la importancia del inicio de las medidas profilácticas desde el momento del trasplante.
En cuanto a la pérdida ósea a largo plazo, se observan discrepancias entre los estudios, constatándose en unos una tasa de pérdida ósea del 1-2% por año en la columna lumbar, mientras que en otros no se demuestran cambios e incluso se objetiva un ligero incremento en la DMO. Estas discrepancias pueden ser debidas al uso de diferentes dosis de mantenimiento de corticoides.
La pérdida ósea rápida que ocurre después del trasplante condiciona una elevada prevalencia (7-20%) e incidencia (3-4% por año) de fracturas.
Las fracturas suelen ocurrir en el postrasplante tardío, y aunque la pérdida ósea es preferentemente en el hueso trabecular, la mayoría afectan al esqueleto apendicular, particularmente a los pies y a los tobillos105.
Al ser la fractura vertebral un potente factor de riesgo para el desarrollo futuro de fracturas, su detección da la oportunidad de intervenir en la prevención secundaria. De ahí que deba incorporarse una técnica de imagen para la detección de deformidades vertebrales asintomáticas en los pacientes trasplantados con mayor riesgo de fractura.
Un tema de debate en la actualidad es si la DMO medida por DEXA tiene el mismo valor predictivo de fractura en el trasplante renal que en la población general106. Un estudio prospectivo reciente en pacientes trasplantados reveló que la existencia de osteopenia u osteoporosis en la cadera incrementó el riesgo subsiguiente de fractura 2,7 y 3,5 veces, respectivamente107.
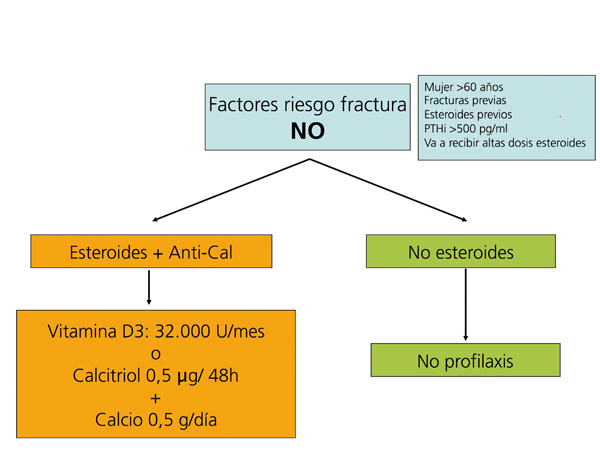
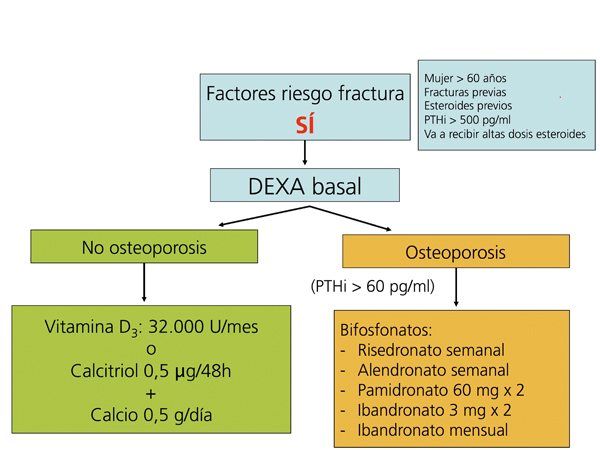
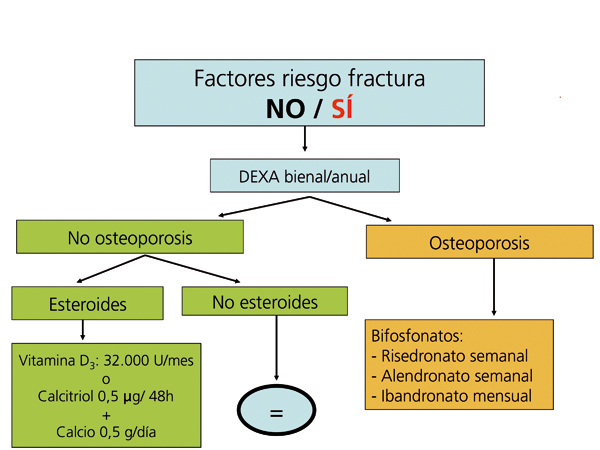
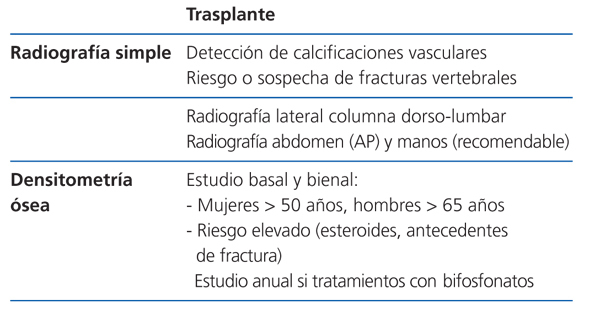
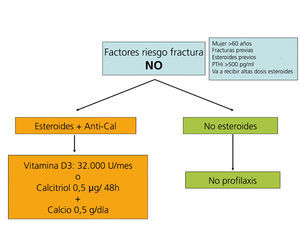
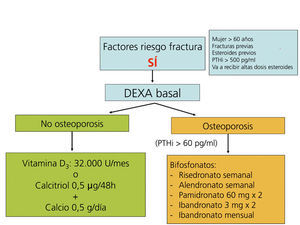
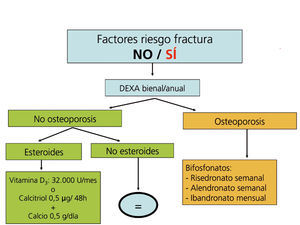
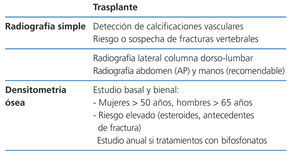
Recomendaciones para la prevención de la pérdida de masa ósea y fracturas postrasplante renal (figura 5, figura 6, figura 7)
La prevención de la pérdida ósea y de las fracturas comienza en el momento del trasplante.
Inmunosupresores
La primera medida es minimizar las dosis de corticosteroides y suspenderlos desde que se considere seguro.
Suplementos de vitamina D y calcio
La administración de suplementos de calcio oral (0,5 g/día) y vitamina D (vitamina D3: 400-800 U/día, o calcitriol: 0,5 µg/48 horas) previene la pérdida de masa ósea en los primeros meses del trasplante108-111(2B).
Se recomienda medir periódicamente (cada 6 meses o un año) tras el trasplante los niveles de 25(OH)D3, y normalizarlos administrando vitamina D3 o 25(OH)D3 (colecalciferol 32.000 U/mes) (2C).
Bifosfonatos
Los bifosfonatos, en combinación con suplementos de calcio y vitamina D, también se han demostrado eficaces en la prevención de la pérdida ósea postrasplante, así como en el tratamiento de la osteoporosis112-121. Todos los bifosfonatos, tanto el pamidronato i.v. como el ibandronato oral mensual o i.v., el risedronato oral semanal o el alendronato semanal han demostrado ser igual de eficaces (2B).
El uso universal de bifosfonatos en el postrasplante no debería recomendarse.
Recomendamos la práctica de una densitometría ósea y de una radiografía lateral de columna torácica y lumbar durante la hospitalización del postrasplante. En los receptores con más riesgo de fractura (tabla). En lugar de la radiografía, puede ser útil la morfometría vertebral obtenida con los nuevos equipos DEXA. En función de la DMO y de la situación de PTH valoraremos inicio del tratamiento con bifosfonatos.
En los pacientes de riesgo se aconseja también repetir la exploración al año (2C). Si aparece un empeoramiento en la densitometría al año, o nuevas fracturas, el tratamiento estándar debe ser un bifosfonato (alendronato, risedronato o ibandronato por vía oral) (2C).
Posteriormente podríamos espaciar la DEXA cada 2 años.
En principio, y dada la ausencia de evidencia, todavía no se aconseja la administración conjunta de calcimiméticos y bifosfonatos.
Hormona paratiroidea
La hormona paratiroidea sintética (teriparatide o PTH 1-84) no ha demostrado ser eficaz para prevenir la pérdida ósea rápida que ocurre en los primeros meses del trasplante122,123.
Si existen sospechas de enfermedad ósea adinámica por la coexistencia de unos niveles de PTH bajos o normales con edad >60 años, o diabetes, debe considerarse el tratamiento con PTH sintética (teriparatida: 20 µg/día s.c. o PTH 1-84: 100 µg/día s.c.) durante un año. No está indicado el uso de PTH sintética en presencia de hiperparatiroidismo secundario (NG).
En los casos más complejos, puede recurrirse a la biopsia ósea previo marcaje con tetraciclina con el fin de dirigir el tratamiento en función del estado del remodelado y la mineralización ósea.
PARATIROIDECTOMÍA
La paratiroidectomía se debe considerar si todas las medidas anteriormente mencionadas son ineficaces para controlar la PTH.
Hoy día, con la introducción de las nuevas alternativas de tratamiento médico, las indicaciones podrían quedar reducidas a (2B):
1. Hiperparatiroidismo secundario con hipercalcemia no iatrogénica (hiperparatiroidismo terciario) resistente a las alternativas médicas (fundamentalmente calcimiméticos).
2. Hiperparatiroidismo primario en pacientes con ERC (especialmente jóvenes).
3. Pacientes con calcifilaxis y PTHi superior a 500 pg/ml, que no responden rápidamente al tratamiento con calcimiméticos, aunque también se podría aconsejar si se presentan complicaciones asociadas como ruptura tendinosa, dolor óseo severo o anemia refractaria.
Se recomiendan técnicas de imagen previas a la paratiroidectomía para valorar tamaño glandular, situación y sobre todo presencia de glándulas ectópicas124. La asociación de gammagrafía-MIBI y ecografía cervical muestra una gran sensibilidad y especificidad (BC).
Existe gran controversia sobre cuál es la técnica de extirpación más adecuada, paratiroidectomía total, subtotal o total con autotrasplante. Actualmente la más utilizada es la paratiroidectomía subtotal, porque es la que presenta menor índice de recidivas posparatiroidectomía, aunque depende en gran parte de la experiencia y capacidad del equipo quirúrgico de cada centro. Nunca se debería dejar como tejido residual (en caso de paratiroidectomía subtotal o para uso como autotrasplante) una glándula que capte en la gammagrafía.
CALCIFILAXIS (ARTERIOLOPATÍA URÉMICA CALCIFICANTE)
La calcifilaxis es una alteración vascular rara aunque grave, con una elevada tasa de morbimortalidad, que se caracteriza por una progresiva calcificación vascular con necrosis isquémica de los tejidos blandos y de la piel y que afecta casi exclusivamente a pacientes con insuficiencia renal crónica. Su diagnóstico es esencialmente clínico.
Suele presentarse tanto en pacientes en hemodiálisis como con trasplante renal, siendo excepcional en los pacientes sometidos a diálisis peritoneal o en estadios prediálisis125-127.
Los factores de riesgo más relevantes para el desarrollo de calcifilaxis son los siguientes:
1. Concentración sérica elevada de calcio y fósforo.
2. HPT2.
3. Hipoalbuminemia.
4. Obesidad.
5. Altas dosis de metabolitos activos de vitamina D.
6. Warfarina.
El procedimiento radiográfico más sensible para detectar la calcifilaxis es la realización de una placa usando la técnica de la mamografía.
La gammagrafía ósea se ha mostrado como una técnica diagnóstica muy sensible, observándose una hipercaptación subcutánea del isótopo (tecnecio-99), característica de la calcifilaxis correspondiente a las placas calcificadas.
Si es posible se debe evitar la biopsia de la lesión cutánea, ya que puede precipitar su ulceración y posterior infección, con el consiguiente riesgo de septicemia. Además, los hallazgos histopatológicos pueden ser inespecíficos. El diagnóstico puede basarse en los hallazgos clínicos característicos antes descritos.
Las medidas terapéuticas que han resultado eficaces, pero de forma irregular incluyen (tabla 10):
1. Normalización de calcemia, fosfatemia y producto fosfo-calcio. Fundamentalmente con el empleo de captores no cálcicos, bajas concentraciones de calcio en el baño de diálisis y evitar el uso de metabolitos activos de vitamina D.
2. Control del HPT2, con calcimiméticos128 o paratiroidectomía ante la falta de rápida respuesta a los calcimiméticos.
3. Cura tópica de las úlceras con antiséptico, sin desbridar. Se han llegado a usar larvas estériles disponibles comercialmente.
4. Cámara hiperbárica, con objeto de aumentar la PO2 tisular y con ello la producción de fibroblastos y de colágeno que pueden favorecer la angiogénesis129-131.
5. Bifosfonatos. Los bifosfonatos poseen un potente efecto inhibitorio sobre la actividad osteoclástica y la resorción ósea. La inhibición de la resorción ósea disminuye la concentración de calcio en sangre y con ello reduciría la tendencia de los núcleos minerales para formarse y crecer en las paredes arteriales. Por otro lado, los bifosfonatos podrían inhibir la secreción de citoquinas proinflamatorias en la pared vascular y con ello podrían contribuir a mejorar el cuadro132-135.
Se pueden emplear bifosfonatos orales o intravenosos; los bifosfonatos orales tienen la ventaja de poder administrarse a dosis menores, más constantes y homogéneas que los intravenosos, y probablemente de esa forma los bifosfonatos orales tendrían un efecto menor sobre el hueso y mayor sobre el tejido vascular.
Las dosis aconsejadas son: ibandronato 6 mg/i.v. o pamidronato 90 mg/i.v. seguidos de cualquier otro bifosfonato oral: ibandronato mensual, 150 mg una vez al mes, alendronato semanal, 70 mg vía oral una vez por semana o risedronato semanal, una dosis oral de 35 mg una vez por semana (1C).
6. Tiosulfato sódico intravenoso. Ha demostrado ser eficaz. Se desconoce el mecanismo de acción, aunque probablemente se relaciona con la disolución de las sales de calcio depositadas en los vasos. Se administra como solución de tiosulfato sódico al 25%, 25 g/1,73 m2 a pasar durante una hora al final de cada sesión de hemodiálisis. Se debería administrar hasta la resolución del cuadro136,137(1C).
Puntos clave
1. Debemos ampliar el concepto de tratar la «osteodistrofia renal» a tratar la «alteración óseo mineral asociada con la enfermedad renal crónica» concebida como un síndrome sistémico.
2. La «alteración óseo-mineral asociada con la enfermedad renal crónica» se corresponde al acrónimo inglés cada vez más utilizado de CKD-MBD (Chronic Kidney Disease- Mineral and Bone Disorder).
3. Las alteraciones óseo-minerales asociadas con la enfermedad renal crónica se inician de modo precoz en el transcurso de la enfermedad renal.
4. Al receptor de la vitamina D y al receptor sensor de calcio debemos ya añadir el receptor del fibroblast growth factor-23 y su cofactor, la proteína Klotho, como elementos fisiopatológicamente importantes en el desarrollo de hiperparatiroidismo secundario e hiperplasia paratiroidea.
5. Además del esqueleto, el sistema cardiovascular, entre otros, es uno de los más importantes tejidos secundariamente afectados por las alteraciones óseo-minerales asociadas a la enfermedad renal crónica.
6. Las calcificaciones vasculares no son sólo un fenómeno pasivo de deposición de calcio y fósforo sino que en la uremia se favorece, por distintos factores, la transformación activa de células musculares lisas vasculares en células de estirpe condrogénica u osteoblástica.
7. Los laboratorios clínicos deberían informar a los clínicos de los métodos de medición empleados (especialmente para la PTH y los niveles de calcidiol).
8. Los valores séricos de calcio y fósforo no son suficientes para el manejo de los pacientes con alteraciones del metabolismo óseo-mineral, y las concentraciones plasmáticas de calcio y fósforo se correlacionan poco con el balance-sobrecarga potencial de ambos elementos.
9. No obstante, es necesaria la monitorización periódica de calcio, fósforo, PTH y fosfatasa alcalina según períodos recomendados. Se sugiere la importancia de la medición también de los niveles de calcidiol dada la elevadísima incidencia-prevalencia de insuficiencia o deficiencia de vitamina D en la enfermedad renal crónica.
10. La PTH es un buen marcador de enfermedad ósea subyacente, pero los niveles intermedios son los menos específicos. Niveles de PTHi >450-500 pg/ml (o equivalente) son específicos de enfermedad ósea de alto remodelado. Niveles de PTHi <100-120 pg/ml (o equivalente) se asocian con enfermedad ósea de bajo remodelado (forma adinámica u osteomalacia).
11. Es importante el concepto de tratar tendencias evolutivas de la PTH y no datos aislados, así como su consideración conjunta y con otros parámetros del complejo CKD-MBD.
12. Se sugiere el uso de fórmulas de corrección de PTH a la referencia equivalente del kit clásico usado (Allegro de Nichols), pero esta aproximación sólo es válida para pacientes en diálisis.
13. Alteraciones en los valores séricos de calcio, fósforo, PTH, fosfatasa alcalina y de vitamina D, entre otros, se han asociado con aumento de mortalidad en los pacientes con enfermedad renal crónica y/o diálisis. Aunque todavía no existe prueba definitiva de causalidad.
14. Las mediciones de la calciuria y de la fostaturia (fracción excretada de fósforo) son parámetros probablemente útiles para valorar una potencial sobrecarga de estos elementos.
15. Aun siendo el FGF-23 un parámetro de futuro, su medición en el ámbito de la práctica clínica habitual todavía no está recomendada.
16. Con un alto grado de evidencia, los pacientes con calcificaciones vasculares o valvulares deben ser considerados en el grupo de riesgo cardiovascular más elevado.
17. Si bien no se recomienda realizar la medición de densidad mineral ósea rutinaria en pacientes con enfermedad renal crónica no trasplantados dado que los hallazgos no se correlacionan con la enfermedad ósea subyacente, está puede ser de cierta utilidad en pacientes con factores de riesgo de osteoporosis o antecedentes de fractura de estrés.
18. Se amplía el uso de la biopsia ósea a pacientes con estadios avanzados de enfermedad renal crónica y en diálisis antes del inicio de tratamiento con bifosfonatos, sobre todo si la hormona paratiroidea no es muy elevada.
19. En pacientes con enfermedad renal crónica prediálisis se sugiere mantener los niveles de calcio y fósforo en límites normales.
20. El uso de calcifediol (Hidroferol®) en pacientes con enfermedad renal crónica debe ir acompañado de controles, al menos ocasionales, de calcio y fósforo plasmáticos.
21. La detección de un aumento de PTH en pacientes con ERC conlleva, en primer lugar, la corrección de factores modificables (hipocalcemia, hiperfosfatemia, déficit de vitamina D).
22. Los derivados activos de la vitamina D y los activadores selectivos de los receptores de la vitamina D se han asociado con efectos beneficiosos (incluso mayor supervivencia) más allá del control de los parámetros bioquímicos, tanto en pacientes en prediálisis como en diálisis, en la gran mayoría de estudios publicados (retrospectivos).
23. Existen diferencias, experimentales, entre los distintos derivados activos de la vitamina D y los activadores selectivos de los receptores de la vitamina D.
24. Se considera que, dada la presencia de numerosas alternativas disponibles y la incapacidad de determinar una dosis segura, el uso prolongado de captores de aluminio debería evitarse.
25. Carbonato de sevelamer y carbonato de lantano son alternativas sin calcio en prediálisis.
26. Se aconseja mantener el fósforo lo más normal posible en los pacientes en diálisis, dada la uniforme importante asociación con mortalidad de niveles altos de fósforo en pacientes con enfermedad renal crónica.
27. Se considera razonable que en la elección del captor se tenga en cuenta el estadio de enfermedad renal crónica, la presencia de otros componentes del complejo CKD-MBD (i.e. calcificación vascular), terapias concomitantes y perfil de efectos secundarios.
28. Se recomienda la restricción de captores basados en calcio si hay hipercalcemia persistente o recurrente y se sugiere su restricción si hay calcificación arterial y/o enfermedad adinámica del hueso y/o si los niveles séricos de PTH son persistentemente bajos.
29. La asociación de acetato de calcio con carbonato de magnesio como captor de fósforo para pacientes en programa de diálisis ha demostrado resultados prometedores con menor aporte cálcico.
30. Se sugiere mantener la PTHi entre 150 y 300 pg/ml, corregida para el kit usado, como objetivo terapéutico, aconsejando evitar especialmente los extremos de riesgo (p. ej., por debajo de 100 y por encima de 500 pg/ml).
31. Es razonable basar la terapia inicial en los niveles de calcio y fósforo, así como otros aspectos de la CKD-MBD (p. ej., calcificación vascular).
32. El cinacalcet reduce de forma significativa los niveles de PTH, con una reducción simultánea de los valores séricos de calcio y, eventualmente, también de fósforo.
33. Se han descrito también efectos pleiotrópicos con el uso de calcimiméticos, así como asociaciones importantes con reducción de paratiroidectomías, fracturas y hospitalizaciones de causa cardiovascular.
34. Pueden asociarse calcimiméticos y derivados activos de la vitamina D, siendo posible una acción aditiva o sinérgica.
35. La administración oral de bifosfonatos no parece alterar la función renal.
36. Si bien se han descrito muy pocos efectos negativos, con la administración intravenosa de bisfofonatos es importante mantener e incluso alargar el tiempo de infusión para evitar efectos secundarios.
37. Si se emplean bifosfonatos en pacientes con filtrado glomerular inferior a 30 ml/min parece aconsejable reducir la dosis a la mitad de la recomendada para pacientes con función renal normal.
38. La persistencia del HPT después del trasplante renal es un factor de riesgo de hipercalcemia, hipofosfatemia, pérdida de masa ósea, incremento del riesgo de fractura y de deterioro de la función renal.
39. Después del trasplante renal se recomienda el tratamiento con calcimiméticos si la calcemia es superior a 10,5 mg/dl.
40. Para prevenir la pérdida de masa ósea postrasplante se debe minimizar la dosis de esteroides y se pueden emplear vitamina D, análogos o bifosfonatos.
41. El uso universal de bifosfonatos en el postrasplante no debería recomendarse y debería reservarse para los pacientes de riesgo.
42. En pacientes con trasplante renal, si existen sospechas de enfermedad ósea adinámica con valores séricos de hormona paratiroidea muy bajos puede considerarse el tratamiento con hormona paratiroidea sintética.
Figura 1. Osteodistrofia renal.
Figura 2. Clasificación ODR.
Figura 3. Algoritmo de tratamiento (orientativo).
Figura 4. Algoritmo de tratamiento (orientativo).
Figura 5. Algoritmo de tratamiento trasplante renal (orientativo).
Figura 6. Algoritmo de tratamiento Trasplante Renal (orientativo).
Figura 7. Algoritmo de tratamiento trasplante renal (orientativo).
Tabla 1. Periodicidad de los estudios bioquímicos
Tabla 2. Periodicidad de los estudios bioquímicos
Tabla 3. Periodicidad de los estudios bioquímicos
Tabla 4. Estrategias diagnósticas. Técnicas de imagen
Tabla 5. Estrategias diagnósticas. Técnicas de imagen
Tabla 6. Estrategias diagnósticas -Técnicas de imagen
Tabla 7. Valores bioquímicos recomendados
Tabla 8. Alternativas terapéuticas
Tabla 9. Alternativas terapéuticas
Tabla 10. Alternativas terapéuticas. Calcifilaxis