Recientes aportaciones a la literatura médica apuntan a que los recién nacidos de bajo peso al nacer, especialmente los nacidos pretérmino, son una población de riesgo para el desarrollo de enfermedad renal crónica. El conocimiento del proceso de nefrogénesis y las consecuencias de una detención prematura del mismo desde la óptica de Brenner, así como las aportaciones de Barker, conforman el marco teórico. Por otro lado la valoración nefrológica de esta población en la edad pediátrica no encuentra anomalías significativas, aunque aporta datos sutiles de disfunción, sobre todo en los pacientes menores de 1.000 g. Probablemente, un seguimiento más a largo plazo mostrará mayor incidencia de enfermedad renal crónica en esta población en comparación con los recién nacidos a término. La principal tarea de los profesionales que les atendemos es la preventiva, procurando un medio ambiente favorable que permita completar de forma adecuada la nefrogénesis tanto intrauterina como extrauterina, para evitar de esta forma la disminución de la masa nefronal al nacer.
CRITERIOS DE REVISIÓN: se ha realizado una búsqueda bibliográfica en Pubmed utilizando como criterios de búsqueda los términos “infant, low birth weight [MeSH]”, “infant, premature, diseases [MeSH]”, renal function, hypertension, kidney. La búsqueda se limitó a los idiomas castellano, ingles y francés y se realizó en artículos originales y de revisión.
_________________________________________________________________________________________________________________________
INTRODUCCIÓN
En la actualidad, se ha constatado un aumento en el número de recién nacidos (RN) de bajo peso, nacidos tras una gestación a término (entre 37 y 42 semanas) o pretérmino (menos de 37 semanas). Se estima que cada año nacen 13 millones de niños pretérmino en todo el mundo, calculando un porcentaje de partos prematuros que oscila entre el 5% en los países industrializados y el 25% en países en vías de desarrollo (OMS 2010). En España, representan alrededor de 40.000 nacimientos, con un incremento del 13% desde 2001.
Inicialmente, los esfuerzos en el cuidado de este grupo de RN estaban dirigidos a aumentar su supervivencia. Con el tiempo y las mejoras en su manejo, nos centramos en la supervivencia sin secuelas derivadas de la propia inmadurez o de las terapias empleadas. Desde el punto de vista nefrológico, somos capaces de diagnosticar y tratar la patología renal en este período de edad con la implementación de técnicas que hace unos años serían impensables. Sin embargo, una vez conseguido esto, el foco de atención se desplaza para intentar responder a la siguientes preguntas: ¿Cómo será la salud renal de estos pacientes en etapas posteriores de la vida? ¿Tendrá alguna repercusión a nivel nefrológico el bajo peso al nacer?
En los últimos años, se han recogido grandes aportaciones en la literatura médica, unas desde un punto de vista teórico, procedentes de distintos campos de la Medicina –Epidemiología, Patología, Nefrología e investigación básica– y otras más prácticas, derivadas del seguimiento de cohortes de bajo peso al nacimiento, que vamos a revisar en este artículo.
APORTACIONES DESDE EL PUNTO DE VISTA TEÓRICO
Origen de la enfermedad y la salud en el desarrollo
Teoría de Barker: «Developmental origins of Health and Disease».
El concepto básico se basa en el hecho de que hay una relación entre el desarrollo fetal y la posibilidad de padecer ciertas enfermedades en la vida adulta.
La idea inicial fue del médico noruego Anders Forsdahl, quien la expuso en la primera comunicación sobre este tema hace ya 34 años (1977)1. Durante su práctica como médico de cabecera, apreció que varios condados noruegos presentaban variaciones considerables en las tasas de mortalidad por cardiopatía isquémica que no podían explicarse por diferencias socioeconómicas ni hábitos de vida. Observó una correlación positiva significativa entre la mortalidad por cardiopatía isquémica en las personas de entre 40 y 69 años y la mortalidad infantil en los primeros años de vida en la misma cohorte. Consideró que estos dos hechos podrían tener algo que ver entre sí, y formuló la hipótesis que relaciona las malas condiciones de vida en la infancia y la enfermedad cardiovascular en la vida adulta.
Posteriormente, David Barker, médico y profesor de Epidemiología Clínica en la Universidad de Southampton, desarrolló esta idea innovadora y publicó en 1986 su obra inicial sobre el tema2. Un análisis detallado de la distribución geográfica del millón de muertes que se produjeron en Inglaterra y Gales entre 1968 y 1978 por cardiopatía isquémica mostró que su localización era muy parecida a la de las muertes infantiles en el período en que dicha generación había nacido. Estableció una hipótesis de trabajo: la asociación entre el bajo peso al nacer (como marcador de malnutrición y retraso de crecimiento intrauterino) y la cardiopatía isquémica en la misma generación en la adultez.
Esta hipótesis se comprobó posteriormente en un estudio poblacional a gran escala3. En dicho estudio se realizó el seguimiento de 5.585 mujeres y 10.141 varones nacidos entre 1911 y 1930, cuyo peso de nacimiento y al año de edad se habían registrado en Hertfordshire (Inglaterra). Se apreció la correlación mencionada entre el peso al año de edad y al nacer, y la muerte por cardiopatía isquémica.
La teoría de Barker relaciona el bajo peso al nacer como expresión de un ambiente intrauterino desfavorable con la tendencia a padecer enfermedades en la edad adulta: cardiopatía isquémica, diabetes mellitus tipo 2, accidentes cerebrovasculares e hipertensión arterial. Dentro de un país, las tasas de morbimortalidad por dichas patologías tienden a ser más altas entre las personas más pobres en los lugares menos favorecidos, independientemente de influencias tales como el hábito de fumar, el empleo, el consumo de alcohol y el ejercicio.
Para explicar esta asociación, Barker recurre a una idea central en su teoría: la plasticidad en el desarrollo, fenómeno por el que un genotipo puede dar lugar a diferentes estados fisiológicos o morfológicos en respuesta a diferentes condiciones ambientales. Así, en palabras del propio autor, al referirse al desarrollo fetal, sostiene que «[…] hay un período crítico en el que un sistema es plástico y sensible al medio ambiente, seguido por la pérdida de la plasticidad y la adquisición de una capacidad funcional fija. Para la mayoría de los órganos y sistemas el período crítico se produce en el útero. Esto es ventajoso en términos de evolución permitiendo la producción de fenotipos que se ajustan mejor a su entorno de lo que sería posible si el mismo fenotipo se produjera en todos los ambientes […]»4. El concepto fue recogido en la hipótesis del «fenotipo ahorrativo», que postula que en condiciones de una nutrición deficiente o desequilibrada se producen unas adaptaciones fetales, incluyendo la reducción del crecimiento somático, con el fin de sobrevivir. Estas adaptaciones inmediatas pueden alterar el fenotipo de manera que sea perjudicial en la vida adulta, lo que se asocia con un mayor riesgo de enfermedades crónicas como la diabetes tipo 2, la hipertensión y las enfermedades coronarias.
Barker creó escuela, y su teoría «Developmental Origins of Health and Disease» se fue expandiendo por todo el mundo. Dos destacados investigadores en este campo son Peter D. Gluckman y Mark A. Hanson. Su aportación al tema es la teoría del mismatch o del desajuste entre el ambiente esperado y aquél para el que se prepara el feto y lo que se encuentra al nacer5. La plasticidad en el desarrollo pretende la regulación fina de la expresión genética para producir un fenotipo que se ajuste bien al ambiente posterior previsto. Cuando este ambiente y el fenotipo se ajustan bien, el organismo permanecerá sano. Si hay un desajuste o mismatch, la habilidad del organismo para responder a retos del ambiente puede ser inadecuada, y el riesgo de enfermar aumenta. Así, el grado de desajuste determinará la susceptibilidad individual a la enfermedad crónica.
Con posterioridad, se ha hallado la base molecular que explica lo que hasta ese momento eran sólo unas ideas brillantes. Utilizamos el término epigenética6 para referirnos a los procesos biológicos que regulan cambios de la expresión genética sin alterar la secuencia de DNA, siendo de particular relevancia la metilación de dinucleótidos C-G en genes promotores y alteraciones en el empaquetamiento de DNA como consecuencia de alteraciones en la histona. El ambiente en el desarrollo puede inducir cambios epigenéticos. Los mecanismos epigenéticos como la metilación del ADN se pueden transmitir a las generaciones sucesivas.
Aportaciones procedentes del campo de la Nefrología (Brenner)
En el año 1985, Wadsworth et al. publicaron el primer trabajo que relaciona el peso al nacer con la presión arterial7. Estos autores valoraron la presión arterial en una cohorte de nacimiento de 5.362 sujetos a la edad de 36 años, y apreciaron una prevalencia de la hipertensión dos veces mayor en los varones que en las mujeres. Entre los parámetros valorados (mortalidad de sus padres, consumo de cigarrillos, factores sociales, masa corporal actual y peso al nacer), el peso al nacer presentaba correlación estadística, de tal forma que, a menor peso al nacer, mayores eran las cifras de presión arterial.
En 1988, Gennser et al. relacionaron el bajo peso al nacer con la susceptibilidad a padecer hipertensión arterial en la edad adulta8.
Ese mismo año, Barker et al., en colaboración con el Dr. J. Golding, analizaron este aspecto en una muestra nacional de 9.921 niños de 10 años de edad, nacidos en Gran Bretaña y seguidos desde el nacimiento9. La presión arterial se relacionó de forma inversamente proporcional al peso al nacer. La presión sistólica disminuía 0,80 mmHg por cada kilogramo de aumento en el peso al nacer.
Barry M. Brenner, también en el año 1988, postula a partir de observaciones clínicas que una masa nefronal disminuida puede producir hipertensión arterial por limitación en la excreción de sal10. Avanza, desde una perspectiva novedosa, la hipótesis de que la dotación de nefronas al nacer está inversamente relacionada con el riesgo de desarrollar hipertensión esencial en el período de adulto. Por primera vez se aplican al campo de la Nefrología las observaciones de Barker y la explicación científica de la relación entre el peso al nacer y la presión arterial en la adultez.
Otro aspecto novedoso de este autor es la descripción de la relación entre la masa nefronal global y, por ende, la superficie de filtración, y la susceptibilidad a padecer enfermedad renal crónica (ERC)11. En 1993 introduce en la clínica un término muy descriptivo: «oligonefropatía congénita», es decir, una disminución de la dotación nefronal individual presente ya en el momento del nacimiento, y lo relaciona con la hipertensión arterial y el riesgo de ERC en la edad adulta12,13.
En una excelente revisión de la ERC y de los factores de progresión, ya incluye el bajo peso al nacer como factor iniciante de ERC14.
Prueba de la relevancia del tema, en la última edición del libro Brenner and Rector´s The Kidney dedica un capítulo entero a este tema15.
Conocimiento de la nefrogénesis
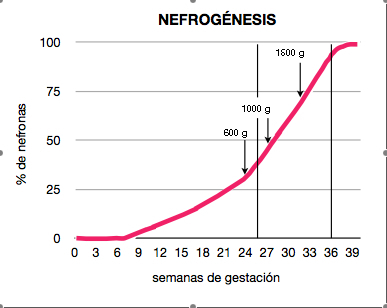
La nefrogénesis –riñón definitivo o metanefros– comienza en la novena semana de gestación, y se extiende hasta la 36. Se inicia a partir de la yema ureteral con sucesivas dicotomizaciones o ramificaciones en cuyo extremo se localiza el blastema metanéfrico, con el que interactúa. Algunas de estas células mesenquimales inician una transición mesénquimo-epitelial que formará la mayoría del epitelio tubular. Tras la formación de vesículas y corpúsculos alargados en forma de coma, el extremo distal se une al brote ureteral y el proximal es invadido por células endoteliales inmaduras que inician la glomerulogénesis y dan lugar a las nefronas. Al realizar el estudio morfológico, se aprecia que las nuevas nefronas/glomérulos se colocan en capas, de tal forma que las nuevas se van situando en capas externas y las antiguas van quedando en regiones más profundas. El 60% de las nefronas se forman en el tercer trimestre de gestación16, dando lugar a 9 o 10 capas de glomérulos visibles en las preparaciones histológicas (figura 1). La dotación o masa nefronal que se alcance en ese momento será aquélla con la que el individuo afrontará el resto de su vida. El riñón fetal en desarrollo es sensible a la masa corporal fetal, de tal forma que el tamaño renal al nacer y el peso están íntimamente relacionados. El peso al nacer es la pista más valiosa de la masa nefronal total.
En el año 2004, María Rodríguez et al. publicaron un trabajo acerca de la nefrogénesis/glomerulogénesis en el RN pretérmino y su expresión patológica16. Gracias a este trabajo, sabemos que el proceso puede continuar en la vida extrauterina a lo largo de 40 días siempre que el ambiente que rodea al RN y su situación clínica sean óptimos. Esta patóloga introduce por primera vez el concepto de «oligonefropatía de la prematuridad», que sería una forma especial de oligonefropatía producida por una detención precoz del proceso de nefrogénesis extrauterina. Este concepto tiene una extraordinaria importancia por lo que se refiere a su aplicación en la clínica diaria. Es labor del neonatólogo y del nefrólogo infantil proporcionar al RN las condiciones óptimas para que la nefrogénesis continúe, procurando una situación hemodinámica buena y evitando fármacos nefrotóxicos, entre los cuales los más representativos son los antiinflamatorios no esteroideos (AINE), como el ibuprofeno o la indometacina, y los aminoglucósidos.
Integración de estas tres aportaciones teóricas
Estas tres aportaciones realizadas inicialmente desde un punto de vista teórico se han ido comprobando en el campo de la clínica con el paso de los años, y nos hacen pensar que, al menos desde un punto de vista teórico, el RN de bajo peso, tras una gestación a término o pretérmino, constituye un grupo de riesgo para padecer ERC. Así, relacionando los tres campos de conocimiento, estamos en condiciones de definir una entidad nosológica propia: la oligonefropatía neonatal por detención de la nefrogénesis. Ésta excluye el daño renal por patología urológica y las displasias renales de causa genética. Puede ser de dos tipos, el primero de los cuales es la congénita: nace ya con la entidad. Se trata de pacientes que han completado el período de nefrogénesis intraútero pero de forma insuficiente o patológica, porque se ha ralentizado o frenado. La causa reside en un medio ambiente intrauterino desfavorable, secundario a una desnutrición materna o a anomalías en la unidad feto-placentaria. El segundo tipo es la adquirida en el período perinatal: nace de forma prematura en plena etapa de nefrogénesis activa. Si las condiciones que le rodean son óptimas, podrá completar seis semanas de nefrogénesis extrauterina. Incluso así, persisten dudas sobre el hecho de que un RN extremadamente pretérmino, nacido en la semana 24-25 de gestación (límite actual de la viabilidad), pueda completar la nefrogénesis, puesto que el período de generación de nefronas abarcaría hasta la semana 30-31, quedando por delante 4-5 semanas de detención de este proceso. Además, debería estar en un medio ambiente óptimo y, sin embargo, en muchas ocasiones una prematuridad tan extrema va asociada a alteraciones fisiológicas graves con inestabilidad hemodinámica, sepsis e insuficiencia respiratoria que hacen necesaria la ventilación mecánica, drogas inotrópicas, aminoglucósidos, AINE y vancomicina, lo que entorpece este proceso.
Posteriormente, esta entidad tiene una evolución similar a otras que cursan con un déficit de masa nefronal; sabemos que los mecanismos de adaptación darán lugar a una sobrecarga hemodinámica glomerular y a una hiperfiltración en las nefronas remanentes, perpetuando el proceso hiperfiltración-hipertensión arterial-proteinuria-esclerosis glomerular, que desembocará en una ERC.
Desde el punto de vista patológico, Hodgin y D’Agati han descrito la anomalía histológica propia de este mecanismo patogénico que es la glomeruloesclerosis segmentaria y focal (GSSF) en seis pacientes prematuros de muy bajo peso al nacer (menos de 1.500 g)17. Todos presentaban esta entidad y ausencia de otros factores de riesgo para GSSF secundaria a una media de edad de 32 años.
ACERCAMIENTO PRÁCTICO
En los últimos años se han publicado en la literatura médica varios artículos de evaluación renal a pacientes de bajo peso al nacer o prematuros. En ellos, se valoran aspectos como la función renal (filtrado glomerular, función tubular, microalbuminuria), el tamaño renal y la tensión arterial.
Función renal
De los últimos años (1992-2010), destacamos 10 artículos acerca de la valoración de la función renal en relación con el peso al nacer o la prematuridad. Estos trabajos valoran el filtrado glomerular, parámetros de función tubular y la medición de la microalbuminuria.
La población de estudio es heterogénea: RN de menos de 1.500 g frente a un grupo de control de RN a término; RN con menos de 32 semanas de gestación frente a RN a término (con subgrupos de peso adecuado a la edad gestacional [AEG] y pequeños para la edad gestacional [PEG]; RN de menos de 1.000 g frente a RN a término; RN (a término o pretérmino) PEG frente a AEG.
La edad a la que se hace la valoración oscila entre los 6 y los 30 años, y los hallazgos más destacables son los siguientes:
Valoración del filtrado glomerular18,20-28
De los diez artículos en los que se valora este aspecto, sólo en tres se encuentran diferencias significativas desde el punto de vista estadístico, sin repercusión clínica y con valores siempre en el rango de la normalidad.
-En un estudio en RN con un peso por debajo de los 1.000 g frente a un grupo control de nacidos a término y valorados a los 6-12 años de edad, se aprecia una creatininemia mayor en el grupo de estudio (0,62 ± 0,1 frente a 0,53 ± 0,1 mg/dl) y un filtrado glomerular estimado por la fórmula de Schwarz menor (117 ± 17 frente a 131 ± 17 ml/min/1,73 m2).21
- En una muy amplia cohorte de 7.457 niños seguidos desde el período neonatal, el Nord Trøndelag Health Study (HUNT) valora la relación entre el peso al nacer y el filtrado glomerular a los 20-30 años de edad24. El aclaramiento de creatinina disminuía 4,0 ml/min en varones y 2,9 ml/min en mujeres por cada descenso en una desviación estándar del peso al nacer. El efecto era menos consistente en mujeres en comparación con varones.
-En una cohorte de 50 pacientes nacidos antes de la semana 30 de gestación, con un peso de menos de 1.000 g, en los que se valora el filtrado glomerular por aclaramiento de inulina a los 7,6 años de media, se aprecia que los que tienen un retraso de crecimiento intrauterino o extrauterino presentan un peor filtrado comparado con los que tienen un crecimiento intrauterino y extrauterino apropiado: 107 frente a 125 ml/min/1,73 m2. El filtrado glomerular medio fue de 112 ml/min/1,73 m2, y ningún paciente presentaba insuficiencia renal26.
Valoración de la función tubular18,19,21,27-29
Seis artículos valoran este aspecto, todos ellos en prematuros de menos de 32 semanas o con un peso inferior a los 1.500 g. Los dos primeros artículos de la literatura que valoran la función tubular del RN prematuro en edad escolar son españoles:
- En el artículo pionero (Monge et al., Santa Cruz de Tenerife) se incluyen RN con peso al nacer por debajo de los 1.500
g. Estos autores encuentran datos de disfunción tubular en el control realizado en edad preescolar/escolar hasta en un 65% de los pacientes. Destaca una disminución de la capacidad de excreción urinaria de amonio tras el estímulo con furosemida (38%), hipercalciuria (26%), hipocitraturia (24%) y un aumento de la excreción urinaria de Nacetilglucosaminidasa (NAG)19.
-En el segundo estudio (Rodríguez-Soriano et al., Bilbao), se encuentran anomalías en el manejo tubular de fosfatos e hipercalciuria21.
-Posteriormente, todos los artículos que valoran esta cuestión aprecian valores de calciuria patológicos de forma significativa, que oscila entre un 17 y un 26% de los pacientes, mientras que otro artículo encuentra anomalías en el manejo tubular de fosfatos en edad escolar29.
Microalbuminuria18,20-23,25-28
Este aspecto nefrológico se valora en nueve artículos. Sólo en dos de ellos se encuentra una incidencia aumentada de microalbuminuria patológica:
- RN con peso al nacer por debajo de 1.500 g, valorados a la edad de 6,3-8,2 años. El 8,3% de los pacientes presentaban microalbuminuria patológica, factor que se relacionó con un episodio de hipotensión en período perinatal, así como con el Z-score del peso a los 12 meses de edad y con el incremento de peso a los 6 y 12 meses de edad corregida23.
-En una cohorte de 50 pacientes nacidos antes de la semana 30 de gestación, con un peso inferior a los 1.000 g, los niños con displasia broncopulmonar presentaban una microalbuminuria significativamente mayor26.
Conclusiones sobre la valoración de la función renal
La evaluación del filtrado glomerular en los primeros 20-30 años de vida es normal. La mayoría de estudios publicados no encuentran diferencias significativas entre la población estudiada y un grupo control, excepto en el caso en que se estudien RN extremadamente prematuros (peso por debajo de 1.000 g), en el que dos artículos encuentran diferencias significativas desde el punto de vista estadístico, pero no clínico. La edad media de valoración fue entre 6 y 12 años21,26. En una amplísima serie de RN también se pudo relacionar el Z-score de peso con el filtrado glomerular24.
La incidencia de hipercalciuria es superior a lo normal en los prematuros que pesan menos de 1.500 g al nacer.
La microalbuminuria es normal.
Tamaño y morfología renal
En los últimos años, destacan ocho artículos acerca de la valoración del tamaño y las características ecográficas renales en relación al peso al nacer o a la prematuridad.
La población de estudio es heterogénea: RN con un peso por debajo de 1.500 g frente a un grupo de control de RN a término; RN de menos de 32 semanas de gestación frente a RN a término (con subgrupos de AEG y PEG); RN con un peso inferior a los 1.000 g frente a RN a término; RN (a término o pretérmino) PEG frente a AEG; RN arborígenes australianos; RN pretérmino PEG frente a AEG.
Estos estudios realizan una valoración a largo plazo, entre los 5 y 20 años18,19,21-23,25-27,30.
Los hallazgos más destacables son:
-Sólo en tres de los ocho artículos mencionados hay anomalías renales en el control ecográfico, mientras que el resto son normales.
Las anomalías encontradas son:
-Aumento de la incidencia de hiperecogenicidad renal de patrón cortical en el control en la edad preescolar/escolar de un grupo de RN con un peso de menos de 1.500 g. en un 18% de la muestra y un 9% de nefrolitiasis19.
- En una población especial como la de los aborígenes australianos, con una alta incidencia de RN de bajo peso (19%) y
ERC, se apreció que el volumen renal en pacientes de bajo peso al nacer frente a un grupo control de peso normal fue
menor de forma significativa30.
- En RN pretérmino de menos de 30 semanas y con un peso al nacer por debajo de 1.000 g, el control ecográfico a los 7,6 años fue menor que en el grupo control26.
Conclusión: la valoración morfológica renal, incluyendo el tamaño renal, es normal. De nuevo, el grupo de pacientes con un peso inferior a los 1.000 g puede presentar un riesgo más elevado.
Tensión arterial
Tensión arterial clínica
En ocho artículos se valora la tensión arterial clínica, en edades que oscilan entre los 5 y 20 años21,23,26,27,33-34. Cabe destacar:
-Dos artículos valoran a los RN pretérmino con un peso de menos de 1.000 g21 o de menos de 1.500 g23 frente a un grupo control de RN a término, en edad escolar (6-12 años), sin encontrar diferencias en las cifras de presión arterial.
-Otro trabajo presenta a los RN extremadamente prematuros (menos de 30 semanas de gestación o con un peso al nacer por debajo de 1.000 g) en su control a los 7,6 años con hipertensión borderline26.
-Destacamos otros tres artículos: el primero, por el tiempo de evolución hasta la evaluación (20 años), realizado a RN con un peso inferior a los 1.500 g frente a un grupo control de RN a término adecuados a la edad gestacional31. Se encontraron diferencias entre ambos grupos en la presión arterial sistólica (PAS). Los otros dos artículos son destacables por el amplio número de participantes. Uno es el estudio inglés basado en el Health Survey for England, que engloba a 15.639 niños (población general) de los que se conocía la edad gestacional y el peso al nacer. A los 15 años, valoraron la tensión arterial, comparando los resultados de acuerdo con el Z-score de peso al nacer y el Z-score de peso a los 15 años32. Se apreció una relación entre el peso al nacer y la presión arterial. Esta relación se potenciaba al añadir en el modelo estadístico el peso a los 15 años. Sin embargo, en el otro estudio que contaba con una amplia población de sujetos, los investigadores estadounidenses pusieron de manifiesto que los niños pequeños para la edad gestacional no presentaban más riesgo de hipertensión que aquéllos con una edad gestacional adecuada, si bien el estudio se hizo a los siete años en contraposición con los 15 años del estudio anterior33. Este trabajo se llevó a cabo con datos del US Collaborative Perinatal Project, que contaba con una cohorte de 29.973 niños. Todos eran RN a término. Por otra parte, se apreció un mayor riesgo de hipertensión arterial en aquellos casos con incremento en el percentil de peso en esos siete años.
Monitorización ambulatoria de la presión arterial (MAPA)
Destacamos once artículos en los que se aplica esta técnica para valorar la relación del peso al nacer con la presión arterial30,31,32,38,40,43 o, más específicamente, la p
Destacamos 11 artículos en los que se aplica esta técnica para valorar la relación del peso al nacer con la presión 28,35-39 o, más específicamente, la prematuridad con la presión arterial20,40-43 en edades posteriores de la vida.
El primer trabajo de la literatura que aplica la MAPA para relacionar el peso al nacer con la presión arterial fue el de Lurbe et al. en el año 199635. Valorados 336 niños nacidos a término cuando tenían entre 6 y 16 años de edad, hallaron que el peso al nacer estaba relacionado de forma inversa con la PAS durante el período de actividad, incluso en ausencia de retraso de crecimiento intrauterino, y que esta influencia se incrementaba con la edad. En el año 2001 ampliaron la muestra a 630 niños de 4 a 18 años, todos ellos nacidos a término, relacionando el menor peso al nacer con valores de presión arterial más altos36. La variabilidad expresada como la desviación estándar sobre la media también era más alta en este grupo. Asimismo, se apreció una relación entre el peso en el momento de la valoración y la PAS a lo largo de las 24 horas del registro.
En el año 2009, este mismo grupo valora la influencia combinada del peso/índice de masa corporal (IMC) en el momento de la valoración con el peso al nacer en la presión arterial39. Al valorar a 442 pacientes entre los 10 y 12 años distribuidos en grupos, constataron que la presión arterial clínica, los valores medios de MAPA 24 horas y la PAS de día y de noche eran mayores en el grupo que se asociaba a bajo peso al nacer y eran obesos frente al grupo de peso normal al nacimiento y no obeso.
También en 2009, en 34 pacientes con bajo peso al nacer frente a un grupo control de nacidos con peso normal y evaluados a los 8-11 años, se describe la relación del peso al nacer con un incremento de la presión arterial diastólica (PAD) 24 horas, la PAD en actividad, la PAS y la PAD nocturnas, y menor descenso nocturno de la PAS y la PAD38.
Por el contrario, dos estudios no encontraron una relación significativa entre el peso al nacer y los valores obtenidos por MAPA: un estudio prospectivo con caso control32 publicado en 2002 a la edad de 12 años y otro publicado recientemente28 valoraron a los pacientes entre los 6 y los 12 años. Ambos comparan dos grupos de RN a término y PEG frente a AEG sin encontrar diferencias.
En cuatro artículos se aplica la técnica específicamente en pacientes prematuros, hallando en todos ellos anomalías. El parámetro afectado fue la PAS. Así, ordenados por año de publicación, quedarían de la siguiente forma:
-PAS media más alta en actividad para RN con menos de 33 semanas de gestación (mujeres) al evaluarlos a los 26 años40.
-PAS nocturna mayor y patrón no dipper en RN pretérmino de menos de 37 semanas frente a un grupo control de nacidos a término al evaluarlos a los 5-17 años41.
-RN de menos de 1.500 g con PAS a lo largo de 24 horas mayor al evaluarlos a los 18-27 años42.
-RN de menos de 32 semanas con PAS en actividad mayor al evaluarlos a los 20 años43.
Conclusión: Las cifras de tensión arterial se relacionan de forma inversamente proporcional con el peso al nacer. Las diferencias entre los grupos comparados alcanzan la significación estadística, aunque la trascendencia clínica en el período de tiempo aplicado es mínima.
Integración de las aplicaciones prácticas
Si en el epígrafe anterior (teoría) hablábamos de la definición, la etiología, la patogenia y la patología de la entidad, después de analizar las publicaciones de seguimiento, podemos proseguir con la clínica y la historia natural de la enfermedad.
A lo largo de la edad pediátrica no hay manifestaciones clínicas de enfermedad renal. El filtrado glomerular es normal y se aprecia una mayor incidencia de hipercalciuria sin nefrolitiasis asociada, así como anomalías en el manejo renal de fosfatos en los pacientes con un peso al nacer inferior a los 1.000 g. No hay mayor incidencia de microalbuminuria patológica. En la mayoría de pacientes, los estudios ecográficos no muestran anomalías en el tamaño renal en estudios en edad escolar hasta los 12 años. Las cifras de presión arterial son superiores a las de la población de control, aunque dentro del rango de la normalidad.
Los artículos de seguimiento publicados a más largo plazo se realizan a 20-30 años. No sabemos qué pasará en seguimientos más prolongados, cuando estas cohortes de prematuros alcancen la edad de 40-50 años. Los datos hasta la fecha indican que se trata de una población de riesgo de ERC, sobre todo el subgrupo de pacientes con peso al nacer por debajo de 1.000 g.
PAUTAS DE ACTUACIÓN
Nuestra labor como nefrólogos incluye:
Prevención
En este tema, la tarea preventiva adquiere una gran importancia. Es una tarea importante y difícil de llevar a cabo, en muchas ocasiones porque requiere la concienciación del profesional. La formación del especialista de Nefrología y Neonatología está enfocada al diagnóstico y tratamiento de la patología una vez que se ha producido, y en muchas ocasiones olvidamos la importancia del mantenimiento del estado de salud para procurar que el paciente quede en esta parcela y no transite al estado de enfermedad. De igual forma, la mayoría de los recursos económicos se invierten en el diagnóstico y tratamiento de enfermedades y, en menor proporción, en tareas preventivas.
En el campo preventivo, podemos actuar de la siguiente forma:
Período gestacional
- Mejorar las condiciones nutricionales. Intentar que los RN tengan un peso adecuado a la edad.
- Disminuir la tasa de partos pretérmino.
- Procurar el acceso a un adecuado control y nutrición materna durante la gestación. La actuación en este campo precisa de políticas sociales y sanitarias que se van más allá de nuestra labor médica y que implica cambios a nivel de salud poblacional y socioeconómicos, ya que el modo de vida va muy ligado a la nutrición materna.
Período neonatal
- Intentar que durante el período de nefrogénesis activa las condiciones extrauterinas sean óptimas.
- Perfeccionar la nutrición extrauterina.
- Evitar las situaciones favorecedoras de daño renal agudo.
- Evitar el uso de aminoglucósidos y AINE.
Es ésta una tarea apasionante, ahora que tan de moda está la terapia regenerativa y, en el futuro, la terapia con células madre. Los profesionales que atendemos a estos pacientes podemos ir más allá para favorecer y no entorpecer la propia terapia generativa del organismo en desarrollo.
Diagnóstico y tratamiento
En el apartado anterior se hacía hincapié en la importancia de la labor preventiva, puesto que de esta forma el RN no presentaría un déficit en la masa nefronal. Aún así, incluso en una situación idónea, los grandes prematuros tendrían complicado completar la nefrogénesis de la misma forma que en una gestación a término sin patología. Por ello, sabiendo que se trata de un grupo de riesgo para el desarrollo de ERC, se debe poner en marcha un programa de detección precoz de esta patología. La técnica de detección es sencilla. Basta con un control clínico adecuado, la realización de tira reactiva de orina, un índice microalbúmina/creatinina en micción aislada y el registro de la tensión arterial. La mayoría de estos pacientes no presentan ningún problema en la infancia, y las pruebas de despistaje suelen ser normales. Por todo esto, la labor de detección debe integrarse en el programa de salud pediátrico, por lo que se refiere al seguimiento del paciente de menos de 1.500 g por parte del pediatra de cabecera. Los controles pediátricos deben ser rutinarios y un poco más exhaustivos. No obstante, el paciente no ha de tener conciencia de enfermedad para «no crear enfermos».
Es muy importante insistir en la importancia de unos buenos hábitos de vida que incluyan la práctica regular de ejercicio y una dieta cardiosaludable, evitando el sobrepeso.
En el caso de encontrar alguna anomalía en estos controles, se ha de derivar al paciente a la consulta de Nefrología. Se iniciarán las medidas de renoprotección, incluyendo el uso de inhibidores de la enzima conversora de la angiotensina/antagonistas de los receptores de angiotensina II y el control del riesgo vascular.
Cuando se alcanza una situación de daño renal avanzado, realmente se trata de un fracaso en nuestra labor preventiva. Si esto sucede, nos estaríamos quedando sólo en la restringida parcela médica que abarca el diagnóstico y el tratamiento de una patología ya instaurada.
PUNTOS CLAVE
1. Los RN de muy bajo peso en el momento del nacimiento (menos de 1.500 g) son un grupo de riesgo de padecer ERC
2. Durante el período de la infancia y la adolescencia, los pacientes permanecen asintomáticos.
3. La principal tarea preventiva corresponde a los neonatólogos y nefrólogos infantiles, para asegurar un ambiente extrauterino favorable para la nefrogénesis.
4. Es necesario el seguimiento a largo plazo de esta población desde el punto de vista nefrológico.
Figura 1. Nefrogénesis
10811_16025_12877_es_tabla_10811_copy1.doc
Tabla 1. Clasificación del recién nacido (RN)