La obesidad se ha convertido en una epidemia mundial, y se ha proyectado que su prevalencia se incrementrá en un 40% en la próxima década. Esta creciente prevalencia supone implicaciones tanto para el riesgo de desarrollo de diabetes y enfermedades cardiovasculares como para el desarrollo de enfermedad renal crónica. Un elevado índice de masa corporal es uno de los factores de riesgo más importantes para el desarrollo de enfermedad renal crónica. En individuos afectados por la obesidad, tiene lugar una hiperfiltración compensatoria necesaria para alcanzar la alta demanda metabólica secundaria al aumento del peso corporal. El incremeno de la presión intraglomerular puede generar daño renal y elevar el riesgo de desarrollar enfermedad renal crónica a largo plazo. La incidencia de glomerulopatía asociada a obesidad se ha incrementado 10 veces en los últimos años. Así mismo se ha demostrado que la obesidad es un factor de riesgo para el desarrollo de nefrolitiasis y un número de neoplasias, incluyendo cáncer renal. Este año, el Día Mundial del Riñón promueve la educación acerca de las consecuencias nocivas de la obesidad y su asociación con la enfermedad renal, abogando por un estilo de vida saludable y la implementación de políticas publicas de salud que promuevan medidas preventivas alcanzables.
En 2014, más de 600 millones de adultos mayores de 18 años, en todo el mundo, presentaban obesidad. La obesidad es un importante factor de riesgo para el desarrollo de enfermedad renal. Incrementa el riesgo de desarrollar los principales factores de riesgo de la enfermedad renal crónica (ERC), como son la diabetes y la hipertensión, y tiene un impacto directo en el desarrollo de ERC y enfermedad renal crónica terminal (ERCT). En individuos afectados por la obesidad, se produce un mecanismo de hiperfiltración, probablemente compensatorio, para satisfacer la alta demanda metabólica asociada al aumento del peso corporal. El aumento de la presión intraglomerular puede generar una lesión renal estructural e incrementar el riesgo de desarrollar ERC a largo plazo.
La buena noticia es que tanto la obesidad como la ERC asociada son en gran medida prevenibles. La educación y la concienciación de los riesgos que genera la obesidad y la adopción de un estilo de vida saludable que incluya dieta adecuada y ejercicio pueden ayudar a prevenir la obesidad y el daño renal. El presente artículo revisa la asociación de obesidad y enfermedad renal con ocasión del Día Mundial del Riñón 2017.
Epidemiología de la obesidad en niños y adultosEn las últimas 3 décadas, la prevalencia de adultos con sobrepeso y obesidad (índice de masa corporal [IMC]≥25kg/m2) se ha incrementado sustancialmente en todo el mundo1. En EE. UU., la prevalencia de obesidad ajustada por edad en 2013–2014 fue del 35% en hombres y del 40,4% en mujeres2. El problema de la obesidad también afecta a los niños. En EE. UU. en 2011–2014, la prevalencia de obesidad fue del 17% y la de obesidad extrema del 5,8%, en niños de 2 a 19 años. El aumento en su prevalencia es una preocupación mundial3,4, ya que se prevé un aumento global de un 40% en la próxima década. Los países de bajos y medianos ingresos han mostrado evidencia de la transición nutricional, al pasar del peso normal al sobrepeso y obesidad, como sucedió hace algunas décadas en partes de Europa y EE. UU.5. Esta creciente prevalencia tiene implicaciones tanto para las enfermedades cardiovasculares como para la ERC; el alto IMC es uno de los principales factores de riesgo para el desarrollo de ERC6,7.
La mayoría de las definiciones de obesidad están basadas en el IMC (peso [kg] dividido por el cuadrado de la altura [metros]). Un IMC entre 18,5 y 25kg/m2 es considerado por la Organización Mundial de la Salud como peso normal, entre 25 y 30kg/m2 como sobrepeso, y un IMC > 30kg/m2 como obesidad. A pesar de que el IMC es fácil de calcular, solo nos proporciona una pobre estimación de la distribución de la grasa corporal, ya que individuos musculosos o aquellos con más tejido graso subcutáneo pueden tener un IMC tan alto como aquellos individuos con mayor masa grasa intraabdominal (visceral). Este último tipo de IMC elevado está asociado con un riesgo sustancialmente mayor de desarrollar enfermedad metabólica y cardiovascular. Los parámetros alternativos para medir de forma más precisa la grasa visceral incluyen la circunferencia de la cintura (CC) y el índice cintura/cadera (ICC) > 102cm y 0,9, respectivamente para hombres, y> 88cm y > 0,8 para mujeres. El ICC ha demostrado ser superior al IMC para la correcta clasificación de la obesidad en ERC.
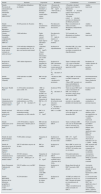
Asociación de obesidad con ERC y otras complicaciones renalesNumerosos estudios poblacionales han demostrado asociación entre obesidad y el desarrollo y progresión de ERC (tabla 1). Un mayor IMC se asocia con la presencia8 y desarrollo9–11 de proteinuria en individuos sin enfermedad renal. Además, en numeroros estudios con gran población de pacientes, un mayor IMC parece asociarse con la presencia8,12 y desarrollo de una menor TFG9,10,13, con una mayor pérdida de la TFG estimada con el tiempo14 y con aumento en la incidencia de ERCT15–18. Un mayor IMC, con obesidad de clase ii en adelante, se ha asociado con una progresión más rápida de la ERC en pacientes con ERC preexistente19. Los pocos estudios que han evaluado la relación entre la obesidad abdominal usando ICC o CC con la ERC describen una asociación entre mayor circunferencia abdominal y albuminuria20, disminución de la TFG8 o incidencia de ERCT21, independientemente del nivel del IMC.
Estudios que evalúan la asociación de obesidad con diversos resultados de ERC
| Estudio | Pacientes | Exposición | Resultados | Conclusiones | Comentarios |
|---|---|---|---|---|---|
| Estudio: Prevención de enfermedad renal terminal y enfermedad vascular (PREVEND)8 | 7.676 individuos holandeses sin diabetes | IMC elevado (sobrepeso y obesidada), y distribución obesidad central (índice cintura-cadera) | −Presencia de albuminuria 30-300mg/24h −TGF elevada y disminuida | −Obesidad+ obesidad central: mayor riesgo de albuminuria −Obesidad±obesidad central: mayor riesgo de TFG elevada −Obesidad central±obesidad asociada con diminución del filtrado glomerular | Análisis transversal |
| Estudio multinacional en pacientes hipertensos ambulatorios20 | 20.828 pacientes de 26 países | IMC y circunferencia de cintura | Prevalencia de albuminuria por tira reactiva | Mayor circunferencia de cintura asociada a albuminuria, independiente del IMC | Análisis transversal |
| Cohorte Framingham tomografía computarizada multicorte (MDCT)22 | 3.099 individuos | Tejido adiposo visceral (TAV) y tejido adiposo subcutáneo (TAS) | Prevalencia de RACU > 25mg/g en mujeres y > 17mg/g en hombres | TAV asociado con albuminuria en hombres, pero no en mujeres | Análisis transversal |
| Estudio CARDIA (Desarrollo de riesgo arterial coronario en adutos jóvenes)11 | 2.354 individuos habitantes de una comunidad entre 28 y 40 años con función renal normal | −Obesidad (IMC > 30kg/m2) −Dieta y factores relacionados con el estilo de vida | Incidencia de oligoalbuminuria | Obesidad (OR 1,9) y dieta no saludable (OR 2,0) asociadas con aparición de oligoalbuminuria | Bajo número de eventos |
| Programa de detección y seguimiento de hipertensión10 | 5.897 adultos hipertensos | Sobrepeso y obesidad por IMCa contra IMC normal | Incidencia de ERC (proteinuria 1+ o mayor en examen general de orina o una TGFe < 60mL/min/1,73 m2) | Tanto el sobrepeso (OR 1,21) como la obesidad (OR 1,40) se asociaron con aparición de ERC | Resultados sin cambios después de excluir a los pacientes diabéticos |
| Estudio Framingham Offspring9 | 2.676 individuos sin ERC estadio 3 | IMC elevado vs. normala | −Incidencia, ERC estadio 3 −Incidencia de proteinuria | −Mayor IMC no asociado con ERC3 después del ajuste −Mayor IMC asociado con mayor probabilidad de aparición de proteinuria | Predominantemente pacientes de raza blanca; limitación geográfica |
| Physicians’ Health Study13 | 11.104 hombres inicialmente sanos en EE. UU. | −IMC en quintiles −Aumento del IMC con el tiempo (vs. IMC estable) | Incidencia TFGe < 60mL/min/1,73 m2 | Tanto un mayor IMC basal como el incremento del IMC con el tiempo se asociaron a mayor riesgo de desarrollar ERC | Exclusivamente hombres |
| Cohorte de la Administración de Veteranos de los Estados Unidos14 | 3.376.187 veteranos estadounidenses con TFGe basal≥60mL/min/1,73 m2 | Categorías de IMC de < 20 a > 50kg/m2 | Rápido deterioro de la función renal (descenso negativo > 5mL/min/1,73 m2 en la TFG) | IMC > 30kg/m2 asociado con una rápida pérdida de la función renal | Asociaciones más acentuadas en personas mayores |
| Estudio nacional basado en la población de Suecia12 | 926 suecos con ERC moderada/avanzada comparados con 998 controles | IMC ≥ 25 contra < 25kg/m2 | ERC vs. no ERC | Mayor IMC asociado con 3 veces más riesgo de desarrollar ERC | −Mayor riesgo en diabéticos, pero aún significativo en no diabéticos −Análisis transversal |
| Estudio poblacional a nivel nacional en Israel17 | 1.194.704 hombres y mujeres adolescentes evaluados para el servicio militar | IMC elevado (sobrepeso y obesidad) vs. IMC normala | Incidencia de ERCT | Tanto el sobrepeso (HR 3,0) como la obesidad (HR 6,89) se asociaron con mayor riesgo de ERCT | Fuerte asociación para ERCT secundaria a diabetes, pero también significativa para ERCT no diabética |
| Estudio de salud Nord-Trøndelag (HUNT-1)15 | 74.986 adultos noruegos | Categorías de IMCa | Incidencia de ERCT o muerte de causa renal | IMC > 30kg/m2 asociado con peores resultados | Asociación no observada en individuos con TA < 120/80mmHg |
| Estudio de detección en la comunidad de Okinawa (Japón)16 | 100.753 individuos mayores de 20 años | IMC en cuartiles | Incidencia de ERCT | Mayor IMC se asoció con mayor riesgo de desarrollo de ERCT en hombres mas no en mujeres | IMC promedio más bajo en Japón comparado con otros países occidentales |
| Cohorte de la Administración de Veteranos de los Estados Unidos19 | 453.946 veteranos estadounidenses con TFGe basal < 60ml/min por 1,73 m2 | Categorías de IMC de < 20 a > 50kg/m2 | −Incidencia de ERCT −Duplicación de creatinina sérica −Descenso de la TGFe | Obsesidad moderada y severa asociada con peores resultados renales | Asociaciones presentes pero débiles en pacientes con ERC avanzada |
| Kaiser Permanente California del Norte18 | 320.252 adultos con y sin ERC basal | Sobrepeso, clase i, ii y obesidad extrema; contra IMC normala | Incidencia de ERCT | Riesgo lineal elevado de ERCT asociado a IMC elevado | Asociación presente aún después del ajuste para DM, hipertensión y ERC basal |
| Estudio REGARDS (Razones de las diferencias geográficas y raciales en el evento cerebrovascular)21 | 30.239 individuos | IMC o circunferencia de cintura elevados | Incidencia de ERCT | −El IMC por arriba de lo normal no se asoció con ERCT después del ajuste por circunferencia de cintura −Mayor circunferencia de cintura asociada con ERCT | La asociación entre la circunferencia de la cintura y la ERCT fue significativa tras el ajuste de las comorbilidades, TFGe y grado de proteinuria basales |
DM: diabetes mellitus; ERC: enfermedad renal crónica; ERCT: enfermedad renal crónica terminal; HR: cociente de riesgo; IMC: índice de masa corporal; OR: razón de momios; RACU: razón albúmina/creatinina urinaria; TFGe: tasa de filtrado glomerular estimada.
Una mayor cantidad de tejido adiposo visceral medido por tomografía computarizada se ha asociado con una mayor prevalencia de albuminuria en hombres22. La asociación entre obesidad abdominal y pobres resultados clinicos renales, independientes del IMC, se ha descrito también con relación a mortalidad en pacientes con ERCT23 y trasplante renal24, lo que indica un papel directo de la grasa visceral en ello. En general, la asociación entre obesidad y los pobres resultados clínico renales persiste aun después de ajustarse a posibles mediadores de sus efectos cardiovascular y metabólico, como las cifras de tensión arterial elevadas y diabetes mellitus, lo que indica que la obesidad puede afectar en parte la función renal a través de mecanismos no relacionados con estas complicaciones.
Los efectos nocivos de la obesidad se extienden a otras enfermedades como el desarrollo de nefrolitiasis y neoplasias renales malignas. Un alto IMC se asocia con un aumento en la prevalencia25 e incidencia26,27 de nefrolitiasis. También la ganancia de peso corporal a través del tiempo y un mayor índice CC basal se han asociado con una mayor incidencia de nefrolitiasis27. La obesidad se asocia también con algunos tipos de neoplasias malignas, particularmente cáncer renal. En un estudio poblacional del Reino Unido, que incluyó 5,24 millones de individuos, el incremento en el IMC de 5kg/m2 se asoció con un riesgo mayor del 25% de desarrollo de cáncer renal, y atribuyó el 10% de todos los cánceres renales al exceso de peso28. Otro estudio que analizó la carga global de obesidad en la aparición de neoplasias estimó que un 17 y un 26% de todos los cánceres renales en hombres y mujeres, respectivamente, fueron atribuibles al exceso de peso29. La asociación entre obesidad y cáncer renal fue consistente tanto en hombres como en mujeres y entre poblaciones de diferentes partes del mundo, en un metaanálisis que incluyó datos de 221 estudios, de los cuales 17 evaluaron neoplasias renales30. Entre las neoplasias evaluadas en este último estudio, el cáncer renal tuvo el tercer lugar de riesgo más alto asociado con obesidad (riesgo relativo por cada 5kg/m2 de IMC de incremento: 1,24; IC 95%: 1,20-1,28; p<0,0001)30.
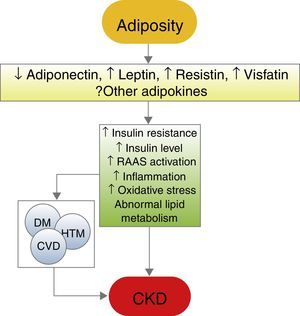
Mecanismos de acción subyacentes a los efectos renales de la obesidadLa obesidad resulta en una amplia gama de anomalías metabólicas complejas que influyen en las diversas enfermedades que afectan a los riñones. El mecanismo exacto a través del cual la obesidad puede empeorar o generar ERC es aún poco claro. El hecho de que la mayoría de los individuos obesos nunca desarrollen ERC, y que se clasifique hasta un 25% de la población obesa como «metabólicamente saludable», indica que el aumento de peso por sí solo no es suficiente para inducir daño renal31. Algunas de las consecuencias renales deletéreas de la obesidad pueden estar mediadas por ciertas condiciones comórbidas asociadas como la diabetes mellitus y la hipertensión; sin embargo, existen también efectos de la propia adiposidad que pueden impactar directamente sobre los riñones, inducidos por la actividad endocrina del tejido graso, mediante la producción, entre otros, de adiponectina32, leptina33 y resistina34 (fig. 1). Estos incluyen el desarrollo de inflamación35, estrés oxidativo36, metabolismo lipídico anormal37, activación del sistema renina–angiotensina-aldosterona38, incremento de la producción de insulina y mayor resistencia a la insulina39,40.
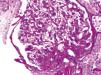
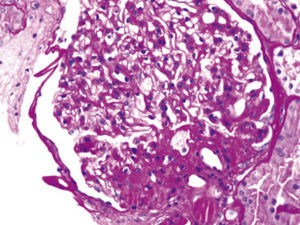
Estos diversos efectos dan lugar a cambios patológicos específicos en el riñón41, lo que podría expllicar el riesgo elevado de ERC mostrado por algunos estudios observacionales. Estos incluyen la acumulación ectópica de lípidos42 y aumento de los depósitos grasos en el seno renal43,44, el desarrollo de hipertensión glomerular e incremento de la permeabilidad glomerular generada por un estado de hiperfiltración, el cual se asocia al daño en la barrera de filtración glomerular45, y finalmente, el desarrollo de glomerulomegalia46 y glomeruloesclerosis focal y segmentaria41 (fig. 2). La incidencia de la llamada glomerulopatía asociada a obesidad se ha incrementado hasta 10 veces en el periodo comprendido entre 1986 y el año 200041. Es importante destacar que la glomerulopatía asociada a obesidad en ocasiones se presenta en conjunto con otros procesos fisiopatológicos propios de otras enfermedades o de la edad avanzada, perpetuando la generación de mayor lesión renal en pacientes con hipertensión47 o en ancianos14,39.
La obesidad se asocia también con una serie de factores de riesgo que contribuyen a la alta incidencia y prevalencia de nefrolitiasis. Un mayor peso corporal se asocia con menor pH urinario48, aumento de oxalato urinario49 y mayor excreción urinaria de ácido úrico, sodio y fósforo50. Las dietas ricas en proteínas y sodio pueden contribuir a la acidificación de la orina y a la disminución del citrato urinario, lo que también contribuye al riesgo de desarrollo de cálculos renales. La resistencia a la insulina, característica de la obesidad, puede predisponer al desarrollo de nefrolitiasis51 a través del impacto que genera en el intercambio tubular Na-H52, la amoniogénesis53 y la generación de un medio ácido54. Complicando aún más el panorama está el hecho de que algunas terapias de pérdida de peso aumentan el riesgo de desarrollo de cálculos renales. Por ejemplo, la cirugía gástrica puede generar un incremento sustancial en la absorción enteral de oxalato y aumentar el riesgo de nefrolitiasis55.
Los mecanismos que hay detrás del mayor riesgo de aparición de neoplasias renales en individuos obesos se encuentran poco claros. La resistencia a la insulina y, consecuentemente, la hiperinsulinemia crónica así como el incremento en la producción de factor de crecimiento similar a insulina de tipo 1 y numerosos efectos humorales secundarios complejos pueden ejercer efectos estimulantes en el crecimiento de varios tipos de células tumorales56. Más recientemente han surgido otras explicaciones adicionales, tales como las funciones endocrinas del tejido adiposo57, sus efectos en la inmunidad58 y la generación de un estado proinflamatorio con efectos complejos sobre el cáncer59,60.
Obesidad en pacientes con enfermedad renal avanzada: la necesidad de un enfoque matizadoTeniendo en cuenta la evidencia antes mencionada sobre los efectos abrumadoramente deletéreos de la obesidad en varios procesos patológicos, es un contrasentido que la obesidad se asocie a menores tasas de mortalidad en pacientes con ERC19,61 y ERCT62,63. Se han descrito asociaciones «paradójicas» similares en otras poblaciones, como en pacientes con insuficiencia cardiaca congestiva64, enfermedad pulmonar obstructiva crónica65, artritis reumatoide66 e incluso en pacientes de edad avanzada67. Es posible que el efecto aparentemente protector de un alto IMC sea el resultado de la imperfección del IMC como medida del grado de obesidad, en tanto que no distingue el efecto de la adiposidad y de otros tejidos no adiposos (músculo) sobre el IMC. En este sentido, los estudios que separaron los efectos de una mayor circunferencia de cintura de aquellos con mayor IMC demuestran una reversión en la asociación inversa con la mortalidad23,24. También se ha demostrado que una mayor masa muscular explica al menos algunos de los efectos positivos atribuidos al IMC elevado63,68. Sin embargo, existe evidencia que señala que mayores niveles de adiposidad, especialmente grasa subcutánea (no visceral), se asocian con mejores resultados en pacientes con ERCT62. Tales beneficios pueden estar presentes en pacientes que tienen una corta expectativa de vida, como la mayoría de los pacientes con ERCT69. De hecho, algunos estudios que han evaluado la asociación del IMC con sobrevida dependiente de tiempo en ERCT han demostrado un marcado contraste entre los efectos protectores a corto plazo y los efectos deletéreos a largo plazo de un mayor IMC70. Existen varios presuntos beneficios a corto plazo atribuibles a una mayor masa corporal, especialmente en individuos enfermos. Esto incluye el beneficio de un mejor estado nutricional típicamente observado en individuos obesos, que provee mejores reservas energético-proteicas frente a una enfermedad aguda, una mayor masa muscular con mayor capacidad antioxidante63, menores niveles plasmáticos circulantes de actina y mayores de gelsolina71, que se asocian con mejores resultados. Otras características hipotéticamente benéficas de la obesidad incluyen una mayor estabilidad hemodinámica con mejor respuesta al estrés, y mayor actividad simpática y del sistema renina–angiotensina72; mayor producción de adiponectina73 y receptores solubles del factor de necrosis tumoral alfa74 por el tejido adiposo, que neutralizan los efectos adversos del factor de necrosis tumoral alfa, y mejor unión de endotoxinas circulantes75 por los niveles más altos de colesterol observados en la obesidad y secuestro de toxinas urémicas por el tejido adiposo76.
Intervenciones potenciales para el manejo de la obesidadLa obesidad genera daño renal a través de mecanismos directos tales como la alteración en la síntesis de diversas citocinas en el tejido adiposo con potencial nefrotóxico, así como de forma indirecta al desencadenar la aparición de diabetes e hipertensión, 2condiciones que se encuentran entre los factores de riesgo más importantes para el desarrollo de ERC. Tal vez, debido a los beneficios observados en la supervivencia de los pacientes obesos con ERC, la prevalencia de ERCT aumentará tanto en EE. UU77. como en Europa78. Las estrategias para controlar la epidemia de ERC relacionada con la obesidad y contrarrestar la evolución a ERC en pacientes obesos representan una de las tareas más importantes que enfrentan los sistemas y administradores de salud, así como los nefrólogos de hoy en día.
La lucha contra la ERC a nivel poblacionalLa mayoría de las asociaciones en el ámbito de la nefrología, incluyendo la Sociedad Internacional de Nefrología (ISN), la Federación Internacional de Fundaciones Renales (IFKF), la Sociedad Europea de Nefrología (ERA-EDTA) y otras sociedades nacionales y regionales, han lanzado convocatorias destinadas a promover intervenciones de salud pública en las comunidades con el fin de prevenir y tratar la ERC en una etapa temprana. En los EE. UU., se puso en marcha el programa «Healthy People 2020», cuyo objetivo es la promoción y prevención en salud a 10 años y su meta principal, las enfermedades renales y la obesidad. La creación de programas de detección de pacientes obesos, en particular de aquellos con alto riesgo de desarrollar ERC (ej. individuos hipertensos o diabéticos obesos) y aquellos que reciben cuidados subóptimos, así como programas de información sobre los riesgos potenciales de desarrollo de ERC al que están expuestos son el primer paso hacia la generación de intervenciones en salud pública. Es prioritario encontrar evidencia de que las intervenciones actuales para reducción de riesgo de ERC en pacientes obesos son eficaces y reproducibles, con el fin de establecer las metas y los medios para la modificación de estos factores. Se requiere documentar de forma adecuada la información existente que explique el riesgo y los beneficios de las intervenciones de prevención primaria y secundaria en individuos obesos, así como la realización de nuevos estudios en esta población, para llenar los vacíos de conocimiento que aún existen. Finalmente, los programas de vigilancia para la monitorización de los avances en detección de individuos de riesgo y la efectividad de los programas de prevención que se implementan79 constituyen el tercer elemento fundamental para el establecimiento de planes eficaces de prevención de ERC a nivel poblacional.
En lugares como el Reino Unido se ha implementado un sistema exitoso de vigilancia del ERC80. Se lanzó una campaña para difundir y aplicar las guías K-DOQI de ERC en niveles de atención primaria dentro del Servicio Nacional de Salud. Esto aumentó progresivamente la adopción de estas guías clínicas y, además, gracias a los incentivos específicos otorgados a los médicos generales del Reino Unido para fomenter la detección de ERC, ha conducido a una mejora impresionante en temas de detección y manejo de la ERC, por ejemplo, un mejor control de la hipertensión y un mayor uso de bloqueadores de los receptores de la enzima convertidora de angiotensina80. Este sistema puede servir como una plataforma para mejorar la prevención de la ERC relacionada con la obesidad. Las campañas encaminadas a reducir la carga de obesidad se encuentran en el centro del escenario mundial y están ampliamente recomendadas por la Organización Mundial de la Salud, y se espera que ayuden a disminuir la incidencia de complicaciones relacionadas con ella, incluyendo la ERC. Sin embargo, las metas en cuanto a obesidad para pacientes con ERC obesos siguen siendo vagas, en gran parte debido a la escasez de estudios de intervención con alto nivel de evidencia para modificar la obesidad en pacientes con ERC81.
Prevención de progresión en individuos obesos con ERCLos estudios observacionales en individuos obesos metabólicamente sanos muestran que el fenotipo obeso no asociado con anormalías metabólicas per se predice un mayor riesgo de incidencia de ERC82, lo que indica que la obesidad por sí misma puede generar disfunción y daño renal incluso sin diabetes e hipertensión. En los pacientes diabéticos con sobrepeso u obesidad, una intervención en el estilo de vida que incluya restricción calórica y aumento de la actividad física en comparación con un seguimiento estándar basado en la educación y soporte para mantener el tratmiento de la diabetes reducen el riesgo de incidencia de ERC en un 30%, aunque no afecta la incidencia de eventos cardiovasculares83. Este efecto protector se da, en parte, gracias a la reducción de peso, del HbA1c y de la presión arterial sistólica. No se han observado problemas de seguridad respecto a eventos adversos renales83. En un metaanálisis reciente de estudios experimentales en pacientes obesos con ERC, las intervenciones encaminadas a reducir el peso corporal mostraron beneficios en reducir la tensión arterial, hiperfiltración glomerular y proteinuria81. En un análisis post hoc del estudio REIN se demostró que el efecto nefroprotector de la inhibición de la ECA en pacientes con ERC y proteinuria es mayor en obesos con ERC, pero mínimo en pacientes con ERC e IMC normal o bajo84. Cabe destacar que se ha propuesto la cirugía bariátrica para pacientes seleccionados con ERC y ERCT, incluyendo a aquellos en diálisis o en lista de espera para trasplante renal85–87.
A nivel mundial, estos hallazgos experimentales proporcionan una prueba de la importancia que tienen algunas intervenciones como la reducción de peso y el uso de inhibidores de la ECA en el tratamiento de la ERC en los pacientes obesos. Los estudios demuestran una mayor supervivencia en los pacientes con ERC y mayor IMC, sin embargo, aún deben ser explicados88. Estos hallazgos limitan nuestra capacidad para hacer recomendaciones fuertes acerca de la utilidad y seguridad de la reducción de peso en individuos con estadios avanzados de ERC. Las recomendaciones de estilo de vida para reducción de peso en personas obesas con riesgo de ERC y ERC en estadios tempranos parecen justificables, particularmente aquellas para el control de la diabetes y la hipertensión. Dado que el efecto independiente que tiene el control de la obesidad en la incidencia y progresión a ERC es difícil de separar de los efectos de la hipertensión y la diabetes de tipo 2, la recomendación de pérdida de peso en la minoría de los pacientes obesos no hipertensos y metabólicamente sanos continúa siendo injustificada. Estas consideraciones muestran que debemos seguir cuidadosamente el tratamiento del sobrepeso y obesidad en pacientes con ERC avanzada u otros estados comórbidos, y tener en cuenta los beneficios esperados y las posibles complicaciones de la pérdida de peso sobre la esperanza de vida de cada paciente en particular.
ConclusionesLa epidemia mundial de obesidad afecta a toda la población del planeta de muchas maneras. Las enfermedades renales, incluyendo ERC, nefrolitiasis y noplasias, se encuentran entre los efectos deletéreos más importantes de la obesidad, con grandes consecuencias perjudiciales que conllevan mayores tasas de morbimortalidad y altos costos tanto para cada individuo como para la sociedad en general. Las intervenciones poblacionales para su control pueden tener efectos benéficos en la prevención tanto del desarrollo como del retraso en la progresión de la ERC. Corresponde a toda la comunidad sanitaria el diseño de estrategias de largo alcance para mejorar la comprensión de los vínculos entre obesidad y las enfermedades renales y así determinar estrategias óptimas para frenar esta marea. El Día Mundial del Riñón 2017 es una gran oportunidad para fomentar la educación y la concienciación con ese fin.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
La Dra. Gabriela Abundis Mora realizó la traducción al español de la versión original en inglés.
Miembros del Comité Directivo del Día Mundial del Riñón: Philip Kam Tao Li, Guillermo García-García, Mohammed Benghanem-Gharbi, Rik Bollaert, Sophie Dupuis, Timur Erk, Kamyar Kalantar-Zadeh, Csaba Kovesdy, Charlotte Osafo, Miguel C. Riella, Elena Zakharova.