Se revisan los nuevos fármacos desarrollados para el tratamiento de la anemia en la enfermedad renal crónica, junto con sus mecanismos de acción. En la actualidad, muchos de ellos se encuentran ya en fases avanzadas de ensayos clínicos y es de esperar que se incorporen al arsenal terapéutico en los próximos años. Se describen las potenciales ventajas y sus posibles limitaciones.
The new drugs developed for the treatment of anemia in chronic kidney disease patients, together with their mechanisms of action are reviewed. At present, many of them are already in advanced stages of clinical trials and is expected to be incorporated into the therapeutic arsenal in the coming years. The potential benefits and possible limitations are also described.
La anemia es una complicación frecuente en la enfermedad renal crónica avanzada (ERCA) y su severidad aumenta conforme disminuye la función renal. El inicio del tratamiento con eritropoyetina (EPO) humana recombinante (epoetina) hace ya 3 décadas cambió por completo la importancia del problema1. En la tabla 1 se muestran los acontecimientos más importantes en el tratamiento de esta complicación hasta la actualidad1-7. Durante todo este tiempo, el tratamiento de la anemia ha estado basado en el uso de agentes estimulantes de la eritropoyesis (AEE), que incluían la epoetina y sus análogos, junto con la administración de hierro por vías oral o parenteral8. Entre los análogos de epoetina, hay que destacar la Darbepoetina y CERA (activador continuo de los receptores de EPO). El primero está constituido por una EPO que incluye 2 moléculas de ácido siálico, que le confieren una vida media más larga, mientras que el segundo es una EPO-β pegilada, con una vida media aún mayor. En los últimos años, se han incorporado al arsenal terapéutico los agentes biosimilares de epoetina, por una cuestión de precio.
Eventos más destacables en el tratamiento de la anemia renal
| 1986 | Primera publicación con rH-EPO1 |
| 1990 | Aprobación de rH-EPO por la EMEA |
| 1998 | Estudio de «normalizacion de Hb»2 |
| 2001 | Introducción de Darbepoetina-¿ |
| 2006 | Estudios CREATE y CHOIR3,4 |
| 2007 | Aprobación de rH-EPO-β pegilada |
| 2009 | Estudio TREAT5 |
| 2009 | Introducción de «biosimilares» |
| 2013 | Primeros ensayos clínicos con EPO-miméticos6,7 |
El objetivo de esta revisión es dar a conocer los fármacos que actualmente están en distintas fases de ensayos clínicos y que pueden constituir la base del tratamiento de la anemia renal en los próximos años. En la tabla 2 se establece una clasificación sencilla de los diferentes AEE que vamos a revisar.
Clasificación de los agentes estimulantes de la eritropoyesis
| EPO exógena |
| Epoetina y análogos |
| Agentes EPO-miméticos |
| Agentes estimulantes de la EPO endógena |
| Inhibidores de la prolil-hidroxilasa (PHI) |
| Inhibidores de GATA |
| Agentes con otros mecanismos de acción |
| Agentes anti-hepcidina |
| Agentes anti-activina |
Dentro de este grupo, se incluyen aquellas moléculas peptídicas que actúan sobre los receptores de EPO de manera similar a como lo hace la EPO endógena. El primer EPO-mimético que se ha llegado a comercializar es el Peginesatide (Hematide®), constituido por 2 cadenas peptídicas de 21 aminoácidos cada una, unidas a un grupo polietilenglicol. Su vida media se estima en unas 80h y puede ser administrado en una inyección mensual, sin diferencias entre las vías intravenosa o subcutánea. Este fármaco fue aprobado por la FDA en 2012, solo para uso en hemodiálisis. Al no precisar de la tecnología genética para su fabricación, se trata de un producto más barato que la epoetina. Estudios preliminares demostraron otras potenciales ventajas tales como la ausencia de inmunogenicidad, por lo que podría ser empleado en casos de aplasia pura de células rojas, y su mayor eficacia en casos de pacientes más resistentes a otros AEE.
En enero de 2013, se publicaron simultáneamente los 2 primeros estudios prospectivos, controlados y aleatorizados con Peginesatide en pacientes con ERCA. El primero de ellos (EMERALD Study) se llevó a cabo en EE.UU. y en Europa. Incluía pacientes en hemodiálisis y se comparaba frente a EPO-α administrada 1-3 veces/semana. La conclusión principal era que Peginesatide, administrado una vez al mes, producía niveles equivalentes de hemoglobina a los obtenidos con epoetina6.
El segundo estudio (PEARL Study) se desarrolló también en los mismos países y comparaba la eficacia de Peginesatide mensual frente a Darbepoetina quincenal en pacientes con ERCA sin diálisis. Los resultados mostraron una eficacia similar entre los 2 fármacos al cabo de 52 semanas. Sin embargo, la mortalidad súbita fue 7 veces superior en el grupo con Peginesatide, y la mortalidad de causa desconocida fue el doble7. Datos poscomercialización han mostrado reacciones graves de hipersensibilidad con varios fallecidos9, motivo por el que la FDA retiró su aprobación. Por todo ello, parece razonable pensar que en un mercado tan altamente competitivo como el de los AEE, el futuro de Peginesatide puede ser bastante oscuro.
En la actualidad, existen otras proteínas de fusión con propiedades EPO-miméticas, que están en fases iniciales de estudio.
Agentes estimulantes de eritropoyetina endógenaInhibidores de la prolil-hidroxilasa (PHI)Los pacientes con ERCA presentan un déficit relativo de EPO, de tal modo que aunque los niveles séricos pueden ser normales, son inapropiados para el nivel de hemoglobina que presentan10. Por otro lado, puede haber una secreción hepática de EPO, que puede estar estimulada por episodios de hepatopatía, como fue demostrado en pacientes en hemodiálisis hace muchos años11. Además, existen células remanentes productoras de EPO a nivel renal y a otros niveles, con rendimiento suficiente para mantener a pacientes en hemodiálisis con ausencia de anemia y sin necesidad de AEE. Esta situación es más frecuente en casos con largo tiempo en tratamiento renal sustitutivo, en pacientes con enfermedad poliquística y en casos de hepatopatía por virus C12.
Desde hace muchos años, se conoce la adaptación de los habitantes del altiplano andino a la hipoxia en la que viven, de la misma manera que el efecto de la altitud ejerce sobre los pacientes en hemodiálisis13. La baja presión de oxígeno expresa el factor inducible por la hipoxia (HIF), que es un factor de transcripción que regula la expresión de los genes implicados en la eritropoyesis en respuesta a los cambios en la presión parcial de oxígeno. Se trata de una proteína heterodimérica, que a su vez tiene 2 componentes: el HIF-α sensible a la hipoxia y el HIF-β, que es un componente inactivo de la propia molécula. El primero de ellos tiene a su vez 3 subunidades, que vienen denominadas como HIF-1α, HIF-2α e HIF-3α. HIF-1α interviene en la síntesis de EPO en estadios embrionarios, perdiendo su importancia tras el nacimiento. Interviene también en procesos de angiogénesis, mediados por VEGF, así como en el metabolismo anaerobio de la glucosa. Recientemente, se ha observado que este factor es también capaz de contribuir al crecimiento de los quistes renales14.
HIF-2α es la subunidad más importante y la responsable de la adaptación en altura y de los cambios genéticos en la población que vive en esas condiciones. Se expresa en gran cantidad de células del organismo que incluyen el endotelio, hepatocitos, cardiomiocitos, células gliales, neumocitos y células intersticiales renales peritubulares, siendo responsable del control de la síntesis de EPO en los adultos y del control del metabolismo férrico. A nivel experimental, se sabe que la inactivación de HIF-2α seguida de una flebotomía produce una anemia que no es recuperable a pesar de tener una función renal normal, lo que da una idea del papel tan relevante que juega. Por todo ello, HIF-2α se convierte en un importante objetivo para el tratamiento farmacológico. HIF-3α es la subunidad con menos importancia y parece jugar un efecto inhibidor.
En situaciones de normoxia, no es necesaria la participación de HIF-2α, por lo que se produce su inactivación por hidroxilación mediante un proceso de degradación proteosómica inducida por una prolil-hidroxilasa (PH). Se conocen al menos 3 subtipos de PH, conocidas como PHD1, PHD2 y PHD3. En cambio, en situaciones de hipoxia, donde es necesario un aumento del número de hematíes para mejorar el transporte de oxígeno, se produce una estabilización de HIF-2α por inhibición de la familia de las PH. Por tanto, HIF-2α se convierte en el regulador principal de la eritropoyesis inducida por hipoxia15.
En la actualidad, está en fase de desarrollo clínico una familia de fármacos que actúan como inhibidores de la PH (PHI). Estas nuevas moléculas son capaces de incrementar la eritropoyesis por 2 mecanismos: el primero es mediante la estabilización de los niveles de HIF-2α, que a su vez estimula la síntesis de EPO renal y hepática, y el segundo es a través de una mejoría del metabolismo férrico, bloqueando el efecto de la hepcidina. Por tanto, los PHI actúan de manera fisiológica, con los mismos mecanismos de acción con los que el organismo se adapta a la menor presión de oxígeno en altitud16.
La hepcidina, sintetizada a nivel hepático, juega un papel importante en la anemia asociada a la inflamación, ya que contribuye a disminuir la biodisponibilidad del hierro. Actúa mediante la degradación de la ferroportina, que es una proteína que actúa como el principal exportador de hierro desde las células. Recordemos que el hierro de los alimentos se absorbe a nivel del duodeno y posteriormente pasa a la circulación sanguínea, donde se une a la transferrina. Desde aquí, pasa a los depósitos en las células hepáticas y del sistema retículo endotelial. Posteriormente, en aquellos casos en los que se necesita activar la eritropoyesis, saldrá de nuevo a la circulación y se incorporará a la médula ósea. Por tanto, la ausencia de ferroportina inducida por hepcidina bloquea la salida de hierro de las células dando lugar a un secuestro de hierro en los enterocitos del duodeno, hepatocitos y en los macrófagos. Fisiológicamente, se produce una inhibición de hepcidina en casos de anemia, ferropenia, hipoxia (inducida por HIF-α2) o por alteraciones genéticas, como en el caso de la hemocromatosis. En cambio, la estimulación de la hepcidina se produce principalmente en casos de inflamación, lo que contribuye al desarrollo de anemia en estos casos.
Datos preliminares en fase 1 ya habían demostrado en 12 pacientes en hemodiálisis y en 6 controles sanos el aumento de hemoglobina tras el tratamiento con FG221616. La tabla 3 incluye algunos de los PHI evaluados recientemente con ensayos clínicos en fase 2. En la actualidad, disponemos de los primeros resultados derivados de ensayos clínicos. Así, a nivel experimental, Molidustat es capaz de estimular la producción de EPO y de reticulocitos, sin aumento en la presión arterial. Su efecto es dosis-dependiente y su administración es por vía oral. Con dosis diaria de 2,5mg/kg, se obtiene un efecto equivalente a la administración de epoetina de 100UI/kg17. Con Roxadustat, en un estudio controlado y aleatorizado frente a placebo, se observa que con dosis de 1mg/kg administrada 2 veces a la semana, se obtiene una respuesta similar en los días 1 y 29, y en ambos, se alcanza el pico máximo de los niveles plasmáticos de EPO endógena alrededor de las 8h después de la administración. El efecto sobre los niveles de hemoglobina es también dosis-dependiente, con dosis óptima en 1,5mg/kg, sin que se encuentren ventajas con dosis superiores, y siendo preferible la administración en 3 veces a la semana en lugar de 2. En cambio, se observa un efecto significativamente mejor en la reducción de los niveles de hepcidina cuando se administra con dosis de 2mg/kg repartido en 3 veces a la semana18. Resultados similares en el incremento de hemoglobina y reticulocitos, así como en el descenso de hepcidina, han sido descritos recientemente con Daprodustat en pacientes con ERCA estadios 3-519. Roxadustat ha demostrado también su eficacia en el mantenimiento de los niveles de hemoglobina en pacientes en hemodiálisis previamente tratados con epoetina, así como en el descenso de los niveles de hepcidina20.
Por tanto, los PHI constituyen un nuevo grupo terapéutico para el tratamiento de la anemia renal con una serie de ventajas como son la capacidad de aumentar los niveles de hemoglobina mediante la estabilización de HIF, con lo que se evitan sus fluctuaciones, tienen administración oral, permiten mejorar la movilización de hierro y presentan un buen perfil de seguridad. Por ello, pueden ser una buena alternativa en el futuro para el manejo de la anemia en pacientes con ERCA, especialmente si el precio resultara competitivo con respecto a los AEE que requieren procesos de ingeniería recombinante para su fabricación. No obstante, son necesarios estudios a más largo plazo para asegurar que el potencial efecto de HIF sobre la angiogénesis no presenta efectos adversos.
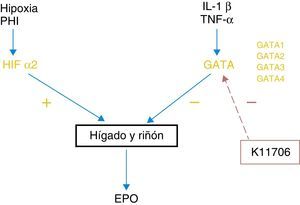
Inhibidores de GATAEl control de la eritropoyesis por HIF-2α está regulado negativamente por GATA, que es un factor de transcripción que inhibe la expresión de EPO en hígado y riñón. Los principales estímulos de este sistema son algunas de las citoquinas proinflamatorias conocidas, como IL-1, IL-6 o TNFα (fig. 1). Existen 4 subtipos de GATA y parece que GATA2 es el que actúa de forma más potente en la regulación de la síntesis de EPO. Así, de la misma manera que aquellos fármacos que logran estabilizar HIF-2α producen un aumento en la síntesis de EPO, aquellos que son capaces de bloquear el sistema GATA pueden actuar de manera similar.
En la actualidad, se conocen al menos 2 inhibidores específicos de GATA. El K7174, que suprime la actividad de GATA-1, -2 y -3, ha demostrado en experiencias animales que es capaz de aumentar la síntesis de EPO previamente inhibida por citoquinas inflamatorias21. El K11706 es un factor inhibidor de GATA-2 y -3 de una forma mucho más potente. Experiencias in vitro han demostrado que su administración oral revierte el descenso de hemoglobina, de reticulocitos y de unidades formadoras de colonias eritroides (CFU-E) inducido por citoquinas como IL-1β, o TNF-α22. Por tanto, este grupo de inhibidores puede mejorar la eritropoyesis inducida por inflamación. No obstante, son necesarios ensayos clínicos en fases más avanzadas para poder pensar que puedan tener un papel en la clínica humana.
Agentes con otros mecanismos de acciónAgentes anti-hepcidinaAdemás del efecto inhibidor de la hepcidina producido por los PHI ya descrito, recientemente, se ha desarrollado un fármaco específico anti-hepcidina, que inicialmente se probó en monos23, pero del que ya disponemos de la primera publicación en humanos. Este fármaco, conocido como Lexaptepid, es capaz de aumentar los niveles séricos de hierro y el índice de saturación de transferrina en sujetos en los que previamente se ha desarrollado un incremento de hepcidina inducido por endotoxinemia. El tratamiento se acompaña de buena tolerancia24. Por tanto, el tratamiento con fármacos anti-hepcidina representa otra nueva vía para el manejo de la anemia asociada a inflamación.
Agentes anti-activinaLa activina es una proteína formada por 2 monómeros similares unidos por enlaces disulfuro, que pertenece a la superfamilia de los TGF-β. Está producida fundamentalmente en el folículo ovárico y gónadas, y tiene como efecto más importante la regulación del ciclo menstrual mediante el control de la secreción de FSH. Otros efectos descritos son el control de la espermatogénesis, así como la participación en los procesos de cicatrización y en la regulación de la secreción de insulina. A nivel óseo, actúa como un inhibidor del crecimiento óseo, mediante la estimulación de osteoclastos y la inhibición de osteoblastos. Presenta 2 tipos de receptores, tipo I y tipo II.
Recientemente, se ha desarrollado un antagonista de los receptores tipo IIA de la activina, denominado Sotatercept, que en un ensayo fase 1 para el tratamiento de la osteoporosis en mujeres posmenopáusicas, demostró una mejoría en los marcadores de formación ósea y una disminución en los de resorción ósea, pero como efecto secundario, se encontró un aumento en los niveles de hemoglobina, así como en el recuento de reticulocitos25. A raíz de estos hallazgos, se han iniciado gran número de ensayos clínicos para el tratamiento de la anemia asociada a procesos neoplásicos, metástasis o ERCA.
Datos preliminares (no publicados), en una muestra pequeña de pacientes en hemodiálisis, han mostrado que Sotatercept produce una mejoría dosis-dependiente en los niveles de hemoglobina, alcanzando la mejor respuesta con 0,7mg/kg. Como efectos añadidos, se observó una estimulación de la formación ósea, con mejoría de su estructura y densidad, valorados por tomografía computarizada cuantitativa, junto con una mejoría en la progresión de las calcificaciones vasculares valoradas con el índice de Agatston. Estos hallazgos sitúan a Sotatercept como una molécula prometedora con capacidad para actuar favorablemente frente a complicaciones habituales en pacientes con ERCA, como son la anemia, las calcificaciones vasculares y las alteraciones óseas.
En resumen, el desarrollo de nuevas moléculas con capacidad para estimular la eritropoyesis por mecanismos diferentes a los actuales AEE, la posibilidad de administrar algunos de ellos por vía oral, la buena tolerancia que han mostrado hasta la actualidad, junto con la posibilidad de disminuir los costes del tratamiento, abren una vía muy esperanzadora para el manejo de la anemia en pacientes con ERCA en los próximos años.
Conceptos clave- •
Los nuevos fármacos para el tratamiento de la anemia renal, actualmente en fases avanzadas de ensayos clínicos, están demostrando resultados muy esperanzadores para los próximos años.
- •
Los PHI estimulan la eritropoyesis mediante la estabilización de HIF y la inhibición de hepcidina.
- •
Los inhibidores de la activina como Sotatercept pueden actuar mejorando la anemia, retrasando las calcificaciones vasculares y mejorando la estructura y densidad ósea.
Los autores declaran no haber recibido financiación alguna para esta revisión.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses con el contenido de esta revisión.